Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
ELISA immunospot (ELISPOT): Quantification des Th-1 réponses immunitaires cellulaires contre des antigènes microbiens
Dans cet article
Résumé
Identification de cibles microbiennes de l'immunité adaptative dans les maladies idiopathiques qui peut être accompli par l'utilisation du dosage immuno-enzymatique.
Résumé
L'immunité adaptative est une composante importante à la clairance des pathogènes intracellulaires. La capacité de détecter et de quantifier ces réponses chez les humains est un outil important de diagnostic. L'épreuve immuno-enzymatique immunospot (ELISPOT) gagne en popularité pour sa capacité à identifier les réponses immunitaires cellulaires contre les antigènes microbiens, y compris les populations immunodéprimées comme les personnes ayant une infection à VIH, transplantation, et l'utilisation de stéroïdes. Ce test a la capacité de quantifier les réponses immunitaires contre les antigènes microbiens spécifiques, ainsi que la distinction si ces réponses sont Th1 ou Th2 dans le caractère. ELISPOT n'est pas limité au site de l'inflammation. Il est polyvalent dans sa capacité à évaluer les réponses immunitaires au sein du sang périphérique, ainsi que les sites de la participation active tels que lavage broncho-alvéolaire, liquide céphalo-rachidien, et une ascite. Détection des réponses immunitaires contre un seul ou plusieurs antigènes est possible, ainsi que des épitopes spécifiques dans les protéines microbiennes. Ce test facilite la détection des réponses immunitaires au cours du temps, ainsi que des distinctions dans les antigènes reconnus par des lymphocytes T hôte. Double tests ELISPOT couleurs sont disponibles pour la détection de l'expression simultanée de deux cytokines. Les applications récentes de cette technique comprennent le diagnostic de tuberculose extrapulmonaire, ainsi que des enquêtes de la contribution des antigènes maladies infectieuses aux maladies auto-immunes.
Protocole
Pour le protocole suivant, nous utilisons des cellules mononucléées du sang périphérique (PBMC) comme les cellules d'intérêt. Cependant, ce protocole peut être utilisé avec d'autres types cellulaires. Effectuer le dosage dans une hotte de culture tissulaire en utilisant une technique stérile.
Jour 1: Préparation de la plaque et les cellules
- Prendre une plaque ELISPOT et ouvrez-le dans la hotte.
- Laver la plaque 3 fois avec 150 ul de PBS 1X aide d'une pipette multicanaux, si disponible, sinon seule pipetage ainsi est acceptable.
- Prenez un paquet de réservoirs et de l'ouvrir dans le capot.
- Ajouter 2 ug / ml de l'anticorps de capture anti-interféron humain-γ, à 11 ml de PBS 1X. Vortex bien. Transfert mélange d'anticorps à un réservoir.
- Placer 100 ml de la solution d'enrobage dans chaque puits en utilisant le multicanal.
- Enveloppez la plaque dans parafilm.
- Placer la plaque dans le réfrigérateur pendant la nuit. Les plaques sont bons pendant des semaines. La règle de base est que si il reste encore liquide dans le puits, la plaque peut être utilisée.
Préparation des cellules
Si les PBMC sont frais, puis compter les cellules et incuber une nuit à 37 ° C avec 5% de CO 2. Pour PBMC stockés dans l'azote liquide, la décongélation des cellules est nécessaire. Le protocole est le suivant:
- Décongeler les cryovial de cellules à 37 ° C jusqu'à ce bain d'eau presque complètement décongelé.
- Immédiatement remettre en suspension dans 5 ml de R10 médias.
- Spin pendant 5 minutes à 225 x g.
- Resuspendre nouveau dans 5 ml de R10 médias et compter les cellules viables en utilisant du bleu trypan.
- Apportez la concentration de 2 x 10 6 cellules / mL dans R10 médias.
- Reste une nuit à 37 ° C avec 5% de CO 2.
Jour 2: Mise en place de la plaque
- Couvercle de la plaque d'étiquettes avec numéro d'identification des échantillons, des conditions bien, et la date.
- Laver la plaque 6 fois avec 150 ul de PBS 1x stérile en utilisant le dump et la méthode blot. Soyez prudent de ne pas éclabousser la plaque tout dumping. Cela pourrait causer des puits de la plaque à son tour violet.
- Ajouter 100 ul de R20 à chaque puits.
- Incuber la plaque à 37 ° C pendant 1 heure.
- Alors que la plaque est en incubation, compter les cellules qui ont été reposé toute la nuit.
- Faites tourner la suspension de cellules à 1500 rpm pendant 5 minutes. Décanter le surnageant et remettre le culot de sorte que vous avez une concentration finale de 1x10 6 cellules par 1ml dans R10 médias.
- Après l'incubation de 1 heure, retirer la R20 en utilisant le dump et la méthode blot. Soyez prudent de ne pas éclabousser la plaque tout dumping.
- Ajouter 100 pi de solution de cellules (10 5 cellules) dans chaque puits. Ajouter peptides appropriés et / ou d'antigènes dans les puits correspondants en double exemplaire. Utiliser un nouvel embout de pipette à chaque fois que vous entrez dans la solution de peptide de travail. Concentration de peptide normale est de 10-40 g / mL. Depuis peptides varient, chaque chercheur doit titrer peptides d'obtenir des résultats optimaux.
- Dans les puits de contrôle négatif, ne font qu'ajouter des cellules (pas de peptides)
- Dans les puits de contrôle positif, ajouter la phytohémagglutinine (PHA; 10 pg / mL; Sigma).
- Incuber une nuit à 37 ° C avec 5% de CO 2 (~ 18 heures).
Jour 3: Développer la plaque
- Laver la plaque 6 fois avec 150 uL 1xPBS utilisant la méthode de dump et efface.
- Ajouter 100 ul de PBS dans chaque puits de la plaque à l'aide de la pipette multicanaux.
- Mettez la plaque au réfrigérateur pendant 15 minutes.
- Prenez la plaque du réfrigérateur et placez-le dans la hotte de culture de tissus.
- Préparer la solution d'anticorps biotine
- Ajouter 0,5 pg / mL d'anticorps biotine (MAB 7-B6-1) à 11ml de PBS.
- Vortex la solution pour bien mélanger.
- Si l'intention d'ajouter la solution en utilisant un multicanaux, le verser dans un réservoir.
- Jeter le CPE en le feuilletant à la poubelle. Soyez prudent de ne pas éclabousser la plaque tout dumping.
- Placer 100 ml de la solution dans chaque puits.
- Incuber la plaque dans la hotte de culture de tissus à la température ambiante pendant une heure.
- Laver la plaque 6 fois avec 150μL 1xPBS utilisant la méthode de dump et efface. Sur le lavage 6 e, quitter le CPE sur la plaque jusqu'à ce que vous avez préparé l'anticorps Streptavidine.
- Préparer l'anticorps Streptavidine.
- Ajouter 5,5 μ L Streptavidine anticorps (streptavidine-ALP) pour 11ml de PBS (1:2000 dilution).
- Vortex la solution pour bien mélanger.
- Si l'intention d'ajouter la solution en utilisant un multicanaux, le verser dans un réservoir.
- Jeter le PBS restant dans les puits et épongez la plaque.
- Ajouter 100 pi de solution de streptavidine à chaque puits.
- Incuber la plaque dans la hotte de culture de tissus à la température ambiante pendant 1 heure.
- Laver les plaques 6 fois avec du PBS en utilisant le dump et la méthode blot. Sur le lavage 6 e, quitter le CPE sur la plaque jusqu'à ce que vous avez fait la solution de couleur.
- Travailler dans l'obscurité. Préparer la solution de phosphatase alcaline substrat (phosphatase alcaline Substrat Kit IV BCIP / NBT):
- Ajouter 4 gouttes de réactif substrat de 1 à 11 ml de tampon Tris, vortex bien. Ajouter 4 gouttes de réactif 2 substrat tampon Tris, vortex bien. Ajouter 4 gouttes de réactif substrat à 3 tampon Tris, vortex bien.
- Jeter le reste du PBS et épongez la plaque.
- Ajouter 100 ml de la solution de couleur à chaque puits de la plaque à l'aide du multicanal.
- Allumez la lumière au bout de 5 à 10 minutes de la couleur en développement.
- Laisser les réactifs de couleur pour rester sur la plaque jusqu'à ce que les taches commencent à tourner pourpre et sont assez sombres. Cela devrait durer de 5 à 20 minutes. Soyez prudent de ne pas laisser la solution de substrat trop longtemps car cela pourrait causer de fond élevé.
- Laver la plaque ELISPOT 3 fois avec l'eau du robinet.
- Laissez sécher pendant environ une heure ou jusqu'au lendemain.
- Lire la plaque soit manuellement ou avec lecteur de plaque ELISPOT.
- Magasin de la plaque dans une boîte loin de l'exposition lumineuse.
Les résultats représentatifs:
ELISPOT est conçu pour quantifier les réponses immunitaires contre des antigènes microbiens. Chaque spot indique une seule cellule réactive, exprimant la cytokine d'intérêt. Les taches peuvent être comptés manuellement ou en utilisant un lecteur de plaque ELISPOT.
Évaluation que l'ELISPOT a été effectuée correctement devrait commencer à l'enquête du contrôle négatif pour la production d'arrière-plan de la cytokine d'intérêt. Dans les puits de contrôle négatif on pourrait s'attendre à voir pas de taches, même si un peu de fond (couleur violette) peuvent être présents. Typiquement, il devrait être inférieur à une moyenne de cinq points par puits. Les puits de contrôle positif confirme que la réaction a été effectuée correctement, et que les cellules sont sensibles à la stimulation antigénique. Dans les puits de contrôle positif que vous attendez de voir un fond pourpre profond dû à une confluence des taches (Fig1). Il devrait y avoir peu ou pas de fond blanc. Si le contrôle positif et les échantillons témoins négatifs sont appropriés, on peut alors compter les puits contenant l'antigène d'intérêt. Un «sous-optimal" résultat se traduirait par un bruit de fond élevé (les puits sont violet), sans taches ou des taches très peu, le centre vide, des taches ou des taches mal définies confluentes. Une liste des conseils de dépannage est fourni (tableau 1).
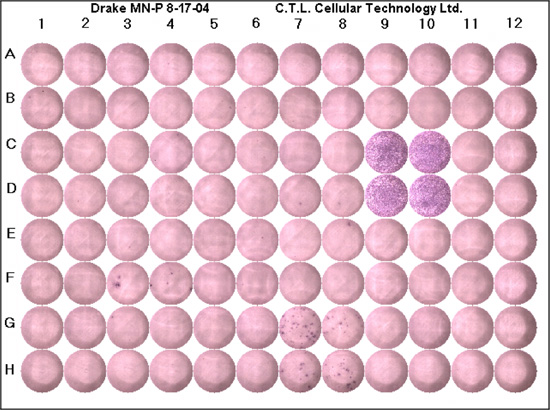
Figure 1. Un représentant de la plaque ELISPOT. Chaque plaque doit comporter un contrôle positif, contrôle négatif et le peptide d'intérêt menée au minimum dans deux puits. C9, C10, D9 et D10 sont les puits de contrôle positif, comme vous pouvez le voir il ya une couleur pourpre profond, les cellules confluentes et presque pas de fond blanc. Les puits de contrôle négatif sont G11, G12, H11 et H12. Ces puits n'ont pas le fond pourpre et sans taches comme prévu. Les taches du G7, du G8, H7 et H8, illustrent les réponses cellulaires aux peptides microbiens; les taches mauves représentent une seule cellule réactive exprimant la cytokine d'intérêt.
Tableau 1
| Observation | Problème possible | Solution possible |
| Bruit de fond élevé | 1. Les deux côtés de la membrane ne lave pas correctement 2. Trop de cellules sécrétant des cytokines 3. Plaque pas séché correctement 4. Plus de plaque développée | 1. Lavez les deux côtés de la membrane avec de l'eau distillée avant et après le développement de couleur. Réactifs peut fuir à travers la membrane dans la base de la plaque, et ils peuvent provoquer de fond élevé s'il n'est pas emporté. 2. Réduire le nombre de cellules par puits, ce qui nécessitera l'optimisation 3. Sécher la plaque avant de lire plus 4. Réduire le temps de développement |
| Pas de taches / Spots Très peu | 1. Cytokine sécrètent pas assez de cellules / protéine d'intérêt 2. Assurer les cellules sont stimulées correctement 3. Cellules non incubées pendant long assez ou peut prendre du temps pour répondre aux stimulants 4. Développement de la couleur inadéquate 5. Pas assez d'anticorps primaire ou secondaire | 1. Augmenter le nombre de cellules. Cela nécessitera l'optimisation 2. Également utiliser un contrôle de stimulation positive - un stimulant qui vous savez induire l'expression de votre cytokine / protéine d'intérêt 3. Augmenter le temps d'incubation de cellules ou d'utiliser la méthode indirecte (pré-traitement des cellules avec des stimulants) 4. Surveiller le développement de couleur avec un microscope frais généraux et s'assurer que les réactifs de développement ont été enregistrés correctement et n'ont pas perdu l'activité 5. La concentration de l'anticorps primaire et / ou secondaire devra être augmenté. Cela nécessitera d'optimisation. |
| Des zones blanches | 1. Membrane non pré-traités 2. Membrane a séché à une certaine étape 3. Cellules inégalement répartie | 1. Assurez-membrane est suffisamment prétraitées avec de l'éthanol à 70% (toutes les membranes n'ont pas besoin de cela afin de vérifier avec votre fournisseur). Lavez-les bien avec du PBS 3X suite 2. Assurer la membrane ne sèche pas 3. Assurez-vous mélangez délicatement les cellules d'avoir une bonne suspension homologue cellulaire avant de pipetage sur dans les puits |
| Centre Blank | 1. Les dommages causés par le lavage | 1. Débit sur la rondelle automatisé (ou pipette) peut être trop élevé. Besoin d'une procédure de lavage plus doux |
| Faux positifs | 1. Agrégats d'anticorps secondaire 2. Cellules toujours sur la membrane 3. Contamination de la culture cellulaire | 1. Filtrer les anticorps secondaire 2. S'assurer que tous les cellules sont lavées de la membrane avec du PBS Tween 20 avant l'incubation anticorps secondaire. Les cellules à gauche sur la membrane donnera irrégulière des taches en forme 3. Gardez réactifs comme stérile et propre que possible. Assurez votre technique de culture cellulaire est aseptique. Vérifier les faux positifs en exécutant un média de contrôle négatif. Pour le mouvement des plaques, des taches mal définies |
| Spots Confluent | 1. Revêtement pauvres, trop d'anticorps 2. Culture cellulaire prolongé 3. Cellules sur-stimulé | 1. Réduire la concentration d'anticorps primaires 2. Le plus les cellules sont incubées, plus de cytokines / protéines qu'ils sécrètent. Cela se traduira par de plus grandes taches qui commencent à fusionner et deviennent indiscernables. 3. Réduire la culture de cellules d'incubation pas de temps. Sur-stimulation se traduira par un grand nombre de cytokines / protéines sont sécrétées par la cellule. Ceci va produire des taches qui vont commencer à fusionner et deviennent indiscernables. Réduire la quantité de stimulants dans les milieux de culture ou de culture pour un court laps de temps |
| Spots mal définis | 1. Membrane non pré-traités (si votre membrane nécessite ce sujet, consultez le fournisseur) 2. Le mouvement des plaques pendant l'incubation des cellules | 1. La membrane doit être pré-traitées avec de l'éthanol ou de ce qui peut entraîner floue, taches mal définies. Il sera difficile pour le lecteur de distinguer ces 2. Ne pas laisser la plaque de se déplacer pendant l'incubation des cellules comme les cellules qui ont déménagé va créer plus d'un spot. Si possible utiliser un incubateur qui consacre ne sera pas ouvert pendant l'incubation. Ne touchez pas la plaque après l'ajout de cellules |
| Contrôle positif puits est faible | 1. Le sous-développement - peut être une conséquence de l'utilisation de streptavidine ALP et / ou BCIP / NBT solutions qui n'ont pas été portées à la température ambiante | 1. Amener les réactifs à température ambiante avant d'ajouter dans les puits |
| Densité des points, il est difficile de les quantifier | 1. Trop de cellules ont été ajoutées aux puits | 1. Faire des dilutions de cellules (par exemple, 1 x 10 6, 5 x 10 5, 1 x 10 5, 5 x 10 4, 1 x 10 4 cellules par puits) pour déterminer le nombre optimal de cellules qui se traduira par la formation de taches distinctes |
Discussion
Le test ELISPOT a émergé comme l'un des essais les plus importants et largement utilisé pour surveiller la réponse immunitaire chez les humains et une variété d'autres espèces. Avec le test ELISPOT, les fréquences des cellules immunitaires peuvent être mesurés au niveau de la cellule unique sans expansion ou la manipulation des populations de cellules. Test ELISPOT a été largement appliqué pour étudier les réponses immunitaires spécifiques d'antigènes dans diverses maladies, y compris les in...
Déclarations de divulgation
Remerciements
Soutenu en partie par Vanderbilt CSTC subvention de 1 UL1 RR024975 du National Center for Research Resources des National Institutes of Health. Ce travail a été financé par le NIH R01 HL 83839; R01 IA 65744.
matériels
A. Préparation des médias

B. Préparation d'un tampon Tris
- Ajouter 800 ml de DDH 2 O à 1 bécher L.
- Mesure 12 grammes de tris et d'ajouter dans le bécher.
- Ajouter 0,12 g de chlorure de magnésium hexahydraté (MgCl 2: 6H 2 O) dans le bécher.
- Remuer avec tige agitation magnétique sur une plaque en remuant automatique.
- Une fois dissous, le pH de la solution à 9,5.
- Ajouter 200 ml de DDH 2 O dans le bécher, le portant à 1000ml.
- Filtrer la solution avec un filtre de 0,22 um.
C. Matériaux nécessaires à l'analyse ELISPOT:

Références
- Dosanjh, D. P., Hinks, T. S., Innes, J. A., Deeks, J. J., Pasvol, G., Hackforth, S., Varia, H., Millington, K. A., Gunatheesan, R., Guyot-Revol, V., Lalvani, A. Improved diagnostic evaluation of suspected tuberculosis. Ann Intern Med. 148, 325-336 (2008).
- Sung, H. K. E. Diagnosis of abdominal tuberculosis by T-cell based assays on peripheral blood and peritoneal fluid mononuclear cells. Journal of Infection. 59, 409-415 (2009).
- Kim, S. -. H. Diagnosis of Central Nervous System Tuberculosis by T-Cell-Based Assays on Peripheral Blood and Cerebrospinal Fluid Mononuclear Cells. Clinical and Vaccine Immunology. , 1356-1362 (2008).
- Drake, W. P., Dhason, M. S., Nadaf, M., Shepherd, B. E., Vadivelu, S., Hajizadeh, R., Newman, L. S., Kalams, S. A. Cellular recognition of Mycobacterium tuberculosis ESAT-6 and KatG peptides in systemic sarcoidosis. Infect Immun. 75, 527-530 (2007).
- Allen, S. S., Evans, W., Carlisle, J., Hajizadeh, R., Nadaf, M., Shepherd, B. E., Pride, D. T., Johnson, J. E., Drake, W. P. Superoxide dismutase A antigens derived from molecular analysis of sarcoidosis granulomas elicit systemic Th-1 immune responses. Respir Res. 25, 36-36 (2008).
- Mutsvangwa, J., Millington, K. A., Chaka, K., Mavhudzi, T., Cheung, Y. B., Mason, P. R., Butterworth, A. E., Corbett, E. L., Lalvani, A. Identifying recent Mycobacterium tuberculosis transmission in the setting of high HIV and TB burden. Thorax. 65, 315-320 (2010).
- Streeck, H., Frahm, N., Walker, B. D. The role of IFN-gamma Elispot assay in HIV vaccine research. Nat Protoc. 4, 461-469 (2009).
- Chaudhary, N., Staab, J. F., Marr, K. A. Healthy human T-Cell Responses to Aspergillus fumigatus antigens. PLoS One. 5, e9036-e9036 (2010).
- Manigold, T., Mori, A., Graumann, R., Llop, E., Simon, V., Ferr, S. M., Valdivieso, F., Castillo, C., Hjelle, B., Vial, P. Highly differentiated, resting gn-specific memory CD8+ T cells persist years after infection by andes hantavirus. PLoS Pathog. 6, e1000779-e1000779 (2010).
- Ndongala, M. L., Kamya, P., Boulet, S., Peretz, Y., Rouleau, D., Tremblay, C., Leblanc, R., Côté, P., Baril, J. G., Thomas, R., Vézina, S., Boulassel, M. R., Routy, J. P., Sékaly, R. P., Bernard, N. F. Changes in function of HIV-specific T-cell responses with increasing time from infection. Viral Immunol. 2, 159-168 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon