Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Enzyme-linked Immunospot Assay (ELISPOT): Quantifizierung von Th-1 zelluläre Immunantworten gegen mikrobielle Antigene
In diesem Artikel
Zusammenfassung
Identifizierung von mikrobiellen Ziele der adaptiven Immunität bei idiopathischer Krankheiten können durch die Verwendung des enzyme-linked immunospot Test durchgeführt werden.
Zusammenfassung
Adaptive Immunität ist ein wichtiger Bestandteil der Freigabe von intrazellulären Erregern. Die Fähigkeit zur Detektion und Quantifizierung dieser Reaktionen beim Menschen ist ein wichtiges diagnostisches Werkzeug. Die enzyme-linked immunospot Assay (ELISPOT) ist an Popularität gewinnt für seine Fähigkeit, zelluläre Immunantworten gegen mikrobielle Antigene, einschließlich immunsupprimierten Bevölkerungsgruppen wie Menschen mit einer HIV-Infektion, Transplantation und Verwendung von Steroiden zu identifizieren. Dieser Test hat die Fähigkeit, die Immunantwort gegen spezifische mikrobielle Antigene, sowie zu unterscheiden, ob diese Antworten Th1-oder Th2-Charakter sind zu quantifizieren. ELISPOT ist nicht auf den Ort der Entzündung begrenzt. Es ist in seiner Fähigkeit, für Immunreaktionen im peripheren Blut, sowie Stellen der aktiven Beteiligung wie BAL, Liquor, Aszites und bewerten vielseitig. Erkennung von Immunantworten gegen ein einzelnes oder mehrere Antigene möglich ist, sowie spezifische Epitope innerhalb mikrobieller Proteine. Dieser Test ermöglicht Nachweis von Immunreaktionen im Laufe der Zeit, als auch Unterschiede in Antigenen von Host-T-Zellen erkannt. Zweifarbige ELISPOT-Assays zur Verfügung für den Nachweis der gleichzeitigen Expression von zwei Zytokinen. Aktuelle Anwendungen für diese Technik sind Diagnose der extrapulmonalen Tuberkulose, sowie Untersuchung des Beitrags von infektiösen Antigenen zu Autoimmunerkrankungen.
Protokoll
Für das folgende Protokoll verwenden wir peripheren mononukleären Blutzellen (PBMC), wie die Zellen von Interesse. Allerdings kann dieses Protokoll mit anderen Zelltypen verwendet werden. Führen Sie den Test in einer Gewebekultur Kapuze mit steriler Technik.
Tag 1: Herstellung von Platten und Zellen
- Nehmen Sie eines ELISPOT Platte und öffnen Sie sie in der Motorhaube.
- Waschen Sie die Platte 3 mal mit 150 ul 1X PBS mit einem Mehrkanal-Pipette, falls vorhanden, sonst einzelne gut Pipettieren akzeptabel ist.
- Nehmen Sie ein Paket von Stauseen und öffnen Sie sie in der Motorhaube.
- Add 2 pg / mL der Fänger-Antikörper, Anti-Human-Interferon-γ, bis 11 ml 1X PBS. Vortex gut. Transfer-Antikörper-Mix mit einem Reservoir.
- Platz 100 ul der Beschichtungslösung in jedes Well mit dem Multichannel.
- Wickeln Sie die Platte in Parafilm.
- Legen Sie die Platte über Nacht im Kühlschrank. Die Platten sind gut für Wochen. Die Faustregel ist, dass, wenn es noch flüssig ist links in die Brunnen, die Platte verwendet werden kann.
Cell Preparation
Wenn die PBMCs frisch sind dann zählen die Zellen beimpft und über Nacht bei 37 ° C mit 5% CO 2. Für PBMC in flüssigem Stickstoff gelagert, Auftauen der Zellen notwendig ist. Das Protokoll ist wie folgt:
- Auftauen Kryoröhrchen von Zellen in 37 ° C Wasserbad bis fast vollständig aufgetaut.
- Unmittelbar in 5 ml R10 Medien resuspendieren.
- Spin für 5 Minuten bei 225 x g.
- Resuspendieren wieder in 5 ml R10 Medien und zählen die lebensfähigen Zellen unter Verwendung von Trypanblau.
- Bringt Konzentration auf 2 x 10 6 Zellen / ml in R10 Medien.
- Rest über Nacht bei 37 ° C mit 5% CO 2.
Tag 2: Aufbau der Plate
- Kennzeichenschild Deckel mit Probe-Identifikationsnummer, auch Bedingungen und Datum.
- Waschen Sie die Platte 6 mal mit 150 ul sterilem 1x PBS mit dem dump und Blot-Methode. Achten Sie darauf, nicht auf den Teller spritzen, während Dumping. Dies könnte die Vertiefungen der Platte zu drehen violett.
- Geben Sie 100 ul der R20 in jede Vertiefung.
- Die Platte bei 37 ° C für 1 Stunde.
- Während die Platte inkubiert, zählen Sie die Zellen, die über Nacht waren ausgeruht.
- Spin der Zellsuspension bei 1500 rpm für 5 Minuten. Den Überstand und das Pellet, so dass Sie zu einer Endkonzentration von 1x10 6 Zellen pro 1 ml in R10 Medien haben.
- Nach dem 1 Stunde Inkubation, entfernen Sie den R20 mit dem dump und Blot-Methode. Achten Sie darauf, nicht auf den Teller spritzen, während Dumping.
- Geben Sie 100 ul der Zell-Lösung (10 5 Zellen) in jede Vertiefung. Add entsprechenden Peptide und / oder Antigene an die entsprechenden Vertiefungen in zweifacher Ausfertigung. Verwenden Sie eine neue Pipettenspitze jedes Mal, wenn Sie in das Peptid funktionierende Lösung. Normale Peptidkonzentration beträgt 10-40 pg / mL. Da Peptide variieren, sollte jeder Prüfer titrieren Peptide, um optimale Ergebnisse zu erzielen.
- In der negativen Kontrolle Brunnen, nur add-Zellen (keine Peptide)
- In der positiven Kontrolle Brunnen, fügen Phytohämagglutinin (PHA; 10 ug / ml, Sigma).
- Inkubieren über Nacht bei 37 ° C mit 5% CO 2 (~ 18 Stunden).
Tag 3: Entwicklung der Platte
- Waschen Sie die Platte 6 mal mit 150 ul 1xPBS mit dem dump und Blot-Methode.
- Geben Sie 100 ul PBS in jede Vertiefung der Platte mit der Mehrkanalpipette.
- Legen Sie die Platte in den Kühlschrank für 15 Minuten.
- Nehmen Sie die Platte aus dem Kühlschrank und legen Sie sie in der Gewebekultur Kapuze.
- Bereiten Sie die Biotin-Antikörper-Lösung
- Add 0,5 ug / ml Biotin-Antikörper (mAK 7-B6-1) zu 11ml PBS.
- Vortex die Lösung gut mischen.
- Wenn der Planung bis zur Lösung hinzu mit einem Mehrkanal-, gießen Sie es in ein Reservoir.
- Entsorgen Sie die PBS durch flicking es in den Papierkorb. Achten Sie darauf, nicht auf den Teller spritzen, während Dumping.
- Platz 100 ul der Lösung in jedes Well.
- Die Platte in der Gewebekultur Haube bei Raumtemperatur für eine Stunde.
- Platte 6 mal mit 150 &mgr; l 1xPBS mit dem dump und Blot-Methode. Am 6. waschen, lassen Sie den PBS auf die Platte, bis Sie das Streptavidin Antikörper vorbereitet haben.
- Bereiten Sie die Streptavidin-Antikörper.
- Add 5,5 μ l Streptavidin-Antikörper (Streptavidin-ALP) zu 11ml PBS (1:2000 Verdünnung).
- Vortex die Lösung gut mischen.
- Wenn der Planung bis zur Lösung hinzu mit einem Mehrkanal-, gießen Sie es in ein Reservoir.
- Entsorgen Sie die PBS übrigen in den Brunnen und trocknen Sie die Platte.
- Add 100 ul Streptavidin-Lösung in jede Vertiefung.
- Die Platte in der Gewebekultur Haube bei Raumtemperatur für 1 Stunde.
- Wash Platten 6 mal mit PBS mit dem dump und Blot-Methode. Am 6. waschen, lassen Sie den PBS auf die Platte, bis Sie die Farbe Lösung gemacht haben.
- Die Arbeit in der Dunkelheit. Bereiten Sie die alkalische Phosphatase-Substrat-Lösung (Alkaline Phosphatase Substrate Kit IV BCIP / NBT):
- 4 Tropfen Substrat Reagenz 1 bis 11 ml Tris-Puffer, vortexen gut. 4 Tropfen Substrat Reagenz 2 bis Tris-Puffer, vortexen gut. 4 Tropfen Substrat Reagenz 3 bis Tris-Puffer, vortexen gut.
- Entsorgen Sie die verbleibenden PBS und trocknen Sie die Platte.
- Geben Sie 100 ul der Farbe Lösung in jede Vertiefung der Platte mit dem Multichannel.
- Schalten Sie das Licht nach 5 bis 10 Minuten Farbe zu entwickeln.
- Lassen Sie die Farbe Reagenzien auf der Platte bleiben, bis die Flecken zu drehen beginnen und lila sind recht dunkel. Dies sollte überall von 5 bis 20 Minuten. Achten Sie darauf, nicht auf die Substrat-Lösung zu lange verlassen, weil damit hohen Hintergrund verursachen könnten.
- Waschen Sie die ELISPOT Platte 3 mal mit Leitungswasser.
- Lassen Sie etwa eine Stunde oder über Nacht trocknen lassen.
- Lesen Platte entweder manuell oder mit ELISPOT-Reader.
- Bewahren Sie die Platte in eine Box vom Lichteinfall.
Repräsentative Ergebnisse:
ELISPOT wurde entwickelt, um Immunantworten gegen mikrobielle Antigene zu quantifizieren. Jeder Spot zeigt eine einzelne Zelle reagiert und drückt das Zytokin von Interesse. Die Spots können manuell oder mit Hilfe eines ELISPOT Plattenlesegerät gezählt werden.
Einschätzung, dass der ELISPOT korrekt durchgeführt wurde sollte mit der Untersuchung der negativen Kontrolle für den Hintergrund der Produktion des Zytokins von Interesse zu beginnen. In der negativen Kontrolle Brunnen würde man erwarten, dass keine Flecken zu sehen, obwohl ein wenig Hintergrund (violett) vorhanden sein. Normalerweise sollte es weniger als durchschnittlich fünf Punkte pro Vertiefung. Die positive Kontrolle Brunnen bestätigen, dass die Reaktion korrekt durchgeführt wurde, und dass die Zellen reagieren auf antigene Stimulation. In der positiven Kontrolle Brunnen Sie erwarten würden, um eine tiefe lila Hintergrund aufgrund eines Zusammenflusses von Flecken (Abb. 1) zu sehen. Es sollte wenig bis gar keine weißen Hintergrund. Wenn die positive und negative Kontrollproben angemessen sind, kann man dann zählen die Vertiefungen mit dem Antigen von Interesse. Ein "suboptimal" führen würde durch eine hohe Hintergrund (die Brunnen sind violett), keine Flecken oder sehr wenigen Stellen, leere Zentrum, schlecht definierte Punkte oder konfluierende Flecken reflektiert werden. Eine Liste von Tipps zur Fehlerbehebung vorgesehen ist (Tabelle 1).
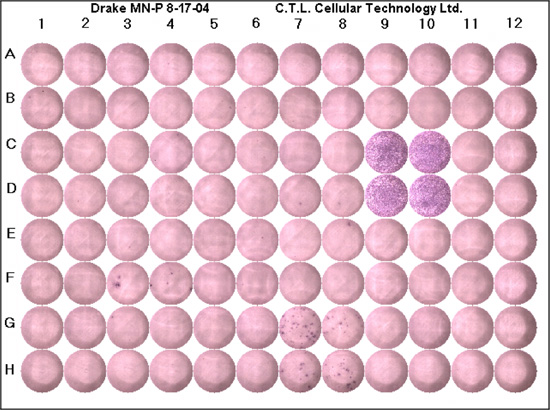
Abbildung 1. Ein Vertreter der ELISPOT Platte. Jede Platte sollte eine positive Kontrolle, Negativ-Kontrolle und Peptid von Interesse am Minimum in zwei Brunnen durchgeführt. C9, C10, D9 und D10 sind die positive Kontrolle Brunnen, wie Sie sehen können gibt es eine tiefe purpurrote Farbe, konfluenten Zellen und kaum weißem Hintergrund. Die negative Kontrolle Brunnen sind G11, G12, H11 und H12. Diese Brunnen haben keine lila Hintergrund und keine Flecken, wie erwartet. Die Spots G7, G8 zeigen, H7 und H8, zellulären Reaktionen auf mikrobielle Peptide, die lila Flecken bilden einen einheitlichen reagieren Zelle, die das Zytokin von Interesse.
Tabelle 1
| Beobachtung | Mögliche Ursache | Mögliche Lösung |
| Hoher Hintergrund | 1. Beide Seiten der Membran nicht richtig gewaschen 2. Zu viele sezernieren Zytokine 3. Platte nicht richtig getrocknet 4. Über entwickelte Platte | 1. Waschen Sie beide Seiten der Membran mit destilliertem Wasser vor und nach der Farbentwicklung. Reagenzien können durch die Membran in die Basis der Platte austreten, und diese können hohe Hintergrund verursachen, wenn nicht weggespült werden. 2. Reduzieren Sie die Anzahl der Zellen pro Vertiefung, wird dies erfordern Optimierung 3. Trocknen Sie die Platte länger vor dem Lesen 4. Reduzieren Sie Entwicklungszeit |
| Keine Flecken / Sehr wenige Spots | 1. Nicht genug sezernieren Zytokine / Protein von Interesse 2. Sicherstellen, dass die Zellen richtig stimuliert werden 3. Cells nicht l inkubiertong genug oder kann einige Zeit dauern, um Stimulans reagieren 4. Unzureichende Farbentwicklung 5. Nicht genug primären oder sekundären Antikörper | 1. Erhöhen Sie die Anzahl der Zellen. Dies erfordert eine Optimierung 2. Auch eine positive Stimulation Kontrolle - ein Stimulans, dass Sie wissen, Ausdruck Ihrer Zytokin / Protein von Interesse hervorrufen 3. Erhöhen Sie die Zelle Inkubationszeit oder indirekten Methode (pre-treat-Zellen mit Stimulans) 4. Monitor Farbentwicklung mit einem Overhead-Mikroskop und sicherzustellen, dass die Entwicklung von Reagenzien wurden ordnungsgemäß gelagert und nicht Aktivität verloren 5. Die Konzentration des primären und / oder sekundären Antikörper müssen erhöht werden. Dies erfordert eine Optimierung. |
| Blank Areas | 1. Membrane nicht vorbehandelt 2. Membrane hat irgendwann getrocknet 3. Cells ungleich verteilt | 1. Stellen Sie sicher, Membran ist ausreichend mit 70% Ethanol (alle Membranen brauchen das nicht so mit Ihrem Lieferanten überprüfen) vorbehandelt. Sorgfältig mit PBS 3X danach 2. Stellen Sie sicher, Membran nicht austrocknet 3. Stellen Sie sicher, mischen Sie die Zellen vorsichtig, um eine gute homologen Zellsuspension wurden vor dem Pipettieren in die Brunnen |
| Blank Center | 1. Schäden aus der Wäsche | 1. Durchfluss auf automatisierten U-Scheibe (oder Pipettieren) zu hoch sein kann. Brauchen Sie eine schonendere Waschverfahren |
| False Positives | 1. Sekundäre Antikörper Aggregate 2. Cells noch auf der Membran 3. Zellkultur Kontamination | 1. Filter des sekundären Antikörpers 2. Sicher, dass alle Zellen von der Membran mit PBS Tween 20 vor sekundären Antikörper-Inkubation gewaschen werden. Die Zellen auf der Membran links geben unregelmäßig geformte Flecken 3. Keep Reagenzien als steril und sauber wie möglich. Stellen Sie sicher, Zellkultur-Technik ist aseptisch. Überprüfen Sie für Fehlalarme, indem Sie einen Medien negative Kontrolle. Für Platte Bewegung, sehen schlecht definierten Stellen |
| Confluent Spots | 1. Schlechte Beschichtung, zu viel Antikörper 2. Längerer Zellkultur 3. Zellen über-stimulierten | 1. Reduzieren primärer Antikörper-Konzentration 2. Je länger die Zellen bebrütet werden, desto mehr Zytokin / Protein sie absondern. Dies wird in größeren Flecken, die beginnen zu verschmelzen und werden ununterscheidbar führen wird. 3. Reduzieren Zellkultur Schritt Inkubationszeit. Over-Stimulation wird in eine Menge von Zytokin / Protein von der Zelle ausgeschieden führen. Dies erzeugt Flecken, die beginnen zu verschmelzen und werden ununterscheidbar wird. Reduzieren Sie die Anzahl von Stimulanzien in den Kulturmedien und Kultur für eine kürzere Zeitspanne |
| Schlecht definierten Spots | 1. Membrane nicht vorbehandelt (wenn Ihr Membran dies erfordert, mit Lieferanten zu überprüfen) 2. Platte Bewegung während Zellinkubation | 1. Die Membran muss mit Ethanol oder kann dies in fuzzy, schlecht definierten Stellen durch vorbehandelt werden. Es wird schwierig für den Leser diese zu unterscheiden 2. Lassen Sie die Platte während Zellinkubation bewegen, wie Zellen, die bewegt haben mehr als einen Ort schaffen. Verwenden Sie möglichst ein eigenes Gründerzentrum, die nicht während der Inkubation wird geöffnet. Tippen Sie nicht auf die Platte nach der Zugabe Zellen |
| Positive Control Brunnen ist gering | 1. Unterentwicklung - kann durch die Verwendung Streptavidin-ALP und / oder BCIP / NBT-Lösungen, die nicht auf Raumtemperatur gebracht worden sein | 1. Die Reagenzien auf Raumtemperatur, bevor Sie in die Vertiefungen |
| Dichte der Flecken macht es schwierig zu quantifizieren | 1. Zu viele Zellen wurden in die Vertiefungen gegeben | 1. Machen Verdünnungen von Zellen (dh 1 x 10 6, 5 x 10 5, 1 x 10 5, 5 x 10 4, 1 x 10 4 Zellen pro Vertiefung), um die optimale Anzahl von Zellen, die bei der Bildung von verschiedenen Stellen durch bestimmen |
Diskussion
Der ELISPOT-Assay wurde als einer der wichtigsten und am häufigsten verwendeten Tests entstanden, um Immunantworten im Menschen zu überwachen und eine Vielzahl anderer Arten. Mit dem ELISPOT-Assay kann Immunzellen Frequenzen bei der einzelnen Zelle Ebene ohne Ausbau oder Manipulation von Zellpopulationen gemessen werden. ELISPOT-Assay wurde in großem Umfang angewendet, um Antigen-spezifische Immunantwort in verschiedenen Krankheiten, darunter Infektionen, Krebs, Allergien und Autoimmunerkrankungen untersuchen. Die An...
Offenlegungen
Danksagungen
Unterstützte teilweise durch Vanderbilt CTSA Grant 1 UL1 RR024975 vom National Center for Research Resources, National Institutes of Health. Diese Arbeit wurde vom NIH R01 HL 83839 finanziert werden; R01 AI 65744.
Materialien
A. Herstellung der Medien

B. Herstellung von Tris-Puffer
- Add 800 ml ddH 2 O auf 1 L Becherglas.
- Maßnahme 12 Gramm Tris und fügen in das Becherglas.
- Add 0,12 Gramm Magnesiumchlorid-Hexahydrat (MgCl 2: 6 H 2 O) in das Becherglas.
- Rühren Sie mit Magnetrührstab auf automatischen Rühren Platte.
- Nach der Auflösung, pH der Lösung auf 9,5.
- Add 200 ml ddH 2 O in das Becherglas, bringt es bis 1000ml.
- Die Lösung wird mit einem 0,22 um Filter.
C. Materialien, die für ELISPOT-Analyse:

Referenzen
- Dosanjh, D. P., Hinks, T. S., Innes, J. A., Deeks, J. J., Pasvol, G., Hackforth, S., Varia, H., Millington, K. A., Gunatheesan, R., Guyot-Revol, V., Lalvani, A. Improved diagnostic evaluation of suspected tuberculosis. Ann Intern Med. 148, 325-336 (2008).
- Sung, H. K. E. Diagnosis of abdominal tuberculosis by T-cell based assays on peripheral blood and peritoneal fluid mononuclear cells. Journal of Infection. 59, 409-415 (2009).
- Kim, S. -. H. Diagnosis of Central Nervous System Tuberculosis by T-Cell-Based Assays on Peripheral Blood and Cerebrospinal Fluid Mononuclear Cells. Clinical and Vaccine Immunology. , 1356-1362 (2008).
- Drake, W. P., Dhason, M. S., Nadaf, M., Shepherd, B. E., Vadivelu, S., Hajizadeh, R., Newman, L. S., Kalams, S. A. Cellular recognition of Mycobacterium tuberculosis ESAT-6 and KatG peptides in systemic sarcoidosis. Infect Immun. 75, 527-530 (2007).
- Allen, S. S., Evans, W., Carlisle, J., Hajizadeh, R., Nadaf, M., Shepherd, B. E., Pride, D. T., Johnson, J. E., Drake, W. P. Superoxide dismutase A antigens derived from molecular analysis of sarcoidosis granulomas elicit systemic Th-1 immune responses. Respir Res. 25, 36-36 (2008).
- Mutsvangwa, J., Millington, K. A., Chaka, K., Mavhudzi, T., Cheung, Y. B., Mason, P. R., Butterworth, A. E., Corbett, E. L., Lalvani, A. Identifying recent Mycobacterium tuberculosis transmission in the setting of high HIV and TB burden. Thorax. 65, 315-320 (2010).
- Streeck, H., Frahm, N., Walker, B. D. The role of IFN-gamma Elispot assay in HIV vaccine research. Nat Protoc. 4, 461-469 (2009).
- Chaudhary, N., Staab, J. F., Marr, K. A. Healthy human T-Cell Responses to Aspergillus fumigatus antigens. PLoS One. 5, e9036-e9036 (2010).
- Manigold, T., Mori, A., Graumann, R., Llop, E., Simon, V., Ferr, S. M., Valdivieso, F., Castillo, C., Hjelle, B., Vial, P. Highly differentiated, resting gn-specific memory CD8+ T cells persist years after infection by andes hantavirus. PLoS Pathog. 6, e1000779-e1000779 (2010).
- Ndongala, M. L., Kamya, P., Boulet, S., Peretz, Y., Rouleau, D., Tremblay, C., Leblanc, R., Côté, P., Baril, J. G., Thomas, R., Vézina, S., Boulassel, M. R., Routy, J. P., Sékaly, R. P., Bernard, N. F. Changes in function of HIV-specific T-cell responses with increasing time from infection. Viral Immunol. 2, 159-168 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten