É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Enzyme-linked immunospot Assay (ELISPOT): Quantificação de Th-1 respostas imunes celulares contra antígenos microbianos
Neste Artigo
Resumo
Identificação de alvos microbiana da imunidade adaptativa em doenças idiopática pode ser realizado através da utilização do ensaio immunospot enzyme-linked.
Resumo
Imunidade adaptativa é um componente importante para eliminação de patógenos intracelulares. A capacidade de detectar e quantificar essas respostas em seres humanos é uma importante ferramenta de diagnóstico. O ensaio de enzyme-linked immunospot (ELISPOT) está ganhando popularidade por sua capacidade de identificar respostas imunes celulares contra antígenos microbianos, incluindo populações imunossuprimidos, como aqueles com infecção pelo HIV, transplante e uso de esteróides. Este ensaio tem a capacidade de quantificar as respostas imunes contra antígenos microbianos específicos, bem como distinguir se estas respostas são Th1 ou Th2 em caráter. ELISPOT não se limita ao local da inflamação. É versátil na sua capacidade para avaliar a resposta imune no sangue periférico, bem como sites de envolvimento ativo, como lavado broncoalveolar, líquor cerebral, e ascite. Detecção de resposta imunológica contra um antígeno único ou múltiplo é possível, bem como epitopos específicos dentro de proteínas microbianas. Este ensaio facilita a detecção das respostas imunes ao longo do tempo, assim como distinções na antígenos reconhecidos pelas células T host. Ensaios de ELISPOT dupla de cores estão disponíveis para a detecção de expressão simultânea de duas citocinas. Aplicações recentes para esta técnica incluem o diagnóstico de tuberculose extrapulmonar, bem como a investigação da contribuição de antígenos infecciosos de doenças auto-imunes.
Protocolo
Para o protocolo a seguir, usamos células mononucleares do sangue periférico (PBMC) como as células de interesse. No entanto, este protocolo pode ser usado com outros tipos celulares. Realizar o ensaio em uma capa de cultura de tecido usando a técnica estéril.
Dia 1: Elaboração de Placa e Células
- Tirar uma placa de ELISPOT e abri-lo no bairro.
- Lavar a placa 3 vezes com 150 mL de PBS 1X usando um pipetador multicanal, se disponível, caso contrário, pipetagem único bem é aceitável.
- Retire um pacote de reservatórios e abri-lo no capô.
- Adicione 2 mg / mL do anticorpo de captura, anti-humana Interferon-γ, a 11 mL de PBS 1X. Vortex bem. Transferência mix de anticorpos para um reservatório.
- Lugar de 100 L da solução de revestimento em cada poço usando o multicanal.
- Embrulhe a placa em parafilme.
- Coloque o prato na geladeira durante a noite. As placas são boas para a semana. A regra de ouro é que se houver ainda resta de líquido nos poços, a placa pode ser utilizada.
Preparação de células
Se o PBMCs são frescos, em seguida, contar as células e incubar durante a 37 ° C com 5% de CO 2. Para PBMC armazenados em nitrogênio líquido, o descongelamento de células é necessário. O protocolo é o seguinte:
- Descongele a cryovial de células em 37 ° C banho-maria até quase completamente descongelado.
- Imediatamente ressuspender em 5 mL de R10 mídia.
- Rodada por 5 minutos a 225 x g.
- Ressuspender novamente em 5 mL de R10 media e contagem de células viáveis com azul de tripano.
- Traga concentração para 2 x 10 6 células / mL em R10 mídia.
- Descansar durante a noite a 37 ° C com 5% de CO 2.
Dia 2: Configurar a placa de
- Tampa etiqueta da placa com o número de amostras de identificação, condições de bem, e data.
- Lave a placa 6 vezes com 150 mL de PBS estéril 1x usando o dump e método blot. Tenha cuidado para não espirrar a placa enquanto dumping. Isso pode causar as cavidades da placa para girar o roxo.
- Adicionar 100 mL de R20 a cada poço.
- Incubar a placa a 37 ° C por 1 hora.
- Enquanto a placa é a incubação, contar as células que foram descansou durante a noite.
- Gire a suspensão celular a 1500 rpm por 5 minutos. Decantar o sobrenadante e ressuspender o sedimento para que você tenha uma concentração final de 1x10 6 células por 1mL em R10 mídia.
- Após a incubação de 1 hora, retire o R20 com o despejo e método blot. Tenha cuidado para não espirrar a placa enquanto dumping.
- Adicionar 100 mL de solução de célula (10 5 células) em cada poço. Adicionar peptídeos apropriados e / ou antígenos para os poços correspondentes em duplicata. Use uma ponteira de pipeta nova cada vez que você entrar na solução de peptídeo de trabalho. Concentração de peptídeo normal é 10-40 mcg / mL. Desde peptídeos variam, cada investigador deverá titular peptídeos para obter os melhores resultados.
- Nos poços de controlo negativo, apenas adicionar células (sem peptídeos)
- Nos poços de controlo positivo, adicione fitohemaglutinina (PHA, 10 mcg / mL; Sigma).
- Incubar durante a 37 ° C com 5% de CO 2 (~ 18 horas).
Dia 3: Desenvolvimento da Prata
- Lave a placa 6 vezes com 150 mL 1xPBS usando o dump e método blot.
- Adicionar 100 mL PBS a cada poço da placa usando o pipetador multicanal.
- Coloque o prato na geladeira por 15 minutos.
- Pegue a placa fora da geladeira e colocá-lo na capa de cultura de tecidos.
- Prepare a solução de anticorpos biotina
- Adicionar 0,5 mg / mL de anticorpos biotina (MAB 7-B6-1) para 11mL PBS.
- Vortex da solução para misturar bem.
- Se o planejamento para adicionar a solução com um multicanal, derramá-la em um reservatório.
- Descartar a PBS sacudindo-a na lixeira. Tenha cuidado para não espirrar a placa enquanto dumping.
- Lugar de 100 L da solução em cada poço.
- Incubar a placa na capa de cultura de tecido em temperatura ambiente por uma hora.
- Lavar placa 6 vezes com 150μL 1xPBS usando o dump e método blot. Sobre a lavagem 6 º, deixe o PBS sobre a placa até que você tenha preparado o anticorpo Estreptavidina.
- Prepare o anticorpo Estreptavidina.
- Adicionar 5,5 μ l Estreptavidina anticorpos (estreptavidina-ALP) para 11mL de PBS (diluição 1:2000).
- Vortex da solução para misturar bem.
- Se o planejamento para adicionar a solução com um multicanal, derramá-la em um reservatório.
- Descartar as restantes PBS nos poços e inverter a placa.
- Adicionar 100 mL de solução de estreptavidina a cada poço.
- Incubar a placa na capa de cultura de tecido em temperatura ambiente por 1 hora.
- Lavar as placas 6 vezes com PBS usando o dump e método blot. Sobre a lavagem 6 º, deixe o PBS sobre a placa até que você tenha feito a solução de cor.
- Trabalhar no escuro. Preparar a solução de substrato de fosfatase alcalina (Alcalina Fosfatase Substrato Kit IV BCIP / NBT):
- Adicione 4 gotas de reagente substrato 1-11 mL Tris buffer, vortex bem. Adicione 4 gotas do reagente substrato 2 a Tris buffer, vortex bem. Adicione 4 gotas do reagente substrato 3 a Tris buffer, vortex bem.
- Descartar as restantes PBS e inverter a placa.
- Adicionar 100 mL da solução de cor a cada poço da placa usando o multicanal.
- Acender a luz depois de 5 a 10 minutos de cor em desenvolvimento.
- Permitir que os reagentes de cor para permanecer na placa até que as manchas começam a ficar roxo e são bastante escuro. Isso deve levar de 5 a 20 minutos. Tenha cuidado para não deixar a solução de substrato por muito tempo, pois isso poderia causar alto background.
- Lave a placa ELISPOT 3 vezes com água da torneira.
- Deixar secar durante cerca de uma hora ou durante a noite.
- Leia placa manualmente ou com ELISPOT leitor de placas.
- Armazenar a placa em uma caixa longe da exposição de luz.
Resultados representativos:
ELISPOT foi projetado para quantificar as respostas imunológicas contra antígenos microbianos. Cada ponto indica uma única célula sensível, expressando a citocina de interesse. As manchas podem ser contados manualmente ou utilizando um leitor de placas ELISPOT.
Avaliação de que o ELISPOT tem sido realizada corretamente deve começar com a investigação do controle negativo para a produção de fundo da citocina de interesse. Nos poços de controlo negativo seria de esperar para ver nenhum ponto, apesar de um pouco de fundo (cor púrpura) podem estar presentes. Normalmente, não deve ser inferior a uma média de cinco pontos por poço. Os poços de controlo positivo confirmar que a reação tenha sido realizada corretamente, e que as células respondem ao estímulo antigênico. Nos poços de controlo positivo que você esperaria ver um fundo roxo profundo devido a uma confluência de pontos (fig. 1). Deve haver pouca ou nenhuma fundo branco. Se o controle positivo e amostras de controlo negativo são apropriados, pode-se contar os poços contendo o antígeno de interesse. Um resultado "subótima" seria refletida pela alta de fundo (os poços são roxo), sem manchas ou pontos muito poucos, o centro em branco, manchas mal definida ou pontos confluentes. Uma lista de dicas de solução é fornecida (Tabela 1).
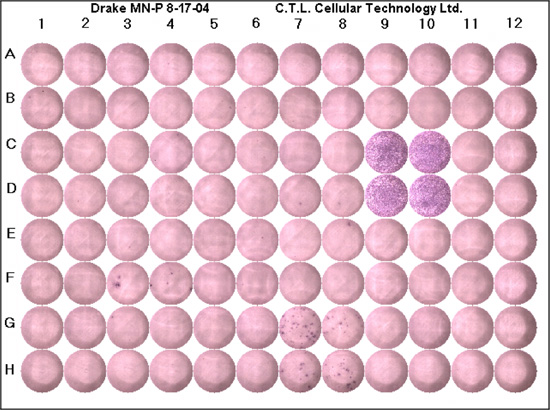
Figura 1. Um representante da chapa de ELISPOT. Cada chapa deve conter um controle positivo, controle negativo e peptídeos de interesse realizados no mínimo em dois poços. C9, C10, D9 e D10 são os poços de controlo positivo, como você pode ver, há uma cor arroxeada, as células confluentes e dificilmente qualquer fundo branco. Os poços de controlo negativo são G11, G12, H11 e H12. Estes poços não tem fundo roxo e sem manchas como esperado. As manchas G7, G8, H7 e H8, ilustrar respostas celulares a peptídeos microbianos; os pontos roxos representam uma única célula sensível expressando a citocina de interesse.
Tabela 1
| Observação | Problema Possível | Solução possível |
| Elevado ruído de fundo | 1. Ambos os lados da membrana não lavadas adequadamente 2. Citocina muitas células secretoras 3. Placa não secas adequadamente 4. Sobre a placa desenvolvida | 1. Lavar ambos os lados da membrana com água destilada antes e após o desenvolvimento da cor. Reagentes podem vazar através da membrana na base da placa, e estes podem causar alto background, se não lavados. 2. Reduzir o número de células por poço, isto exigirá otimização 3. Secar a placa mais antes de ler 4. Reduzir o tempo de desenvolvimento |
| Sem manchas / Spots Muito poucos | 1. Não o suficiente células secretoras de citocinas / proteína de interesse 2. Assegurar que as células são estimuladas corretamente 3. Células não incubadas por long suficiente ou pode levar algum tempo para responder a estimulante 4. Desenvolvimento de cor inadequada 5. Anticorpos não é suficiente primária ou secundária | 1. Aumentar o número de células. Isso exigirá a otimização 2. Também usar um controle de estimulação positiva - um estimulante que você sabe que vai induzir a expressão do seu citocina / proteína de interesse 3. Aumentar o tempo de incubação da célula ou utilizar o método indirecto (pré-tratamento de células com estimulante) 4. Monitorar o desenvolvimento de cor com um microscópio de sobrecarga e assegurar que os reagentes em desenvolvimento têm sido armazenados corretamente e não perdeu a atividade da 5. Concentração do anticorpo primário e / ou secundário terá de ser aumentado. Isso vai exigir de otimização. |
| Áreas em branco | 1. Membrana não pré-tratados 2. Membrana secou em algum estágio 3. Células distribuídas de forma desigual | 1. Garantir a membrana é adequadamente pré-tratados com etanol 70% (todas as membranas não precisa deste modo a verificar com o seu fornecedor). Lave bem com PBS 3X depois 2. Garantir a membrana não seca 3. Certifique-se de misturar as células com cuidado para ter uma boa suspensão de células homólogas antes de pipetar para fora dos poços |
| Centro em branco | 1. Danos da lavagem | 1. Taxa de fluxo na máquina de lavar automática (ou pipetagem) pode ser muito alto. Precisa de um procedimento de lavagem mais suave |
| Falsos positivos | 1. Secundário de agregados de anticorpos 2. Células ainda na membrana 3. Contaminação de cultura de células | 1. Filtrar o anticorpo secundário 2. Garantir que todas as células são lavadas da membrana com PBS Tween 20 antes da incubação do anticorpo secundário. Células à esquerda na membrana dará irregular manchas em forma 3. Manter reagentes como estéril e limpo possível. Garantir a sua técnica de cultura de células é asséptica. Verifique se há falsos positivos, executando um controle de mídia negativa. Para o movimento das placas, ver os pontos mal definidos |
| Spots confluentes | 1. Pobres revestimento, anticorpos muito 2. Cultura de células prolongada 3. Células sobre-estimulados | 1. Reduzir a concentração de anticorpo primário 2. Quanto mais tempo as células são incubadas, mais de citocinas / proteína eles secretam. Isto irá resultar em manchas maiores, que vai começar a se fundir e tornar-se indistinguíveis. 3. Reduzir o tempo de incubação de cultura de células passo. Sobre-estimulação resultará em uma grande quantidade de citocina / proteína que está sendo secretada pela célula. Isto irá produzir spots que vão começar a se fundem e tornam-se indistinguíveis. Reduzir a quantidade de estimulantes nos meios de cultura ou cultura para um curto período de tempo |
| Spots mal definidas | 1. Membrana não pré-tratados (se sua membrana exige isso, verifique com o fornecedor) 2. Movimento da placa durante a incubação de células | 1. A membrana deve ser pré-tratados com etanol ou isso pode resultar em fuzzy, spots mal definidos. Vai ser difícil para o leitor a distinguir estes 2. Não permita que a placa se mover durante a incubação de células como as células que se mudaram irá criar mais de um ponto. Se possível, use uma incubadora dedicada que não será aberto durante a incubação. Não toque na placa após a adição de células |
| Controle positivo poços é baixa | 1. Subdesenvolvimento - pode ser resultado do uso de streptavidina-ALP e / ou BCIP / NBT soluções que não foram trazidas à temperatura ambiente | 1. Trazer os reagentes à temperatura ambiente antes de adicionar aos poços |
| Densidade dos pontos faz com que seja difícil quantificá-los | 1. Células demais foram adicionados aos poços | 1. Fazer diluições de células (ou seja, 1 x 10 6, 5 x 10 5, 1 x 10 5, 5 x 10 4, 1 x 10 4 células por poço) para determinar o número ideal de células que irá resultar na formação de pontos distintos |
Discussão
O ensaio de ELISPOT tem emergido como um dos ensaios mais importantes e amplamente utilizados para monitorar as respostas imunes em humanos e uma variedade de outras espécies. Com o ensaio ELISPOT, as freqüências de células imunes podem ser medidos no nível da célula única, sem expansão ou a manipulação de populações de células. ELISPOT tem sido amplamente aplicado para investigar antígeno específico respostas imunes em várias doenças, incluindo infecções, câncer, alergias e doenças auto-imunes. A a...
Divulgações
Agradecimentos
Apoiado em parte pela Vanderbilt CTSA conceder um UL1 RR024975 do Centro Nacional de Pesquisa de Recursos, National Institutes of Health. Este trabalho foi financiado pelo NIH R01 HL 83839; R01 AI 65744.
Materiais
A. Preparação de Mídia

B. Elaboração de Tris tampão
- Adicione 800 ml de DDH 2 O a 1 copo L.
- Medida 12 gramas de Tris e adicione ao copo.
- Adicionar 0,12 gramas de cloreto de magnésio hexa-hidratado (MgCl 2: 6H 2 O) no copo.
- Mexa com vara de agitação magnética na placa de agitação automática.
- Uma vez dissolvido, pH da solução para 9,5.
- Adicionar 200 mL de DDH 2 O para o copo, levando-o até 1000ml.
- Filtrar a solução com um filtro de 0,22 mM.
C. Materiais necessários para as análises ELISPOT:

Referências
- Dosanjh, D. P., Hinks, T. S., Innes, J. A., Deeks, J. J., Pasvol, G., Hackforth, S., Varia, H., Millington, K. A., Gunatheesan, R., Guyot-Revol, V., Lalvani, A. Improved diagnostic evaluation of suspected tuberculosis. Ann Intern Med. 148, 325-336 (2008).
- Sung, H. K. E. Diagnosis of abdominal tuberculosis by T-cell based assays on peripheral blood and peritoneal fluid mononuclear cells. Journal of Infection. 59, 409-415 (2009).
- Kim, S. -. H. Diagnosis of Central Nervous System Tuberculosis by T-Cell-Based Assays on Peripheral Blood and Cerebrospinal Fluid Mononuclear Cells. Clinical and Vaccine Immunology. , 1356-1362 (2008).
- Drake, W. P., Dhason, M. S., Nadaf, M., Shepherd, B. E., Vadivelu, S., Hajizadeh, R., Newman, L. S., Kalams, S. A. Cellular recognition of Mycobacterium tuberculosis ESAT-6 and KatG peptides in systemic sarcoidosis. Infect Immun. 75, 527-530 (2007).
- Allen, S. S., Evans, W., Carlisle, J., Hajizadeh, R., Nadaf, M., Shepherd, B. E., Pride, D. T., Johnson, J. E., Drake, W. P. Superoxide dismutase A antigens derived from molecular analysis of sarcoidosis granulomas elicit systemic Th-1 immune responses. Respir Res. 25, 36-36 (2008).
- Mutsvangwa, J., Millington, K. A., Chaka, K., Mavhudzi, T., Cheung, Y. B., Mason, P. R., Butterworth, A. E., Corbett, E. L., Lalvani, A. Identifying recent Mycobacterium tuberculosis transmission in the setting of high HIV and TB burden. Thorax. 65, 315-320 (2010).
- Streeck, H., Frahm, N., Walker, B. D. The role of IFN-gamma Elispot assay in HIV vaccine research. Nat Protoc. 4, 461-469 (2009).
- Chaudhary, N., Staab, J. F., Marr, K. A. Healthy human T-Cell Responses to Aspergillus fumigatus antigens. PLoS One. 5, e9036-e9036 (2010).
- Manigold, T., Mori, A., Graumann, R., Llop, E., Simon, V., Ferr, S. M., Valdivieso, F., Castillo, C., Hjelle, B., Vial, P. Highly differentiated, resting gn-specific memory CD8+ T cells persist years after infection by andes hantavirus. PLoS Pathog. 6, e1000779-e1000779 (2010).
- Ndongala, M. L., Kamya, P., Boulet, S., Peretz, Y., Rouleau, D., Tremblay, C., Leblanc, R., Côté, P., Baril, J. G., Thomas, R., Vézina, S., Boulassel, M. R., Routy, J. P., Sékaly, R. P., Bernard, N. F. Changes in function of HIV-specific T-cell responses with increasing time from infection. Viral Immunol. 2, 159-168 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados