A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الميتوكوندريا من عزل العضلات والهيكل العظمي
* These authors contributed equally
In This Article
Summary
يصف هذا البروتوكول إجراء دراسة التنفس من الميتوكوندريا المعزولة من عضلات الهيكل العظمي. وقد تم تكييف هذا الأسلوب من Scorrano وآخرون. (2007). لإجراء العزل الميتوكوندريا يتطلب حوالي 2 ساعة. ويمكن الانتهاء من تنفس الميتوكوندريا في حوالي 1 ساعة.
Abstract
الميتوكوندريا هي عضيات السيطرة على حياة وموت الخلية. يشاركون في التفاعلات الأيضية الرئيسية ، تجميع معظم لاعبي التنس المحترفين ، وتنظيم عدد من الإشارات شلالات 2،3. وقد عزل الباحثون في الماضي والحاضر الميتوكوندريا من أنسجة الجرذان والفئران مثل المخ والكبد والقلب 4،5. في السنوات الأخيرة ، ركزت العديد من الباحثين على دراسة وظيفة الميتوكوندريا من عضلات الهيكل العظمي.
هنا ، نحن تصف الطريقة التي استخدمناها بنجاح لعزل الميتوكوندريا من عضلات الهيكل العظمي 6. إجراءاتنا يتطلب أن يتم إجراء كافة المخازن والكواشف الطازجة ويحتاجون لحوالي 250-500 ملغ من الهيكل العظمي والعضلات. درسنا الميتوكوندريا المعزولة من الساق الجرذان والفئران والحجاب الحاجز والعضلات خارج المقلة الفئران. ويتم قياس تركيز البروتين الميتوكوندريا مقايسة مع برادفورد. من المهم أن تظل عينات الجليد الميتوكوندريا الباردة خلال إعداد وتنفيذ الدراسات أن وظيفية في غضون فترة زمنية قصيرة نسبيا (~ 1 ساعة). ويتم قياس التنفس الميتوكوندريا باستخدام تخطيط الاستقطاب الكهربائي مع كلارك من نوع (Oxygraph النظام) عند 37 درجة مئوية 7. معايرة القطب الأكسجين هو خطوة أساسية في هذا البروتوكول ، ويجب أن يقوم عليها يوميا. الميتوكوندريا المعزولة (150 ميكروغرام) تضاف إلى 0.5 مل من العازلة التجريبية (EB). 2 حالة التنفس يبدأ مع اضافة الغلوتامات (5mM) ومالات (2.5 ملم). ثم ، يضاف ثنائي فسفات الأدينوزين (ADP) (150 ميكرومتر) لبدء ولاية 3. يستخدم Oligomycin (1 ميكرون) ، ومانع سينسيز أتباز ، لتقدير الدولة 4. أخيرا ، الكربونيل السيانيد ف [trifluoromethoxy] هو المضافة فينيل هيدرازون (FCCP ، و 0.2 ميكرومتر) لmeasurestate 5 أو 6 uncoupled التنفس. ويتم احتساب نسبة سيطرة الجهاز التنفسي (RCR) ، ونسبة 3 إلى حالة الدولة 4 ، بعد كل تجربة. يعتبر RCR ≥ 4 كدليل على مستحضر الميتوكوندريا قابلة للحياة.
باختصار ، نقدم طريقة لعزل الميتوكوندريا قابلة للحياة من عضلات الهيكل العظمي التي يمكن استخدامها في (مثل نشاط انزيم ، مناعي ، البروتيوميات ،) البيوكيميائية والدراسات الفنية (الميتوكوندريا التنفس).
Protocol
1. إعداد المخازن
- بدوره على 5804R الطرد المركزي وتعيين إلى 4 درجات مئوية. بدوره على حمام ماء Isotemp 3006D وتعيين إلى 37 درجة مئوية.
- إعداد الحلول التالية قبل العزلة العضلات :
- PBS : ذوب الفوسفات مخزنة المالحة (PBS) أقراص في الماء المقطر (5 أقراص / لتر). مزيج جيد.
- برنامج تلفزيوني بالاضافة الى 10 ملي EDTA : لإعداد حل 100 مل ، إضافة 2 مل من EDTA ملي 500-98 مليلتر من برنامج تلفزيوني.
- الميتوكوندريا العازلة 8X : 10.28 غرام من السكروز عن تركيز النهائي من 0.6 متر ، 400 ملغ من الأحماض الدهنية الحرة ألبومين المصل البقري (BSA) لتركيز النهائي من 0.8 ٪ ، 2،08 غرام من HEPES لتركيز النهائي من 160 مم ، ودرجة الحموضة وإلى 7.4 QS إلى 50 مل بالماء المقطر.
- الاحتياطي العزلة 1 (IB1) : أضف 200 ميكرولتر من EDTA 500 مم لتركيز النهائي من 10 مم ، 0.392 غرام من مد مانيتول لتركيز النهائي من 215 مم ، 1.25 مل من 8X الميتوكوندريا درجة الحموضة ، وإلى 7.4 العازلة QS إلى 10 مل من الماء المقطر.
- الاحتياطي العزلة 2 (IB2) : أضف 60 ميكرولتر من EGTA 500 مم لتركيز النهائي من 3 مم ، 0.392 غرام من مد مانيتول لتركيز النهائي من 215 مم ، 1.25 مل من 8X الميتوكوندريا درجة الحموضة ، وإلى 7.4 العازلة QS إلى 10 مل من الماء المقطر.
- الاحتياطي التجريبية (EB) : أضف 100 ميكرولتر من 500 مم 2 للMgCl تركيز النهائي من 5 ملم ، 0.392 غرام من مد مانيتول لتركيز النهائي من 215 ملم ، 25 ميكرولتر من 2.5 ملي KH 2 PO 4 لتركيز النهائي 6.25 ميكرومتر ، 2 ميكرولتر من EGTA 100 ملم لتركيز النهائي من 20 ميكرون ، 1.25 مل من الميتوكوندريا العازلة ، ودرجة الحموضة إلى 7.4 وQS إلى 10 مل بالماء المقطر.
2. عزل العضلات
- في دلو الثلج ، وضعت ثلاثة أكواب 10 مل ، والمطاحن ، Elvehjem بوتر الأنسجة وغيرها من الصكوك كل ما يلزم / لوازم على الجليد. كل شيء يجب أن يبقى الثلج الباردة طوال التجربة.
- مكان IB1 وIB2 في دلو الثلج وEB في حمام ماء دافئ عند الانتهاء.
- في الأكواب three 10 مل ، ينبغي أن تضاف الحلول التالية :
- الكأس 1 : 10 مل من برنامج تلفزيوني
- دورق 2 : 10 مل من PBS / EDTA
- دورق 3 : 3 مل من IB1
- قتل الفئران إنسانية على النحو الذي أقرته الخاص المحلي رعاية الحيوان واللجنة المؤسسية الاستخدام.
- عزل بسرعة 250-500 ملغ من الهيكل العظمي والعضلات ، وشطف بيكر في 1 ، ثم نقل إلى الكوب 2.
3. التجانس / عزل الميتوكوندريا
- نقل العضلات لبيكر (3) واللحم المفروم ناعما العضلات مع المقص.
- نقل حل لالخالط بوتر - Elvehjem. التجانس العضلات باستخدام مدقة بمحركات (صحافة الحفر سوف قيام بهذه المهمة) 10 مرات في الحفاظ على أنبوب الثلج في جميع الأوقات.
- جناسة نقل مبردة إلى ما قبل microcentrifuge أنابيب 2 مل والطرد المركزي في 700 غ لمدة 10 دقيقة على 4 درجات مئوية.
- طاف لنقل أنبوب جديد microcentrifuge قبل مبردة. تجاهل بيليه.
- طاف في أجهزة الطرد المركزي 10500 ز لمدة 10 دقائق على 4 درجات مئوية.
- طاف لنقل أنبوب جديد microcentrifuge قبل المبردة وSN1 تسمية (طاف عدد 1) ونوع العضلات.
- اعادة تعليق بيليه في 500 ميكرولتر من IB2.
- ز الطرد المركزي في 10500 لمدة 10 دقائق على 4 درجات مئوية.
- طاف لنقل أنبوب جديد microcentrifuge قبل المبردة وSN2 تسمية (طاف عدد 2) ونوع العضلات.
- تعليق النهائي الميتوكوندريا بيليه في 100 ميكرولتر من IB2.
- إعادة دوران تعليق الميتوكوندريا النهائي في minifuge لبضع ثوان. إذا كان هناك بيليه ، ونقل طاف لأنبوب جديد microcentrifuge قبل المبردة وتجاهل بيليه.
- تحديد تركيز البروتين باستخدام مقايسة برادفورد 8.
4. القطب المعايرة
ملاحظة : أكمل المعايرة الكهربائي خلال العزلة الميتوكوندريا.
- إضافة 100 مل من الماء المقطر إلى 250 مل من القارورة. تحريك بقوة لمدة 20 دقيقة للتوازن الماء مع الغاز في الغلاف الجوي.
- إضافة بضع قطرات من 50 ٪ إلى القطب بوكل Oxygraph.
- ضع قطعة صغيرة من الورق المتداول Rizla الأزرق على قمة القطب.
- ضع قطعة من الغشاء PTFE على رأس ورقة المتداول.
- تطبيق الحلقة الداخلية باستخدام قضيب الطوق ثم ضع الطوق الخارجي في الأخدود الكهربائي.
- توصيل الأقطاب الكهربائية وتجميع ما تبقى من المعدات : أكبر قاعدة حلقة من البلاستيك ، وغرفة الميتوكوندريا ، وخراطيم المياه.
- بدوره على صناديق Oxygraph وبدء برنامج Oxygraph.
- يضاف الماء إلى الغرفة معايرتها الميتوكوندريا.
- إضافة شريط تحريك وتشغيل إلى سرعة 60.
- تبدأ تجربة جديدة.
- انقر على معايرة ثم السائل المعايرة للمرحلة الإطار 1. التغير في درجة الحرارة إلى 37 درجة مئوية ، وانقر على زر "موافق" مرتين.
- عندما "تجاوز" تغييرات "موافق" فوقه وفتح خزان غاز النيتروجين.
- غيض مكان متصلة دبابات النتروجين في الغرفة ووضع الأكسجين صفر. Cلعق "موافق" عندما ينتقل من "تجاوز".
- نضح الماء وإضافة 500 ميكرولتر من EB العازلة لغرف الميتوكوندريا.
- ختم الغرفة مع الغطاس.
- إذا باستخدام صناديق متعددة ، كرر الخطوات 11-15 لمعايرة الإطار 2.
5. الميتوكوندريا التنفس
- بدء تجربة جديدة ، فلتكن لتشغيل حوالي 1 دقيقة لتحقيق الاستقرار في الإشارة.
- إضافة حجم اللازمة لتعليق الميتوكوندريا (الخطوة 3.11) لمدة 150 ميكروغرام في كل من المجلسين ، الحدث علامة ، والسماح لها الترشح ل1 دقيقة.
- أضف 10 ميكرولتر من الحارة 250 ملي mM/125 الغلوتامات / مالات لتركيز النهائي من 5 ملي mM/2.5. وترك علامة تشغيل لمدة 1 دقيقة. يتم تعريف هذه الدولة كما 2.
- إضافة 7.5 ميكرولتر من ADP 10 مم لتركيز النهائي من 150 ميكرومتر ، العلامة ، والسماح للتشغيل لمدة 30 ثانية. يتم تعريف هذه الدولة كما 3.
- إضافة آخر ميكرولتر 7.5 من 10 ملي ADP ، العلامة ، والسماح للتشغيل لمدة 1.5 دقيقة.
- إضافة 0.5 ميكرولتر من البرد oligomycin 10 مم لتركيز النهائي من 1 ميكرون ، العلامة ، والسماح للتشغيل لمدة 3 دقائق. ويعرف هذا كدولة 4.
- إضافة 1 ميكرولتر من البرد FCCP 0.1 ملم لتركيز النهائي من 0.2 ميكرون ، العلامة ، والسماح للتشغيل لمدة 3 دقائق. يتم تعريف هذه الدولة كما 5.
- عند الانتهاء ، في نهاية التجربة وحفظها.
- الحصول على معدلات التنفس باستخدام البرمجيات Oxygraph.
- أدخل عامل التطبيع : إذا ما أضيف 150 ميكروغرام من البروتين الميتوكوندريا ، وعامل تطبيع سيتم 0.15.
- حساب معدلات التنفس طبيعيا لدول تنفس مختلفة.
- حساب نسبة مراقبة الجهاز التنفسي (RCR) بتقسيم الدولة 3 في الدولة 4.
6. ممثل النتائج :
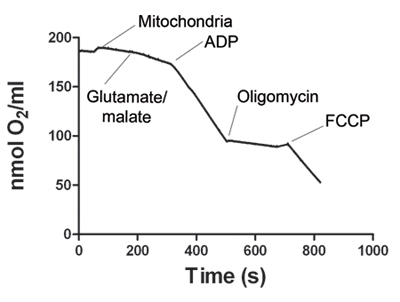
الشكل 1. يظهر ممثل تتبع استهلاك الأوكسجين من قبل العضلات والهيكل العظمي الميتوكوندريا. بعد أن يستقر في إشارة الكهربائي ، إضافة إلى عينة الميتوكوندريا Oxygraph الغرفة. 2 حالة التنفس يبدأ مع اضافة الغلوتامات ومالات. إضافة ADP يزيد استهلاك الأوكسجين ، وتحديد الدولة 3 التنفس. تم حظر سينسيز اعبي التنس المحترفين عن طريق إضافة للحصول على دولة oligomycin 4 التنفس. أخيرا ، إضافة إلى فك الارتباط بين FCCP التنفس الميتوكوندريا (الدولة 5). يبين الجدول 1 معدلات استهلاك الأوكسجين ممثل للدول 2 ، 3 ، 4 و 5. ويتم احتساب نسبة سيطرة الجهاز التنفسي (RCR) لكل تجربة. RCR يعتبر ≥ 4 كدليل على مستحضر الميتوكوندريا قابلة للحياة.
| الدول | تطبيع أسعار |
| الدولة 2 | 34.74 |
| الدولة 3 | 153.40 |
| الدولة 4 | 16.49 |
| 5 الدولة | 143.70 |
| RCR | 9.30 |
الجدول 1. معدلات التنفس الميتوكوندريا. Representativeoxygen معدلات الاستهلاك من الهيكل العظمي والعضلات الميتوكوندريا. تم تطبيع القيم إلى مبلغ الميتوكوندريا إضافة إلى الغرفة. يتم تحديد نسبة السيطرة التنفسية (RCR) بتقسيم الدولة من قبل الدولة 3 4. وRCR ≥ 4 يمثل إعداد قابلة للحياة الميتوكوندريا.
Access restricted. Please log in or start a trial to view this content.
Discussion
نقدم بروتوكول لعزل الميتوكوندريا قابلة للحياة من عضلات الهيكل العظمي. إذا كان العائد هو المشكلة ، يمكن تعديل البروتوكول من قبل تفرخ في عضلة معزولة في 5 مل من PBS/10mM التربسين EDTA/0.01 ٪ لمدة 30 دقيقة في الجليد. لضمان إتمام عملية الهضم العضلات مع التربسين ، والعضلات تحتاج إلى ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
Acknowledgements
وأيد هذا العمل من خلال منحة من المعهد الوطني للعيون (R01 EY12998) لاندرادي FH.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 95% CO2 / 5% O2 mix | Local Gas Supplier | ||
| Adenosine 5′-diphosphate sodium salt | Sigma-Aldrich | A2754 | |
| Blue Rizla Paper | Hansatech | 890101 | |
| Bradford protein assay | Bio-Rad | 500-0006 | |
| Carbonylcyanide p-trifluoromethoxyphenylhydrazone (FCCP) | Sigma-Aldrich | C2920 | |
| Centrifuge 5804R | Eppendorf | ||
| Compressed nitrogen | Local Gas Supplier | ||
| D-mannitol | Sigma-Aldrich | M9647 | |
| Ethlyene-glycol-bis-tetraacetic acid (EGTA) | Sigma-Aldrich | E3889 | |
| Ethylenediaminetetraacetic acid (EDTA) | Bio-Rad | 161-0728 | |
| Free fatty acid bovine serum albumin | Sigma-Aldrich | A8806 | |
| Glutamic acid | Sigma-Aldrich | G5889 | |
| HEPES sodium salt | Sigma-Aldrich | H7006 | |
| Isotemp 3006D | Fisher Scientific | ||
| Magnesium chloride | Sigma-Aldrich | M8266 | |
| Male Sprague Dawley Rats | Harlan Laboratories | 300-500g | |
| Malic acid | Sigma-Aldrich | M9138 | |
| Minifuge | ISC Bioexpress | C1301P | |
| Oligomycin | Sigma-Aldrich | O4876 | |
| Oxygen electrode disc | Hansatech | S1 | |
| Oxygraph | Hansatech | ||
| Oxygraph Plus V1.01 Software | Hansatech | ||
| pH-meter | Mettler Toledo | 1225506149 | |
| Phosphate-buffered saline (PBS) | Sigma-Aldrich | P4417 | |
| Potassium chloride | Sigma-Aldrich | P3911 | |
| Potassium phosphate | Sigma-Aldrich | P8416 | |
| Potter-Elvehjem homogenizers | Fisher Scientific | 08-414-14A | |
| PTFE (0.0125mm × 25mm) membrane | Hansatech | S4 | |
| SKIL 3320 drill press | Hardware store | ||
| Sucrose | Sigma-Aldrich | S5016 |
References
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle and cultured fibroblasts. Nat Protoc. 2, 287-295 (2007).
- Duchen, M. R. Roles of mitochondria in health and disease. Diabetes. 53, Suppl 1. S96-S102 (2004).
- Johannsen, D. L., Ravussin, E. The role of mitochondria in health and disease. Curr Opin Pharmacol. , (2009).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 80, 3-44 (2007).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 65, 1-35 (2001).
- Gamboa, J. L., Andrade, F. H. Mitochondrial content and distribution changes specific to mouse diaphragm after chronic normobaric hypoxia. Am J Physiol Regul Integr Comp Physiol. , (2009).
- Patel, S. P., Gamboa, J. L., McMullen, C. A., Rabchevsky, A., Andrade, F. H. Lower respiratory capacity in extraocular muscle mitochondria: evidence for intrinsic differences in mitochondrial composition and function. Invest Ophthalmol Vis Sci. 50, 180-186 (2009).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved