需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
骨骼肌的线粒体分离
摘要
这个协议描述一个过程来研究从骨骼肌中分离出的线粒体呼吸。这种方法改编自Scorrano等。(2007年)。线粒体的分离过程中需要约2小时。线粒体呼吸在大约1个小时就可以完成。
摘要
线粒体是细胞器控制细胞死亡的生命和。他们参与重要的代谢反应,合成的ATP,规范的信号级联 2,3 。过去和目前研究人员已经从大鼠和小鼠的组织,如肝,脑和心脏4,5中分离出线粒体。近年来,许多研究人员都集中在研究从骨骼肌线粒体功能。
在这里,我们描述了,我们已经成功地用于从 6骨骼肌线粒体隔离的方法。我们的程序要求,所有的缓冲液和试剂都取得了新的和需要约250-500毫克骨骼肌。我们研究了从大鼠和小鼠腓肠肌和隔膜中分离出线粒体,鼠眼外肌。线粒体蛋白浓度测定Bradford法。重要的是保持在编制和功能的研究是一个相对较短的时间(约1小时)内进行线粒体样品冰冷。线粒体呼吸是用一个克拉克型电极(Oxygraph系统)在37 ° C 7极谱。氧电极的校准是在本议定书中的关键一步,它每天必须执行。隔离线粒体(150微克)被添加到实验缓冲液(EB)0.5毫升。国家2呼吸开始,除谷氨酸(5MM)和苹果酸(2.5毫米)。然后,二磷酸腺苷(ADP)(150微米)被添加到启动状态3。寡(1μM),ATP酶合成酶阻断剂,用于估计状态4。最后,羰基氰化物的P -三氟甲氧基] -苯基腙(FCCP,0.2微米)添加到measurestate 5,或耦合呼吸 6 。呼吸控制率(RCR),状态3状态4的比例,计算后,每一个实验。 RCR≥4被认为是一个可行的线粒体准备的证据。
总之,我们目前的隔离,可用于生化(例如,研究酶的活性,免疫检测,蛋白质组学)和功能(线粒体呼吸)的骨骼肌线粒体可行的方法。
研究方案
1。缓冲区的制备
- 开启离心机5804R,并设置为4 ° C。 Isotemp 3006D水浴,并设置转到37 ° C
- 肌肉隔离前的准备以下解决方案:
- PBS:磷酸盐缓冲液(PBS)药片溶解在蒸馏水(5片/升)。拌匀。
- PBS加10 mM的EDTA:要准备100毫升溶液,添加98毫升的PBS 2毫升500毫米EDTA。
- 8X线粒体缓冲液:蔗糖10.28克终浓度为0.6米,400毫克的自由脂肪酸的牛血清白蛋白(BSA)终浓度为0.8%,为160毫米的终浓度2.08克HEPES,pH值7.4和QS至50毫升,用蒸馏水。
- 隔离缓冲1(IB1):加入200μL500 mM的EDTA的终浓度为10毫米,0.392克终浓度为215毫米D -甘露醇,8X线粒体缓冲液,pH 1.25毫升至7.4和QS至10毫升,用蒸馏水。
- 隔离缓冲2(IB2):加入终浓度为3毫米,0.392克终浓度为215毫米D -甘露醇,8X线粒体缓冲液,pH 1.25毫升至7.4和QS 60至10μL500毫米EGTA毫升,用蒸馏水。
- 实验缓冲液(EB):加入终浓度为100μLMgCl 2的 500毫米的终浓度为5毫米,0.392克终浓度为215毫米D -甘露醇,25微升2.5毫米KH 2 PO 4 6.25微米,2个100毫米EGTAμL终浓度为20微米,1.25毫升线粒体缓冲液,pH为7.4和QS至10毫升,用蒸馏水。
2。肌肉隔离
- 在冰桶中,把3个10毫升的烧杯中,波特Elvehjem组织磨床和其他一切必要的仪器/用品上冰。整个实验过程中的一切都必须保持冰冷。
- 放置在冰桶和温水浴EB IB1和IB2完成时的场所。
- 在三个10毫升的烧杯中,应增加以下解决方案:
- 烧杯1:10毫升的PBS
- 烧杯2:10毫升的PBS / EDTA
- 烧杯3:3毫升IB1
- 杀死老鼠人道本地机构的动物护理和使用委员会批准。
- 迅速隔离骨骼肌250-500毫克,在烧杯1冲洗,然后转移到烧杯2。
3。同质化/线粒体隔离
- 肌肉转移到烧杯3和精细直言不讳地用剪刀肌肉。
- 传输的解决方案,以波特Elvehjem匀浆。均质使用机动杵(一台钻床,会做的工作)的10倍,在任何时候都保持在冰管的肌肉。
- 转移匀浆在700 克 10分钟,在4 ° C预冷的2毫升离心管和离心机
- 上清转移到一个新的预冷的离心管。弃去沉淀。
- 上清离心10分钟,在10500 克 ,4 ° C 。
- 上清转移到一个新的预冷的离心管和标签SN1(上清1号)和肌肉类型。
- 重悬在500μL的IB2颗粒。
- 离心10分钟,在10500 克在4 ° C。
- 上清转移到一个新的预冷的离心管和标签SN2(上清2)和肌肉类型。
- 暂停在100μL的IB2最终线粒体颗粒。
- 重新自旋最终线粒体悬浮在minifuge几秒钟。如果有颗粒,转移上清到一个新的预冷的离心管,弃去沉淀。
- 确定蛋白浓度用Bradford检测8。
4。电极校准
注:在线粒体隔离期间完成电极校准。
- 加入100毫升蒸馏水至250毫升容量瓶中。大力搅拌20分钟,以平衡水与大气中的气体。
- 添加几滴50%氯化钾Oxygraph电极。
- 放置一个电极上的一小块蓝Rizla卷烟纸。
- PTFE膜放置一块卷烟纸的顶部。
- 申请使用环撒施,然后放置在电极槽外圈内圈。
- 连接电极和组装其他设备:较大的塑料环基地,线粒体室,水管。
- Oxygraph箱打开,并启动Oxygraph软件。
- 平衡水线粒体室。
- 搅拌棒和打开速度为60。
- 开始一个新的实验。
- 点击“校准”和液相校准框1。变温度至37 ° C,然后单击“确定”两次。
- 当“覆盖”转变到“确定”点击它,打开氮气罐。
- 广场一角相连氮气罐室,并建立零氧。点击“OK”时,从开关“覆盖。”
- 吸干水和线粒体商会的EB缓冲液加入500μL。
- 密封腔与柱塞。
- 如果使用多个盒子,重复步骤11-15校准盒2。
5。线粒体呼吸
- 开始一个新的实验,让它运行约1分钟,以稳定的信号。
- 添加必要的线粒体悬液量(步长3.11),为150微克每一个分庭,标志事件,并让它运行1分钟。
- 加入10μl的温暖250 mM/125 mM的谷氨酸/苹果酸终浓度为5 mM/2.5毫米。马克和让运行1分钟。这是定义为国家2。
- 加入终浓度为150微米,马克7.5μL10 mM的ADP公司,并让运行了30秒。这被定义为国家3。
- 添加另有10毫米ADP,马克7.5μL,让运行1.5分钟。
- 加入终浓度为1微米,马克0.5μL冷10毫米寡,让运行3分钟。这被定义为国家4。
- 加入终浓度为0.2微米,马克1μL0.1 mM的FCCP冷,让运行3分钟。这是定义为5国。
- 完成后,结束实验,并保存。
- 获取使用Oxygraph软件的呼吸速率。
- 进入正常化的因素:如果添加150微克的线粒体蛋白,正常化的因素将是0.15。
- 规范化呼吸率计算出不同的呼吸状态。
- 计算除以3国4国的呼吸控制率(RCR)。
6。代表性的成果:
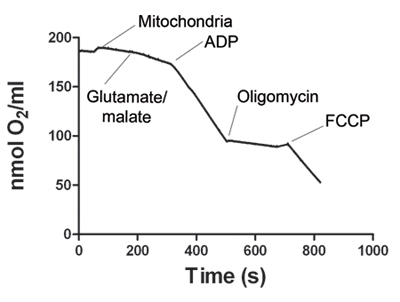
图1显示了一个代表骨骼肌线粒体消耗氧气的跟踪。电极信号稳定后,线粒体样品添加到Oxygraph室。国家2呼吸开始除了与谷氨酸和苹果酸。此外ADP的增加氧的消耗,定义状态3呼吸。 ATP合酶阻断寡此外,获得国家4呼吸。最后,FCCP添加到解耦线粒体呼吸(状态5), 表1显示了国2,3,4和5代表氧的消耗率。呼吸控制率(RCR)是计算每个实验。 RCR≥4被认为是一个可行的线粒体准备的证据。
国家 | 归价格 |
状态2 | 34.74 |
状态3 | 153.40 |
国家4 | 16.49 |
国5 | 143.70 |
RCR | 9.30 |
表1。线粒体呼吸速率。Representativeoxygen骨骼肌线粒体的消费率。值进行归一室线粒体的添加量。呼吸控制率(RCR),是由分裂状态3状态4。 RCR≥4代表一个可行的线粒体准备。
讨论
我们提出了一个协议孤立可行的骨骼肌线粒体。如果收益率是一个问题,该协议可以修改孵化5毫升30分钟,在冰PBS/10mM EDTA/0.01%胰蛋白酶的孤立肌肉。为了保证胰蛋白酶完成肌肉消化,肌肉需要充分剁碎。 PBS/10mM EDTA/0.01%胰蛋白酶溶液孵育30分钟后,必须完全取代隔离缓冲区1(IB1)3毫升。此外,使用胰蛋白酶,可能会干扰线粒体呼吸协议中的一些基板。这一协议处于良好的使用胰蛋白酶时线粒?...
披露声明
致谢
这项工作是由一个由美国国家眼科研究所(R01 EY12998)授予FH安德拉德支持。
材料
| Name | Company | Catalog Number | Comments |
| 95% CO2 / 5% O2 mix | Local Gas Supplier | ||
| Adenosine 5′-diphosphate sodium salt | Sigma-Aldrich | A2754 | |
| Blue Rizla Paper | Hansatech | 890101 | |
| Bradford protein assay | Bio-Rad | 500-0006 | |
| Carbonylcyanide p-trifluoromethoxyphenylhydrazone (FCCP) | Sigma-Aldrich | C2920 | |
| Centrifuge 5804R | Eppendorf | ||
| Compressed nitrogen | Local Gas Supplier | ||
| D-mannitol | Sigma-Aldrich | M9647 | |
| Ethlyene-glycol-bis-tetraacetic acid (EGTA) | Sigma-Aldrich | E3889 | |
| Ethylenediaminetetraacetic acid (EDTA) | Bio-Rad | 161-0728 | |
| Free fatty acid bovine serum albumin | Sigma-Aldrich | A8806 | |
| Glutamic acid | Sigma-Aldrich | G5889 | |
| HEPES sodium salt | Sigma-Aldrich | H7006 | |
| Isotemp 3006D | Fisher Scientific | ||
| Magnesium chloride | Sigma-Aldrich | M8266 | |
| Male Sprague Dawley Rats | Harlan Laboratories | 300-500g | |
| Malic acid | Sigma-Aldrich | M9138 | |
| Minifuge | ISC Bioexpress | C1301P | |
| Oligomycin | Sigma-Aldrich | O4876 | |
| Oxygen electrode disc | Hansatech | S1 | |
| Oxygraph | Hansatech | ||
| Oxygraph Plus V1.01 Software | Hansatech | ||
| pH-meter | Mettler Toledo | 1225506149 | |
| Phosphate-buffered saline (PBS) | Sigma-Aldrich | P4417 | |
| Potassium chloride | Sigma-Aldrich | P3911 | |
| Potassium phosphate | Sigma-Aldrich | P8416 | |
| Potter-Elvehjem homogenizers | Fisher Scientific | 08-414-14A | |
| PTFE (0.0125mm × 25mm) membrane | Hansatech | S4 | |
| SKIL 3320 drill press | Hardware store | ||
| Sucrose | Sigma-Aldrich | S5016 |
参考文献
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle and cultured fibroblasts. Nat Protoc. 2, 287-295 (2007).
- Duchen, M. R. Roles of mitochondria in health and disease. Diabetes. 53, S96-S102 (2004).
- Johannsen, D. L., Ravussin, E. The role of mitochondria in health and disease. Curr Opin Pharmacol. , (2009).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 80, 3-44 (2007).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 65, 1-35 (2001).
- Gamboa, J. L., Andrade, F. H. Mitochondrial content and distribution changes specific to mouse diaphragm after chronic normobaric hypoxia. Am J Physiol Regul Integr Comp Physiol. , (2009).
- Patel, S. P., Gamboa, J. L., McMullen, C. A., Rabchevsky, A., Andrade, F. H. Lower respiratory capacity in extraocular muscle mitochondria: evidence for intrinsic differences in mitochondrial composition and function. Invest Ophthalmol Vis Sci. 50, 180-186 (2009).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。