Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Митохондриальная Изоляция от скелетных мышц
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол описывает процедуры для изучения дыхания митохондрии, выделенные из скелетных мышц. Этот метод был заимствован из Scorrano Соавт. (2007). Митохондриальной процедуры изоляции требуется около 2 часов. Митохондриального дыхания может быть завершена в 1 час.
Аннотация
Митохондрии являются органеллами управления жизнью и смертью клетки. Они участвуют в основных метаболических реакций, синтезировать большинство из АТФ, и регулировать число сигнальных каскадов 2,3. Прошлые и текущие исследователи выделили митохондрии от крыс и мышей тканей, таких как печень, мозг и сердце 4,5. В последние годы многие исследователи сосредоточились на изучении функции митохондрий из скелетных мышц.
Здесь мы опишем метод, который мы успешно используется для выделения митохондрий из скелетных мышц 6. Наша процедура требует, чтобы все буферы и реагенты производятся свежими и нужно около 250-500 мг скелетных мышц. Мы изучали митохондрии, выделенные из крыс и мышей икроножной мышцы и диафрагма и мышцы крысы экстраокулярных. Митохондриальная концентрации белка измеряется с помощью анализа Брэдфорда. Важно, что митохондриальная образцы хранятся ледяной во время подготовки и функциональных исследований, что быть выполнена в течение относительно короткого времени (~ 1 час). Митохондриальная дыхания измеряется с помощью полярографии с Кларком типа электрода (Oxygraph системы) при температуре 37 ° C 7. Калибровка кислородного электрода является ключевым шагом в этом протоколе, и оно должно быть исполнено в день. Изолированные митохондрии (150 мкг) добавляют к 0,5 мл экспериментальных буфера (ИС). Состояние 2 дыхания начинается с того глутамата (5мм) и малат (2,5 мм). Затем, аденозин дифосфат (АДФ) (150 мкм) добавляется в начальное состояние 3. Олигомицин (1 мкМ), блокатор АТФазы синтазы, используется для оценки состояния 4. Наконец, карбонильные цианида р-[трифторметокси]-фенил-гидразона (FCCP, 0,2 мкМ) добавляется к measurestate 5, или несвязанных дыхания 6. Дыхательный коэффициент (РКП), отношение государственного 3 до состояния 4, рассчитывается после каждого эксперимента. RCR ≥ 4 рассматривается как свидетельство жизнеспособных митохондрий подготовки.
Таким образом, мы представляем метод выделения жизнеспособных митохондрий скелетных мышц, которые можно использовать в биохимических (например, активность ферментов, иммунодетекции, протеомика) и функциональные исследования (митохондриального дыхания).
протокол
1. Подготовка буферов
- Включите центрифуги 5804R и установить до 4 ° C. Включите Isotemp 3006D водяную баню и установить до 37 ° C.
- Подготовьте следующие решения до мышц изоляции:
- PBS: Растворите фосфатным буферным раствором (PBS) таблетки в дистиллированной воде (5 таблеток / литр). Хорошо перемешайте.
- ФСБ, содержащего 10 мМ ЭДТА: подготовить 100 мл раствора, добавляют 2 мл 500 мМ ЭДТА до 98 мл PBS.
- 8X Митохондрии буфера: 10,28 г сахарозы для конечной концентрации 0,6 М, 400 мг свободных жирных кислот бычьего сывороточного альбумина (БСА) в конечной концентрации 0,8%, 2,08 г HEPES для конечной концентрации 160 мМ, рН до 7,4 и QS до 50 мл дистиллированной воды.
- Изоляция буфера 1 (IB1): Добавить 200 мкл 500 мМ ЭДТА для конечной концентрации 10 мМ, 0,392 г D-маннита для конечной концентрации 215 мМ, 1,25 мл 8X митохондрий буфере, рН до 7,4 и до 10 QS мл дистиллированной водой.
- Изоляция буфера 2 (IB2): Добавьте 60 мкл 500 мМ EGTA для конечной концентрации 3 мМ, 0,392 г D-маннита для конечной концентрации 215 мМ, 1,25 мл 8X митохондрий буфере, рН до 7,4 и до 10 QS мл дистиллированной водой.
- Экспериментальные буфера (EB): Добавить 100 мкл 500 мМ MgCl 2 для конечной концентрации 5 мМ, 0,392 г D-маннита для конечной концентрации 215 мМ, 25 мкл 2,5 мМ KH 2 PO 4 для конечной концентрации 6,25 мкм, 2 мкл 100 мМ EGTA для конечной концентрации 20 мкМ, 1,25 мл митохондриальной буфере, рН до 7,4 и QS до 10 мл дистиллированной воды.
2. Мышцы Изоляция
- В ведерко со льдом, положить три 10 мл стаканы, Поттер-Elvehjem шлифовальные ткани и все другие необходимые инструменты / поставок на льду. Все должно оставаться ледяной течение всего эксперимента.
- Место IB1 и IB2 в ведро льда и EB в теплой ванне, когда закончите.
- В трех 10 мл стаканы, следующие решения должны быть добавлены:
- Стакан 1: 10 мл PBS
- Стакан 2: 10 мл PBS / ЭДТА
- Стакан 3: 3 мл IB1
- Убийство крысы гуманно утвержденной локальной институциональной уходу и использованию животных комитета.
- Быстро изолировать 250-500 мг скелетных мышц, промыть в Стакан 1, то трансфер в Стакан 2.
3. Гомогенизация / Митохондриальная Изоляция
- Передача мышцы Стакан 3 и мелко рубят мышц с помощью ножниц.
- Передача решение Поттер-Elvehjem гомогенизатора. Однородный мышцы с использованием моторизованных пестиком (сверлильный станок будет делать эту работу) 10 раз соответствии трубки во льду во все времена.
- Передача гомогената предварительно охлажденное 2 мл микроцентрифужных труб и центрифуге при 700 г в течение 10 минут при 4 ° C.
- Передача супернатант в новую предварительно охлажденное микроцентрифужных трубки. Отменить гранул.
- Центрифуга супернатант в 10500 г в течение 10 минут при 4 ° C.
- Передача супернатант в новую предварительно охлажденной трубки микроцентрифужных и этикетки SN1 (супернатанта № 1) и мышечного типа.
- Повторное приостановить гранул в 500 мкл IB2.
- Центрифуга на 10 500 г в течение 10 минут при 4 ° C.
- Передача супернатант в новую предварительно охлажденной трубки микроцентрифужных и этикетки SN2 (супернатанта № 2) и мышечного типа.
- Приостановить окончательного митохондриальные гранулы в 100 мкл IB2.
- Re-спинового окончательного митохондриальной суспензии в minifuge за несколько секунд. Если есть шарик, передача супернатант в новую предварительно охлажденное микроцентрифужных трубки и отбросить гранул.
- Определение концентрации белка использованием анализа Брэдфорда 8.
4. Электрод калибровки
ПРИМЕЧАНИЕ: Полный калибровки электрода во время митохондриальной изоляции.
- Добавить 100 мл дистиллированной воды до 250 мл колбу. Перемешать энергично в течение 20 минут, чтобы уравновесить воды с атмосферным газом.
- Добавить несколько капель 50% KCl на Oxygraph электрода.
- Место небольшой кусочек синий Rizla прокатки бумаги поверх электрода.
- Место кусок мембраны PTFE на вершине прокатки бумаги.
- Применить внутреннее кольцо с помощью кольца аппликатором, а затем поместить внешнего кольца в паз электрода.
- Подключите электроды и собрать остальное оборудование: большие пластиковые кольца основания, митохондриальная камеры и водяные шланги.
- Включите Oxygraph коробки и начать Oxygraph программного обеспечения.
- Добавить уравновешенной воды митохондриальной камеры.
- Добавить мешалкой и повернуть на скорости 60.
- Начало нового эксперимента.
- Нажмите на калибровку и затем жидкость калибровки фазы для вставке 1. Изменение температуры до 37 ° C и нажмите "ОК" два раза.
- Когда "Override" меняется на "ОК", выберите его и открыть резервуар азота.
- Место наконечник подключен к азота резервуара в камеру и установить нулевой кислорода. Cлизать "OK", когда оно переходит из "Override".
- Аспирируйте воды и добавить 500 мкл буфера EB для митохондриальных камер.
- Печать камеру с поршнем.
- Если вы используете несколько ящиков, повторите шаги 11-15 для калибровки вставке 2.
5. Митохондриального дыхания
- Начало нового эксперимента, дайте ему поработать в течение приблизительно 1 минуты, чтобы стабилизировать сигнал.
- Добавить необходимого объема митохондриального подвески (шаг 3,11) на 150 мкг в каждой камере, отмечают событие, и дайте ему поработать в течение 1 минуты.
- Добавьте 10 мкл теплой 250 mM/125 мМ глутамат / малат для конечной концентрации 5 мМ mM/2.5. Марк и давайте работать в течение 1 минуты. Это определено как состояние 2.
- Добавить 7,5 мкл 10 мМ АДФ для конечной концентрации 150 мкМ, знак, и пусть запустить в течение 30 секунд. Это определено как состояние 3.
- Добавить еще 7,5 мкл 10 мМ АДФ, знак, и пусть баллотироваться на 1,5 минуты.
- Добавить 0,5 мкл холодного 10 мМ олигомицину для конечной концентрации 1 мкМ, знак, и пусть баллотироваться на 3 минуты. Это определено как состояние 4.
- Добавить 1 мкл холодного 0,1 ммоль FCCP для конечной концентрации 0,2 мкМ, знак, и пусть баллотироваться на 3 минуты. Это определено как состояние 5.
- По окончании эксперимента конца и сохранить.
- Приобретать дыхания ставки использованием Oxygraph программного обеспечения.
- Введите нормализации фактор: если добавление 150 мкг митохондриальных белков, нормализации коэффициент будет 0,15.
- Рассчитать нормированные ставки дыхания для различных состояний дыхания.
- Рассчитать дыхательный коэффициент (РКП), путем деления государства 3 к государству 4.
6. Представитель Результаты:
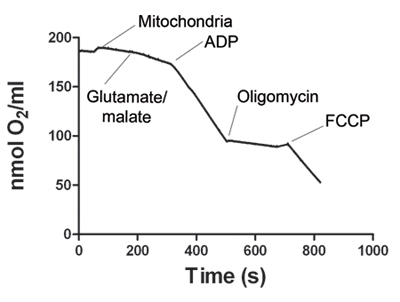
Рисунок 1. Показывает, представитель отслеживание потребления кислорода скелетных мышц митохондриями. После электрода сигнал стабилизируется, митохондрии образец добавляется в камере Oxygraph. Состояние 2 дыхания начинается с того глутамата и малата. Добавление АДФ увеличивает потребление кислорода, определяющие состояние 3 дыхания. АТФ-синтазы блокируется добавлением олигомицину получить состояние 4 дыхания. Наконец, FCCP добавляется разъединять митохондриального дыхания (состояние 5). В таблице 1 приведены представитель ставки потребление кислорода на 2 государства, 3, 4 и 5. Дыхательный коэффициент (РКП) рассчитывается для каждого эксперимента. RCR ≥ 4 рассматривается как свидетельство жизнеспособных митохондрий подготовки.
| Государства | Нормализованные цены |
| Состояние 2 | 34,74 |
| Состояние 3 | 153,40 |
| Состояние 4 | 16,49 |
| Государство 5 | 143,70 |
| RCR | 9,30 |
Таблица 1. Митохондриальная ставки дыхания. Representativeoxygen нормы потребления из скелетных мышц митохондриями. Значения нормированы на количество митохондрий добавляется в камере. Дыхательный коэффициент (РКП), определяется путем деления состояние 3 государственными 4. RCR ≥ 4 представляет собой реальную митохондрий подготовки.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Мы представляем протокол, чтобы изолировать жизнеспособных митохондрий скелетных мышц. Если выход проблему, протокол может быть изменен путем инкубации изолированной мышцы в 5 мл PBS/10mM EDTA/0.01% трипсина в течение 30 минут во льду. Для обеспечения полного переваривания мышц трипсином, мышц?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Благодарности
Эта работа была поддержана грантом Национального института глаза (R01 EY12998) до FH Андраде.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 95% CO2 / 5% O2 mix | Local Gas Supplier | ||
| Adenosine 5′-diphosphate sodium salt | Sigma-Aldrich | A2754 | |
| Blue Rizla Paper | Hansatech | 890101 | |
| Bradford protein assay | Bio-Rad | 500-0006 | |
| Carbonylcyanide p-trifluoromethoxyphenylhydrazone (FCCP) | Sigma-Aldrich | C2920 | |
| Centrifuge 5804R | Eppendorf | ||
| Compressed nitrogen | Local Gas Supplier | ||
| D-mannitol | Sigma-Aldrich | M9647 | |
| Ethlyene-glycol-bis-tetraacetic acid (EGTA) | Sigma-Aldrich | E3889 | |
| Ethylenediaminetetraacetic acid (EDTA) | Bio-Rad | 161-0728 | |
| Free fatty acid bovine serum albumin | Sigma-Aldrich | A8806 | |
| Glutamic acid | Sigma-Aldrich | G5889 | |
| HEPES sodium salt | Sigma-Aldrich | H7006 | |
| Isotemp 3006D | Fisher Scientific | ||
| Magnesium chloride | Sigma-Aldrich | M8266 | |
| Male Sprague Dawley Rats | Harlan Laboratories | 300-500g | |
| Malic acid | Sigma-Aldrich | M9138 | |
| Minifuge | ISC Bioexpress | C1301P | |
| Oligomycin | Sigma-Aldrich | O4876 | |
| Oxygen electrode disc | Hansatech | S1 | |
| Oxygraph | Hansatech | ||
| Oxygraph Plus V1.01 Software | Hansatech | ||
| pH-meter | Mettler Toledo | 1225506149 | |
| Phosphate-buffered saline (PBS) | Sigma-Aldrich | P4417 | |
| Potassium chloride | Sigma-Aldrich | P3911 | |
| Potassium phosphate | Sigma-Aldrich | P8416 | |
| Potter-Elvehjem homogenizers | Fisher Scientific | 08-414-14A | |
| PTFE (0.0125mm × 25mm) membrane | Hansatech | S4 | |
| SKIL 3320 drill press | Hardware store | ||
| Sucrose | Sigma-Aldrich | S5016 |
Ссылки
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle and cultured fibroblasts. Nat Protoc. 2, 287-295 (2007).
- Duchen, M. R. Roles of mitochondria in health and disease. Diabetes. 53, Suppl 1. S96-S102 (2004).
- Johannsen, D. L., Ravussin, E. The role of mitochondria in health and disease. Curr Opin Pharmacol. , (2009).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 80, 3-44 (2007).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 65, 1-35 (2001).
- Gamboa, J. L., Andrade, F. H. Mitochondrial content and distribution changes specific to mouse diaphragm after chronic normobaric hypoxia. Am J Physiol Regul Integr Comp Physiol. , (2009).
- Patel, S. P., Gamboa, J. L., McMullen, C. A., Rabchevsky, A., Andrade, F. H. Lower respiratory capacity in extraocular muscle mitochondria: evidence for intrinsic differences in mitochondrial composition and function. Invest Ophthalmol Vis Sci. 50, 180-186 (2009).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены