É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Isolamento mitocondrial do músculo esquelético
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo descreve um procedimento para estudar a respiração das mitocôndrias isoladas dos músculos esqueléticos. Este método foi adaptado de Scorrano Et al. (2007). O procedimento de isolamento mitocondrial requer cerca de 2 horas. A respiração mitocondrial pode ser concluído em cerca de 1 hora.
Resumo
As mitocôndrias são organelas controlar a vida ea morte da célula. Eles participam nos principais reações metabólicas, sintetizar a maior parte do ATP, e regular uma série de cascatas de sinalização 2,3. Pesquisadores passadas e actuais, mitocôndrias isoladas de ratos e camundongos tecidos como fígado, cérebro e coração 4,5. Nos últimos anos, muitos pesquisadores se concentraram em estudar a função mitocondrial dos músculos esqueléticos.
Aqui, descrevemos um método que temos utilizado com sucesso para o isolamento de mitocôndrias de músculo esquelético 6. Nosso procedimento requer que todos os tampões e reagentes são feitas fresco e precisa de cerca de 250-500 mg de músculo esquelético. Foram estudadas mitocôndrias isoladas de ratos e camundongos gastrocnêmio e diafragma e os músculos extra-oculares de ratos. Concentração de proteína mitocondrial é medido com o ensaio de Bradford. É importante que as amostras mitocondrial ser mantida gelada durante a preparação e que estudos funcionais ser realizada dentro de um prazo relativamente curto (~ 1 hr). Respiração mitocondrial é medida usando polarografia com um eletrodo do tipo Clark (sistema Oxygraph) a 37 ° C 7. Calibração do eletrodo de oxigênio é um passo fundamental neste protocolo e deve ser realizada diariamente. Mitocôndrias isoladas (150 mg) são adicionados a 0,5 ml de tampão experimental (EB). Estado respiração 2 começa com adição de glutamato (5mM) e malato (2,5 mM). Então, difosfato de adenosina (ADP) (150 mM) é adicionado para começar estado 3. Oligomicina (1 mM), um bloqueador sintase ATPase, é usado para estimar o estado 4. Por último, carbonil cianeto de p-[trifluoromethoxy]-fenil-hidrazona (FCCP, 0,2 mM) é adicionado à measurestate 5, ou não atrelados a respiração 6. A relação de controle respiratório (RCR), a relação entre o estado 3 para o estado 4, é calculado depois de cada experimento. Um RCR ≥ 4 é considerado como evidência de uma preparação de mitocôndrias viáveis.
Em resumo, apresentamos um método para o isolamento de mitocôndrias viáveis a partir de músculos esqueléticos que podem ser usadas em bioquímica (por exemplo, atividade enzimática, imunodetecção, proteômica) estudos e funcionais (respiração mitocondrial).
Protocolo
1. Preparação de Buffers
- Ligue 5804R centrífuga e definir a 4 ° C. Ligue Isotemp banho de água 3006D e definida para 37 ° C.
- Preparar as soluções seguintes antes de isolamento muscular:
- PBS: Dissolver tampão fosfato salino (PBS) comprimidos em água destilada (5 comprimidos / litro). Misture bem.
- PBS acrescido de 10 mM EDTA: Para preparar uma solução de 100 ml, adicionar 2 ml de 500 mM EDTA a 98 ml de PBS.
- Buffer de mitocôndrias 8X: 10,28 g de sacarose para uma concentração final de 0,6 M, 400 mg de ácido graxo livre-albumina sérica bovina (BSA) para uma concentração final de 0,8%, 2,08 g de HEPES para uma concentração final de 160 mM, pH para 7,4 e QS de 50 ml com água destilada.
- Tampão de isolamento 1 (IB1): Adicione 200 mL de 500 mM EDTA para uma concentração final de 10 mM, 0,392 g de D-manitol para uma concentração final de 215 mM, 1,25 ml de 8X mitocôndrias tampão pH, para 7,4 e QS a 10 ml com água destilada.
- Tampão de isolamento 2 (IB2): Adicionar 60 mL de 500 mM EGTA para uma concentração final de 3 mM, 0,392 g de D-manitol para uma concentração final de 215 mM, 1,25 ml de 8X mitocôndrias tampão pH, para 7,4 e QS a 10 ml com água destilada.
- Tampão Experimental (EB): Adicionar 100 l de 500 mM MgCl 2 para uma concentração final de 5 mM, 0,392 g de D-manitol para uma concentração final de 215 mm, 25 mL de 2,5 mM KH 2 PO 4 para uma concentração final de 6,25 mM, 2 l de 100 mM EGTA para uma concentração final de 20 mM, 1,25 ml de tampão mitocondrial, pH de 7,4 e QS a 10 ml com água destilada.
2. Isolamento muscular
- Em um balde de gelo, colocar três copos de 10 ml, moedores Potter-Elvehjem tecido e todos os outros instrumentos necessários / supplies no gelo. Tudo deve ficar gelada durante todo o experimento.
- Lugar IB1 e IB2 em balde de gelo e EB em banho de água quente quando terminar.
- Nos três copos 10 ml, as seguintes soluções devem ser adicionadas:
- Copo 1: 10 ml de PBS
- Copo 2: 10 ml de PBS / EDTA
- Copo de 3: 3 ml de IB1
- Matar um rato humanamente aprovado pelo seu Animal Care locais Institucional e Comitê de uso.
- Isolar rapidamente 250-500 mg de músculo esquelético, lavar em uma taça, e transferir para Beaker 2.
3. Homogeneização / isolamento mitocondrial
- Transferência de músculo para copo de 3 e finamente picada do músculo com uma tesoura.
- Transferir a solução para o homogeneizador Potter-Elvehjem. Homogeneizar o músculo usando um pilão motorizado (uma imprensa de broca irá fazer o trabalho) 10 vezes mantendo o tubo no gelo em todos os momentos.
- Transferência de homogenato de pré-refrigerados tubos de microcentrífuga 2 ml e centrifugar a 700 g por 10 minutos a 4 ° C.
- Transfira o sobrenadante para um tubo de microcentrífuga novo pré-refrigerados. Descartar pellet.
- Centrifugar o sobrenadante do 10.500 g por 10 minutos a 4 ° C.
- Transfira o sobrenadante para um tubo de microcentrífuga novo pré-refrigerados e SN1 etiqueta (número sobrenadante 1) e tipo de músculo.
- Re-suspender pellet em 500 mL de IB2.
- Centrifugar a 10.500 g por 10 minutos a 4 ° C.
- Transfira o sobrenadante para um tubo de microcentrífuga novo pré-refrigerados e SN2 etiqueta (número sobrenadante 2) e tipo de músculo.
- Suspender finais mitocondrial pellet em 100 ml de IB2.
- Re spin-finais suspensão mitocondrial em minifuge por alguns segundos. Se houver um pellet, transferir o sobrenadante para um novo tubo de microcentrífuga pré-refrigerados e descartar o pellet.
- Determinar a concentração de proteína utilizando o ensaio de Bradford 8.
4. Calibração do eletrodo
NOTA: calibração do eletrodo Completa durante o isolamento mitocondrial.
- Adicione 100 ml de água destilada para 250 ml. Mexa vigorosamente por 20 minutos para equilibrar a água com gás atmosférico.
- Adicione algumas gotas de 50% KCl no eletrodo Oxygraph.
- Coloque um pequeno pedaço de papel de Blue Rizla rolando em cima do eletrodo.
- Coloque um pedaço de membrana PTFE em cima do papel para enrolar.
- Aplicar o anel interno utilizando o aplicador de anel e, em seguida, coloque o anel externo na ranhura do eletrodo.
- Conectar eletrodos e montar o resto do equipamento: base maior anel de plástico, câmara mitocondrial, e mangueiras de água.
- Ligar caixas de Oxygraph e começar software Oxygraph.
- Adicione a água equilibrada para a câmara mitocondrial.
- Adicionar agitar bar e ligue a uma velocidade de 60.
- Começar uma nova experiência.
- Clique em calibrar e, em seguida, a calibração de fase líquida para Box 1. Mudança de temperatura para 37 ° C e clique em "OK" duas vezes.
- Quando "Substituir" muda para "OK" clique nele e abrir o tanque de gás nitrogênio.
- Ponta lugar conectadopara o tanque de nitrogênio na câmara e estabelecer oxigênio zero. Clique em "OK" quando se muda de "Ignorar".
- Aspirar água e adicionar 500 mL de tampão EB às câmaras mitocondrial.
- Vedação de câmara com êmbolo.
- Se estiver usando várias caixas, repita os passos 11-15 para calibração de Caixa 2.
5. A respiração mitocondrial
- Iniciar uma nova experiência; deixá-lo correr por cerca de 1 minuto para estabilizar sinal.
- Adicionar o volume necessário da suspensão mitocondrial (passo 3.11) para 150 mg em cada câmara, o evento marca, e deixá-lo correr por 1 minuto.
- Adicionar 10 ml de morno 250 mM/125 mM glutamato / malato para uma concentração final de 5 mM mM/2.5. Marca e deixar correr por 1 minuto. Esta é definida como estado 2.
- Adicionar 7,5 mL de 10 mM ADP para uma concentração final de 150 mM, marca, e deixar correr por 30 segundos. Isto é definido como Estado 3.
- Adicionar outro mL 7,5 mM ADP, de 10, marca, e deixar correr para 1,5 minutos.
- Adicionar 0,5 mL de oligomicina mM frio 10 para uma concentração final de 1 mM, marca, e deixar correr por 3 minutos. Isto é definido como Estado 4.
- Adicionar 1 ml de frio 0,1 mM FCCP para uma concentração final de 0,2 mM, marca, e deixar correr por 3 minutos. Isto é definido como Estado 5.
- Quando terminar, final experimentar e salvar.
- Adquirir taxas de respiração usando software Oxygraph.
- Digite fator de normalização: se a adição de 150 mg de proteína mitocondrial, o fator de normalização será 0,15.
- Calcular as taxas de respiração normalizada para os estados de respiração diferente.
- Calcular a Razão de Controle Respiratório (RCR) dividindo-se 3 por Estado Estado 4.
6. Resultados representativos:
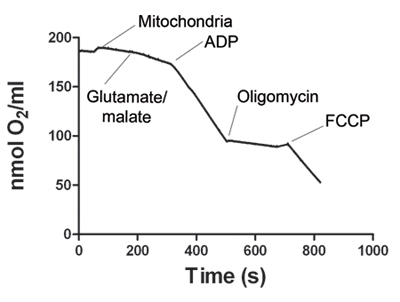
Figura 1. Mostra um representante rastreamento do consumo de oxigênio pelo músculo esquelético mitocôndrias. Após o sinal de eletrodo é estabilizado, a amostra mitocôndria é adicionado à câmara Oxygraph. Estado respiração 2 começa com adição de glutamato e malato. Adição de ADP aumenta o consumo de oxigênio, que define a respiração estado 3. ATP sintase é bloqueada pela adição de oligomicina para obter a respiração estado 4. Finalmente, FCCP é adicionado ao desacoplar respiração mitocondrial (estado 5). Tabela 1 mostra as taxas de consumo de oxigênio representante para os estados 2, 3, 4 e 5. A relação de controle respiratório (RCR) é calculado para cada experimento. RCR ≥ 4 é considerado como evidência de uma preparação de mitocôndrias viáveis.
Estados | Preços normalizado |
Estado 2 | 34,74 |
Estado 3 | 153,40 |
Estado 4 | 16,49 |
Estado 5 | 143,70 |
RCR | 9,30 |
Tabela 1. Taxas de respiração mitocondrial. Taxas de consumo Representativeoxygen do músculo esquelético mitocôndrias. Os valores são normalizados para a quantidade de mitocôndrias adicionado à câmara. A relação de controle respiratório (RCR) é determinado pela divisão do estado 3 por estado 4. Um RCR ≥ 4 representa uma preparação viável mitocôndrias.
Access restricted. Please log in or start a trial to view this content.
Discussão
Nós apresentamos um protocolo para isolar mitocôndrias viáveis do músculo esquelético. Se o rendimento é um problema, o protocolo pode ser modificada, incubando o músculo isolado em 5 ml de tripsina EDTA/0.01 PBS/10mM% por 30 minutos em gelo. Para assegurar a digestão muscular completo com tripsina, o músculo precisa ser totalmente picada. Após a incubação de 30 minutos, a solução de tripsina PBS/10mM EDTA/0.01% deve ser completamente substituído com 3 ml de isolamento tampão 1 (IB1). Além disso, ...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Agradecimentos
Este trabalho foi financiado por uma concessão do National Eye Institute (R01 EY12998) para FH Andrade.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 95% CO2 / 5% O2 mix | Local Gas Supplier | ||
| Adenosine 5′-diphosphate sodium salt | Sigma-Aldrich | A2754 | |
| Blue Rizla Paper | Hansatech | 890101 | |
| Bradford protein assay | Bio-Rad | 500-0006 | |
| Carbonylcyanide p-trifluoromethoxyphenylhydrazone (FCCP) | Sigma-Aldrich | C2920 | |
| Centrifuge 5804R | Eppendorf | ||
| Compressed nitrogen | Local Gas Supplier | ||
| D-mannitol | Sigma-Aldrich | M9647 | |
| Ethlyene-glycol-bis-tetraacetic acid (EGTA) | Sigma-Aldrich | E3889 | |
| Ethylenediaminetetraacetic acid (EDTA) | Bio-Rad | 161-0728 | |
| Free fatty acid bovine serum albumin | Sigma-Aldrich | A8806 | |
| Glutamic acid | Sigma-Aldrich | G5889 | |
| HEPES sodium salt | Sigma-Aldrich | H7006 | |
| Isotemp 3006D | Fisher Scientific | ||
| Magnesium chloride | Sigma-Aldrich | M8266 | |
| Male Sprague Dawley Rats | Harlan Laboratories | 300-500g | |
| Malic acid | Sigma-Aldrich | M9138 | |
| Minifuge | ISC Bioexpress | C1301P | |
| Oligomycin | Sigma-Aldrich | O4876 | |
| Oxygen electrode disc | Hansatech | S1 | |
| Oxygraph | Hansatech | ||
| Oxygraph Plus V1.01 Software | Hansatech | ||
| pH-meter | Mettler Toledo | 1225506149 | |
| Phosphate-buffered saline (PBS) | Sigma-Aldrich | P4417 | |
| Potassium chloride | Sigma-Aldrich | P3911 | |
| Potassium phosphate | Sigma-Aldrich | P8416 | |
| Potter-Elvehjem homogenizers | Fisher Scientific | 08-414-14A | |
| PTFE (0.0125mm × 25mm) membrane | Hansatech | S4 | |
| SKIL 3320 drill press | Hardware store | ||
| Sucrose | Sigma-Aldrich | S5016 |
Referências
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle and cultured fibroblasts. Nat Protoc. 2, 287-295 (2007).
- Duchen, M. R. Roles of mitochondria in health and disease. Diabetes. 53, Suppl 1. S96-S102 (2004).
- Johannsen, D. L., Ravussin, E. The role of mitochondria in health and disease. Curr Opin Pharmacol. , (2009).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 80, 3-44 (2007).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 65, 1-35 (2001).
- Gamboa, J. L., Andrade, F. H. Mitochondrial content and distribution changes specific to mouse diaphragm after chronic normobaric hypoxia. Am J Physiol Regul Integr Comp Physiol. , (2009).
- Patel, S. P., Gamboa, J. L., McMullen, C. A., Rabchevsky, A., Andrade, F. H. Lower respiratory capacity in extraocular muscle mitochondria: evidence for intrinsic differences in mitochondrial composition and function. Invest Ophthalmol Vis Sci. 50, 180-186 (2009).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados