A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الإنسان في المختبر قمع وأداة الكشف عن الاعتراف للدولة في وقت مبكر من الخلل المناعي
In This Article
Summary
Tregs والمكثفات قوية من الجهاز المناعي. هناك عدم وجود علامات سطح فريدة لتعريف بهم ، وبالتالي ، تعريفات Tregs وظيفية في المقام الأول. نحن هنا تصف الأمثل في المختبر مقايسة قادرة على تحديد الخلل المناعي في المواد المعرضة للخطر لتطوير T1D.
Abstract
التنظيمية خلايا T (Tregs) هي الحاسمة وسطاء التسامح المناعي في تقرير المصير ، مستضدات. بالإضافة إلى ذلك ، هم المنظمين الحاسمة للاستجابة مناعية بعد العدوى. على الرغم من الجهود المبذولة لتحديد علامة فريدة من نوعها على سطح Tregs ، الميزة الفريدة فقط هو قدرتها على منع انتشار الأسلحة النووية وظيفة الخلايا التائية المستجيب. في حين أنه من الواضح أن المقايسات فقط في المختبر يمكن استخدامها في تقييم وظيفة Treg الإنسان ، وهذا يصبح مشكلة عند تقييم النتائج من دراسات مستعرضة فيها الخلايا السليمة والخلايا المعزولة من الموضوعات مع أمراض المناعة الذاتية (مثل مرض السكري نوع 1 - T1D) الحاجة ويمكن مقارنة. هناك تفاوت كبير بين المختبرات في عدد ونوع من الخلايا التائية المستجيب وطبيعة وقوة التحفيز ، Treg : نسب المستجيب وعدد ونوع من خلايا مولدة تقديم (APC) المستخدمة في قمع الإنسان في فحوصات المختبر. هذا التباين يجعل المقارنة بين الدراسات قياس وظيفة Treg صعبة. الحقل Treg يحتاج الى فحص قمع موحدة من شأنها أن تعمل بشكل جيد مع كل من الاشخاص الاصحاء والمصابين بأمراض المناعة الذاتية. طورنا في الفحص المختبري القمع الذي يظهر القليل جدا من داخل مقايسة التباين في تحفيز خلايا تي المعزولة من المتطوعين الأصحاء مقارنة مع الموضوعات الأساسية تدمير المناعة الذاتية للخلايا البنكرياس β. الهدف الرئيسي لهذه القطعة لوصف تجربة في المختبر قمع الإنسان أن يسمح بإجراء مقارنة بين مجموعات مختلفة الموضوع. بالإضافة إلى ذلك ، هذا الاختبار لديه القدرة على رسم خسارة صغيرة في nTreg وظيفة وتوقع مزيد من الخسائر في المستقبل ، ومن ثم تحديد الموضوعات التي يمكن أن تستفيد من المعالجة المناعية الوقائية 1. أدناه ، ونحن نقدم وصف دقيق للخطوات التي ينطوي عليها هذا الإجراء. نأمل أن تسهم في توحيد في المختبر فحص قمع المستخدمة لقياس وظيفة Treg. بالإضافة إلى ذلك ، فإننا نقدم هذا الاختبار كأداة ليتعرف على الدولة في وقت مبكر من الخلل المناعي والعلامات البيولوجية المحتملة وظيفية للT1D.
Protocol
1. قبل وضع مقايسة القمع ، واحد يحتاج إلى معطف الخرز tosylactivated المضادة للبشرية CD3 (استنساخ UCHT1 ، 1μg/ml تركيز النهائي) لتحفيز الخلية ، وبعد ذلك يتم التحقق مما اذا كانت مغلفة بكفاءة حبات من خلال إنشاء المختبر في فحص انتشار استخدام الإنسان الخلايا التائية
- 1ml من اتخاذ M - 450 قنينة من الخرز tosylactivated الأصلي ، في مكان الوقوف والانتظار حتى مغناطيسي جميع حبات انضمت إلى جانب الأنبوب. إزالة أنبوب العازلة بينما لا تزال في موقف المغناطيسي. اتخاذ موقف من الأنبوب المغناطيسي وإضافة 1ml من buffer1 ، وضع أنبوب في الوقوف مرة أخرى المغناطيسي وإزالة أنبوب buffer1 بينما هو في موقف المغناطيسي ، في 1ml من الخرز buffer1 resuspend وإضافة 40μl المضادة للCD3 الإنسان ، تستنهض الهمم في 37 ° مئوية لمدة 15 دقيقة ، إضافة 0.1 ٪ W / V جيش صرب البوسنة وتواصل التحريض على 16 ساعة القادمة.
- تغسل حبات في buffer2 مرتين لمدة 5 دقائق في 2-8 درجة مئوية ، ومرة واحدة في buffer3 لمدة 5 دقائق في 2-8 درجة مئوية باستخدام الوقوف المغناطيسي كما هو موضح أعلاه ؛ إزالة العازلة وresuspend حبات في 1ml من buffer2 ، والخرز و 4x10 التركيز النهائي 8 / مل وجاهزة للاستخدام.
- قسامة و50000 25000 PBMC / جيد في triplicates في صفيحة 96 - جيدا وإضافة عدد متغير من CD3 المغلفة الخرز (4x10 8 حبات / لتر ، CD3 1μg/ml ، على سبيل المثال 1 ، 2 ، 3 ، 4 ، 5 حبات / خلية ) من أجل تحديد العدد الأمثل من الخرز لكل خلية. بعد 72 ساعة في الثقافة ، إضافة 1μCi [3 H] ثيميدين ومواصلة احتضان عند 37 درجة مئوية لمدة 16 ساعة المقبلة. خلايا الحصاد في موسم الحصاد لوحة متعددة الشاشات (ميليبور) ، إضافة السائل التلألؤ وقراءة التهم لكل دقيقة (CPM) / أعلى البئر باستخدام NXT عدد (باكارد ، CT). استخدام الخرز / نسبة تكلفة الألف ظهور الخلية عندما هم فوق 5000 ولكن أقل من 15000 لتجنب فرط من Tregs ، والتي قد تفقد وظيفتها القمعية. عادة ، ونسبة 3 حبات / خلية يحفز الخلايا على حد سواء والرد Treg في جميع الفئات الخاضعة اختبارها حتى الان 1-4.
2. PBMC العزلة من الدم الكامل من المتبرعين الأصحاء أو من الإنسان أو leukopacks الغلالة الشهباء (قبل الميلاد) تؤخذ عادة من المتطوعين الأصحاء ومتاحة مجانا من مراكز نقل الدم المحلي (الشكل 1)
- تمييع قبل الميلاد (~ 50ml) 01:06 مع برنامج تلفزيوني (إضافة 250ml). الآن هناك إجمالي حجم 300ml. وأضاف ببطء طبقة 25ml من ق المخفف على رأس 15ml Ficoll - PLUS Paque لأنابيب 50ml فالكون ، من دون إزعاج طبقات. تحولت أجهزة الطرد المركزي في 800xg (1400rpm في جهاز للطرد المركزي Sorvall مع الدوار دلو يتأرجح SH - 3000) لمدة 30 دقيقة في 4 درجات مئوية ، مع مكابح إيقاف.
- جمع بعناية طبقة PBMC (المرحلة المتوسطة) وتحويلها إلى أنابيب جديدة فالكون 50ml. غسل PBMC عن طريق ملء أنابيب تصل إلى 50ml مع DPBS. جمع الكرات الخلية 2 في أنبوب واحد. الطرد المركزي في 400xg لمدة 10 دقيقة على 4 درجات مئوية. تكرار الغسيل الخطوة مرتين ، كل مرة يجمع بين الكريات الخلية 2 في أنبوب واحد. الجمع بين جميع الكريات الخلية في أنبوب واحد 50ml.
- العد PBMC التريبان باستخدام اختبار استبعاد الأزرق. جعل تخفيف 01:10 في التريبان الأزرق بإضافة 20μl من PBMC ل180μl التريبان الأزرق وصمة عار. تخلط جيدا واتخاذ 20μl الاعتماد في عدادة الكريات على الفور. عد الأرقام من جميع الخلايا الملون غير ملوثين والأزرق فقط وتقع في مبنيين يحتوي كل منها على مساحة 16 متر مربع أصغر. أخذ متوسط كل من الأرقام وتتضاعف بنسبة 10. يقسم هذا العدد بنسبة 100 في الحصول على عدد من PBMC / مل. النسبة المئوية للخلايا قابلة للحياة حساب ك [1 -- (عدد الخلايا الزرقاء / عدد الخلايا الكل) X100]. إذا كان البقاء هو المضي قدما ≥ 95 ٪.
3. MACS قبل نوع من الخلايا التائية CD4
- قبل المتابعة ، ونقل 1ml من PBMC في أنبوب جديد ، إضافة إلى وسائل الإعلام 4ml إعداد الخلايا لتشعيع مع 5000rad ، ستكون هذه مستضد تقديم الخلايا (APC).
- الطرد المركزي بقية الخلايا في 250xg العازلة في PBS/2mM BSA EDTA/0.5 ٪ لل10min في 4 درجات مئوية. من أجل إيقاف الخلايا طاف ، وresuspend 4ml في المخزن المؤقت PBS/2mM BSA EDTA/0.5 ٪.
- إضافة 200μl من microbeads مكافحة MACS CD4 ويحضن في 4 لمدة 20 دقيقة درجة مئوية.
- غسل بإضافة 40ml من العازلة PBS/2mM BSA EDTA/0.5 ٪ ، وأجهزة الطرد المركزي في ل10min 250xg في 4 درجات مئوية. تخلصي وطاف في resuspend 8ml degassed من درجة حرارة الغرفة ، PBS/2mM العازلة BSA EDTA/0.5 ٪.
- مرشح مستقل تعليق الخلية باستخدام مرشحات فصل تمهيدي قبل تحميلها على العمود ليرة سورية.
- انقسام الخلية وتعليق 4ml طبقة معايرة LS كل عمود على (مع 3ml من deggassed PBS/2mM العازلة BSA EDTA/0.5 ٪). يتم إصلاح LS العمود في MidiMACS فاصل. قبل التعليق الخلية نفدت ، إما إعادة تشغيل أو إضافة flowthrough 3ml من درجة حرارة الغرفة العازلة deggassed PBS/2mM BSA EDTA/0.5 ٪ والسماح للتشغيل من خلال العازلة. إضافة المزيد من المخزن حتى يأتي واضحا بها.
- ماصة العازلة deggassed 5ml على العمود LS ، إزالة عمود LS من فاصل MidiMACS ومكان في عالم جديد العقيمة أنبوب جمع 15ml ~ السماح بتشغيل خلال 1.0ml. وضع المكبس في العمود ببطء ودفع بقيةحجم الخروج.
- أن تفعل الشيء نفسه مع كل من الأعمدة ليرة سورية والجمع بين CD4 + two الكسور. إضافة إلى برنامج تلفزيوني وعدد الخلايا 50ml. العائد المتوقع هو ما يصل الى 8 خلايا 5x10. الطرد المركزي في 400xg لمدة 10 دقائق وخلايا resuspend جيدا في 2ml PBS/2mM العازلة BSA EDTA/0.5 ٪.
4. فلوري الفرز الخلية المنشط (FACS) العزلة (الشكل 2)
- جعل مزيج من الأجسام المضادة لعلامات علامات القرص المضغوط إلى سطح الخلية التالية (الحفاظ عليها وحمايتها من الضوء) : 20 ميكرولتر المضادة للبشرية FITC - CD8 (استنساخ RPA - T8) ، و 20 ميكرولتر المضادة للبشرية FITC - CD14 (استنساخ M5E2 ؛ LPS مستقبلات) ، و 20 ميكرولتر المضادة للبشرية CD32 - FITC (استنساخ FLI8.26 ؛ FcγR من النوع الثاني) و 6 ميكرولتر المضادة للبشرية FITC - CD116 (استنساخ M5D12 ؛ GM - CSFRα السلسلة) ، وبدلا من ذلك ، إضافة المضادة 40μl البشرية CD4 - APCCy7 (استنساخ RPA - T4).
- تأخذ 5μl من تعليق خلية 2ml وصمة عار مع 2μl من الكوكتيل وصمة عار ، وهذا هو أنبوب لتحديد العتبة (ناقص واحد ملون تألقي FMO) 5.
- إضافة 50 ميكرولتر المضادة للبشرية CD25 - PE (M - A251 استنساخ ؛ IL - 2Rα) إلى كوكتيل وصمة عار ، وإضافة إلى تعليق الكوكتيل الخلية واحتضان عند 4 درجة مئوية 30 دقيقة. غسل الخلايا في المخزن برنامج تلفزيوني ، الطرد المركزي في 400xg لمدة 10 دقائق وخلايا resuspend إلى تركيز خلية من 10 7 / مل.
- تحضير الخلايا والخلايا غير ملوثين او الخرز الملون ملون تألقي مع واحد بأن يستعمل مثل التعويض عن السيطرة على الخلية الفرز الأغنية FACS دينار بحريني (العلوم البيولوجية ، وسان خوسيه ، ونيو جيرسي).
- الحصول على الخلايا في الأنبوب FMO التي سوف تسمح للمستخدم لتعيين الحد الأدنى لفرز الخلايا CD25 + T (الشكل 2A). مجموعة بوابة FITC سلبية حول الخلايا لاستبعاد FITC إيجابية الخلايا التي تتكون حيدات ، الضامة ، وغيرها من جميع CD4 + T - غير الخلايا (الشكل 2B).
- في مؤامرة منفصلة ، ورسم لبوابات CD25 ، - T CD25low وCD25high خلايا Tregs (أعلى من 1 ٪ من الخلايا معربا عن أكبر عدد من CD25) (الشكل 2C). عادة ما تظهر خلية فرعية عالية النقاء (الشكل 2D ، 2E و2F).
- الطرد المركزي أنابيب جمع مع الخلايا في 400xg لمدة 10 دقائق ، وتبقيهم على الجليد حتى الطلاء.
5. انشاء خلية ثقافة في لوحة 96 - جيدا (مخطط المرفقة بوصفها Table1) في 200μl/well
- 50μl قسامة من CD3 المغلفة الخرز (1 ميكروغرام / مل) محسوبة لتكون 3 حبات / المستجيب خلية في بئر ، معلق في وسائل الإعلام كاملة مع 10 ٪ تجميع المصل AB الإنسان في أسفل U - 96 - جيدا لوحات. (على سبيل المثال ، لجعل وسائل الاعلام مع 2ml CD3 المغلفة ، واتخاذ 7.5μl من المخزون من CD3 المغلفة الخرز النهائي 4x10 تركيز 8 / مل وتمييع 2ml في وسائل الإعلام ، وكل 50μl سيحتوي beads-3beads/cell 75000).
- تمييع APC المشع لتركيز الخلية 5x10 5 / مل وإضافة 50μl (سيحتوي 2.5 × 10 4 خلايا) في كل جيدا مع التحفيز واضاف في السابق ، بما في ذلك الآبار وصفت بانها "Tregs فقط" ، "APC فقط" و "وسائل الاعلام فقط" في الجدول 1.
- إضافة 2.5 × 10 / 4 CD4CD25 جيدا أو خلايا تي في CD4CD25low triplicates التالية في تصميم الجدول 1.
- إضافة إلى المشاركة في Tregs الثقافات (B صف ، الجدول رقم 1) في نسبة 01:10 (خلايا Treg 2500) والآبار وصفت بانها "Tregs فقط" واحتضان لوحة عند 37 درجة مئوية في ثاني أكسيد الكربون مع حاضنة 2 5 2 ٪ في الرطوبة المشبعة لمدة 72 ساعة.
- نبض الآبار مع 1μCi [3 H] ثيميدين وتستمر الحضانة عند 37 درجة مئوية لمدة 16 ساعة المقبلة.
6. الحصاد والفرز
- حصاد الخلايا على لوحة متعددة الشاشات الحصاد باستخدام باكارد filtermate حصادة أو نظام بديل.
- إضافة التلألؤ السائل (Microscint 20) ، وغطاء لوحة الحصاد مع غطاء بلاستيكي شفاف تمهيدا للخطوة النهائية.
- قراءة التهم لكل دقيقة (CPM) / جيدا باستخدام NXT الأعلى الكونت (باكارد ، CT) أو نظام بديل.
7. نسبة الحوسبة القمع
- كما تم تربيتها في الخلايا triplicates ، يتم حساب المتوسط لكل حالة. إذا كان معامل الاختلاف هو> 30 ٪ ، ويتم التخلص من الاجتماع التحضيري للمؤتمر وناشز فقط من بئرين في المتوسط. يتم الحصول على نسبة مئوية من قمع الحوسبة [(SC) / ق] × 100 ٪ ، حيث s = نسخة في ثقافة واحدة وج = CPM في المشاركة في الثقافة.
- وساذجة (CD25) ، وتنشيط الجسم الحي (CD25low) هي مطلي الخلايا التائية وخلايا T المستجيب المستجيب ، هو القبض على الاختلاف في قدرة Tregs لقمع كل من هذه المجموعات الفرعية واستخدامها كمؤشر النذير الوظيفية المحتملة استنادا إلى فرضية يمكنهم أن الخلايا هي أصعب لقمع.
8. ممثل النتائج :
التباين الكبير في الأساليب المستخدمة والنتائج المستمدة من فحص في المختبر قمع الإنسان دفعتنا لإجراء دراسة شاملة للظروف المؤثرة في مقايسة 1. طورنا مقايسة ان الاختبارات ليس فقط وظيفة Treg ، ولكن أيضا نقائها ، بالنظر إلى النسبة المنخفضة بين Tregs : Teffs (1:10) ، والتي حددناها في وقت سابق من 6. بالإضافة إلى ذلك ، تختلف في ال TregsEIR القدرة على قمع بنجاح والسذاجة في خلايا الجسم الحي T - تفعيلها حتى في الاشخاص الاصحاء ، كما هو مبين في الشكل (3) وفي دراستنا السابقة 2،4 ، الذي يصبح أكثر بروزا في حالة خطر التوازن المناعي ، كما هو الحال في موضوعات في خطر لتطوير T1D . في مقايسة عملت بشكل جيد جدا في دراسة مقارنة أين نحن من وظيفة القمعية الطبيعية (nTregs) ، محرض (iTregs) ، وتوسعت في nTregs المختبر ، مما يسمح لنا للمقارنة بين وظيفتها مراقبة صحية ، والأخيرة ، ظهور (RO) ومنذ فترة طويلة T1D (LS ) T1D الموضوعات. استنتجنا أن الموضوعات T1D ريال عماني وكان أفضل القدرة على توليد والوظيفية على حد سواء iTregs nTregs توسعت مقارنة الموضوعات LS السيطرة T1D وصحية 7. وبالتالي ، يمكن استخدام هذا الاختبار أداة ممتازة في الاعتراف بالدولة على حد سواء المبكرة والمتأخرة من الخلل المناعي.
عرض مخطط تخطيطي 1 من الخطوات المتبعة في فحص في المختبر قمع

الشكل 1. خطوات للفحص في المختبر قمع قدم مع الصور
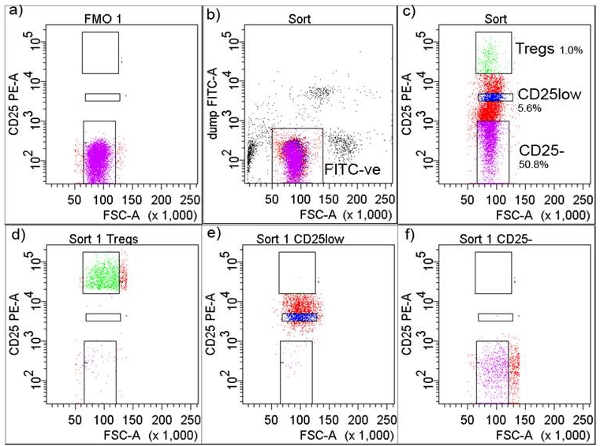
الشكل 2. استراتيجية المحاصرة في عزلة الخلية FACS. تم تعديل أ) عتبة + CD25 وفقا لملون تألقي ناقص واحد (FMO) ، ب) الخلايا وبوابات والسلبية FITC ، ج) FITC سلبية الخلايا وزيادة بوابات والتي جمعت في + CD CD25 ، CD25high + CD + CD25low وأقراص ( Tregs) تظهر مع النسب المئوية ، د) FACS فرز Tregs بعد الفرز ، ه) FACS فرز CD + CD25low بعد الفرز ، و) FACS CD4 + CD25 فرز - T الخلايا بعد الفرز
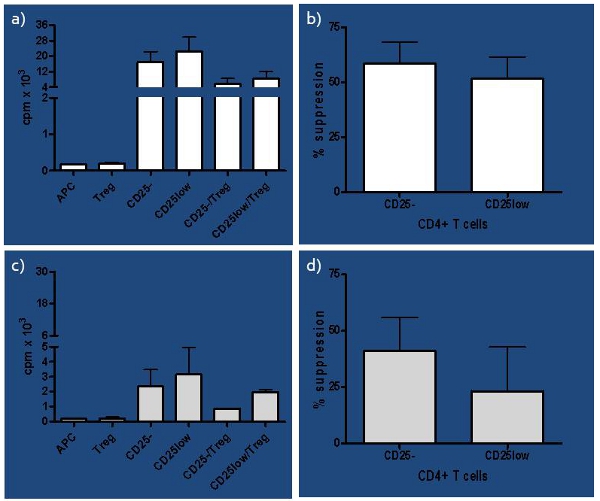
الشكل 3. نتائج الممثل من الموضوعات الصحية أ) نتائج ممثل التهم في الدقيقة (CPM) من الموضوعات الصحية المقدمة ، لأن الحضارات واحد لجميع خلايا فرعية المعنية (السذاجة - CD25 ، في الجسم الحي تفعيلها CD25low ، مستضد تقديم الخلايا وAPC T - Treg الخلايا التنظيمية) ، وكذلك شارك في ثقافات الخلايا التائية المستجيب (CD25 أو CD25low) وTregs. ب) النسبة المئوية لقمع كل CD25 ويرد CD25low المستجيب الخلايا التائية التي Tregs ذاتي لالضابطة الصحية (ن = 4). كما تم حساب قمع [(SC) / ق] × 100 ٪ ، حيث s = نسخة في ثقافة واحدة وج = CPM في الثقافة المشتركة. وقد لوحظ على الرغم من اختلاف طفيف في قدرة Tregs المستجيب لقمع الخلايا التائية ، لم يكن كبيرا (إقران اختبار t ع = 0.08). ج) من مقدمة والاجتماع التحضيري للمؤتمر في موضوعات المخاطر بالنسبة لكل ثقافة واحدة ، بما في ذلك وCD25 - CD25low والمستجيب الخلايا التائية وكذلك APC وTregs ، وشارك فيها ثقافات المصنف كل خلية T المستجيب فرعية مع النسبة المئوية (CD25-/Tregs وCD25low/Tregs). د) Tregs قمع كل CD25 - T والخلايا CD25low مستجيب بواسطة ذاتي ويرد في لTregs الموضوعات خطر (ن = 4). وكان الفرق في قدرة Tregs لقمع CD25 ، مقابل CD25low المستجيب الخلايا التائية كبيرة (إقران اختبار t ع = 0.04).
الجدول 1. مجموعة تتكون من التخطيطي في مقايسة قمع المختبر
| 1-3 | 4-6 | 7-9 | 10-12 | |
| A | CD4CD25 - | CD4CD25low | وسائل الاعلام فقط | وسائل الاعلام فقط |
| B | CD4CD25 - / Tregs | CD4CD25low / Tregs | Tregs فقط | APC فقط |
| C | ||||
| D | ||||
| E | ||||
| F | ||||
| G | ||||
| H |
Discussion
والميزة الفريدة فقط لTregs ، يجب اختبار الوظيفة القمعية وموثوق بها بشكل موحد بين الموضوعات في مختلف مراحل تطور المرض داخل نفسه ، وبين الدراسات المختلفة. ونحن نقدم تفاصيل قمع مقايسة وضعت في مختبرنا ومساهمتنا في توحيد هذا الاختبار. في دراستنا التحسين واسعة ، ونحن مصممون ...
Disclosures
Acknowledgements
وأيد هذه الدراسة ماكجي ماكس المركز القومي للبحوث الطبية لكلية Diabetesat الأحداث ويسكونسن وطفولة معهد البحوث ويسكونسن. كان الممولين أي دور في تصميم الدراسة وجمع البيانات وتحليلها ، أو في الإعداد للمخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف أو صك | شركة | فهرس العدد | تعليقات (اختياري) |
|---|---|---|---|
| Ficoll - PLUS Paque | أمرشام فارماسيا في مجال التكنولوجيا الحيوية | 17-1440-03 | |
| DPBS - 1X | Gibco | 14190-144 | |
| التريبان الأزرق | Invitrogen | 15250-061 | |
| مكافحة CD4 microbeads | Miltenyi | 130-045-101 | |
| قبل فصل المرشحات | Miltenyi | 130-041-407 | |
| LS العمود | Miltenyi | 130-042-401 | |
| EDTA | Invitrogen | 15575-020 | |
| BSA | سيغما الدريخ | B4287 | |
| مكافحة الإنسان CD4 - APCCy7 (استنساخ RPA - T4) | دينار بحريني Pharmingen | 557852 | |
| مكافحة الإنسان CD25 - PE (M - A251 استنساخ ؛ IL - 2Rα) | دينار بحريني Pharmingen | 555432 | |
| مكافحة الإنسان CD8 - FITC (استنساخ RPA - T8) | دينار بحريني Pharmingen | 555366 | |
| مكافحة الإنسان CD14 - FITC (استنساخ M5E2 ؛ مستقبلات LPS) | دينار بحريني Pharmingen | 555397 | |
| مكافحة الإنسان CD32 - FITC (استنساخ FLI8.26 ؛ FcγR من النوع الثاني) | دينار بحريني Pharmingen | 555448 | |
| مكافحة الإنسان CD116 - FITC (استنساخ M5D12 ؛ GM - CSFRα السلسلة) | دينار بحريني Pharmingen | 554532 | |
| tosylactivated Dynalbeads M - 450 | Invitrogen | 140-13 | |
| مكافحة الإنسان CD3 | أنسل | 144-024 | |
| Buffer1 | محلية الصنع | 0.1M نا 2 B 4 O 7 pH7.6 | |
| Buffer2 | محلية الصنع | PBS/2mM BSA EDTA / 0.1 ٪ pH7.4 | |
| Buffer3 | محلية الصنع | 0.2M Tris/0.1 ٪ BSA pH8.5 | |
| استكمال وسائل الاعلام RPMI | محلية الصنع | RPMI 1640 وسائل الإعلام 2 مم L - الجلوتامين HEPES ملي 5 100 U / ميكروغرام / مل peni / strept الصوديوم 0.5 مم البيروفات | |
| [3 H] ثيميدين | بيركن إلمر | NET027Z005MC | |
| الإنسان المجمعة AB المصل | اتلانتا البيولوجية | S40110 | |
| لوحة متعددة الشاشات الحصاد | ميليبور | MAHFC1H60 | |
| Microscint 20 | بيركن إلمر | 6013621 |
References
- Barge, A., Cravotto, G., Gianolio, E., Fedeli, F. How to determine free Gd and free ligand in solution of Gd chelates. A technical note. Contrast Med. Mol. Imaging. 1, 184-188 (2006).
- Nagaraja, T. N., Croxen, R. L., Panda, S., Knight, R. A., Keenan, K. A., Brown, S. L., Fenstermacher, J. D., Ewing, J. R. Application of arsenazo III in the preparation and characterization of an albumin-linked, gadolinium-based macromolecular magnetic resonance contrast agent. J. Neurosci. Methods. 157, 238-245 (2006).
- Supkowski, R. M., Horrocks, W. D. On the determination of the number of water molecules, q, coordinated to europium(III) ions in solution from luminescence decay lifetimes. Inorg. Chim. Acta. 340, 44-48 (2002).
- Menjoge, A. R., Kannan, R. M., Tomalia, D. A. Dendrimer-based drug and imaging conjugates: design considerations for nanomedical applications. Drug Discovery Today. 15, 171-185 (2010).
- Que, E. L., Chang, C. J. Responsive magnetic resonance imaging contrast agents as chemical sensors for metals in biology and medicine. Chem. Soc. Rev. 39, 51-60 (2010).
- Uppal, R., Caravan, P. Targeted probes for cardiovascular MR imaging. Future Med. Chem. 2, 451-470 (2010).
- Major, J. L., Meade, T. J. B. i. o. r. e. s. p. o. n. s. i. v. e. Bioresponsive, cell-penetrating, and multimeric MR contrast agents. Acc. Chem. Res. 42, 893-903 (2009).
- Datta, A., Raymond, K. N. Gd-hydroxypyridinone (HOPO)-based high-relaxivity magnetic resonance imaging (MRI) contrast agents. Acc. Chem. Res. 42, 938-947 (2009).
- Leôn-Rodríguez, L. M. D., Lubag, A. J. M., Malloy, C. R., Martinez, G. V., Gillies, R. J., Sherry, A. D. Responsive MRI agents for sensing metabolism in vivo. Acc. Chem. Res. 42, 948-957 (2009).
- Castelli, D. D., Gianolio, E., Crich, S. G., Terreno, E., Aime, S. Metal containing nanosized systems for MR-molecular imaging applications. Coord. Chem. Rev. 252, 2424-2443 (2008).
- Caravan, P., Ellison, J. J., McMurry, T. J., Lauffer, R. B. Gadolinium(III) chelates as MRI contrast agents: structure, dynamics, and applications. Chem. Rev. 99, 2293-2352 (1999).
- Lauffer, R. B. Paramagnetic metal complexes as water proton relaxation agents for NMR imaging: theory and design. Chem. Rev. 87, 901-927 (1987).
- Yoo, B., Pagel, . An overview of responsive MRI contrast agents for molecular imaging. Front. Biosci. 13, 1733-1752 (2008).
- Pandya, S., Yu, J., Parker, D. Engineering emissive europium and terbium complexes for molecular imaging and sensing. Dalton Trans. 23, 2757-2766 (2006).
- Nwe, K., Xu, H., Regino, C. A. S., Bernardo, M., Ileva, L., Riffle, L., Wong, K. J., Brechbiel, M. W. A new approach in the preparation of dendrimer-based bifunctional diethylenetriaminepentaacetic acid MR contrast agent derivatives. Bioconjugate Chem. 20, 1412-1418 (2009).
- Nwe, K., Bernardo, M., Regino, C. A. S., Williams, M., Brechbiel, M. W. Comparison of MRI properties between derivatized DTPA and DOTA gadolinium-dendrimer conjugates. Bioorg. Med. Chem. 18, 5925-5931 (2010).
- Caravan, P., Das, B., Deng, Q., Dumas, S., Jacques, V., Koerner, S. K., Kolodziej, A., Looby, R. J., Sun, W. -. C., Zhang, Z. A lysine walk to high relaxivity collagen-targeted MRI contrast agents. Chem. Commun. , 430-432 (2009).
- Leôn-Rodríguez, L. M. D., Kovacs, Z. The synthesis and chelation chemistry of DOTA-peptide conjugates. Bioconjugate Chem. 19, 391-402 (2008).
- Boswell, C. A., Eck, P. K., Regino, C. A. S., Bernardo, M., Wong, K. J., Milenic, D. E., Choyke, P. L., Brechbiel, M. W. Synthesis, characterization, and biological evaluation of integrin αVβ3-targeted PAMAM dendrimers. Mol. Pharm. 5, 527-539 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved