Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Человек In Vitro Борьбе как инструмент для скрининга Признание ранней стадии иммунного дисбаланса
В этой статье
Резюме
Tregs являются мощными супрессоры иммунной системы. Существует недостаток уникальных маркеров поверхности, чтобы определить их, следовательно, определения Tregs в первую очередь функциональны. Здесь мы опишем оптимизированы В пробирке Анализ позволяет идентифицировать иммунный дисбаланс в предметы на риск развития СД1.
Аннотация
Регуляторных Т-клеток (Tregs) являются важнейшими медиаторами иммунной толерантности к самостоятельной антигенов. Кроме того, они играют решающую роль регуляторов иммунного ответа следующие инфекции. Несмотря на усилия по выявлению уникальных маркеров на поверхности Tregs, только уникальная особенность заключается в их способности подавлять пролиферацию и функцию эффекторных Т-клеток. Хотя очевидно, что только в лабораторных анализов могут быть использованы в оценке человеческой функции Treg, это становится проблематичным при оценке результатов из перекрестных исследований, в которых здоровые клетки и клетки, выделенные из пациентов с аутоиммунными заболеваниями (например, диабетом типа 1-СД1) нуждаются в для сравнения. Существует большая вариабельность лабораторий в количестве и типе ответчик Т-клеток, характера и силы раздражения, Treg: ответчик соотношения и количества и типа антиген-представляющих клеток (АПК), используемых в человека в пробирке тесты подавления. Эта изменчивость делает сравнение между исследованиями измерения Treg функции трудно. Treg поле должно стандартизированного анализа подавления, что будет хорошо работать с обоими здоровых людей и людей с аутоиммунными заболеваниями. Мы разработали в пробирке подавления анализ показывает, что очень мало внутри-анализ изменчивости стимуляции Т-клеток, выделенных из здоровых добровольцев по сравнению с людьми с сопутствующими аутоиммунными разрушение поджелудочной β-клеток. Основной целью этой части является описание в пробирке человеческих анализа подавления, что позволяет провести сравнение между различными группами тему. Кроме того, этот анализ имеет потенциал, чтобы очертить небольшой потерей в nTreg функции и предвидеть дальнейшую потерю в будущем, таким образом, определение субъектов, которые могут извлечь пользу из профилактическую терапию иммуномодулирующими 1. Ниже мы приводим подробное описание этапов этой процедуры. Мы надеемся внести свой вклад в стандартизацию в пробирке подавления анализа, используемые для измерения Treg функции. Кроме того, мы предлагаем этот анализ в качестве инструмента для признать ранней стадии иммунного дисбаланса и потенциал функциональных биомаркером СД1.
протокол
1. Перед настройкой подавления анализа, необходимо, чтобы покрыть tosylactivated бусин с анти-CD3 человека (клон UCHT1, окончательный 1μg/ml концентрация) для стимуляции клеток и потом проверить бисер эффективно покрытием путем создания в пробирке анализ распространения с использованием человеческих Т-клетки
- Возьмите 1 мл М-450 tosylactivated бусы из оригинального флакона, помещают в магнитное стоять и держать, пока все бусины присоединившимся к стороне трубки. Удалить буфер, пока трубка находится все еще в магнитных стенда. Возьмите трубку из магнитных стоять и добавить 1 мл buffer1, место трубки в магнитное снова встать и снять buffer1 в то время как трубка в магнитном стенде; ресуспендирования бисером в 1 мл buffer1 и добавить 40μl анти-CD3 человека, агитировать при 37 ° С в течение 15 минут, добавьте 0,1% м / о BSA и продолжают агитировать за следующие 16 часов.
- Вымойте бусины buffer2 два раза в течение 5 минут при температуре 2-8 ° С и один раз в buffer3 в течение 5 минут при температуре 2-8 ° С с использованием магнитных стоять, как описано выше, удалите буфер и ресуспендируйте бисером в 1 мл buffer2; бисер 4x10 8 / мл конечной концентрации и готов к использованию.
- Алиготе 50000 и 25000 РВМС / лунку в трем образцам в 96-луночного планшета и добавить переменное количество CD3 покрытием шариков (4x10 8 бусин / мл, CD3 1μg/ml, например 1, 2, 3, 4, 5 бусин / элемент ), с тем чтобы определить оптимальное количество бусин на ячейку. После 72 часов в культуре, добавить 1μCi [3 H] тимидина и продолжают инкубацию при 37 ° С в течение следующих 16 часов. Урожай клеток в Multiscreen пластины урожая (Millipore), добавить жидкие сцинтилляционные и читать импульсов в минуту (CPM) / также использованием Top Граф NXT (Packard, штат Коннектикут). Использование бусин / элемент отношения, когда CPMS выше 5000, но менее 15000, чтобы избежать перевозбуждения из Tregs, которые могут потерять подавляющую функцию. Как правило, соотношение 3 бисер / клетка стимулирует как ответчик и Treg клетки во всех предметных группах испытания до сих пор 1-4.
2. РВМС изоляции от цельной крови здоровых доноров или от человека leukopacks или лейкомассы (BC) обычно берут от здоровых добровольцев и предоставляется бесплатно от местных центров переливания крови (рис. 1)
- Развести до н.э. (~ 50 мл) с 1:06 PBS (добавить 250 мл). Теперь есть 300 мл общего объема. Медленно слой 25 мл разбавленной до нашей эры на вершине 15 мл Ficoll-Paque PLUS добавлены 50 мл Сокол трубы, не нарушая слоев. Центрифуга на 800xg (1400rpm в центрифуге Sorvall с качающимися ведро ротор SH-3000) в течение 30 минут при температуре 4 ° С, с тормозами выключен.
- Осторожно собрать слой РВМС (промежуточные фазы) и передать его на свежий 50мл Сокол труб. Вымойте РВМС, заполняя трубы до 50 мл с DPBS. Сбор 2 гранулы ячейки в одну трубу. Центрифуга на 400xg в течение 10 мин при 4 ° C. Повторите промывание войти дважды, каждый раз сочетание 2 гранулы клетки в одной трубе. Смешайте все ячейки шариков в одном 50 мл трубки.
- Граф РВМС использованием Голубой Трипан исключения тест. Сделать 1:10 растворение в Голубой Трипан путем добавления 20 мкл РВМС на 180μl из Голубой Трипан пятно. Хорошо перемешать и принимать 20 мкл рассчитывать в hemacytometer немедленно. Граф номера всех неокрашенных и только синий окрашенных клеток, расположенных в два квадратных блоков каждый из которых содержит 16 малых квадратов. Возьмите среднего числа и умножить на 10. Разделите это число на 100, чтобы получить число РВМС / мл. Процент жизнеспособных клеток рассчитывать, что и [1 - (количество синих клеток / общее количество клеток) x100]. Приступить в случае жизнеспособность ≥ 95%.
3. MACS предварительной сортировки клеток CD4 Т-клеток
- Прежде чем продолжить, передача 1 мл РВМС в новую пробирку, добавляют 4 мл среды для подготовки клетки при облучении 5000rad-они будут антиген-представляющих клеток (АПК).
- Центрифуга остальные клетки на 250xg в PBS/2mM EDTA/0.5% буфера BSA в течение 10 минут при 4 ° C. Слейте надосадочную и ресуспендирования клеток в 4 мл PBS/2mM EDTA/0.5% буфера BSA.
- Добавить 200 мкл MACS анти-CD4 микрошарики и инкубировать при температуре 4 ° С в течение 20 минут.
- Вымойте, добавив 40 мл PBS/2mM EDTA/0.5% BSA буфера и центрифуге при 250xg в течение 10 минут при 4 ° C. Слейте надосадочную и ресуспендируют в 8 мл дегазированной, комнатная температура PBS/2mM EDTA/0.5% буфера BSA.
- Фильтр-отдельной клеточной суспензии с использованием предварительно разделения фильтров, прежде чем загружать их на колонку LS.
- Разделение суспензии клеток и слой 4мл каждого за калиброванный LS колонке (с 3 мл deggassed PBS/2mM EDTA/0.5% буфера BSA). Л. С. колонки фиксируется в сепаратор MidiMACS. Перед суспензии клеток заканчивается, либо повторно запустить flowthrough или добавить 3 мл deggassed комнатной температуре PBS/2mM EDTA/0.5% BSA буфера и пусть проходят через буфер. Добавить больше буфер, пока он выйдет ясно.
- Внесите 5 мл deggassed буфера на LS колонки, удалить LS столбца из сепаратора MidiMACS и поместить в новые стерильные 15 мл трубки коллекция позволяя ~ 1,0 мл пробегать. Поместите поршень в колонне и медленно толкать остальнойручки громкости.
- Сделайте то же самое и с Л. С. колонн и объединить два CD4 + фракций. Добавить до 50 мл PBS и считать клетки. Ожидаемая доходность до 5х10 8 клеток. Центрифуга на 400xg в течение 10 минут и ресуспендируют клетки также в 2 мл PBS/2mM EDTA/0.5% буфера BSA.
4. Флуоресцентные Активированный сортировки клеток (FACS) изоляции (рис. 2)
- Сделайте коктейль из антител к CD маркеров для следующих поверхности клеток маркеры (хранить в защищенном от света): 20 мкл анти-человеческий CD8-FITC (клон РПА-T8), 20 мкл анти-человеческий CD14-FITC (клон M5E2; LPS рецептор), 20 мкл анти-человеческий CD32-FITC (клон FLI8.26; FcγR типа II) и 6 мкл анти-человеческого CD116-FITC (клон M5D12; GM-CSFRα цепи) и, наоборот, добавить 40μl анти -человеческий CD4-APCCy7 (клон РПА-T4).
- Возьмите 5 мкл из 2 мл клеточной суспензии и пятна с 2μl пятен коктейль, это трубка для определения порога (флуорохромами минус один-FMO) 5.
- Добавить 50 мкл анти-человеческий CD25-PE (клон M-A251, Ил-2Rα), чтобы пятно коктейль, а также добавить коктейль для клеточной суспензии и инкубировать при температуре 4 ° С 30 минут. Вымойте клеток в PBS буфера, центрифуге при 400xg в течение 10 минут и ресуспендируют клетки к клетке концентрация 10 7 / мл.
- Подготовка неокрашенные клетки и клетки, окрашенные или шарики с одним флуорохромом для использования в качестве компенсации управления для сортировки клеток на FACS Ария (BD Biosciences, Сан-Хосе, штат Нью-Джерси).
- Приобретать клеток в трубке FMO, которая позволит пользователю установить порог для сортировки CD25 + Т-клеток (рис. 2а). Установить ворота вокруг FITC-негативные клетки, чтобы исключить FITC-положительных клеток включающий моноцитов, макрофагов и других лимфоцитов CD4 +-не-Т-клетки (рис. 2б).
- В отдельном участке, сделать ворота для CD25-, CD25low и CD25high Т-клетки-Tregs (верхний 1% клеток, экспрессирующих наибольшее количество CD25) (рис. 2в). Сотовые подмножества правило, свидетельствуют о высокой чистоты (Рис. 2d, 2e и 2е).
- Центрифуга коллекции трубки с клетками 400xg в течение 10 минут и держать их на льду до обшивки.
5. Настройка клеточных культур в 96-луночного планшета (схема приводится в табл.1) в 200μl/well
- Алиготе 50 мкл CD3 покрытием бисером (1 мкг / мл), рассчитанный в 3 бисер / ответчик ячейки хорошо, ресуспендируют в полной среде с 10% объединенных человека АВ сыворотки в U-дно 96-луночных планшетах. (Например, чтобы сделать 2 мл среды с CD3, покрытые оболочкой, принимают 7.5μl из запаса CD3 покрытием бисером финал 4x10 концентрации 8 / мл и разбавить в 2 мл среды, каждый 50 мкл будет содержать 75000 beads-3beads/cell).
- Развести облученных APC до 5х10 5 / мл концентрации клеток и добавить 50 мкл (будет содержать 2,5 х 10 4 клеток) в каждую лунку с ранее добавленного стимуляции, в том числе скважин помечены как "Tregs только", "APC только" и "средства массовой информации только" в таблице 1.
- Добавить 2,5 х 10 4 / а CD4CD25 или CD4CD25low Т-клеток в следующем трем образцам дизайна в таблице 1.
- Добавить Tregs к сотрудничеству культур (строка B, таблица 1) в соотношении 1:10 (2500 Treg клетки), а также скважин помечены как "Tregs только" и инкубировать пластины при температуре 37 ° C в CO 2 инкубаторе с 5% CO 2 , в насыщенной влажности в течение 72 часов.
- Импульсный скважин с 1μCi [3 H] тимидина и продолжают инкубацию при 37 ° С в течение следующих 16 часов.
6. Сбор и подсчет
- Урожай клеток на многоэкранных пластины урожай использованием Packard filtermate комбайн или альтернативные системы.
- Добавить сцинтилляционные жидкости (Microscint 20), накрыть крышкой уборки пластины с прозрачной пластиковой крышкой в рамках подготовки к заключительному шагу.
- Прочитано импульсов в минуту (CPM) / также использованием Top Граф NXT (Packard, КТ) или альтернативные системы.
7. Вычислительная процент подавления
- Как клетки культивировали в трем образцам, среднее значение рассчитывается для каждого условия. Если коэффициент вариации составляет> 30%, выброс исключается и только копий в минуту из двух скважин усредняются. Процент подавления получается путем вычисления [(п) / с] х 100%, где S = копий в минуту в одной культуре и с = копий в минуту в совместной культуре.
- Как наивны (CD25-) и в естественных условиях активирован (CD25low) эффекторные Т-клетки высевают в качестве ответчика Т-клеток, разница в способности Tregs подавить каждом из этих подмножеств захвачен и использован в качестве потенциальных функциональных показателей прогностической основывается на предпосылке, , что активированные клетки труднее подавить.
8. Представитель Результаты:
Великий изменчивости использованных методов и результатов, полученных в пробирке человеческих анализа подавления побудило нас провести всестороннее изучение условий, влияющих на анализе 1. Мы разработали анализа, которая проверяет не только Treg функции, но и их чистота, учитывая низкое соотношение между Tregs: Teffs (1:10), который мы определили ранее 6. Кроме того, Tregs отличаются йОДП способность успешно подавить наивно и в естественных условиях активированных Т-клеток, даже у здоровых людей, как показано на рисунке 3 и в наших предыдущих исследований, 2,4, который становится более заметным, если иммунный баланс находится под угрозой, так как по предметам, на риск развития СД1 . Анализ работал очень хорошо в кабинете, где мы сравнили подавляющие функцию естественного (nTregs), индуцируемый (iTregs) и в пробирке расширен nTregs, что позволяет нам сравнить их функции между здоровыми управления, последние началом (RO) T1D и давние (LS ) T1D предметам. Мы пришли к выводу, что РО T1D испытуемые должны были лучше мощность производящего функционала и iTregs и расширена nTregs по сравнению с LS T1D и здоровой контрольной группе 7. Таким образом, этот анализ может быть использована как отличный инструмент в признании как ранние и поздние состояния иммунного дисбаланса.
Схема 1 Схема презентация этапов в анализе подавление пробирке

Рисунок 1. Шаги в анализе подавление пробирке представлены с фотографиями
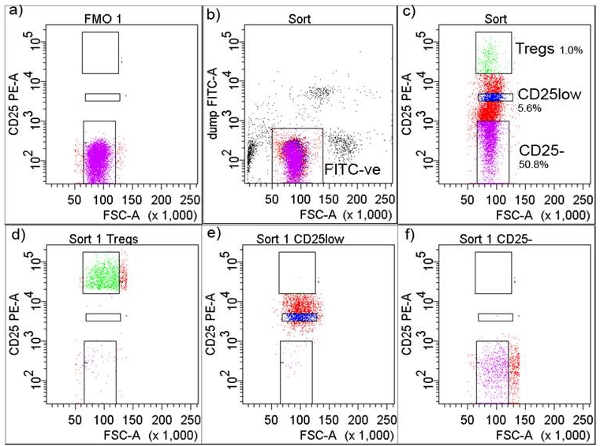
Рисунок 2. Память стратегии в изоляторе СУИМ. ) CD25 + порог был скорректирован в соответствии с флуорохромами минус один (FMO), б) клетки закрытого как FITC-отрицательных, в) FITC-негативные клетки были дополнительно закрытого типа, и собранные в CD + CD25-, CD + CD25low и CD + CD25high ( Tregs), показанные с процентами, г) FACS отсортированы Tregs после сортировки, е), FACS отсортированы CD + CD25low после сортировки, и е) FACS отсортированы CD4 + CD25-Т-клетки после сортировки
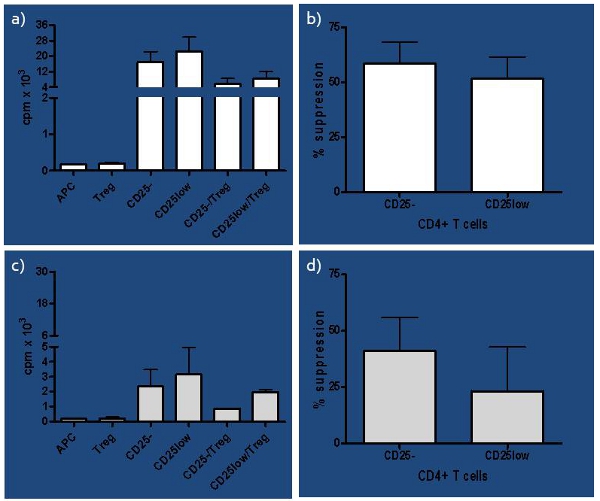
Рисунок 3. Представителю результаты здоровых людей) Представитель результаты импульсов в минуту (CPM) практически здоровых людей представлены в виде одной культуры для всех клеточных подмножеств участвует (наивно-CD25-, в естественных условиях активирован-CD25low, антиген-представляющих клеток, БТР и регуляторных Т-клеток-Treg), а также со-культур ответчик Т-клеток (CD25-или CD25low) и Tregs. б) Процент подавления каждого CD25-и CD25low ответчик Т-клеток путем аутологичной Tregs представляется для здоровой контрольной группой (п = 4). Подавление был рассчитан по формуле [(п) / с] х 100%, где S = копий в минуту в одной культуре и с = копий в минуту в совместной культуре. Хотя небольшая разница в мощности Tregs подавить ответчик Т-клеток, было замечено, он не был значительным (парный Т-тест р = 0,08). В) Представлены копии в минуту, по крайней риска предметов для каждой отдельной культуры, в том числе CD25-и CD25low как ответчик Т-клетки, а также АПК и Tregs, и сотрудничество культур, где каждая ячейка ответчик Т подмножество засеяно Tregs (CD25-/Tregs и CD25low/Tregs). г) Процент подавления каждого CD25-и CD25low ответчик Т-клеток путем аутологичной Tregs представляется для риску субъектов (п = 4). Разница в мощности Tregs подавить CD25-против CD25low ответчик Т-клеток было значительным (парный Т-тест р = 0,04).
Таблица 1. Схема настройка в анализе подавление пробирке
| 1-3 | 4-6 | 7-9 | 10-12 | |
| CD4CD25- | CD4CD25low | СМИ только | СМИ только | |
| B | CD4CD25-/ Tregs | CD4CD25low / Tregs | Tregs только | APC только |
| C | ||||
| D | ||||
| E | ||||
| F | ||||
| G | ||||
| H |
Обсуждение
Как только уникальная особенность, чтобы Tregs, подавляющие функции должны быть проверены надежно и равномерно между субъектами на различных стадиях развития заболевания в пределах одного и между различными исследованиями. Мы предлагаем детали подавления анализ в нашей лаборатории, ка...
Раскрытие информации
Благодарности
Это исследование было поддержано Макс Макги Национального исследовательского центра по делам несовершеннолетних Diabetesat Медицинского колледжа Висконсина и детской научно-исследовательского института штата Висконсин. Спонсоры не участвовал в дизайн исследования, сбор и анализ данных, или подготовке рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента или инструмента | Компания | Номер в каталоге | Комментарии (необязательно) |
|---|---|---|---|
| Ficoll-Paque PLUS | Amersham Pharmacia Biotech | 17-1440-03 | |
| DPBS-1X | Гибко | 14190-144 | |
| Голубой Трипан | Invitrogen | 15250-061 | |
| анти-CD4 микрошарики | Miltenyi | 130-045-101 | |
| Предварительное разделение фильтры | Miltenyi | 130-041-407 | |
| Л. С. колонке | Miltenyi | 130-042-401 | |
| ЭДТА | Invitrogen | 15575-020 | |
| BSA | Sigma-Aldrich | B4287 | |
| Анти-человека CD4-APCCy7 (клон РПА-T4) | BD Pharmingen | 557852 | |
| Анти-CD25 человека-PE (клон M-A251, Ил-2Rα) | BD Pharmingen | 555432 | |
| Анти-человека CD8-FITC (клон РПА-T8) | BD Pharmingen | 555366 | |
| Анти-CD14 человека-FITC (клон M5E2; LPS рецептор) | BD Pharmingen | 555397 | |
| Анти-CD32 человека-FITC (клон FLI8.26; FcγR типа II) | BD Pharmingen | 555448 | |
| Анти-человеческого CD116-FITC (клон M5D12; GM-CSFRα цепи) | BD Pharmingen | 554532 | |
| Dynalbeads М-450 tosylactivated | Invitrogen | 140-13 | |
| Anti-CD3 человека | Анселл | 144-024 | |
| Buffer1 | Домашний | 0,1 М Na 2 B 4 O 7 pH7.6 | |
| Buffer2 | Домашний | PBS/2mM ЭДТА / 0,1% BSA pH7.4 | |
| Buffer3 | Домашний | 0,2 М Tris/0.1% BSA pH8.5 | |
| Полное RPMI СМИ | Домашний | RPMI 1640 СМИ 2 мМ L-глутамина, 5 мМ HEPES 100 ед. / мкг / мл пени / strept 0,5 мМ пирувата натрия | |
| [3 H] тимидина | Перкин Элмер | NET027Z005MC | |
| человека объединенных AB сыворотке | Атланты биологические | S40110 | |
| Multiscreen пластины урожая | Millipore | MAHFC1H60 | |
| Microscint 20 | Перкин Элмер | 6013621 |
Ссылки
- Barge, A., Cravotto, G., Gianolio, E., Fedeli, F. How to determine free Gd and free ligand in solution of Gd chelates. A technical note. Contrast Med. Mol. Imaging. 1, 184-188 (2006).
- Nagaraja, T. N., Croxen, R. L., Panda, S., Knight, R. A., Keenan, K. A., Brown, S. L., Fenstermacher, J. D., Ewing, J. R. Application of arsenazo III in the preparation and characterization of an albumin-linked, gadolinium-based macromolecular magnetic resonance contrast agent. J. Neurosci. Methods. 157, 238-245 (2006).
- Supkowski, R. M., Horrocks, W. D. On the determination of the number of water molecules, q, coordinated to europium(III) ions in solution from luminescence decay lifetimes. Inorg. Chim. Acta. 340, 44-48 (2002).
- Menjoge, A. R., Kannan, R. M., Tomalia, D. A. Dendrimer-based drug and imaging conjugates: design considerations for nanomedical applications. Drug Discovery Today. 15, 171-185 (2010).
- Que, E. L., Chang, C. J. Responsive magnetic resonance imaging contrast agents as chemical sensors for metals in biology and medicine. Chem. Soc. Rev. 39, 51-60 (2010).
- Uppal, R., Caravan, P. Targeted probes for cardiovascular MR imaging. Future Med. Chem. 2, 451-470 (2010).
- Major, J. L., Meade, T. J. B. i. o. r. e. s. p. o. n. s. i. v. e. Bioresponsive, cell-penetrating, and multimeric MR contrast agents. Acc. Chem. Res. 42, 893-903 (2009).
- Datta, A., Raymond, K. N. Gd-hydroxypyridinone (HOPO)-based high-relaxivity magnetic resonance imaging (MRI) contrast agents. Acc. Chem. Res. 42, 938-947 (2009).
- Leôn-Rodríguez, L. M. D., Lubag, A. J. M., Malloy, C. R., Martinez, G. V., Gillies, R. J., Sherry, A. D. Responsive MRI agents for sensing metabolism in vivo. Acc. Chem. Res. 42, 948-957 (2009).
- Castelli, D. D., Gianolio, E., Crich, S. G., Terreno, E., Aime, S. Metal containing nanosized systems for MR-molecular imaging applications. Coord. Chem. Rev. 252, 2424-2443 (2008).
- Caravan, P., Ellison, J. J., McMurry, T. J., Lauffer, R. B. Gadolinium(III) chelates as MRI contrast agents: structure, dynamics, and applications. Chem. Rev. 99, 2293-2352 (1999).
- Lauffer, R. B. Paramagnetic metal complexes as water proton relaxation agents for NMR imaging: theory and design. Chem. Rev. 87, 901-927 (1987).
- Yoo, B., Pagel, . An overview of responsive MRI contrast agents for molecular imaging. Front. Biosci. 13, 1733-1752 (2008).
- Pandya, S., Yu, J., Parker, D. Engineering emissive europium and terbium complexes for molecular imaging and sensing. Dalton Trans. 23, 2757-2766 (2006).
- Nwe, K., Xu, H., Regino, C. A. S., Bernardo, M., Ileva, L., Riffle, L., Wong, K. J., Brechbiel, M. W. A new approach in the preparation of dendrimer-based bifunctional diethylenetriaminepentaacetic acid MR contrast agent derivatives. Bioconjugate Chem. 20, 1412-1418 (2009).
- Nwe, K., Bernardo, M., Regino, C. A. S., Williams, M., Brechbiel, M. W. Comparison of MRI properties between derivatized DTPA and DOTA gadolinium-dendrimer conjugates. Bioorg. Med. Chem. 18, 5925-5931 (2010).
- Caravan, P., Das, B., Deng, Q., Dumas, S., Jacques, V., Koerner, S. K., Kolodziej, A., Looby, R. J., Sun, W. -. C., Zhang, Z. A lysine walk to high relaxivity collagen-targeted MRI contrast agents. Chem. Commun. , 430-432 (2009).
- Leôn-Rodríguez, L. M. D., Kovacs, Z. The synthesis and chelation chemistry of DOTA-peptide conjugates. Bioconjugate Chem. 19, 391-402 (2008).
- Boswell, C. A., Eck, P. K., Regino, C. A. S., Bernardo, M., Wong, K. J., Milenic, D. E., Choyke, P. L., Brechbiel, M. W. Synthesis, characterization, and biological evaluation of integrin αVβ3-targeted PAMAM dendrimers. Mol. Pharm. 5, 527-539 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены