Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Homme In Vitro comme outil de dépistage pour la reconnaissance d'un Etat précoce de déséquilibre immunitaire
Dans cet article
Résumé
Tregs sont suppresseurs puissants du système immunitaire. Il ya un manque de marqueurs de surface unique de les définir, par conséquent, les définitions des Treg sont principalement fonctionnelle. Nous décrivons ici une optimisation In vitro Test capable d'identifier déséquilibre immunitaire chez les sujets à risque de développer le DT1.
Résumé
Les cellules T régulatrices (Treg) sont des médiateurs essentiels de la tolérance immunitaire aux antigènes du soi. De plus, ils sont des régulateurs essentiels de la réponse immunitaire après une infection. Malgré les efforts pour identifier les marqueurs de surface unique sur Tregs, la seule caractéristique unique est leur capacité à supprimer la prolifération et la fonction des lymphocytes T effecteurs. Alors qu'il est clair que seuls les essais in vitro peuvent être utilisés pour évaluer la fonction Treg humains, cela devient problématique lorsque l'évaluation des résultats à partir des études transversales où les cellules saines et les cellules isolées de sujets atteints de maladies auto-immunes (comme diabète de type 1-DT1) doivent être comparés. Il ya une grande variabilité entre les laboratoires dans le nombre et le type de cellules T intervenant, la nature et la force de stimulation, Treg: ratios répondeur et le nombre et le type de cellules présentatrices d'antigènes (APC) utilisés en médecine humaine dans les tests in vitro de suppression. Cette variabilité rend la comparaison entre les études mesurant la fonction Treg difficile. Le champ Treg a besoin d'un test de suppression standardisé qui va bien travailler avec des sujets sains et ceux atteints de maladies auto-immunes. Nous avons élaboré une épreuve suppression in vitro qui montre que très peu la variabilité intra-essai dans la stimulation des cellules T isolées chez des volontaires sains par rapport aux sujets avec une destruction auto-immune sous-jacente du pancréas β-cellules. L'objectif principal de cette pièce est de décrire un essai in vitro de suppression humaine qui permet la comparaison entre les groupes de sujets différents. De plus, ce test a le potentiel pour délimiter une petite perte de fonction et d'anticiper nTreg d'autres pertes dans le futur, donc sujets identification qui pourraient bénéficier d'une thérapie immunomodulatrice préventives 1. Ci-dessous, nous fournir une description approfondie des différentes étapes de cette procédure. Nous espérons contribuer à la standardisation de l'analyse de suppression in vitro utilisé pour mesurer la fonction Treg. En outre, nous offrons ce test comme outil de reconnaître un état de déséquilibre début immunitaire et un biomarqueur potentiel fonctionnel pour DT1.
Protocole
1. Avant de mettre en place un test de suppression, on a besoin de perles robe tosylactivated avec des anti-CD3 humain (clone UCHT1, 1μg/ml concentration finale) pour la stimulation des cellules et par la suite vérifier si les perles sont efficacement revêtus par la création d'une prolifération in vitro de dosage à l'aide humaine Les cellules T
- Prenez 1ml de M-450 perles tosylactivated du flacon d'origine, lieu support magnétique et maintenez jusqu'à ce que toutes les perles ont adhéré à la paroi du tube. Retirez le tampon tandis tube est toujours dans le support magnétique. Prenez le tube de support magnétique et ajouter 1ml de buffer1, placer le tube dans support magnétique à nouveau et retirez le tube est alors buffer1 dans le support magnétique; perles remettre en suspension dans 1ml de buffer1 et ajouter 40μl de l'anti-CD3 humain, agiter à 37 ° C pendant 15 minutes, ajouter 0,1% p / v de BSA et continuer l'agitation pour la prochaine 16 heures.
- Laver les billes en buffer2 fois pendant 5 minutes à 2-8 ° C et une fois dans buffer3 pendant 5 minutes à 2-8 ° C en utilisant support magnétique, comme expliqué ci-dessus; retirer le tampon et remettre les billes en 1ml de buffer2; les perles sont 4x10 concentration 8 / ml final et prêt à l'emploi.
- Aliquoter 50000 et 25000 PBMC / puits en triple dans une plaque de 96 puits et ajouter un nombre variable de cellules CD3 billes recouvertes (4x10 8 billes / ml, CD3 1μg/ml, par exemple 1, 2, 3, 4, 5 billes / cellules ) afin de déterminer le nombre optimal de perles par cellule. Après 72 heures de culture, ajouter 1μCi [3 H] thymidine et poursuivre l'incubation à 37 ° C pour les 16 prochaines heures. Récolte des cellules dans la plaque de la récolte Multiscreen (Millipore), ajouter à scintillation liquide et lire comptages par minutes (cpm) / puits à l'aide Top Count NXT (Packard, CT). Utilisez les perles / ratio de cellule lorsque CPMS sont au dessus de 5000 mais inférieur à 15000 pour éviter une stimulation excessive des Treg, qui pourrait perdre la fonction suppressive. Habituellement, le ratio de 3 billes / cellules stimule à la fois intervenants et les cellules Treg dans tous les groupes de sujets testés jusqu'à 1-4.
2. Isolation de PBMC du sang total de donneurs sains ou de leukopacks humaine ou buffy coat (BC) sont généralement prises par des volontaires sains et disponibles gratuitement auprès de centres locaux de transfusion sanguine (figure 1)
- Diluer le BC (~ 50 ml) 01h06 avec du PBS (ajouter 250ml). Maintenant, il ya 300ml volume total. Lentement couche de 25ml de BC diluée sur le dessus de 15ml Ficoll-Paque PLUS ajoutée à 50ml tubes Falcon, sans perturber les couches. Centrifuger à 800xg (1400rpm dans une centrifugeuse Sorvall avec godet oscillant du rotor SH-3000) pendant 30 minutes à 4 ° C, avec des freins éteint.
- Recueillir soigneusement la couche PBMC (phase intermédiaire) et le transférer à une nouvelle tubes Falcon 50 ml. Lavez PBMC par le remplissage des tubes jusqu'à 50 ml avec du DPBS. Recueillir 2 culots de cellules dans un tube. Centrifuger à 400xg pendant 10 min à 4 ° C. Répéter l'étape de lavage à deux reprises, chaque fois que la combinaison de 2 culots de cellules dans un tube unique. Mélanger tous les culots cellulaires dans un seul tube 50ml.
- Comptez PBMC en utilisant le test exclusion du bleu trypan. Faire une dilution 1:10 dans bleu Trypan en ajoutant 20 pi de PBMC à 180μl de bleu de trypan tache. Mélangez bien et de prendre 20 pi à compter en hématimètre immédiatement. Comptez le nombre de toutes les cellules non colorées et seulement teinté bleu situé à deux pâtés de maisons carrés contenant chacun 16 petits carrés. Prendre la moyenne des deux nombres et la multiplier par 10. Divisez ce nombre par 100 pour obtenir le nombre de PBMC / ml. Pourcentage de cellules viables de calculer que [1 - (nombre de cellules bleues / nombre de cellules totales) x100]. Procéder, si la viabilité est ≥ 95%.
3. MACS pré-tri des cellules T CD4
- Avant de procéder, le transfert de 1ml de PBMC dans un nouveau tube, ajouter 4ml de médias pour la préparation des cellules pour l'irradiation avec des 5000rad-ci seront cellules présentatrices d'antigènes (APC).
- Centrifuger le reste des cellules à 250xg dans PBS/2mM BSA tampon EDTA/0.5% pour 10min à 4 ° C. Décanter le surnageant des cellules, et remettre en suspension dans 4 ml de tampon BSA PBS/2mM EDTA/0.5%.
- Ajouter 200 ul de microbilles MACS anti-CD4 et incuber à 4 ° C pendant 20 minutes.
- Lavez en ajoutant 40ml de tampon BSA PBS/2mM EDTA/0.5% et centrifuger à 250xg pendant 10 minutes à 4 ° C. Décanter le surnageant et remettre en suspension dans 8 ml de dégazée, la température ambiante PBS/2mM tampon EDTA/0.5% de BSA.
- Filtre-séparée de la suspension cellulaire à l'aide de pré-séparation des filtres avant de les charger sur une colonne LS.
- Fractionner la suspension cellulaire et 4ml couche de chaque colonne LS plus calibré (avec 3ml de tampon BSA deggassed PBS/2mM EDTA/0.5%). Colonne de LS est fixé dans le séparateur MidiMACS. Avant la suspension cellulaire s'épuise, soit ré-exécuter accréditives ou d'ajouter 3ml de la température ambiante deggassed PBS/2mM tampon EDTA/0.5% de BSA et de laisser le tampon traversent. Ajoutez plus de mémoire tampon jusqu'à ce qu'il ressorte clairement.
- Pipette 5ml de tampon deggassed sur la colonne LS, enlever la colonne LS à partir du séparateur MidiMACS et le placer dans un nouveau tube de prélèvement stérile 15ml laissant courir ~ 1.0ml travers. Remettre le piston dans la colonne et poussez lentement le reste de lale volume de sortie.
- Faites de même avec les deux colonnes LS et combiner les deux fractions de CD4 +. Ajoutez jusqu'à 50ml cellules PBS et compter. Rendement attendu est à 5x10 8 cellules. Centrifuger à 400xg pendant 10 minutes et remettre les cellules bien dans 2ml de tampon BSA PBS/2mM EDTA/0.5%.
4. Fluorescent Activated tri cellulaire (FACS) isolement (figure 2)
- Faire un cocktail d'anticorps dirigés contre des marqueurs CD pour les marqueurs suivants surface cellulaire (garder l'abri de la lumière): 20 pl de l'anti-CD8 humain-FITC (clone RPA-T8), 20 pl de l'anti-CD14 humain-FITC (clone M5E2; LPS récepteur), 20 pl de l'anti-CD32-FITC humain (clone FLI8.26; FcyR type II) et 6 pl d'anti-humain CD116-FITC (clone M5D12; GM-CSFRα chaîne) et, subsidiairement, ajouter 40μl de lutte contre -CD4 humain APCCy7 (clone RPA-T4).
- Prenez 5uL de la suspension de cellules et de 2ml tache avec 2μl de cocktail aux taches, ce qui est un tube pour déterminer le seuil (fluorochrome Minus One-FMO) 5.
- Ajouter 50 ul d'anti-humain CD25-PE (clone M-A251; IL-2Rα) au cocktail de tache, et ajouter le cocktail à la suspension de cellules et incuber à 4 ° C 30 minutes. Laver les cellules dans du tampon PBS, centrifuger à 400xg pendant 10 minutes et remettre les cellules à une concentration cellulaire de 10 7 / ml.
- Préparer cellules non colorées et les cellules ou des perles colorées par simple fluorochrome pour l'utiliser comme commande de compensation pour le tri cellulaire sur FACS Aria (BD Biosciences, San Jose, NJ).
- Acquérir des cellules dans le tube de la FMO qui permettra à l'utilisateur de fixer le seuil pour le tri de cellules CD25 + T (figure 2a). Régler une porte autour FITC cellules négatives pour exclure FITC cellules positives comprenant les monocytes, les macrophages et les lymphocytes CD4 + d'autres non-cellules T (Figure 2b).
- Dans une parcelle séparée, dessiner pour les portes-CD25, et CD25low CD25high cellules T-Tregs (top 1% des cellules exprimant le plus grand nombre de CD25) (figure 2c). Sous-ensembles de cellules montrent typiquement une pureté élevée (Figure 2D, 2E et 2F).
- Centrifuger les tubes de prélèvement de cellules au 400xg pendant 10 minutes et les garder sur la glace jusqu'à ce plaquage.
5. Mettre en place des cultures de cellules dans la plaque de 96 puits (schéma ci-joint sous Table1) dans 200μl/well
- 50 pl aliquote de billes recouvertes CD3 (1 pg / ml) calculé à 3 billes / cellules intervenant dans un puits, remis en suspension dans les médias avec 10% de sérum humain AB en U-96 puits à fond des assiettes. (Par exemple, pour rendre les médias 2ml avec CD3-couché, prenez 7.5μl du stock de billes recouvertes CD3-finale de concentration 4x10 8 / ml et diluer dans 2 ml de médias; tous les 50 pl contiendra 75000 beads-3beads/cell).
- Diluer APC irradiées à 5x10 concentration cellulaire 5 / ml et ajouter 50 pl (contiendra 2,5 x 10 4 cellules) dans chaque puits avec une stimulation précédemment ajoutés, y compris les puits étiquetés comme «Tregs seulement", "seul APC» et «médias seulement" dans le tableau 1.
- Ajouter 2,5 x 10 4 / ainsi CD4CD25 ou CD4CD25low cellules T en triple suivant la conception dans le tableau 1.
- Ajouter Tregs au co-cultures (ligne B, tableau 1) dans le rapport 01:10 (2500 cellules Treg) et à des puits étiquetés comme «Tregs seulement" et incuber la plaque à 37 ° C en CO 2 incubateur avec 5% de CO 2 en humidité saturée pendant 72 heures.
- Pulse puits avec 1μCi [3 H] thymidine et continuent d'incubation à 37 ° C pour les prochaines 16 heures.
6. La récolte et le comptage
- Récolte des cellules sur la plaque de récolte multivision utilisant Packard Filtermate abatteuse ou un système alternatif.
- Ajouter à scintillation liquide (Microscint 20), couvrir la récolte assiette avec couvercle en plastique transparent en préparation pour l'étape finale.
- Lire comptes par minutes (cpm) / puits à l'aide Top Count NXT (Packard, CT) ou un système alternatif.
7. Pourcentage de calcul de la répression
- Comme les cellules étaient cultivées en triple, la moyenne est calculée pour chaque condition. Si le coefficient de variation est> 30%, la valeur aberrante est éliminée et que la CMP à partir de deux puits sont en moyenne. Pourcentage de suppression est obtenue en calculant [(sc) / s] x 100%, où s = cpm en culture simple et c = cpm en co-culture.
- Comme naïfs (CD25-) et in vivo activé (CD25low) lymphocytes T effecteurs sont plaquées comme des cellules T intervenant, la différence dans la capacité des Tregs pour supprimer chacune de ces sous-ensembles est capturé et utilisé comme un indicateur pronostique fonctionnelle potentielle fondée sur la prémisse que les cellules activées sont plus difficiles à supprimer.
8. Les résultats représentatifs:
Une grande variabilité dans les méthodes utilisées et les résultats issus de test in vitro avec la suppression humaine nous a incité à effectuer une étude approfondie des conditions influençant le dosage 1. Nous avons développé un test qui teste pas seulement fonction de Treg, mais aussi leur pureté, considérant le faible ratio entre les Tregs: Teffs (1:10), que nous avons déterminé plus tôt 6. En outre, les Tregs diffèrent èmela capacité de l'EIR succès suppriment naïfs et dans les cellules T activées in vivo, même chez des sujets sains, comme le montre la figure 3 et dans nos études précédentes 2,4, ce qui devient plus importante si l'équilibre immunitaire est affaibli, comme chez les sujets à risque de développer le DT1 . Le test a très bien fonctionné dans l'étude où nous avons comparé la fonction suppressive des ressources naturelles (nTregs), inductible (iTregs) et dans nTregs élargi in vitro, nous permettant de comparer leurs fonctions entre le contrôle sain, d'apparition récente (RO) DT1 et de longue date (LS ) sujets DT1. Nous avons conclu que RO sujets DT1 avaient une meilleure capacité de générer à la fois fonctionnelle et iTregs nTregs élargi par rapport à des sujets de contrôle LS DT1 et sain 7. Ainsi, ce test peut être utilisé comme un excellent outil dans la reconnaissance des deux un état précoce et tardive de déséquilibre immunitaire.
Représentation schématique du schéma 1 les étapes impliquées dans la répression dans le dosage in vitro

Figure 1. Étapes de l'analyse de suppression in vitro avec des photographies présentées
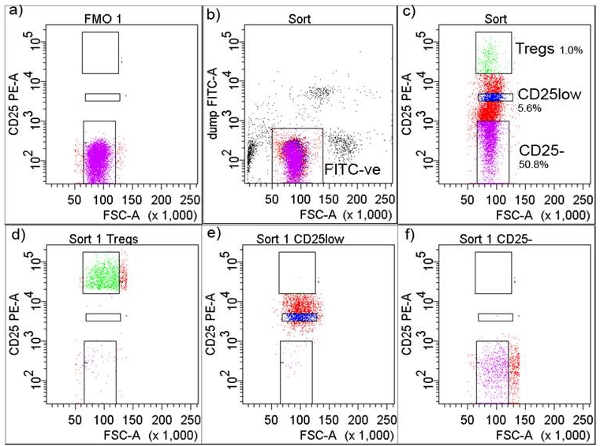
Figure 2. Gating stratégie en isolement cellulaire par FACS. a) CD25 + seuil a été ajusté en fonction de Fluorochrome Minus One (FMO), b) les cellules ont été fermée que le FITC-négatif, c) FITC négative cellules ont ensuite été fermé et recueillies dans le CD + CD25-, CD25high CD + CD25low et CD + ( Tregs) illustré avec des pourcentages, d) FACS triés Tregs après le tri, e) FACS triés CD + CD25low après le tri, et f) FACS CD4 + CD25 triés cellules T après le tri
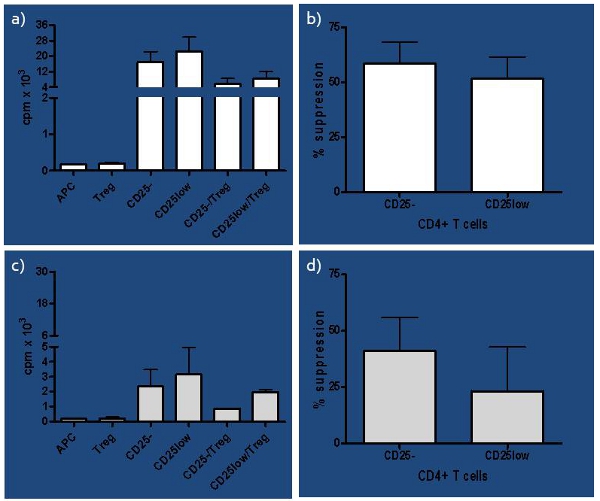
Figure 3. Les résultats représentatifs de sujets sains a) Les résultats représentatifs de coups par minute (cpm) de sujets sains présenté comme unique pour toutes les cultures cellulaires sous-ensembles concernés (naïve-CD25-, in vivo activées CD25low, cellules présentatrices d'antigène-APC et lymphocytes T régulateurs-Treg) ainsi que des co-cultures de cellules T intervenant (CD25-ou CD25low) et Tregs. b) Pourcentage de la suppression de chaque CD25 et CD25low répondeur cellules T autologues par Tregs est présenté pour le contrôle des sujets sains (n = 4). Répression a été calculé comme [(sc) / s] x 100%, où s = cpm en culture simple et c = cpm en co-culture. Bien que légère différence dans la capacité des Treg à réprimer répondeur cellules T a été remarqué, il n'était pas significative (test t apparié p = 0,08). C) Présenté sont cpm de sujets à risque pour chaque culture unique, y compris CD25 et CD25low de répondeur Les cellules T ainsi que APC et Tregs, et co-cultures où chaque sous-ensemble de lymphocytes T intervenant est ensemencé avec Tregs (CD25-/Tregs et CD25low/Tregs). d) Pourcentage de la suppression de chaque CD25-et les cellules T CD25low répondeur d'une autogreffe Tregs est présenté pour les sujets à risque (n = 4). La différence dans la capacité des Treg à réprimer CD25 versus CD25low répondeur cellules T a été significative (test t apparié p = 0,04).
Tableau 1. Schéma de mise en place dans le dosage de suppression in vitro
| 1-3 | 4-6 | 7-9 | 10-12 | |
| Une | CD4CD25- | CD4CD25low | médias seulement | médias seulement |
| B | CD4CD25-/ Tregs | CD4CD25low / Tregs | Tregs seule | Seul APC |
| C | ||||
| D | ||||
| E | ||||
| F | ||||
| G | ||||
| H |
Discussion
Comme la seule caractéristique unique de Tregs, fonction suppressive doit être testé de façon fiable et uniforme entre les sujets à différentes phases de développement de la maladie dans les mêmes et entre les différentes études. Nous vous proposons des détails sur le test de suppression développés dans notre laboratoire que notre contribution à la standardisation de ce dosage. Dans notre étude d'optimisation approfondie, nous avons déterminé que la stimulation des cellules T avec des anti-CD3 humai...
Déclarations de divulgation
Remerciements
Cette étude a été soutenue par Max McGee Centre national de recherche pour les jeunes Diabetesat Medical College of Wisconsin et l'enfance Institut de recherche du Wisconsin. Les bailleurs de fonds n'a joué aucun rôle dans la conception de l'étude, la collecte de données et d'analyse, ou de la préparation du manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif ou d'un instrument | Société | Numéro de catalogue | Commentaires (optionnel) |
|---|---|---|---|
| Ficoll-Paque PLUS | Amersham Pharmacia Biotech | 17-1440-03 | |
| DPBS-1X | Gibco | 14190-144 | |
| Bleu Trypan | Invitrogen | 15250-061 | |
| anti-CD4 microbilles | Miltenyi | 130-045-101 | |
| Pré-filtres de séparation | Miltenyi | 130-041-407 | |
| Colonne de LS | Miltenyi | 130-042-401 | |
| EDTA | Invitrogen | 15575-020 | |
| BSA | Sigma-Aldrich | B4287 | |
| Anti-CD4 humain APCCy7 (clone RPA-T4) | BD Pharmingen | 557852 | |
| Anti-CD25-PE humains (clone M-A251; IL-2Rα) | BD Pharmingen | 555432 | |
| Anti-CD8 humain-FITC (clone RPA-T8) | BD Pharmingen | 555366 | |
| Anti-CD14 humain-FITC (clone M5E2; récepteurs LPS) | BD Pharmingen | 555397 | |
| Anti-CD32-FITC humain (clone FLI8.26; FcyR type II) | BD Pharmingen | 555448 | |
| Anti-humain CD116-FITC (clone M5D12; GM-CSFRα chaîne) | BD Pharmingen | 554532 | |
| Dynalbeads M-450 tosylactivated | Invitrogen | 140-13 | |
| Anti-CD3 humain | Ancell | 144-024 | |
| Buffer1 | Homemade | 0,1 M Na 2 B 4 O 7 pH 7,6 | |
| Buffer2 | Homemade | PBS/2mM EDTA / BSA 0,1% pH 7,4 | |
| Buffer3 | Homemade | 0,2% de BSA Tris/0.1 pH 8,5 | |
| RPMI complet des médias | Homemade | Du milieu RPMI 1640 2 mM L-glutamine 100 mM HEPES 5 U / pg / ml pénicilline / strept 0,5 mM pyruvate de sodium | |
| [3 H] thymidine | Perkin Elmer | NET027Z005MC | |
| humains mis en commun sérum AB | Atlanta Biologicals | S40110 | |
| Plaque de la récolte Multiscreen | Millipore | MAHFC1H60 | |
| Microscint 20 | Perkin Elmer | 6013621 |
Références
- Barge, A., Cravotto, G., Gianolio, E., Fedeli, F. How to determine free Gd and free ligand in solution of Gd chelates. A technical note. Contrast Med. Mol. Imaging. 1, 184-188 (2006).
- Nagaraja, T. N., Croxen, R. L., Panda, S., Knight, R. A., Keenan, K. A., Brown, S. L., Fenstermacher, J. D., Ewing, J. R. Application of arsenazo III in the preparation and characterization of an albumin-linked, gadolinium-based macromolecular magnetic resonance contrast agent. J. Neurosci. Methods. 157, 238-245 (2006).
- Supkowski, R. M., Horrocks, W. D. On the determination of the number of water molecules, q, coordinated to europium(III) ions in solution from luminescence decay lifetimes. Inorg. Chim. Acta. 340, 44-48 (2002).
- Menjoge, A. R., Kannan, R. M., Tomalia, D. A. Dendrimer-based drug and imaging conjugates: design considerations for nanomedical applications. Drug Discovery Today. 15, 171-185 (2010).
- Que, E. L., Chang, C. J. Responsive magnetic resonance imaging contrast agents as chemical sensors for metals in biology and medicine. Chem. Soc. Rev. 39, 51-60 (2010).
- Uppal, R., Caravan, P. Targeted probes for cardiovascular MR imaging. Future Med. Chem. 2, 451-470 (2010).
- Major, J. L., Meade, T. J. B. i. o. r. e. s. p. o. n. s. i. v. e. Bioresponsive, cell-penetrating, and multimeric MR contrast agents. Acc. Chem. Res. 42, 893-903 (2009).
- Datta, A., Raymond, K. N. Gd-hydroxypyridinone (HOPO)-based high-relaxivity magnetic resonance imaging (MRI) contrast agents. Acc. Chem. Res. 42, 938-947 (2009).
- Leôn-Rodríguez, L. M. D., Lubag, A. J. M., Malloy, C. R., Martinez, G. V., Gillies, R. J., Sherry, A. D. Responsive MRI agents for sensing metabolism in vivo. Acc. Chem. Res. 42, 948-957 (2009).
- Castelli, D. D., Gianolio, E., Crich, S. G., Terreno, E., Aime, S. Metal containing nanosized systems for MR-molecular imaging applications. Coord. Chem. Rev. 252, 2424-2443 (2008).
- Caravan, P., Ellison, J. J., McMurry, T. J., Lauffer, R. B. Gadolinium(III) chelates as MRI contrast agents: structure, dynamics, and applications. Chem. Rev. 99, 2293-2352 (1999).
- Lauffer, R. B. Paramagnetic metal complexes as water proton relaxation agents for NMR imaging: theory and design. Chem. Rev. 87, 901-927 (1987).
- Yoo, B., Pagel, . An overview of responsive MRI contrast agents for molecular imaging. Front. Biosci. 13, 1733-1752 (2008).
- Pandya, S., Yu, J., Parker, D. Engineering emissive europium and terbium complexes for molecular imaging and sensing. Dalton Trans. 23, 2757-2766 (2006).
- Nwe, K., Xu, H., Regino, C. A. S., Bernardo, M., Ileva, L., Riffle, L., Wong, K. J., Brechbiel, M. W. A new approach in the preparation of dendrimer-based bifunctional diethylenetriaminepentaacetic acid MR contrast agent derivatives. Bioconjugate Chem. 20, 1412-1418 (2009).
- Nwe, K., Bernardo, M., Regino, C. A. S., Williams, M., Brechbiel, M. W. Comparison of MRI properties between derivatized DTPA and DOTA gadolinium-dendrimer conjugates. Bioorg. Med. Chem. 18, 5925-5931 (2010).
- Caravan, P., Das, B., Deng, Q., Dumas, S., Jacques, V., Koerner, S. K., Kolodziej, A., Looby, R. J., Sun, W. -. C., Zhang, Z. A lysine walk to high relaxivity collagen-targeted MRI contrast agents. Chem. Commun. , 430-432 (2009).
- Leôn-Rodríguez, L. M. D., Kovacs, Z. The synthesis and chelation chemistry of DOTA-peptide conjugates. Bioconjugate Chem. 19, 391-402 (2008).
- Boswell, C. A., Eck, P. K., Regino, C. A. S., Bernardo, M., Wong, K. J., Milenic, D. E., Choyke, P. L., Brechbiel, M. W. Synthesis, characterization, and biological evaluation of integrin αVβ3-targeted PAMAM dendrimers. Mol. Pharm. 5, 527-539 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon