このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ヒトのインビトロ抑制
要約
Tregsのは、免疫系の強力な抑制因子である。それ故に、それらを定義するためにユニークな表面マーカーの欠如が存在する、Tregsのの定義は、主に機能的です。ここでは、最適化を説明 in vitroでアッセイ。
要約
制御性T細胞(Treg)は自己抗原に対する免疫寛容の重要なメディエーターである。さらに、彼らは感染後の免疫応答の重要な調節因子である。 Tregsの上でユニークな表面マーカーを同定するための努力にもかかわらず、唯一のユニークな特徴は、エフェクターT細胞の増殖や機能を抑制する能力です。それが唯一のin vitroアッセイにおいてヒトTregの機能を評価に使用される場合があることは明らかですが健康な細胞と細胞(1型糖尿- T1Dのような)自己免疫疾患を有する被験者から分離された横断的研究からの結果を評価する際に、これは問題となる必 要があります。比較する。応答者の比率とのin vitro抑制アッセイにおけるヒトで使用されている抗原提示細胞(APC)の数と種類:レスポンダーT細胞、刺激の性質と強さ、Tregの数と種類の研究所の間で大きなばらつきがあります。この変動は、困難なTregの機能を測定する研究間の比較を行います。 Tregのフィールドには、健常者と自己免疫疾患患者の両方でうまく動作する標準化された抑制アッセイを必要とします。我々は、膵β細胞の自己免疫破壊の根底にあるの被験者に比べて健康なボランティアから単離したT細胞の刺激ではほとんどのイントラアッセイのばらつきを示すin vitroでの抑制アッセイで開発した。この作品の主な目的は、異なる被験者グループ間の比較を可能にするin vitroでヒトの抑制アッセイで記述することです。さらに、このアッセイは、このように予防的免疫療法の1から利益を得ることができる科目を識別する、機能をnTregに小さな損失を描くと、将来のさらなる損失を予測する可能性を秘めています。以下、我々は、この手順に必要な手順の徹底的な説明を提供しています。我々はTregの機能を測定するために使用されるin vitroでの抑制アッセイの標準化に貢献したいと考えています。さらに、我々は免疫不均衡の初期の状態とT1Dのための潜在的な機能のバイオマーカーを認識するツールとして、このアッセイを提供する。
プロトコル
1。抑制アッセイを設定する前に、その後の細胞の刺激とするための抗ヒトCD3(クローンUCHT1、最終濃度1μg/mlの)でコーティングtosylactivatedビーズへの1つのニーズは、ビーズが効率的に人間を用いた in vitro増殖アッセイで設定することによって被覆されているかどうかを確認するT細胞
- オリジナルバイアル、磁気スタンドの場所からM - 450 tosylactivatedビーズを1mlを取り、すべてのビーズがチューブの側面に付着するまで押し続けます。チューブは、磁気スタンドに入れたままでバッファを削除します。 37、撹拌機を再懸濁しますビーズをbuffer1の1mlの抗ヒトCD3の40μlのを追加°、磁気スタンドからチューブを取り、buffer1の1mlを追加、再び磁気スタンドにチューブを配置し、チューブを磁気スタンドにある間buffer1を削除するC 15分間、0.1%w / vのBSAを追加し、次の16時間攪拌を続行。
- バッファを削除するとbuffer2の1mlのビーズを再懸濁さ;ビーズがある℃、一回5分間buffer3で2〜8℃上記で説明したように磁気スタンドを使用して2〜8℃で5分間二回buffer2でビーズを洗浄4 × 10 8 / mlの最終濃度、使用できるようになります。
- 分注し50,000 25000 PBMC /ウェル、96ウェルプレートでトリプリケートでとCD3でコーティングされたビーズの数が可変(4 × 10 8ビーズ/ mlと、CD31μg/mlの、例えば1、2、3、4、5ビーズ/細胞追加)細胞当たりのビーズの最適数を決定するために。文化の中で72時間後、1μCi[3 H]チミジンを追加し、37℃でインキュベートし、次の16時間継続する。マルチスクリーン収穫プレート(ミリポア)で収穫細胞は、シンチレーション液を追加し、トップカウントNXT(パッカード、CT)を使用しても/分当たりのカウント(cpm)をお読みください。抑制機能を失う可能性が制御性T、の過剰刺激を避けるために、ビーズ/インプレッション単価が5000を超えている細胞の比率が15000未満を使用してください。通常、3ビーズ/細胞の比は、これまでに1から4までテストしたすべての被験者群でのレスポンダとTreg細胞の両方を刺激する。
2。地元の輸血センターから健康なドナーからのまたは人間leukopacksまたはバフィーコート(BC)からの全血からPBMCを分離、通常健康なボランティアから採取し、無料で利用できる(図1)
- BC(〜50ml)にPBS 1:6を(250ミリリットルを追加する)希釈してください。今すぐ300ミリリットルの合計体積があります。徐々に15ミリリットルをFicoll - Paqueの上に希薄化後のBCの25ミリリットル層PLUSは、層を乱すことなく、50ミリリットルのファルコンチューブに加えた。 4℃で30分間800xg(スイングバケットローターSH - 3000とソーバル遠心機で1400rpm)で遠心° C、ブレーキをオフにした。
- 慎重にPBMC層(中間相)を収集し、新鮮な50ミリリットルファルコンチューブに移す。 DPBSで50ミリリットルにチューブが満杯になってPBMCを洗ってください。つのチューブに2細胞ペレットを収集する。で10分間4℃で400xgで遠心分離、二回一本のチューブに2細胞ペレットを組み合わせたたびに洗浄ステップを繰り返します。シングル50ミリリットルチューブにすべての細胞ペレットを組み合わせる。
- トリパンブルー排除試験を用いてPBMCを数えます。染色トリパンブルーの180μlにPBMCの20μlのを追加してトリパンブルーで1:10希釈液を加えます。よく混和して、直ちに血球計でカウントする20μlのかかります。二つの四角いブロック16より小さい正方形を含むそれぞれの内にあるすべての未染色とのみ青色に染色された細胞数を数える。両方の数値の平均を取ると10を掛けます。 PBMC / mlの数を得るために100でこの数を分け。生存細胞の割合として計算する[1 - (全細胞の青色のセル/数の数)× 100]。生存率が≥95%の場合進みます。
3。 CD4 T細胞のMACS事前ソート
- 先に進む前に、新しいチューブにPBMCの1mlを転送する、5000rad - これらは、抗原提示細胞(APC)になると照射のために細胞を調製するためにメディアの4ミリリットル加える。
- 4℃で10分間PBS/2mM EDTA/0.5%BSAバッファー中で250xgでの細胞の残りを遠心分離℃にPBS/2mM EDTA/0.5%BSAバッファーの4ミリリットルで上清、再懸濁します細胞を捨て。
- MACS抗CD4マイクロビーズ200μlのを追加し、4℃でインキュベート℃で20分間。
- 4℃で10分間250xgでPBS/2mM EDTA/0.5%BSAバッファーと遠心の40ミリリットルを追加することで、洗う℃に脱気、室温PBS/2mM EDTA/0.5%BSAバッファーの8ミリリットルの上清と再懸を捨て。
- LSカラム上にロードする前に、プレセパレーションフィルターを使用してフィルタ - 別々の細胞懸濁液。
- キャリブレーションLSカラムに各細胞懸濁液および層の4ミリリットルを分割(deggassed PBS/2mM EDTA/0.5%BSAバッファーの3ミリリットルを持つ)。 LSカラムはMidiMACSセパレータに固定されています。細胞懸濁液は、再実行のフロースルー、不足またはdeggassed室温PBS/2mM EDTA/0.5%BSAバッファーの3ミリリットルを加えるとバッファがから実行できるようにする前に。それが出て明らかになるまでより多くのバッファを追加。
- LSのカラムにピペット5ミリリットルdeggassedバッファ、〜1.0ミリリットルを介して実行させる新しい滅菌15ミリリットルコレクションチューブにMidiMACSセパレータと場所からLSカラムを削除します。列にプランジャーを入れて、ゆっくりと残りの部分を押してくださいボリュームから。
- 両方のLSの列でも同じことが二CD4 +分画を組み合わせる。 50ミリリットルPBSとカウントセルを追加します。予想される収量は、5 × 10 8細胞までです。 2ミリリットルPBS/2mM EDTA/0.5%BSAバッファー中でも10分、懸濁し、細胞のために400xgで遠心分離します。
4。蛍光活性化細胞選別(FACS)の分離(図2)
- 、抗ヒトCD8 - FITC(クローンRPA - T8)、抗ヒトCD14 - FITC(クローンM5E2の20μlを、20μlの次の細胞表面マーカー(光から保護保持)にCDのマーカーに対する抗体のカクテルを作るLPS受容体)、抗ヒトCD32 - FITC(クローンFLI8.26の20μlを、FcγRのタイプII)と抗ヒトCD116 - FITC(クローンM5D126μlの、GM -CSFRαチェーン)とは、代わりに、40μlの抗を追加ヒトCD4 - APCCy7(クローンRPA - T4)。
- 5μlのは、2ミリリットルの細胞懸濁液を取り出し、汚れカクテルの2μlのと染色、これは、しきい値(蛍光色素マイナスOne - FMO)5を決定するためのチューブです。
- 染色カクテルに、そして4℃で30分で細胞懸濁液とインキュベートするカクテルを追加し、抗ヒトCD25 - PE(IL -2RαクローンM - A251)の50μlを追加。 PBS緩衝液、10分および10 7 / mlの細胞濃度に懸濁し、細胞のための400xgで遠心分離で細胞を洗浄。
- 未染色の細胞と細胞またはFACSアリア(BD Biosciences社、サンノゼ、ニュージャージー州)での細胞選別のために補償制御として使用する単一の蛍光色素で染色されたビーズを準備します。
- ユーザーは、CD25 + T細胞(図2a)のソートのしきい値を設定できるようになりますFMOチューブに細胞を取得する。単球、マクロファージおよび他のすべてのCD4 + -非T細胞(図2b)からなるFITC陽性細胞を除外するためにFITC -陰性細胞の周りのゲートを設定します。
- 別のプロットでは、CD25 -、CD25lowとCD25high T細胞- Tregsの(CD25の最大数を発現する細胞の上位1%)(図2c)のためにゲートを描きます。細胞サブセットは一般的に高純度(図2d、2eと2fを)示しています。
- 10分間400xgで細胞を用いたコレクションチューブを遠心し、メッキまで氷上で保管して下さい。
5。 200μl/wellで96穴プレート(表1として添付する方式)で細胞培養を設定する
- CD3でコーティングされたビーズのアリコート50μlの(1μg/ mlの)は3ビーズ/ U -底部では10%プールしたヒトAB血清で完全なメディアに再懸濁してウェル内のレスポンダのセル、96ウェルプレートになるように計算。 (たとえば、CD3でコーティングした2ミリリットルのメディアを作るために、CD3でコーティングされたの株式ビーズ-最終濃度4 × 10 8 / mlから7.5μl取るとメディアの2ミリリットルで希釈し、すべての50μlのは75,000 beads-3beads/cellが含まれます)。
- 5 × 10 5 / mlの細胞濃度と、"唯一のTregsの"というラベルの井戸を含む、以前に追加した刺激、との各ウェルに(2.5 × 10 4細胞を含む)50μlずつを追加し、"APCだけ"と、表の"メディアのみ"に照射APCを薄める1。
- 表1の設計は、次の連で2.5 × 10 4 /ウェルCD4CD25 -またはCD4CD25low T細胞を追加。
- 比1:10(2,500 Treg細胞)の共培養(列B、表1)にし、"唯一のTregsの"というラベルのウェルにTregsのを追加し、5%CO 2とCO 2インキュベーターで37℃プレート℃でインキュベートする、72時間飽和湿度インチ
- パルス1μCi[3 H]チミジンをウェルの中とは° C次の16時間37℃でインキュベーションを続ける。
6。収穫とカウント
- パッカードfiltermate収穫機または別のシステムを使用してマルチスクリーン収穫プレート上に細胞を回収。
- シンチレーション液(Microscint 20)追加、最後のステップの準備のために透明なプラスチックカバーでプレートを収穫するカバー。
- 分当たりのカウント数(cpm)を読んで/ウェルトップカウントNXT(パッカード、CT)または別のシステムを使用して。
7。抑制のコンピューティングの割合
- 細胞は三連で培養したように、平均を各条件ごとに計算されます。変動係数が> 30%の場合、外れ値が排除され、2つの井戸からのみCPMは平均化されます。抑制の割合は、共培養の単文化とc = CPMの計算[(SC)/秒] × 100%、S = CPMすることによって得られる。
- ナイーブ(CD25 -)とin vivoで活性化(CD25low) にエフェクターT細胞は、レスポンダーT細胞として播種され、これらのサブセットの各々を抑制する制御性Tの能力の差が前提に基づいて潜在的な機能的な予後の指標として取り込まれ、使用されているようにその活性化細胞では抑制が困難です。
8。代表的な結果:
方法に大きなばらつきが使用され、in vitroでヒトの抑制アッセイから得られた結果は、私たちはアッセイ1に影響を与える条件の総合的な研究を実行するためのプロンプトが表示。我々は以前の6に決定Teffs(1:10)、:私達はTregsの間に低比を考慮するだけでなく、Tregの機能をテストする検定だけでなく、その純度を開発している。さらに、Tregsのは目に異なる免疫バランスが侵害された場合T1D開発するためにリスクのある被験者のように成功し、ナイーブと、図3に、より顕著になる私たちの以前の研究2,4に示すように、さらに健常者の in vivo活性化T細胞における抑制するEIRの能力。アッセイは、LS(最近発症(RO)T1Dと長年、私たちは健康な制御との間でそれらの機能を比較することが、我々は自然(nTregs)の抑制機能を比較して研究、誘導(iTregs) と in vitro拡張のnTregs で非常にうまくいった)T1D科目。我々はRO T1D被験者はLS T1Dと健常者7に比べて機能的iTregs両方と拡張nTregsを生成するのより良い能力を持っていたと結論づけた。したがって、このアッセイは免疫不均衡の初期および後期の状態の両方の認識に優れたツールとして使用することができます。
in vitroでの抑制アッセイのために必要な手順のスキーム1回路図のプレゼンテーション

図1写真を提示in vitroでの抑制アッセイのステップ
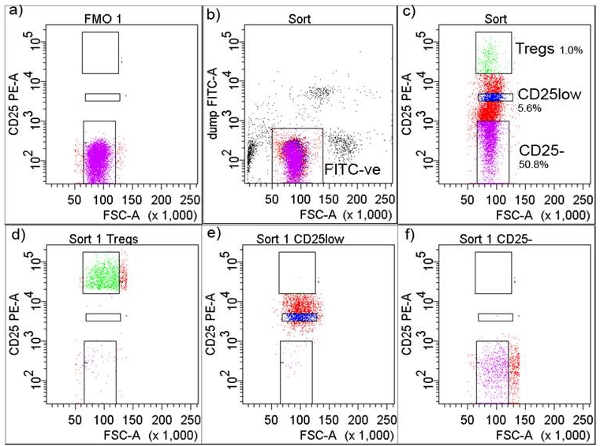
FACS細胞の分離2。ゲーティング戦略図 。 )CD25 +しきい値は、FITC -陰性細胞は(さらにゲートしたとCD + CD25 -、CD + CD25lowとCD + CD25highとして収集された)細胞は、C FITC陰性としてゲーティングした)蛍光色素マイナスワン(FMO)、Bに応じて調整された割合、dで示すように、Tregsのは))、電子、ソート後にTregsのをソートFACS)ソート後にソートされたCD + CD25lowをFACS、およびf)ソート後にソートされたCD4 + CD25 - T細胞をFACS
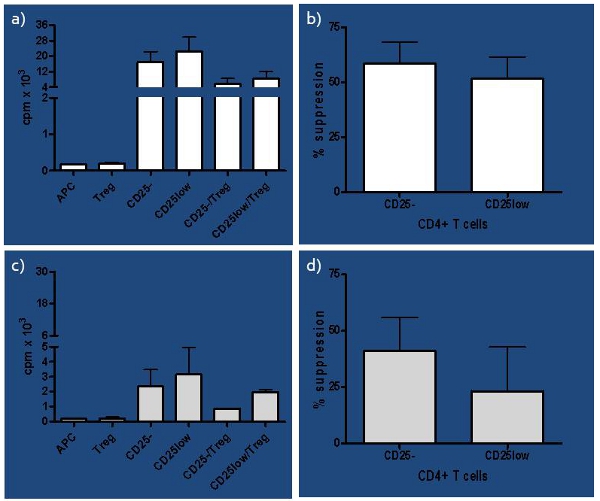
図3。健常者の代表の結果)関連するすべての細胞サブセットのための単一文化として提示健常者(ナイーブ- CD25 -、in vivoで活性化- CD25low で 、抗原提示細胞- APCの毎分のカウントの代表的な結果(CPM)がと各CD25 -と自己制御性TによってCD25lowレスポンダーT細胞は健常者のために提示されている(nの抑制の制御性T細胞- Tregの)だけでなく、レスポンダーT細胞の共培養(CD25 -またはCD25low)とTregsの。B)の割合= 4)。抑制は、共培養の単文化とc = CPMで[(SC)/秒]として× 100%、S = CPMを計算した。レスポンダーT細胞を抑制する制御性Tの容量のわずかな違いが気づいていたが、それは。C(t検定P = 0.08ペア))発表は、応答側としてCD25 -とCD25lowを含め、それぞれ単一の文化のためのリスクの被験者でのcpmである有意ではなかったT細胞だけでなく、それぞれのレスポンダーT細胞サブセットは、自家で各CD25 -とCD25lowレスポンダーT細胞の抑制の制御性T(CD25-/TregsとCD25low/Tregs)。d)の割合で播種されたAPCとTregsの、そして共培養Tregsのは、リスクの被験者(N = 4)でのために提示されます。 CD25 -対CD25lowレスポンダーT細胞を抑制する制御性Tの能力の差は有意であった(t検定P = 0.04をペアになった)。
表1。回路図は 、in vitro 抑制アッセイのセットアップ
| 1月3日 | 4月6日 | 7月9日 | 10月12日 | |
| A | CD4CD25 - | CD4CD25low | メディアのみ | メディアのみ |
| B | CD4CD25 - / Tregsの | CD4CD25low / Tregsの | のみTregsの | APCのみ |
| C | ||||
| D | ||||
| E | ||||
| F | ||||
| G | ||||
| H |
ディスカッション
Tregsのへの唯一のユニークな特徴として、抑制機能は、同じ内および異なる研究間の疾患の開発のさまざまな段階での被験者の間で確実にかつ均一にテストする必要があります。我々は、このアッセイの標準化への貢献として、当研究室で開発抑制アッセイの詳細を提供します。私たちの広範な最適化の研究では、我々は自然の刺激を提供するAPCとしてPBMCとの併用で抗ヒトCD3でコーティング...
開示事項
謝辞
この研究は、ウィスコンシン州とウィスコンシン州の子どもの研究所の少年Diabetesat医科大学のマックスマギー国立研究センターによってサポートされていました。資金提供者は、研究デザイン、データ収集と分析の役割、または原稿の準備がなかった。
資料
| Name | Company | Catalog Number | Comments |
| 試薬や器具の名前 | 会社 | カタログ番号 | コメント(省略可能) |
|---|---|---|---|
| をFicoll - Paque PLUS | アマシャムファルマシアバイオテク | 17-1440-03 | |
| DPBS - 1X | ギブコ | 14190-144 | |
| トリパンブルー | インビトロジェン | 15250-061 | |
| 抗CD4マイクロビーズ | 国内でのみ有効 | 130-045-101 | |
| プレセパレーションフィルター | 国内でのみ有効 | 130-041-407 | |
| LSカラム | 国内でのみ有効 | 130-042-401 | |
| EDTA | インビトロジェン | 15575-020 | |
| BSA | シグマアルドリッチ | B4287 | |
| 抗ヒトCD4 - APCCy7(クローンRPA - T4) | BD Pharmingen社 | 557852 | |
| 抗ヒトCD25 - PE(クローンM - A251、IL -2Rα) | BD Pharmingen社 | 555432 | |
| 抗ヒトCD8 - FITC(クローンRPA - T8) | BD Pharmingen社 | 555366 | |
| 抗ヒトCD14 - FITC(クローンM5E2、LPSの受容体) | BD Pharmingen社 | 555397 | |
| 抗ヒトCD32 - FITC(クローンFLI8.26、FcγRのタイプII) | BD Pharmingen社 | 555448 | |
| 抗ヒトCD116 - FITC(クローンM5D12、GM -CSFRαチェーン) | BD Pharmingen社 | 554532 | |
| Dynalbeads M - 450 tosylactivated | インビトロジェン | 140から13 | |
| 抗ヒトCD3 | Ancell | 144から024 | |
| Buffer1 | 手作り | 0.1MのNa 2 B 4 O 7 pH7.6 | |
| Buffer2 | 手作り | PBS/2mM EDTA / 0.1%BSA pH7.4の | |
| Buffer3 | 手作り | 0.2M Tris/0.1%BSA pH8.5 | |
| 完全RPMI培地 | 手作り | RPMI 1640培地2mM L -グルタミン、5mMのHEPES 100 U /μg/ mlのpeni / strept 0.5mMのピルビン酸ナトリウム | |
| [3 H]チミジン | パーキンエルマー | NET027Z005MC | |
| 人間のプールされたAB血清 | アトランタバイオ | S40110 | |
| マルチスクリーン収穫プレート | ミリポア | MAHFC1H60 | |
| Microscint 20 | パーキンエルマー | 6013621 |
参考文献
- Barge, A., Cravotto, G., Gianolio, E., Fedeli, F. How to determine free Gd and free ligand in solution of Gd chelates. A technical note. Contrast Med. Mol. Imaging. 1, 184-188 (2006).
- Nagaraja, T. N., Croxen, R. L., Panda, S., Knight, R. A., Keenan, K. A., Brown, S. L., Fenstermacher, J. D., Ewing, J. R. Application of arsenazo III in the preparation and characterization of an albumin-linked, gadolinium-based macromolecular magnetic resonance contrast agent. J. Neurosci. Methods. 157, 238-245 (2006).
- Supkowski, R. M., Horrocks, W. D. On the determination of the number of water molecules, q, coordinated to europium(III) ions in solution from luminescence decay lifetimes. Inorg. Chim. Acta. 340, 44-48 (2002).
- Menjoge, A. R., Kannan, R. M., Tomalia, D. A. Dendrimer-based drug and imaging conjugates: design considerations for nanomedical applications. Drug Discovery Today. 15, 171-185 (2010).
- Que, E. L., Chang, C. J. Responsive magnetic resonance imaging contrast agents as chemical sensors for metals in biology and medicine. Chem. Soc. Rev. 39, 51-60 (2010).
- Uppal, R., Caravan, P. Targeted probes for cardiovascular MR imaging. Future Med. Chem. 2, 451-470 (2010).
- Major, J. L., Meade, T. J. B. i. o. r. e. s. p. o. n. s. i. v. e. Bioresponsive, cell-penetrating, and multimeric MR contrast agents. Acc. Chem. Res. 42, 893-903 (2009).
- Datta, A., Raymond, K. N. Gd-hydroxypyridinone (HOPO)-based high-relaxivity magnetic resonance imaging (MRI) contrast agents. Acc. Chem. Res. 42, 938-947 (2009).
- Leôn-Rodríguez, L. M. D., Lubag, A. J. M., Malloy, C. R., Martinez, G. V., Gillies, R. J., Sherry, A. D. Responsive MRI agents for sensing metabolism in vivo. Acc. Chem. Res. 42, 948-957 (2009).
- Castelli, D. D., Gianolio, E., Crich, S. G., Terreno, E., Aime, S. Metal containing nanosized systems for MR-molecular imaging applications. Coord. Chem. Rev. 252, 2424-2443 (2008).
- Caravan, P., Ellison, J. J., McMurry, T. J., Lauffer, R. B. Gadolinium(III) chelates as MRI contrast agents: structure, dynamics, and applications. Chem. Rev. 99, 2293-2352 (1999).
- Lauffer, R. B. Paramagnetic metal complexes as water proton relaxation agents for NMR imaging: theory and design. Chem. Rev. 87, 901-927 (1987).
- Yoo, B., Pagel, . An overview of responsive MRI contrast agents for molecular imaging. Front. Biosci. 13, 1733-1752 (2008).
- Pandya, S., Yu, J., Parker, D. Engineering emissive europium and terbium complexes for molecular imaging and sensing. Dalton Trans. 23, 2757-2766 (2006).
- Nwe, K., Xu, H., Regino, C. A. S., Bernardo, M., Ileva, L., Riffle, L., Wong, K. J., Brechbiel, M. W. A new approach in the preparation of dendrimer-based bifunctional diethylenetriaminepentaacetic acid MR contrast agent derivatives. Bioconjugate Chem. 20, 1412-1418 (2009).
- Nwe, K., Bernardo, M., Regino, C. A. S., Williams, M., Brechbiel, M. W. Comparison of MRI properties between derivatized DTPA and DOTA gadolinium-dendrimer conjugates. Bioorg. Med. Chem. 18, 5925-5931 (2010).
- Caravan, P., Das, B., Deng, Q., Dumas, S., Jacques, V., Koerner, S. K., Kolodziej, A., Looby, R. J., Sun, W. -. C., Zhang, Z. A lysine walk to high relaxivity collagen-targeted MRI contrast agents. Chem. Commun. , 430-432 (2009).
- Leôn-Rodríguez, L. M. D., Kovacs, Z. The synthesis and chelation chemistry of DOTA-peptide conjugates. Bioconjugate Chem. 19, 391-402 (2008).
- Boswell, C. A., Eck, P. K., Regino, C. A. S., Bernardo, M., Wong, K. J., Milenic, D. E., Choyke, P. L., Brechbiel, M. W. Synthesis, characterization, and biological evaluation of integrin αVβ3-targeted PAMAM dendrimers. Mol. Pharm. 5, 527-539 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved