JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
사람의 체외에서 억제
요약
Tregs는 면역 시스템의 강력한 진압하고 있습니다. 그들을 정의하는 독특한 표면 마커의 부족이있다, 그러므로, Tregs의 정의는 주로 기능입니다. 여기서 우리는 최적화된 설명을 체외에서 검정.
초록
규제 T 세포 (Tregs)는 자기 항원에 면역 관용의 중요한 중재자입니다. 또한, 그들은 다음과 같은 감염 면역 반응의 중요한 규제하고 있습니다. Tregs의 독특한 표면 마커를 식별할 수 있도록 노력에도 불구하고, 유일한 고유 기능은 효과기 T 세포의 증식과 기능을 억제하는 능력이다. 그것은 체외의 assays 인간의 Treg의 기능을 평가에서 사용할 수있는 것이 분명이지만 건강한 세포와 세포가자가 면역 질환 (제 1 형 당뇨병 - T1D 등) 필요로하는 과목에서 격리 교차 단면 연구의 결과를 평가하면,이 문제가됩니다 비교합니다. 응답 비율과 항원 제시 세포의 수와 유형 (APC)는 체외 억제의 assays 인간의 사용 : 응답 T 세포, 자극의 자연과 강도, Treg의 수와 유형 실험실 사이 큰 변화가있다. 이 변화는 Treg 함수가 어려운 측정 연구 사이의 비교를합니다. Treg 필드는 건강한 과목과 면역 질환있는 사람 모두 잘 작동하는 표준 억제 분석이 필요합니다. 우리는 췌장 β - 세포의 면역 파괴를 기본과 과목에 비해 건강한 지원자에서 격리 T 세포의 자극에 아주 작은 내부 분석 변화를 보여줍니다 체외 억제 분석에을 개발했습니다. 이 작품의 주요 목표는 서로 다른 주제 그룹 간의 비교를 허용 체외 인간 억제 분석에 대해 설명하는 것입니다. 또한이 분석은 기능을 nTreg의 작은 손실을 윤곽을 그리다하고 앞으로 손실, 예방 immunomodulatory 치료 1에서 혜택을 누릴 수 있으므로 식별 과목을 예상할 수있는 잠재력이있다. 아래, 우리는이 절차에 관련된 단계 철저한 설명을 제공합니다. 우리는 Treg 기능을 측정하는 데 사용되는 체외 억제 분석에의 표준화에 기여할 수 있도록 최선을 다하겠습니다. 또한, 우리는 면역 불균형의 초기 상태와 T1D에 대한 잠재적인 biomarker 기능을 인식하는 도구로 분석을 제공합니다.
프로토콜
1. 억압의 분석을 설정하기 전에, 이후 세포 자극과에 대한 안티 인간 인 경우에는 3 번 CD (복제 UCHT1, 최종 농도 1μg/ml)로 코팅 tosylactivated 구슬 하나 필요는 비즈가 효율적으로 인간을 사용하여 체외 확산 분석에를 설정하여 코팅 여부 확인 T 세포
- 원래 유리병, 자기 스탠드의 장소에서 M - 450 tosylactivated 구슬의 1ml을 가지고 모든 구슬이 튜브의 측면을 준수 때까지 기다려. 튜브는 자기 서서 아직도있는 동안 버퍼를 제거합니다. 37, 선동을 resuspend 비즈를 buffer1의 1ml 및 안티 인간 인 경우에는 3 번 CD의 40μl를 추가 °, 마그네틱 스탠드 밖으로 튜브를 타고 buffer1의 1ml을 추가, 다시 자기 스탠드에 튜브를 삽입하고 튜브는 자기 스탠드에있는 동안 buffer1를 제거 C 15 분, 0.1 % W / V BSA를 추가하고 다음 16시간에 대한 agitating 계속합니다.
- 버퍼를 제거하고 buffer2의 1ml에있는 구슬을 resuspend,, 비즈가 ° C 한번 5 분 buffer3에서 2-8에서 ° C 이상의 설명으로 자기 스탠드를 사용하여 2-8에서 5 분 동안 두 번 buffer2에 비즈 와시 4x10 8 / ML 최종 농도 및 사용을위한 준비.
- 나누어지는 50000 및 25000 PBMC / 잘 96 - 웰 플레이트에 triplicates에서 인 경우에는 3 번 CD - 코팅 구슬의 변수 번호 (4x10 8 구슬 / ML, 인 경우에는 3 번 CD에 들어 1μg/ml, 예를 들어 1, 2, 3, 4, 5 구슬 / 셀 추가 ) 셀 당 구슬의 최적의 수를 결정하기 위해서. 문화 72 시간 후, 1μCi [3 H] thymidine을 추가하고 37 ° C 잠복기를으로 16 시간 동안 계속합니다. Multiscreen 수확 플레이트 (Millipore)에 수확 세포는 섬광 액체를 추가하고 위로 카운트 NXT (팩커드, CT)를 사용하여 잘 / 분 당 카운트 (CPM)을 참조하십시오. 진압 기능을 잃을지도 모른다고 Tregs의 overstimulation을 피하기 위해 비즈 / 노출당 비용은 5,000 위 아르 셀 비율이지만 미만 15,000을 사용합니다. 보통, 3 구슬 / 세포의 비율은 지금까지 테스트 1-4 전체 제목 그룹에서 응답하고 Treg 세포 모두를 자극.
2. 건강한 기증자 또는 인간 leukopacks 또는 일반적으로 지역 수혈 센터에서 무료로 건강 자원 봉사자 이용할에서 가져온 버피 코트 (BC) (그림 1)에서 전체 혈액에서 PBMC 절연
- BC을 (~ 50ml) 1시 6분 PBS로 (추가 250ml) 희석. 지금은 300ml 총 볼륨이 있습니다. 천천히 15ml Ficoll - Paque 위에 희석 BC의 25ml 계층 Plus는 레이어를 방해하지 않고, 50ml 팰컨 튜브에 추가됩니다. 4 30 분 ° C, 브레이크에 대한 800xg에서 원심 분리기는 (스윙 양동이 로터 SH - 3000와 Sorvall 원심 분리기에서 1400rpm) 해제.
- 조심스럽게 PBMC 층 (중간 단계)를 수집하고 신선한 50ml 팰컨 튜브로 전송할 수 있습니다. DPBS와 50ml로 튜브를 작성하여 PBMC 씻으십시오. 한 튜브에이 세포 알약을 수집합니다. 4 10 분 400xg에서 원심 분리기 ° C. 때마다 하나의 튜브로이 세포 알약을 결합하여, 두 번 세척 단계를 반복합니다. 단일 50ml 튜브로 모든 세포 알약을 결합합니다.
- Trypan 블루 제외 테스트를 사용하여 PBMC를 계산합니다. Trypan 블루 180μl 얼룩 PBMC의 20μl를 추가하여 Trypan 블루에서 1시 10분 희석하십시오. 잘 믹스 즉시 hemacytometer에서 셀 20μl 가져가라. 두 블럭 16 작은 사각형을 포함하는 각에 위치한 모든 흠없는 오직 푸른 스테인드 세포의 숫자를 계산합니다. 두 숫자의 평균을 10으로 곱하면됩니다. PBMC / ML의 번호를 100으로이 번호를 나눕니다. 가능한 세포의 비율로 계산 [1 - (총 세포의 세포 블루 / 숫자 번호) x100의]. 생존 능력은 ≥ 95% 경우 진행합니다.
3. CD4 T 세포의 맥 사전 정렬
- 계속하기 전에, 새로운 튜브로 PBMC의 1ml을 전송 5000rad - 다음과 방사선에 대한 세포를 준비하는 미디어 4ml를 추가 항원 제시 세포 (APC)가 될것이다.
- 4 10 분 대한 PBS/2mM EDTA/0.5 % BSA의 버퍼에 250xg에있는 세포의 나머지 부분을 원심 ° C. PBS/2mM EDTA/0.5 % BSA 버퍼의 4ml에 뜨는하고, resuspend 세포를 하거라.
- 맥스 안티 - CD4의 microbeads의 200μl를 추가하고 4 품어 ° C를 20 분.
- 4 10 분 대한 250xg에 PBS/2mM EDTA/0.5 % BSA 버퍼와 원심 분리기의 40ml를 추가하여 씻어 ° C. degassed, 실온 PBS/2mM EDTA/0.5 % BSA 버퍼의 8ml에 뜨는 및 resuspend을 하거라.
- LS 칼럼 그들을 로딩하기 전에 사전 분리 필터를 사용하여 필터 - 별도의 세포 현탁액.
- 세포 현탁액 및 레이어 4ml 각 이상의 보정 LS 칼럼 (deggassed PBS/2mM EDTA/0.5 % BSA 버퍼의 3ml)를 분할. LS 칼럼은 MidiMACS 구분 기호에서 해결되었습니다. 세포 현탁액은 다시 실행 flowthrough 중 하나를 실행하거나 PBS/2mM EDTA/0.5 % BSA 버퍼를 deggassed 실내 온도의 3ml 추가하고 버퍼를 통해 실행하게하기 전에. 그것이 밖으로 명확 올 때까지 더 많은 버퍼를 추가합니다.
- LS 칼럼에 피펫 5ml deggassed 버퍼를 통해 ~ 1.0ml 실행시키는 새로운 살균 15ml 수집 관에 MidiMACS 분리 및 장소에서 LS 열을 제거하십시오. 칼럼로 플런저를 넣고 천천히 나머지를 밀어볼륨보세요.
- 두 LS 컬럼과 동일한 작업을 수행하고 두 CD4 + 분수를 결합. 50ml PBS와 수를 셀 개까지 추가할 수 있습니다. 예상 수확량은 5x10 8 세포에 달려있다. 2ml PBS/2mM EDTA/0.5 % BSA 버퍼에 잘 10 분, resuspend 전지 400xg에서 원심 분리기.
4. 형광 활성 세포 정렬 (외과) 격리 (그림 2)
- 다음과 같은 세포 표면 마커 (빛으로부터 보호 유지)로 CD 마커에 항체의 칵테일 만들기 : 안티 - 인간의 CD8 - FITC (클론 RPA - T8), 안티 - 인간 CD14 - FITC (클론 M5E2 20 μl 20 μl; LPS 수용체), 안티 - 인간 CD32 - FITC (클론 FLI8.26 20 μl, FcγR 타입 II) 및 안티 인간 CD116 - FITC (클론 M5D12 6 μl, GM - CSFRα 체인) 및, 또는, 40μl 안티를 추가 인간 CD4 - APCCy7 (클론 RPA - T4).
- 2ml 세포 현탁액에서 5μl을 가지고 얼룩 칵테일의 2μl와 얼룩,이 임계값 (Fluorochrome 빼기 1 - FMO) 5를 결정하기위한 튜브입니다.
- 얼룩 칵테일로, 4 ° C 삼십분에 세포 현탁액과 부화 칵테일을 추가, 안티 - 인간 CD25 - PE (IL - 2Rα 복제 M - A251) 50 μl를 추가합니다. 10 7 / ML의 세포 농도로 10 분, resuspend 전지 400xg에서 PBS 버퍼, 원심 분리기에서 세포를 씻으십시오.
- 흠없는 세포와 세포 또는 외과 아리아 (BD Biosciences, 산호세, NJ)에서 셀 정렬에 대한 보상 제어로 사용할 하나의 fluorochrome 물들일 구슬을 준비합니다.
- 사용자가 CD25 + T 세포 (그림 2A)의 정렬에 대한 임계값을 설정할 수 FMO 튜브에 세포를 취득. monocytes, macrophages 및 기타 모든 CD4 + - 비 - T 세포 (그림 2B)로 구성된 FITC - 양성 세포를 제외 FITC - 부정적인 세포 주위에 게이트를 설정합니다.
- 별도의 음모에, CD25 -, CD25low 및 CD25high T 세포 - Tregs (상단 CD25 가장 높은 숫자를 표현하는 세포의 1 %) (그림 2C)의 빌 게이츠를 그립니다. 세포 하위 집합은 일반적으로 고순도 (그림 2D, 2E 및 2 층)를 보여줍니다.
- 10 분 400xg에서 전지 수집 튜브를 원심 분리기 및 도금까지 얼음에 있습니다.
5. 200μl/well에서 96 - 웰 플레이트 (계획은 Table1로 첨부)에서 세포 배양을 설정
- 인 경우에는 3 번 CD - 코팅 구슬 나누어지는의 50μl (1 μg / ML) 3 구슬 / U - 바닥에서 10 % 풀링된 인간 AB 혈청 완벽한 미디어 resuspended 우물에 응답 세포, 96 - 웰 플레이트로 계산. (예를 들어, 인 경우에는 3 번 CD - 코팅과 2ml 미디어를 만들기 위해, 인 경우에는 3 번 CD - 코팅 재고 비즈 - 최종 농도 4x10 8 / ML에서 7.5μl 가지고 미디어 2ml에 희석, 모든 50μl가 75,000 beads-3beads/cell를 포함합니다.)
- 5x10 5 / ML 세포 농도로 조사 APC를 희석하고 "오직 Tregs"로 표시 우물, "오직 APC"와 테이블에서 "미디어 전용"을 포함하여 이전에 추가 자극, 각 우물에 (2.5 X 10 4 세포를 포함) 50μl 추가 1.
- 표 1의 디자인을 다음과 triplicates 2.5 × 10 4 / 잘 CD4CD25 또는 CD4CD25low T 세포를 추가합니다.
- 비율 1시 10분 (2500 Treg 세포)의 공동 문화 (행 B, 표 1)과 "오직 Tregs"로 표시 우물에 Tregs을 추가하고 5 % CO 2와 CO 2 배양기에서 37 접시 ° C를 품어 72 시간 동안 포화 습도 인치
- 펄스 1μCi [3 H] thymidine과 우물 및 ° C으로 16 시간 동안 37 인큐베이션을 계속합니다.
6. 수확 및 계산
- 팩커드 filtermate 하베스터 또는 다른 시스템을 사용 multiscreen 수확 접시에 수확 세포.
- 섬광 액체 (Microscint 20) 추가 마지막 단계에 대비하여 투명 플라스틱 커버 플레이트를 수확 커버.
- 분 당 카운트 (CPM)을 읽기 / 잘 톱 카운트 NXT (패커드, CT) 또는 다른 시스템을 사용합니다.
7. 억압의 컴퓨팅 비율
- 세포 triplicates에서 교양 것처럼, 평균은 각 조건에 대해 계산됩니다. 변화의 계수가> 30 %면, 국외자는 평균 두 우물에서 제거되며 CPM입니다. 억제 비율은 계산에 의해 얻어진다 [(SC) / S] X 100 %, 어디서 S = 노출당 비용 (CPM) 단일 문화와 C = 공동 문화 노출당 비용 (CPM).
- 나이브 (CD25 -) 및 생체내 활성 (CD25low)에 효과기 T 세포 응답 T 세포로 도금이며, 이러한 집합의 각을 억제하는 Tregs의 능력의 차이는 전제를 기반으로 잠재적인 기능 전조 표시기로 캡처하고 사용되는 그 활성 세포 억제가 어렵습니다.
8. 대표 결과 :
방법에 큰 변화가 사용하고 체외 인간 억제 분석의에서 파생된 결과는 우리가 분석 한 영향을 미치는 조건의 종합적인 연구를 수행하라는 메시지가 나타납니다. 우리가 이전에 6 결정 Teffs (1시 10분) : 우리는 Tregs 간의 낮은 비율을 고려, Treg 기능뿐만 아니라 시험 분석뿐만 아니라, 자신의 순결을 개발했습니다. 또한, Tregs는 일에 차이가면역 균형에 문제가있다면 T1D 개발 위험이 과목에서와 같이 성공적으로 순진한와 그림 3에서 더 유명되고 우리의 이전 연구 2,4, 표시도 건강한 과목 생체내 활성화된 T 세포에 억제 EIR 능력 . 분석 우리가 건강 관리 사이에 자신의 기능을 비교할 수 있도록, 우리는 자연 (nTregs), inducible (iTregs)과 체외 확장의 nTregs에의 진압 기능을 비교 연구에서 매우 잘 작동, 최근 - 발병 (RO) T1D과 오랜 (LS ) T1D 과목. 우리는 RO T1D 과목 LS T1D 건강 관리 과목 7 비해 기능 iTregs 모두 및 확장 nTregs를 생성하는보다 능력이 있다고 결론을 내렸다. 따라서,이 분석은 면역 불균형의 초기과 늦은 상태 모두의 인식의 훌륭한 도구로 사용할 수 있습니다.
체외 억제 분석에 관련된 단계 계획 1 도식 프레 젠 테이션

그림 1. 사진과 함께 제공 체외 억제 분석의 각 단계
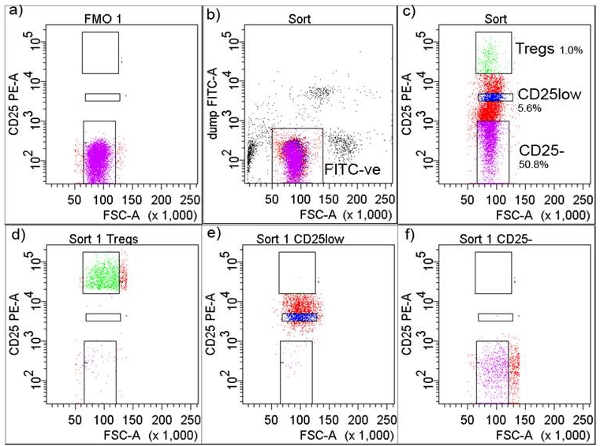
그림 2. 외과 세포 격리 게이팅 전략. A) CD25 + 임계값은 FITC - 부정적인 세포 (자세한 문이 있었고, CD + CD25 -, CD + CD25low과 CD + CD25high로 회수) 세포, C FITC - 부정적으로 문이되었습니다) Fluorochrome 빼기 1 (FMO), B에 따라 조정되었습니다 Tregs)가) 백분율, D로 표시 전자는 정렬 후 CD + CD25low를 정렬, 정렬 후 Tregs를 정렬 외과) 외과, 그리고 F) 정렬 후 정렬 CD4 + CD25 - T 세포를 외과
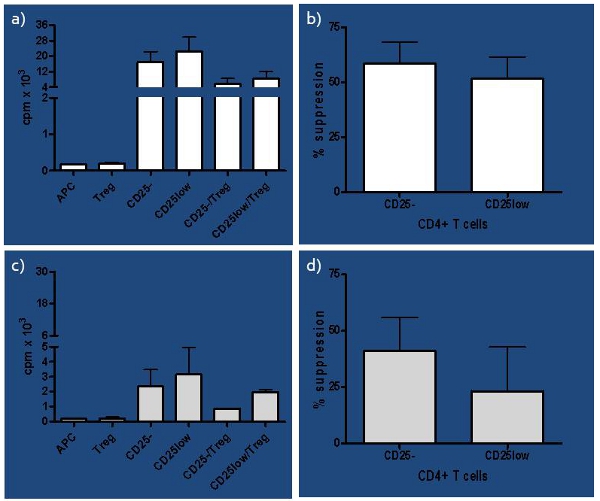
그림 3. 건강한 과목 대표 결과) 관련된 모든 셀의 하위 집합에 대해 하나의 문화로 제시 건강한 과목 (순진한 - CD25 -, 생체내 활성 - CD25low에서 항원 제시 세포 - APC의 분당 카운트 대표 결과 (CPM)을하고 각 CD25 및 autologous Tregs에 의해 CD25low 응답 T 세포가 건강한 제어 과목 제시 (N의 억압의 규제 T 세포 - Treg)뿐만 아니라 응답 T 세포의 공동 문화 (CD25 또는 CD25low)와 Tregs. B) 비율 = 4). 억제는 [(SC) / S]로 계산했습니다 X 100 %, 어디서 S = 노출당 비용 (CPM) 단일 문화와 C = 노출당 비용 (CPM) 공동 문화 인치 응답 T 세포를 억제하는 Tregs의 능력에 약간의 차이가 발견되었지만, 그것은. C (T - 테스트 P = 0.08 이점)) 발표는 응답으로 CD25 및 CD25low 포함하여 각 단일 문화에 대한 위험 과목에의 CPM 아르 중요 아니었 T 세포뿐만 아니라 각 응답 T 세포 부분 집합은 autologous 각 CD25 및 CD25low 응답 T 세포의 억제의 Tregs (CD25-/Tregs 및 CD25low/Tregs.) D) 비율과 씨앗을 품고있다 APC와 Tregs 및 공동 문화 Tregs는 위험 과목 (n은 = 4)에서 제시합니다. CD25 - 대 CD25low 응답 T 세포를 억제하는 Tregs의 용량의 차이는 상당한되었다 (T - 테스트 P는 = 0.04를 결합하여).
표 1. 개략도 체외 억제 분석에의 준비
| 1-3 | 4-6 | 7-9 | 10-12 | |
| CD4CD25 - | CD4CD25low | 전용 미디어 | 전용 미디어 | |
| B | CD4CD25 - / Tregs | CD4CD25low / Tregs | 단 Tregs | APC 전용 |
| C | ||||
| D | ||||
| E | ||||
| F | ||||
| G | ||||
| H |
토론
Tregs 수있는 유일한 고유 기능으로, 진압 기능은 동일한 시간과 여러 연구 사이의 질병 개발의 다른 단계에서 과목 사이에 안정적으로 균일하게 테스트해야합니다. 우리는이 분석의 표준화로 우리의 기여로 저희 연구실에서 개발된 억제 분석의 세부 사항을 제공합니다. 우리의 광범위한 최적화 연구에서는, 우리는 안티 - 인간 인 경우에는 3 번 CD - 코팅 구슬 (APC로 PBMC와 함께 1μg/ml의 농도 UCHT1 복...
공개
감사의 말
이 연구는 위스콘신과 위스콘신의 어린이 연구소 소년 Diabetesat 메디컬 칼리지에 대한 최대 맥기 국립 연구소에 의해 지원되었다. funders는 연구 설계의 데이터 수집과 분석, 또는 원고의 준비를 전혀 역할을 없었다.
자료
| Name | Company | Catalog Number | Comments |
| 시약이나 악기의 이름 | 회사 | 카탈로그 번호 | 댓글 (옵션) |
|---|---|---|---|
| Ficoll - Paque PLUS | 애머스햄 Pharmacia 생명 공학 | 17-1440-03 | |
| DPBS - 1X | Gibco | 14190-144 | |
| Trypan 블루 | Invitrogen | 15250-061 | |
| 안티 CD4의 microbeads | Miltenyi | 130-045-101 | |
| 사전 분리 필터 | Miltenyi | 130-041-407 | |
| LS 칼럼 | Miltenyi | 130-042-401 | |
| EDTA (에틸렌 다이아 민 테트라 초산) | Invitrogen | 15575-020 | |
| BSA | 시그마 - 알드리치 | B4287 | |
| 안티 인간 CD4 - APCCy7 (클론 RPA - T4) | BD Pharmingen | 557852 | |
| 안티 인간 CD25 - PE (클론 M - A251, IL - 2Rα) | BD Pharmingen | 555432 | |
| 안티 인간 CD8 - FITC (클론 RPA - T8) | BD Pharmingen | 555366 | |
| 안티 인간 CD14 - FITC (클론 M5E2, LPS 수용체) | BD Pharmingen | 555397 | |
| 안티 인간 CD32 - FITC (클론 FLI8.26, FcγR 타입 II) | BD Pharmingen | 555448 | |
| 안티 인간 CD116 - FITC (클론 M5D12, GM - CSFRα 체인) | BD Pharmingen | 554532 | |
| Dynalbeads M - 450 tosylactivated | Invitrogen | 140-13 | |
| 안티 - 인간 인 경우에는 3 번 CD에 들어 | Ancell | 144-024 | |
| Buffer1 | 홈메이드 | 0.1M 나 2 B 4 O 7 pH7.6 | |
| Buffer2 | 홈메이드 | PBS/2mM EDTA (에틸렌 다이아 민 테트라 초산) / 0.1 % BSA pH7.4 | |
| Buffer3 | 홈메이드 | 0.2M Tris/0.1 % BSA pH8.5 | |
| 완료 RPMI 미디어 | 홈메이드 | RPMI 1640 미디어 2 MM L - 글루타민 5 MM의 HEPES 100 U / μg / ML peni / strept 0.5 MM 나트륨 pyruvate | |
| [3 H] thymidine | 퍼어킨 엘머 | NET027Z005MC | |
| 인간의 풀링 AB 혈청 | 애틀랜타 체액 | S40110 | |
| Multiscreen 수확 플레이트 | Millipore | MAHFC1H60 | |
| Microscint 20 | 퍼어킨 엘머 | 6,013,621 |
참고문헌
- Barge, A., Cravotto, G., Gianolio, E., Fedeli, F. How to determine free Gd and free ligand in solution of Gd chelates. A technical note. Contrast Med. Mol. Imaging. 1, 184-188 (2006).
- Nagaraja, T. N., Croxen, R. L., Panda, S., Knight, R. A., Keenan, K. A., Brown, S. L., Fenstermacher, J. D., Ewing, J. R. Application of arsenazo III in the preparation and characterization of an albumin-linked, gadolinium-based macromolecular magnetic resonance contrast agent. J. Neurosci. Methods. 157, 238-245 (2006).
- Supkowski, R. M., Horrocks, W. D. On the determination of the number of water molecules, q, coordinated to europium(III) ions in solution from luminescence decay lifetimes. Inorg. Chim. Acta. 340, 44-48 (2002).
- Menjoge, A. R., Kannan, R. M., Tomalia, D. A. Dendrimer-based drug and imaging conjugates: design considerations for nanomedical applications. Drug Discovery Today. 15, 171-185 (2010).
- Que, E. L., Chang, C. J. Responsive magnetic resonance imaging contrast agents as chemical sensors for metals in biology and medicine. Chem. Soc. Rev. 39, 51-60 (2010).
- Uppal, R., Caravan, P. Targeted probes for cardiovascular MR imaging. Future Med. Chem. 2, 451-470 (2010).
- Major, J. L., Meade, T. J. B. i. o. r. e. s. p. o. n. s. i. v. e. Bioresponsive, cell-penetrating, and multimeric MR contrast agents. Acc. Chem. Res. 42, 893-903 (2009).
- Datta, A., Raymond, K. N. Gd-hydroxypyridinone (HOPO)-based high-relaxivity magnetic resonance imaging (MRI) contrast agents. Acc. Chem. Res. 42, 938-947 (2009).
- Leôn-Rodríguez, L. M. D., Lubag, A. J. M., Malloy, C. R., Martinez, G. V., Gillies, R. J., Sherry, A. D. Responsive MRI agents for sensing metabolism in vivo. Acc. Chem. Res. 42, 948-957 (2009).
- Castelli, D. D., Gianolio, E., Crich, S. G., Terreno, E., Aime, S. Metal containing nanosized systems for MR-molecular imaging applications. Coord. Chem. Rev. 252, 2424-2443 (2008).
- Caravan, P., Ellison, J. J., McMurry, T. J., Lauffer, R. B. Gadolinium(III) chelates as MRI contrast agents: structure, dynamics, and applications. Chem. Rev. 99, 2293-2352 (1999).
- Lauffer, R. B. Paramagnetic metal complexes as water proton relaxation agents for NMR imaging: theory and design. Chem. Rev. 87, 901-927 (1987).
- Yoo, B., Pagel, . An overview of responsive MRI contrast agents for molecular imaging. Front. Biosci. 13, 1733-1752 (2008).
- Pandya, S., Yu, J., Parker, D. Engineering emissive europium and terbium complexes for molecular imaging and sensing. Dalton Trans. 23, 2757-2766 (2006).
- Nwe, K., Xu, H., Regino, C. A. S., Bernardo, M., Ileva, L., Riffle, L., Wong, K. J., Brechbiel, M. W. A new approach in the preparation of dendrimer-based bifunctional diethylenetriaminepentaacetic acid MR contrast agent derivatives. Bioconjugate Chem. 20, 1412-1418 (2009).
- Nwe, K., Bernardo, M., Regino, C. A. S., Williams, M., Brechbiel, M. W. Comparison of MRI properties between derivatized DTPA and DOTA gadolinium-dendrimer conjugates. Bioorg. Med. Chem. 18, 5925-5931 (2010).
- Caravan, P., Das, B., Deng, Q., Dumas, S., Jacques, V., Koerner, S. K., Kolodziej, A., Looby, R. J., Sun, W. -. C., Zhang, Z. A lysine walk to high relaxivity collagen-targeted MRI contrast agents. Chem. Commun. , 430-432 (2009).
- Leôn-Rodríguez, L. M. D., Kovacs, Z. The synthesis and chelation chemistry of DOTA-peptide conjugates. Bioconjugate Chem. 19, 391-402 (2008).
- Boswell, C. A., Eck, P. K., Regino, C. A. S., Bernardo, M., Wong, K. J., Milenic, D. E., Choyke, P. L., Brechbiel, M. W. Synthesis, characterization, and biological evaluation of integrin αVβ3-targeted PAMAM dendrimers. Mol. Pharm. 5, 527-539 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유