A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تنقية Hsp104 ، وهو بروتين Disaggregase
In This Article
Summary
هنا ، نحن تصف وضع بروتوكول لتنقية نشطة للغاية Hsp104 ، وهو AAA + hexameric البروتين من الخميرة ، والتي المائي ATP الأزواج على تصنيفها البروتين. هذا المخطط يستغل بناء His6 الموسومة لتنقية تقارب من E. القولونية تليها أنيون تبادل اللوني ، His6 ، مع إزالة علامة TEV البروتيني ، واللوني الحجم الاستبعاد.
Abstract
Hsp104 هو hexameric AAA + البروتين 1 من الخميرة ، والتي المائي ATP الأزواج على تصنيفها بروتين 20-10 (الشكل 1). يضفي هذا النشاط الانتقائي ميزتان الرئيسية. أولا ، استعادة الطبيعة من المجاميع التي المختلين Hsp104 يخول بقاء الخميرة بعد تشدد البروتين misfolding المختلفة ، بما في ذلك الصدمة الحرارية 3،5،11،12. ثانيا ، إعادة تشكيل الألياف اميلويد بيتا عبر Hsp104 التي تمكن من استغلال الخميرة البريونات لا تعد ولا تحصى (amyloids المعدية) كمستودع للفائدة وراثية الاختلاف المظهري 13-22. بشكل ملحوظ ، ويعيد تشكيل Hsp104 مباشرة oligomers preamyloid والألياف اميلويد ، بما فيها تلك التي تتكون من بروتينات بريون الخميرة وSup35 Ure2 23-30. هذه الوظيفة اميلويد هو إعادة تشكيل الوجه المتخصصة Hsp104 الخميرة. وهاء orthologue القولونية ، ClpB ، فشل أو يعيد oligomers preamyloid ييفات اميلويد 26،31،32.
تم العثور على orthologues Hsp104 في جميع ممالك الحياة باستثناء perplexingly والحيوانات. في الواقع ، ما إذا كانت الخلايا الحيوانية تمتلك أي نظام الأنزيمية أن الأزواج تصنيفها البروتين لاستعادة الطبيعة (بدلا من التدهور) لا يزال غير معروف 33-35. وبالتالي ، اقترحنا وغيرها التي يمكن وضعها Hsp104 كعامل العلاجية لمختلف الأمراض العصبية مرتبطة misfolding من بروتينات معينة في oligomers preamyloid السامة والألياف اميلويد 4،7،23،36-38. لا توجد علاجات التي تستهدف بشكل مباشر الأنواع المجمعة المرتبطة بهذه الأمراض. حتى الآن ، ويذوب Hsp104 oligomers السامة ويتألف من الألياف اميلويد synuclein ألفا ، والتي ترتبط مع مرض باركنسون 23 فضلا عن أشكال من الأميلويد بي ار بي 39. الأهم من ذلك ، يقلل Hsp104 تجميع البروتين وإلى التقليل من تنكس عصبي في نماذج من القوارض مرض باركنسون 23 و 38 مرض هنتنغتون. من الناحية المثالية ، لتحسين العلاج والتقليل من الآثار الجانبية ، ستكون هندستها وHsp104 potentiated لإعادة انتقائي المجاميع الخاصة المركزية لهذا المرض في السؤال 4،7. ومع ذلك ، فإن الفهم المحدود الهيكلية والميكانيكية لليقسم Hsp104 كيف يمكن لمثل ذخيرة متنوعة من هياكل مجمعة والبروتينات لا علاقة لها يحبط هذه المساعي 30،40-42.
لفهم بنية وآلية Hsp104 ، فإنه لا بد من دراسة هذا البروتين النقي وإعادة نشاطها disaggregase بمكونات ضئيلة. Hsp104 هو بروتين 102kDa مع الباياء من ~ 5.3 ، الذي hexamerizes في وجود أو ADP ATP ، أو على تركيزات عالية من البروتين في غياب 43-46 النوكليوتيدات. هنا ، نحن تصف بروتوكول الأمثل لتنقية Hsp104 ، نشطة للغاية مستقرة من E. القولونية. استخدام E. القولونية يسمح مبسطة على نطاق واسع الإنتاج ويمكن أن يؤديها لدينا وسيلة سريعة وموثوق بها عن المتغيرات Hsp104 عديدة. بروتوكول لدينا زيادات Hsp104 النقاء ويبسط له 6 - إزالة علامة مقارنة طريقة تنقية السابقة من E. 47 القولونية. وعلاوة على ذلك ، والبروتوكول لدينا أكثر من سهلة ومريحة بروتوكولين أكثر حداثة 26،48.
Protocol
1. التعبير عن Hsp104
- وتستخدم لتنقية البلازميد في E. القولونية ، pPROEX - HTB - Hsp104 ، يحتوي على Hsp104 مفتوح القراءة الإطار تحت سيطرة محرض لجنة الحقيقة والمصالحة المروج 26. وتنتج Hsp104 البلازميد مع N - محطة صاحب العلامة - 6 التي يمكن إزالتها عن طريق الانقسام TEV البروتيني. تحويل pPROEX - HTB - Hsp104 في كودون الأمثل E. القولونية - BL21 - CodonPlus RIL الخلايا (Stratagene ، اجيلنت تكنولوجيز) باستخدام إجراء تحول نموذجي الجرثومية (وفقا على سبيل المثال لتعليمات الشركة الصانعة). من المهم استخدام E. كودون الأمثل القولونية سلالة Hsp104 لأن لديه تحيز كودون غير عادية.
- تطعيم ثقافة 100ML 2XYT (USB. الوصفة : 16G / L الكازين ببتون ، 10G / L خلاصة الخميرة ، 5G / لتر كلوريد الصوديوم ، ودرجة الحموضة 7.0) تستكمل مع 100μg/mL أمبيسلين والكلورامفينيكول 34μg/mL مع transformants الطازجة وتنمو بين عشية وضحاها في 37 ° C مع اهتزاز في 200rpm.
- 10ML تطعيم الثقافة بين عشية وضحاها إلى 6 X 1L 2XYT مع الأمبيسيلين والكلورامفينيكول 100μg/mL 34μg/mL في قوارير 2L. هزة في 250rpm عند 37 درجة مئوية حتى OD 600 = 0،4-0،6. وقف الهز وخفض درجة الحرارة إلى 15 درجة مئوية. يسمح للخلايا لكي تتوازن unagitated ل30min في الحاضنة حتى تصل إلى 15 درجة مئوية. مرة واحدة 15 درجة مئوية يتم التوصل الى حمل بروتين تعبير بإضافة IPTG إلى التركيز النهائي لل1MM. استئناف تهتز في 250rpm بين عشية وضحاها (12-16 ساعة).
2. حصاد الخلايا وتحلل
- حصاد الخلايا بواسطة الطرد المركزي (في الدوار precooled) في 4000 دورة في الدقيقة ل20min عند 4 درجة مئوية (نستخدم RC Sorvall 3BP + الطرد المركزي). يجب تنفيذ الخطوات اللاحقة على الفور بسبب تقلص النشاط عند Hsp104 E. يتم تجميد الخلايا القولونية. وعلاوة على ذلك ، يجب تنفيذ كافة الخطوات اللاحقة على الجليد أو على 4 درجة مئوية.
- خلية الكريات Resuspend في prechilled (على الجليد) 10ML العازلة تحلل (40mM HEPES KOH - 7.4 درجة الحموضة ، بوكل 500mM ، MgCl 20mM 2 ، 2.5 ٪ (W / V) الجلسرين ، إيميدازول 20mM ، pepstatin 5μM ألف ، مثبط البروتياز كاملة الكوكتيل (1 EDTA خالية tablet/50mL) ، و2mm وβ - المركابتويثانول).
- ليز الخلايا مع الخالط الفرنسية (Emulsiflex) صحفى ان يستخدم مبادل حراري مغمورة في الماء المثلج. قبل الاستخدام ، وضمان أن تم solubilized جميع كتل الخلية. بعد equilibrating الخالط مع العازلة تحلل ، واثنين من يمر من خلال اسطوانة مع ضغط 15،000-18،000 رطل كافية لتحلل الكامل. إذا كانت الصحافة الفرنسية غير متوفرة ، ويمكن استخدامها مع حضانة الليزوزيم تليها صوتنة (انظر المناقشة). حفظ عينة صغيرة من الخلايا لتحليل lysed SDS - PAGE (1μL) (Lysate في الشكل 2).
- إزالة الحطام الخلية بواسطة الطرد المركزي في 16000 دورة في الدقيقة ل20min عند 4 درجة مئوية (نستخدم RC5C Sorvall centifuge +). طاف الاحتفاظ للخطوة التالية وحفظ عينة صغيرة (1μL) من طاف للSDS - PAGE التحليل (ني تحميل في الشكل 2).
3. Hsp104 تنقية
- طاف مزيج من الخطوة مع 2.4 12mL (2mL ني Sepharose الخرز في 1L من الخلايا) من 50 ٪ من الطين الخرز العازلة تحلل ني Sepharose معايرتها (GE).
- تدوير العينة ببطء لمدة 3 ساعات في 4 درجات مئوية بحيث ني Sepharose يبقى معلقا بالتساوي ويتم تصغير مزبد. أقصر الأوقات حضانة ممكنة ، ولكن سوف تنخفض الغلة. عند 4 درجة مئوية في وجود مثبطات الأنزيم البروتيني ، وتدهور قليلا يحدث ، و3 ساعات فترة حضانة ني Sepharose لا يقل النشاط للمنتج النهائي. جمع ني Sepharose بواسطة الطرد المركزي لمدة 2 دقيقة على 4 درجات مئوية في 2000 دورة في الدقيقة (إيبندورف 5810R الطرد المركزي). حفظ عينة صغيرة من طاف للSDS - PAGE التحليل (1μL) وتجاهل بقية (ني تتدفق من خلال (FT) في الشكل رقم 2).
- غسل استرجاع ني Sepharose مع وحدات التخزين العمود 25 من غسل العازلة (40mM HEPES KOH - 7.4 درجة الحموضة ، 150mM بوكل ، MgCl 20mM 2 ، 2.5 ٪ (W / V) الجلسرين ، إيميدازول 20mM ، 2mm وβ - المركابتويثانول) ، العمود 5 من وحدات التخزين غسل العازلة مع بوكل 1M لإزالة الملوثات كهربية متجهة إلى Hsp104 ، وأحجام العمود 25 من غسل العازلة. جمع ني Sepharose بعد كل غسل بواسطة الطرد المركزي لمدة 2 دقيقة على 4 درجات مئوية في 2000 دورة في الدقيقة (إيبندورف 5810R الطرد المركزي). بعد كل دورة غسيل والطرد المركزي ، وإزالة العازلة الطموح.
- لأزل Hsp104 ، مزيج ني Sepharose العازلة مع شطف 1mL (40mM HEPES KOH - 7.4 درجة الحموضة ، 150mM بوكل ، MgCl 20mM 2 ، 2.5 ٪ (W / V) الجلسرين ، إيميدازول 350mM ، 2mm وβ - المركابتويثانول) لكل 1mL ني وSepharose تناوب على 4 درجات مئوية لمدة 20 دقيقة. تركيز عالية إيميدازول يعطل حبة صاحب ني 6 التفاعل. إزالة ني Sepharose مع الأعمدة فارغة 1.2 تدور مل (بيو راد) بواسطة الطرد المركزي لمدة 2 دقيقة على 4 درجات مئوية في 2000 دورة في الدقيقة (إيبندورف 5810R الطرد المركزي). حفظ 1μL من شطافة لتحليل SDS - PAGE (ني شطافة في الشكل 2). عن كل لتر من الخلايا ، ويتم الحصول ~ 15mg من Hsp104 في هذه الخطوة.
- شطافة تبادل العازلة في سؤال العازلة (20mM تريس - 8 حمض الهيدروكلوريك درجة الحموضة ، 0.5mM EDTA ، MgCl 5mM 2 ، 50mM كلوريد الصوديوم) باستخدام MWCO 30000 Amicon الترا (MILlipore) 15mL المكثف وحدات الطرد المركزي. الأول ، تركيز البروتين ل~ 1.5mL ثم إضافة 14.5mL من س الاحتياطي لتخفيف البروتين بمقدار 10 أضعاف. كرر 3 مرات لتبادل العازلة. زيادة درجة الحموضة والملح منخفضة Hsp104 يضمن له تهمة ارتفاع سلبية.
- تنقية Hsp104 أنيون عبر تبادل اللوني باستخدام الاحتياطي س معايرتها العمود الموارد 6mL س (GE). قبل الحقن ، ويتم تصفية من خلال بروتين منخفض البروتين ملزمة Millex GP PES غشاء 0.22μM حقنة تصفية (ميليبور). نحن نوظف معدل تدفق 1mL/min. يغسل البروتينات ضعيف ملزمة مع حجم العمود 1 من الاحتياطي 20 ٪ س + (20mM تريس - 8 حمض الهيدروكلوريك درجة الحموضة ، 0.5mM EDTA ، MgCl 5mM 2 ، 1M كلوريد الصوديوم). أزل Hsp104 مع الانحدار الخطي (20 ٪ -50 ٪ العازلة س +) على حجم العمود 5 (الشكل 3). جمع الكسور 1ml. ومعظم المتغيرات Hsp104 أزل عادة في كلوريد الصوديوم ~ 400mM (31mS/cm). حفظ عينات من الكسور الذروة (1μL) لتحليل SDS - PAGE (الشكل رقم 3 ، أقحم).
- لإزالة صاحب العلامة 6 البروتين الصرف ، وذلك باستخدام مكثف Amicon الطرد المركزي وصفه أعلاه (انظر الخطوة 3.5) إلى انشقاق العازلة (20mM HEPES KOH - 7.4 درجة الحموضة ، بوكل 140mM وMgCl 10MM 2). استخدام proTEV البروتيني (Promega) أو AcTEV البروتيني (Invitrogen) وفقا لتعليمات الشركة الصانعة. لHsp104 ، وجدنا أن ارتفاع نسب البروتيني TEV : مطلوب Hsp104 عن انشقاق كامل. نستخدم نسبة 1 في وحدة البروتيني Hsp104 12μg. يجب أن يتم تنفيذ الشق في 30 درجة مئوية لمدة 2-4 ساعات ، تليها الحضانة 16 ساعة في 4 درجات مئوية. وينبغي أن يكون هناك تركيز Hsp104 النهائي بين 20 75μM مونومر. تستنزف ما تبقى أي Hsp104 His6 الموسومة والبروتيني TEV مع ني Sepharose (GE) وذلك بإضافة ني Sepharose الزائدة إلى مبلغ Hsp104 في رد فعل الانقسام (تفترض الخرز يمكن ربط 15mg من البروتين لكل مليلتر من راتنج معبأة). إزالة أعمدة الدوران مع حبات فارغة (بيو راد) بواسطة الطرد المركزي ل2min في 2000 دورة في الدقيقة في 4 درجات مئوية. جمع العينات قبل وبعد الانقسام (1μL) لSDS - PAGE التحليل لضمان الانقسام ، وإزالة البروتين uncleaved (الشكل 4).
- تبادل العازلة في استبعاد حجم (20mM HEPES KOH - 7.4 درجة الحموضة ، بوكل 140mM ، 10MM MgCl 2 ، EDTA 0.1mM ، 1MM DTT) باستخدام MWCO 30000 Amicon الترا (ميليبور) كما هو موضح في الخطوة 3.5.
- كذلك عبر تنقية Hsp104 الحجم الاستبعاد اللوني. استخدام Superose حجم المخزن المؤقت استبعاد 6 أو معايرتها Superdex 200 عمود (سواء من شركة جنرال الكتريك) (الشكل 5). قبل الحقن ، ويتم تصفية من خلال بروتين منخفض البروتين ملزمة Millex GP PES غشاء 0.22μM حقنة تصفية (ميليبور). لأقل من 10mg من البروتين ، ويمكن استخدام الأعمدة حجم 10/300 (24mL) ويتم جمع الكسور 0.5ml. للحصول على عينات أكبر من 10mg ، يجب استخدام العمود حجم 12/60 (120mL) ويتم جمع الكسور 1 مل. الرجوع إلى تعليمات الشركة الصانعة لمعدلات التدفق وحجم العينة ليتم تحميلها. بعد تنقيتها ، ويتم تجميع الكسور Hsp104 كما هو مبين في الشكل. (5) وتتركز في وحدات الطرد المركزي Amicon المكثف (ميليبور). يتم تخزين Hsp104 كما هو موضح أدناه. بسبب فقدان المواد الواردة في الفصل بين المنتجات والملوثات Hsp104 تدهور المحصول النهائي لتنقية كامل طول Hsp104 هو ~ 1 - 3mg للتر الواحد ابتداء من الثقافة.
4. Hsp104 Disaggregase نشاط
- بعد تنقيتها ، فمن الممارسة الجيدة لتقييم Hsp104 النشاط في مقايسة تصنيفها. عادة ، ونحن توظيف مقايسة تنشيط luciferase 2 (الشكل 6). في هذا الاختبار ، Hsp104 بالاقتران مع نظام كوصي Hsp70 (Hsp70 وHsp40) يقسم اليوريا متمسخ المجاميع luciferase يراعة 2. luciferase ذوبان يحفز أكسدة luciferin لoxyluciferin ، وهو رد فعل تطلق الضوء. التلألؤ بواسطة الرصد ، وتنشيط نسبي ، وتصنيفها لذلك ، يمكن للluciferase يتم تحديدها. يجب أن تكون قادرة على Hsp104 التعاون يتحالف مع النظام المشترك كوصي Hsp70. كمية من التألق تعافى يعتمد على Hsp70 الدقيقة : الزوج Hsp40 المستخدمة. نحن نوظف بشكل روتيني وHsp72 Hsp40 (تصاميم الفحص). كحد أدنى ، ينبغي نشط Hsp104 انتاج بنسبة 5 أضعاف في تنشيط luciferase بالمقارنة مع تنشيط بواسطة Hsp72 : Hsp40 وحدها (الشكل 6). يتم تجاهل Hsp104 الاستعدادات التي تفشل في الوصول إلى هذا المستوى من النشاط.
5. Hsp104 التخزين
- للتخزين على المدى القصير ، يمكن الاحتفاظ Hsp104 في 4 درجات مئوية في الحجم الاستبعاد العازلة. ومع ذلك ، فإن النشاط تراجع بعد 2-3 أيام في 4 درجات مئوية ، وبشكل حاد بعد 1 الاسبوع في 4 درجات مئوية. المقايسات لتصنيفها نوصي التي يجب استخدامها Hsp104 في أقرب وقت ممكن بعد تنقيتها. من الناحية المثالية ، ينبغي أن تستخدم Hsp104 على الفور الحصول على المقايسات تصنيفها اميلويد.
- إذا يجب أن يتم تخزين البروتين الطويل الأجل ، ويتم تبادل Hsp104 العازلة في التخزين (20mM HEPES KOH - 7.4 درجة الحموضة ، بوكل 140mM ، 10MM MgCl 2 ، EDTA 0.1mM ، DTT 1MM ، الجلسرين بنسبة 10 ٪ (W / V)). aliquots 100μl المفاجئة هي مجمدة في النيتروجين السائل وتخزينه في -80 درجة مئوية. تجميد أذاب دورات خفض كبير Hsp104 النشاطوينبغي تجنب و. نوصي الذوبان ببطء Hsp104 على الجليد. اميلويد disaggregase النشاط سوف تنخفض بشكل حاد بعد 1 الشهر عند -80 درجة مئوية.
6. النتائج تمثيلا وارقام :
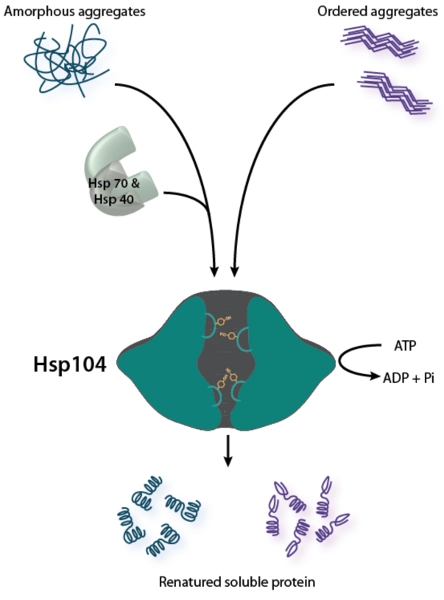
الشكل 1. Hsp104 هو disaggregase Bifunctional. تفصيل المجاميع المختلين (كما هو موضح على اليسار) يتطلب التعاون من جانب النظام كوصي Hsp70 (Hsp70 وHsp40) 2. أمر يعيد تشكيل المجاميع Hsp104 اميلويد (كما هو موضح على اليمين) من دون مساعدة من Hsp70 وHsp40 في المختبر ، ولكن Hsp70 Hsp40 ويمكن أن تحسن النشاط Hsp104 ضد اميلويد 26،28. لكلا النوعين من هياكل مجمعة ، Hsp104 المائي ATP إزفاء الأزواج على ركيزة من خلال قناته المركزية لتعزيز تصنيفها. حلقات المسام التيروزين الحاملة للمكوك إشراك وركيزة من خلال قناة مركزية 49-52.

الشكل 2. SDS - PAGE تحليل ني sepharose تقارب خطوة التنقية. كانت Lysate ، ني الحمولة ، وعينات FT ني ني شطافة مجزأة بواسطة SDS - PAGE باستخدام 40-20 ٪ حمض الهيدروكلوريك تريس - 1.0mm معيار هلام (بيو راد) والملون Coomassie . علما بأن ليس كل Hsp104 قادرة على ربط ني sepharose. وتظهر علامات واسعة النطاق الوزن الجزيئي (بيو راد) (يسار حارات).
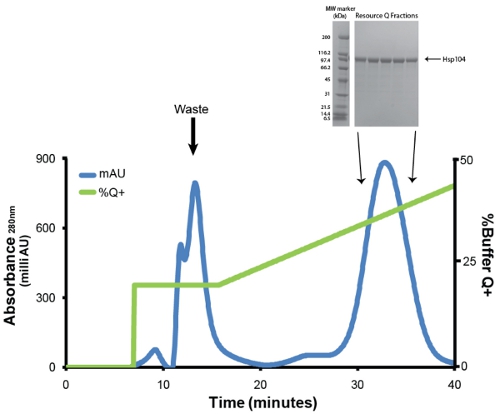
الشكل 3. س تنقية الموارد ني sepharose شطافة. تتبع الأزرق يمثل الامتصاصية في تتبع 280nm والأخضر يمثل ٪ س + مخزن (الحد الأقصى عند 50 ٪). ذروة الأولى ، التي elutes بنسبة 20 ٪ س + يحتوي على شوائب ، والمنتجات وتدهور Hsp104 مطوية بشكل غير صحيح. والذروة الثانية والرئيسية يحتوي Hsp104 مطوية بشكل صحيح وفعال. وكان معدل تدفق 1ml/min. التدرج من 20-50 ٪ س + 30 دقيقة أو وحدات التخزين العمود 5. أقحم : الكسور يتم حلها عن طريق التحليل ذروة SDS - PAGE باستخدام 40-20 ٪ حمض الهيدروكلوريك تريس - 1.0mm معيار هلام (بيو راد) وCoomassie الملون. وتظهر علامات واسعة النطاق الوزن الجزيئي (بيو راد) (اليسار).

الشكل 4. كان يعامل SDS - PAGE تحليل البروتيني proTEV خطوة الانقسام. صاحب 6 - Q Hsp104 من تنقية الموارد البروتيني مع proTEV لمدة 4 ساعات في 30 درجة مئوية ومن ثم 16 ساعة في 4 درجات مئوية. وكانت العينات مجزأة بواسطة SDS - PAGE باستخدام 40-20 ٪ حمض الهيدروكلوريك تريس - 1.0mm معيار هلام (بيو راد) وCoomassie الملون. علما بأن proTEV Hsp104 المشقوق يهاجر بسرعة أكبر. لقد استنفدت TEV البروتيني وHsp104 uncleaved مع ني Sepharose كما هو موضح في الخطوة 3.7. وتظهر علامات واسعة النطاق الوزن الجزيئي (بيو راد) (اليسار).
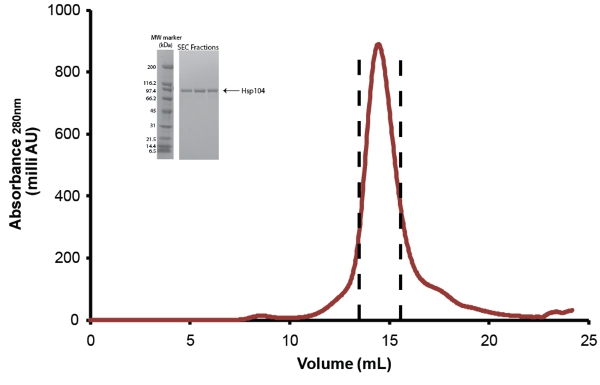
الشكل 5. المشقوق الحجم الاستبعاد تنقية Hsp104. المنقى وكذلك عن طريق Hsp104 6 Superose هلام العمود الترشيح (10 / 300 ، وجنرال الكتريك). معدل التدفق = 0.4ml/min. قمة بين الخطوط المتقطعة تمثل الكسور المجمعة. أقحم : الكسور يتم حلها عن طريق التحليل ذروة SDS - PAGE باستخدام 40-20 ٪ حمض الهيدروكلوريك تريس - 1.0mm معيار هلام (بيو راد) وCoomassie الملون. وتظهر علامات واسعة النطاق الوزن الجزيئي (بيو راد) (اليسار).
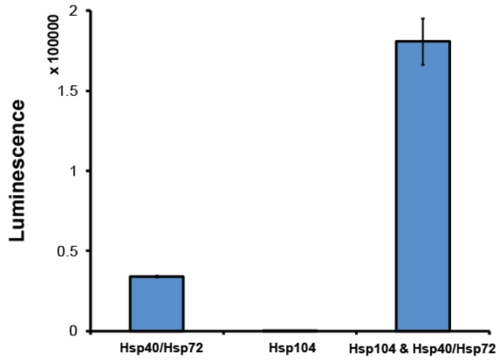
الشكل 6. وحضنت Luciferase مقايسة تنشيط. متمسخ المجاميع يراعة luciferase (50nM) وإما مع Hsp72 Hsp40 (1μM) (وكلاهما من النماذج الفحص) ، Hsp104 (6μM مونومر) أو Hsp104 ، وHsp72 Hsp40 ل90min في 25 درجة مئوية. فقط luciferase متمسخ تنشيط بالكامل في حضور كل من وHsp104 Hsp40/Hsp72. ويقاس على التلألؤ تعافى القارئ لانهائي لوحة M1000 (Tecan). تمثل القيم يعني ± SEM (ن = 3).
Discussion
الجدول الزمني : بالنسبة للنشاط Hsp104 القصوى من المستحسن أن يتم الانتهاء من خطة لتنقية كامل في أسرع وقت ممكن. ومع ذلك ، فإن عددا من الخطوات لتنقية جدول زمني يجعل المطالبة التي قد لا تكون دائما عملية. إذا نفذت الخطوات تنقية في أسرع وقت ممكن ، والوقت من نهاية التعبير من ?...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وأيد هذا العمل عن طريق منحة من المعاهد القومية للصحة (5T32GM008275 - 22) ، وزمالة جمعية القلب الاميركية predoctoral (لقمة شرق آسيا) ، وزمالة واجهة الكيمياء ، علم الأحياء من المعاهد الوطنية للصحة (2T32GM071339 - 06A1) (لMED) ، والمنح المقدمة من المعاهد الوطنية للصحة (1DP2OD002177 - 01 - 0110 وNS067354) ، والمؤسسة الطبية إليسون ، ومؤسسة بيل وميليندا غيتس (للشبيبة).
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | |
|---|---|---|---|
| BL21 - CodonPlus - RIL الخلايا المختصة | Stratagene ، اجيلنت تكنولوجيز | 230255 | |
| 2XYT مرق | USB | 75864 | |
| كاملة ، صغير ، مثبط البروتياز EDTA خالية اقراص | روش | 1836170 | |
| Pepstatin A | سيغما | P4265 | |
| NI - 6 Sepharose التدفق السريع | جنرال إلكتريك للرعاية الصحية | 17-5318-02 | |
| Amicon الترا 15 وحدة تصفية الطرد المركزي (MWCO 30،000) | ميليبور | UFC903008 | |
| الموارد س -- العمود 6ml | جنرال إلكتريك للرعاية الصحية | 17-1179-01 | |
| proTEV البروتياز | Promega | V6052 | |
| AcTEV البروتياز | Invitrogen | 12575015 | |
| 6 Superose 10/300 GL | جنرال إلكتريك للرعاية الصحية | 17-5172-01 | |
| Hsp40 | مقايسة تصاميم | SPP - 400 | |
| Hsp72 | مقايسة تصاميم | ADI - NSP - 555 |
References
- Erzberger, J. P., Berger, J. M. Evolutionary relationships and structural mechanisms of AAA+ proteins. Annu Rev Biophys Biomol Struct. 35, 93-114 (2006).
- Glover, J. R., Lindquist, S. Hsp104, Hsp70, and Hsp40: A Novel Chaperone System that Rescues Previously Aggregated Proteins. Cell. 94, 73-82 (1998).
- Parsell, D. A., Kowal, A. S., Singer, M. A., Lindquist, S. Protein disaggregation mediated by heat-shock protein Hsp104. Nature. 372, 475-478 (1994).
- Vashist, S., Cushman, M., Shorter, J. Applying Hsp104 to protein-misfolding disorders. Biochem Cell Biol. 88, 1-13 (2010).
- Parsell, D. A., Sanchez, Y., Stitzel, J. D., Lindquist, S. Hsp104 is a highly conserved protein with two essential nucleotide-binding sites. Nature. 353, 270-273 (1991).
- Doyle, S. M., Wickner, S. Hsp104 and ClpB: protein disaggregating machines. Trends Biochem Sci. 34, 40-48 (2009).
- Shorter, J. Hsp104: a weapon to combat diverse neurodegenerative disorders. Neurosignals. 16, 63-74 (2008).
- Glover, J. R., Lum, R. Remodeling of protein aggregates by Hsp104. Protein Pept Lett. 16, 587-597 (2009).
- Mogk, A., Haslberger, T., Tessarz, P., Bukau, B. Common and specific mechanisms of AAA+ proteins involved in protein quality control. Biochem Soc Trans. 36, 120-125 (2008).
- Grimminger-Marquardt, V., Lashuel, H. A. Structure and function of the molecular chaperone Hsp104 from yeast. Biopolymers. 93, 252-276 (2010).
- Sanchez, Y., Lindquist, S. L. HSP104 required for induced thermotolerance. Science. 248, 1112-1115 (1990).
- Sanchez, Y., Taulien, J., Borkovich, K. A., Lindquist, S. Hsp104 is required for tolerance to many forms of stress. Embo J. 11, 2357-2364 (1992).
- Alberti, S., Halfmann, R., King, O., Kapila, A., Lindquist, S. A systematic survey identifies prions and illuminates sequence features of prionogenic proteins. Cell. 137, 146-158 (2009).
- Halfmann, R., Alberti, S., Lindquist, S. Prions, protein homeostasis, and phenotypic diversity. Trends Cell Biol. 20, 125-1233 (2010).
- Shorter, J., Lindquist, S. Prions as adaptive conduits of memory and inheritance. Nat Rev Genet. 6, 435-450 (2005).
- True, H. L., Berlin, I., Lindquist, S. L. Epigenetic regulation of translation reveals hidden genetic variation to produce complex traits. Nature. 431, 184-187 (2004).
- True, H. L., Lindquist, S. L. A yeast prion provides a mechanism for genetic variation and phenotypic diversity. Nature. 407, 477-483 (2000).
- Tyedmers, J., Madariaga, M. L., Lindquist, S. Prion switching in response to environmental stress. PLoS Biol. 6, e294-e294 (2008).
- Chernoff, Y. O., Lindquist, S. L., Ono, B., Inge-Vechtomov, S. G., Liebman, S. W. Role of the chaperone protein Hsp104 in propagation of the yeast prion-like factor [psi+]. Science. 268, 880-884 (1995).
- Halfmann, R., Lindquist, S. Epigenetics in the extreme: prions and the inheritance of environmentally acquired traits. Science. 330, 629-632 (2010).
- Satpute-Krishnan, P., Langseth, S. X., Serio, T. R. Hsp104-dependent remodeling of prion complexes mediates protein-only inheritance. PLoS Biol. 5, e24-e24 (2007).
- Sweeny, E. A., Shorter, J. Prion proteostasis: Hsp104 meets its supporting cast. Prion. 2, 135-140 (2008).
- Lo Bianco, C. Hsp104 antagonizes alpha-synuclein aggregation and reduces dopaminergic degeneration in a rat model of Parkinson disease. J Clin Invest. 118, 3087-3097 (2008).
- Narayanan, S., Walter, S., Reif, B. Yeast prion-protein, sup35, fibril formation proceeds by addition and substraction of oligomers. Chembiochem. 7, 757-765 (2006).
- Savistchenko, J., Krzewska, J., Fay, N., Melki, R. Molecular chaperones and the assembly of the prion Ure2p in vitro. J Biol Chem. 283, 15732-15739 (2008).
- Shorter, J., Lindquist, S. Hsp104 catalyzes formation and elimination of self-replicating Sup35 prion conformers. Science. 304, 1793-1797 (2004).
- Shorter, J., Lindquist, S. Destruction or potentiation of different prions catalyzed by similar Hsp104 remodeling activities. Mol Cell. 23, 425-438 (2006).
- Shorter, J., Lindquist, S. Hsp104, Hsp70 and Hsp40 interplay regulates formation, growth and elimination of Sup35 prions. Embo J. 27, 2712-2724 (2008).
- Doyle, S. M. Asymmetric deceleration of ClpB or Hsp104 ATPase activity unleashes protein-remodeling activity. Nat Struct Mol Biol. 14, 114-122 (2007).
- Wendler, P. Atypical AAA+ subunit packing creates an expanded cavity for disaggregation by the protein-remodeling factor Hsp104. Cell. 131, 1366-1377 (2007).
- Hinault, M. P. Stable alpha-synuclein oligomers strongly inhibit chaperone activity of the Hsp70 system by weak interactions with J-domain co-chaperones. J Biol Chem. 285, 38173-38182 (2010).
- Tipton, K. A., Verges, K. J., Weissman, J. S. In vivo monitoring of the prion replication cycle reveals a critical role for Sis1 in delivering substrates to Hsp104. Mol Cell. 32, 584-591 (2008).
- Bieschke, J., Cohen, E., Murray, A., Dillin, A., Kelly, J. W. A kinetic assessment of the C. elegans amyloid disaggregation activity enables uncoupling of disassembly and proteolysis. Protein Sci1. 8, 2231-2241 (2009).
- Cohen, E., Bieschke, J., Perciavalle, R. M., Kelly, J. W., Dillin, A. Opposing activities protect against age-onset proteotoxicity. Science. 313, 1604-1610 (2006).
- Cohen, E. Reduced IGF-1 signaling delays age-associated proteotoxicity in mice. Cell. 139, 1157-1169 (2009).
- Cushman, M., Johnson, B. S., King, O. D., Gitler, A. D., Shorter, J. Prion-like disorders: blurring the divide between transmissibility and infectivity. J Cell Sci. 23, 1191-11201 (2010).
- Carmichael, J. Bacterial and yeast chaperones reduce both aggregate formation and cell death in mammalian cell models of Huntington's disease. Proc Natl Acad Sci. 97, 9701-9705 (2000).
- Vacher, C., Garcia-Oroz, L., Rubinsztein, D. C. Overexpression of yeast hsp104 reduces polyglutamine aggregation and prolongs survival of a transgenic mouse model of Huntington's disease. Hum Mol Genet. 14, 3425-3433 (2005).
- Liu, Y. H. Heat Shock Protein 104 Inhibited the Fibrillization of Prion Peptide 106-126 and Disassembled Prion peptide 106-126 Fibrils in vitro. Int J Biochem Cell Biol. , (2011).
- Wendler, P., Saibil, H. R. Cryo electron microscopy structures of Hsp100 proteins: crowbars in or out. Biochem Cell Biol. 88, 89-96 (2010).
- Wendler, P. Motor mechanism for protein threading through Hsp104. Mol Cell. 34, 81-92 (2009).
- Lee, S., Sielaff, B., Lee, J., Tsai, F. T. CryoEM structure of Hsp104 and its mechanistic implication for protein disaggregation. Proc Natl Acad Sci. 107, 8135-8140 (2010).
- Parsell, D. A., Kowal, A. S., Lindquist, S. Saccharomyces cerevisiae Hsp104 protein. Purification and characterization of ATP-induced structural changes. J Biol Chem. 269, 4480-4487 (1994).
- Schirmer, E. C., Queitsch, C., Kowal, A. S., Parsell, D. A., Lindquist, S. The ATPase activity of Hsp104, effects of environmental conditions and mutations. J Biol Chem. 273, 15546-15552 (1998).
- Schirmer, E. C., Ware, D. M., Queitsch, C., Kowal, A. S., Lindquist, S. L. Subunit interactions influence the biochemical and biological properties of Hsp104. Proc Natl Acad Sci. 98, 914-919 (2001).
- Hattendorf, D. A., Lindquist, S. L. Cooperative kinetics of both Hsp104 ATPase domains and interdomain communication revealed by AAA sensor-1 mutants. EMBO J. 21, 12-21 (2002).
- Schirmer, E. C., Lindquist, S. Purification and properties of Hsp104 from yeast. Methods Enzymol. 290, 430-444 (1998).
- Hattendorf, D. A., Lindquist, S. L. Analysis of the AAA sensor-2 motif in the C-terminal ATPase domain of Hsp104 with a site-specific fluorescent probe of nucleotide binding. Proc Natl Acad Sci. 99, 2732-2737 (2002).
- Lum, R., Niggemann, M., Glover, J. R. Peptide and protein binding in the axial channel of Hsp104. Insights into the mechanism of protein unfolding. J Biol Chem. 283, 30139-30150 (2008).
- Lum, R., Tkach, J. M., Vierling, E., Glover, J. R. Evidence for an unfolding/threading mechanism for protein disaggregation by Saccharomyces cerevisiae Hsp104. J Biol Chem. 279, 29139-29146 (2004).
- Tessarz, P., Mogk, A., Bukau, B. Substrate threading through the central pore of the Hsp104 chaperone as a common mechanism for protein disaggregation and prion propagation. Mol Microbiol. 68, 87-97 (2008).
- Weibezahn, J. Thermotolerance requires refolding of aggregated proteins by substrate translocation through the central pore of ClpB. Cell. 119, 653-665 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved