É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Purificação da Hsp104, um Disaggregase Protein
Neste Artigo
Resumo
Aqui, nós descrevemos um protocolo para a purificação de altamente ativa Hsp104, a AAA hexamérica + proteína de levedura, que acopla a hidrólise de ATP a desagregação de proteína. Este esquema explora uma construção His6 marcadas para a purificação de afinidade E. coli Seguido de cromatografia de troca aniônica, His6 tag-remoção com protease TEV e tamanho-exclusão cromatografia.
Resumo
Hsp104 é um hexamérica AAA + 1 proteína de levedura, que acopla a hidrólise de ATP para a proteína desagregação 10/02 (Fig. 1). Esta atividade dá dois principais vantagens seletivas. Primeiro, renaturalização de agregados desordenada por Hsp104 capacita sobrevivência levedura após várias proteínas-misfolding salienta, incluindo choque térmico 3,5,11,12. Em segundo lugar, a remodelação das fibrilas de cross-beta-amilóide por Hsp104 permite levedura para explorar prions miríade (amilóides infecciosas) como um reservatório de benéfico e hereditárias variação fenotípica 13-22. Notavelmente, Hsp104 diretamente remodela oligômeros preamyloid e fibrilas amilóides, incluindo aqueles composto de proteínas de levedura prion Sup35 e Ure2 23-30. Esta funcionalidade amilóide remodelação é uma faceta especializados de levedura Hsp104. O E. orthologue coli, ClpB, não oligômeros remodelar preamyloid ou fibrilas amilóides 26,31,32.
Orthologues Hsp104 são encontrados em todos os reinos da vida, exceto, perplexidade, os animais. De fato, se as células animais possuem qualquer sistema enzimático que os casais desagregação proteína para renaturalização (ao invés de degradação) permanece desconhecido 33-35. Assim, nós e outros propuseram que Hsp104 pode ser desenvolvido como um agente terapêutico para várias doenças neurodegenerativas relacionadas com o misfolding de proteínas específicas em oligômeros preamyloid tóxicos e fibrilas amilóides 4,7,23,36-38. Não existem tratamentos que visam directamente as espécies agregados associados a estas doenças. No entanto, se dissolve Hsp104 oligômeros tóxicos e fibrilas amilóides composto de alfa-sinucleína, que são conectados com Doença de Parkinson 23, bem como formas de amilóide de PrP 39. Importante, Hsp104 reduz a agregação da proteína e melhora a neurodegeneração em modelos de roedores da doença de Parkinson 23 e doença de Huntington 38. Idealmente, para otimizar o tratamento e minimizar os efeitos colaterais, Hsp104 seria projetado e potencializadas para seletivamente remodelar agregados específicos central para a doença em questão 4,7. No entanto, a limitada compreensão estrutural e mecânica de como Hsp104 desagrega um repertório tão diversificado de estruturas agregadas e proteínas não relacionadas frustra estes esforços 30,40-42.
Para compreender a estrutura e mecanismo de Hsp104, é essencial para estudar a proteína pura e reconstituir a sua actividade disaggregase com componentes mínimos. Hsp104 é uma proteína 102kDa com um pI de aproximadamente 5,3, que hexamerizes na presença de ADP ou ATP, ou em concentrações da proteína na ausência de 43-46 nucleotídeos. Aqui, nós descrevemos um protocolo otimizado para a purificação de altamente ativa, Hsp104 estável de E. coli. O uso de E. coli simplificado permite produção em larga escala e nosso método pode ser realizado de forma rápida e confiável para inúmeras Hsp104 variantes. Nosso protocolo aumenta Hsp104 pureza e simplifica a sua remoção 6 tag em comparação com um método de purificação prévia do E. coli 47. Além disso, o nosso protocolo é mais fácil e conveniente do que dois protocolos mais recentes 26,48.
Protocolo
1. Expressão de Hsp104
- O plasmídeo utilizado para a purificação em E. coli, pPROEX-HTB-Hsp104, contém o Hsp104 estrutura aberta de leitura sob o controle do promotor induzível trc 26. O plasmídeo produz Hsp104 com um N-terminal Seu 6 tag que pode ser removido por clivagem da protease TEV. PPROEX transformar-HTB-Hsp104 em códon otimizado E. coli BL21-CodonPlus-RIL células (Stratagene, Agilent Technologies) usando um procedimento típico de transformação bacteriana (por exemplo, de acordo com as instruções do fabricante). É importante usar um E. códon otimizado coli cepa Hsp104 porque tem um viés códon incomum.
- Inocular uma cultura 100mL 2XYT (USB. Receita: 16g / L de caseína peptona, 10g / L de extrato de levedura, 5g / L NaCl, pH 7,0) suplementado com ampicilina e cloranfenicol 100μg/mL 34μg/mL com transformantes fresco e crescer durante a noite a 37 ° C com agitação de 200 rpm.
- Inocular 10 ml da cultura durante a noite em 6 X 1L 2XYT com 100μg/mL ampicilina e cloranfenicol 34μg/mL em frascos de 2L. Agite a 250rpm a 37 ° C até OD 600 = ,4-0,6. Parar de tremer e reduzir a temperatura para 15 ° C. Permitem que as células para equilibrar sem agitação por 30min na incubadora até atingir 15 ° C. Uma vez que 15 ° C é atingido induzir a expressão da proteína pela adição de IPTG a uma concentração final de 1mM. Retomar a agitação a 250rpm durante a noite (12-16 horas).
2. Colheita de células e de Lise
- Células colheita por centrifugação (em um rotor pré-resfriada) a 4.000 rpm por 20min a 4 ° C (usamos um Sorvall RC 3BP centrífuga +). Etapas subseqüentes devem ser realizados imediatamente, porque Hsp104 atividade é diminuída quando E. células coli são congelados. Além disso, todas as etapas subseqüentes devem ser realizados no gelo ou a 4 ° C.
- Ressuspender pellets de células em prechilled (no gelo) 10 ml tampão de lise (40mm HEPES-KOH pH 7,4, 500mM KCl, 20mM MgCl 2, 2,5% (w / v) de glicerol, 20mM imidazol, 5m pepstatin A, cocktail inibidor da protease completa (1 EDTA sem tablet/50mL), e 2mM β-mercaptoetanol).
- Lisar as células com uma imprensa francesa homogeneizador (Emulsiflex) que usa um trocador de calor imerso em água gelada. Antes da utilização, garantir que todos os aglomerados celulares foram solubilizados. Depois de equilibrar homogeneizador com tampão de lise, duas passagens do cilindro com uma pressão de 15,000-18,000 psi é suficiente para a lise completa. Se uma imprensa francesa não está disponível, a incubação com a lisozima seguido de sonicação pode ser usado (ver discussão). Salvar uma pequena amostra de células lisadas por SDS-PAGE análise (1μL) (Lysate na figura. 2).
- Remover restos celulares por centrifugação a 16.000 rpm por 20min a 4 ° C (usamos um RC5C Sorvall centifuge +). Reter sobrenadante para o próximo passo e salvar uma pequena amostra (1μL) do sobrenadante para análise SDS-PAGE (Ni Load na figura. 2).
3. Purificação Hsp104
- Mix sobrenadante do passo 2.4 com 12 ml (2 ml Ni-Sepharose pérolas por 1L de células) de dejetos de 50% de tampão de lise equilibrada Ni Sepharose-beads (GE).
- Rode a amostra lentamente por 3 horas a 4 ° C tal que Ni-Sepharose permanece uniformemente suspensa e espuma é minimizado. Menor tempo de incubação são possíveis, mas vai diminuir o rendimento. A 4 ° C na presença de inibidores de protease, a degradação ocorre pouco, e um tempo de incubação 3 horas Ni Sepharose-não diminui a atividade do produto final. Coletar Ni-Sepharose por centrifugação por 2 min a 4 ° C a 2.000 rpm (Eppendorf 5810R centrífuga). Salvar uma pequena amostra do sobrenadante para análise SDS-PAGE (1μL) e descartar o resto (Ni Flow Through (FT) na figura. 2).
- Lavar os recuperados Ni Sepharose com 25 volumes de coluna de tampão de lavagem (40mm HEPES-KOH pH 7.4, 150mm KCl, 20mM MgCl 2, 2,5% (w / v) de glicerol, 20mM imidazol, 2mM β-mercaptoetanol), 5 volumes da coluna tampão de lavagem com KCl 1M para remover os contaminantes ligados eletrostaticamente para Hsp104, e 25 volumes de coluna de tampão de lavagem. Coletar Ni-Sepharose após cada lavagem por centrifugação por 2 min a 4 ° C a 2.000 rpm (Eppendorf 5810R centrífuga). Após cada ciclo de lavagem e centrifugação, remover tampão por aspiração.
- Para eluir Hsp104, misture Ni-Sepharose com 1mL tampão de eluição (40mm HEPES-KOH pH 7.4, 150mm KCl, 20mM MgCl 2, 2,5% (w / v) de glicerol, imidazol 350mm, 2mM β-mercaptoetanol) por 1 ml Ni-Sepharose e girar a 4 ° C por 20 minutos. A concentração de imidazol alta interrompe o talão Ni-6 Sua interação. Remover Ni-Sepharose com colunas vazias 1,2 mL de rotação (Bio-Rad) por centrifugação por 2 min a 4 ° C a 2.000 rpm (Eppendorf 5810R centrífuga). Salvar 1μL de eluato para análise SDS-PAGE (Ni eluato na figura. 2). Para cada litro de células, ~ 15mg de Hsp104 é obtido nesta etapa.
- Tampão eluído em troca de buffer Q (20mM Tris-HCl pH 8, EDTA 0,5 mM, MgCl 5mM 2, 50 mM NaCl), utilizando MWCO 30.000 Amicon Ultra (Millipore) 15mL unidades concentrador centrífugo. Primeiro, concentrado protéico de ~ 1,5 ml em seguida, adicione 14.5mL de tampão para diluir proteína Q 10 vezes. Repita 3 vezes para a troca de buffer. O pH aumentou e baixo teor de sal garante que Hsp104 tem uma alta carga negativa.
- Purify Hsp104 através de troca aniônica cromatografia usando um tampão Q equilibrada Resource Q coluna 6ml (GE). Antes da injeção, a proteína é filtrada através de uma baixa ligação protéica Millex GP PES Membrana 0.22μM seringa filtro (Millipore). Nós empregamos uma vazão de 1mL/min. Lavar fracamente proteínas de ligação com 1 volume de tampão de coluna 20% Q + (20mM Tris-HCl pH 8, EDTA 0,5 mM, MgCl 2 5mM, 1M NaCl). Eluir Hsp104 com gradiente linear (20% -50% de buffer Q +) mais de 5 volumes da coluna (Fig. 3). Coletar frações de 1ml. Hsp104 e mais variantes tipicamente eluída no NaCl ~ 400mm (31mS/cm). Salvar amostras de frações de pico (1μL) para análise de SDS-PAGE (Fig. 3, inset).
- Para remover sua 6 tag, proteína de troca utilizando o concentrador Amicon centrífuga como descrito acima (veja o passo 3.5) em tampão de clivagem (20mM HEPES-KOH pH 7.4, 140mm KCl, 10mM MgCl e 2). Use proTEV protease (Promega) ou AcTEV protease (Invitrogen) de acordo com instruções do fabricante. Para Hsp104, descobrimos que os rácios mais elevados de protease TEV: Hsp104 são necessários para a clivagem completa. Nós usamos uma proporção de 1 unidade de protease por 12μg Hsp104. Clivagem deve ser realizada a 30 ° C por 2-4 horas, seguido de incubação de 16 horas a 4 ° C. Hsp104 concentração final deve ser entre 20-75μM monômero. Destroem qualquer Hsp104 restantes His6-marcadas e protease TEV com Ni-Sepharose (GE), adicionando-Ni Sepharose em excesso para a quantidade de Hsp104 na reação de clivagem (assumir contas pode ligar 15mg de proteína por mL de resina embalado). Remover contas com colunas de spin vazia (Bio-Rad) por centrifugação de 2min a 2.000 rpm a 4 ° C. Coletar amostras antes e depois da clivagem (1μL) para SDS-PAGE análise para garantir clivagem, ea remoção de proteínas uncleaved (Fig. 4).
- Em troca de tamanho do buffer de exclusão (20mM HEPES-KOH pH 7.4, 140mm KCl, 10mM MgCl 2, 0,1 mM EDTA, 1mM DTT) usando MWCO 30.000 Amicon Ultra (Millipore), como descrito no passo 3.5.
- Purificar Hsp104 via tamanho-exclusão cromatografia. Use o tamanho do buffer Superose exclusão equilibrado 6 ou Superdex 200 coluna (ambos da GE) (Fig. 5). Antes da injeção, a proteína é filtrada através de uma baixa ligação protéica Millex GP PES Membrana 0.22μM seringa filtro (Millipore). Por menos de 10 mg de proteína, o 10/300 colunas tamanho (24mL) pode ser usado e frações de 0,5 ml são coletados. Para as amostras superiores a 10 mg, a coluna tamanho 12/60 (120ml) deve ser usado e 1 ml frações são coletadas. Consulte as instruções do fabricante para caudais e volumes de amostra a ser carregado. Após purificação, as frações Hsp104 são agrupados conforme mostrado na figura. 5 e concentrada em Unidades Concentrador Amicon centrífugas (Millipore). Hsp104 é armazenado como descrito abaixo. Devido à perda de material em separar Hsp104 produtos de degradação e contaminantes no rendimento final da purificação full-length Hsp104 é ~ 1-3mg por litro de partida cultura.
4. Hsp104 Atividade Disaggregase
- Após purificação, é uma boa prática para avaliar Hsp104 atividade em um ensaio de desagregação. Normalmente, nós empregamos um ensaio de reativação luciferase 2 (Fig. 6). Neste ensaio, Hsp104 em conjunto com o sistema chaperone Hsp70 (Hsp70 e Hsp40) desagrega-uréia desnaturado agregados luciferase firefly 2. Solúveis luciferase catalisa a oxidação da luciferina para oxiluciferina, uma reação que libera luz. Por luminescência de monitoramento, a reativação relativa, e, portanto, desagregação, da luciferase pode ser determinada. Hsp104 deve ser capaz de sinergicamente colaborar com o sistema de co-chaperone Hsp70. A quantidade de luminescência recuperado depende da Hsp70 exata: par Hsp40 utilizado. Empregamos rotineiramente Hsp72 e Hsp40 (Designs Assay). No mínimo, ativos Hsp104 deve produzir um aumento de 5 vezes na reativação da luciferase, quando comparado à reativação de Hsp72: Hsp40 sozinho (Fig. 6). Hsp104 preparações que não conseguem atingir esse nível de atividade são descartados.
5. Hsp104 Armazenamento
- De curto prazo de armazenamento, Hsp104 pode ser mantido a 4 ° C em tamanho-exclusão buffer. No entanto, a atividade vai diminuir depois de 2-3 dias a 4 ° C e acentuadamente após uma semana a 4 ° C. Para ensaios de desagregação recomendamos que Hsp104 deve ser usado o mais rapidamente possível após a purificação. Idealmente, Hsp104 deve ser utilizado imediatamente para ensaios de desagregação amilóide.
- Se a proteína deve ser armazenado a longo prazo, Hsp104 é trocada dentro do buffer de armazenamento (20mM HEPES-KOH pH 7.4, 140mm KCl, 10mM MgCl 2, 0,1 mM EDTA, 1mM DTT, glicerol 10% (w / v)). Alíquotas são 100μl pressão congelados em nitrogênio líquido e armazenadas a -80 ° C. Ciclos de congelamento e descongelamento reduzir drasticamente Hsp104 atividadee deve ser evitado. Recomendamos lentamente descongelamento Hsp104 no gelo. Amilóide disaggregase-atividade irá diminuir drasticamente depois de 1 mês a -80 ° C.
6. Resultados representante e números:
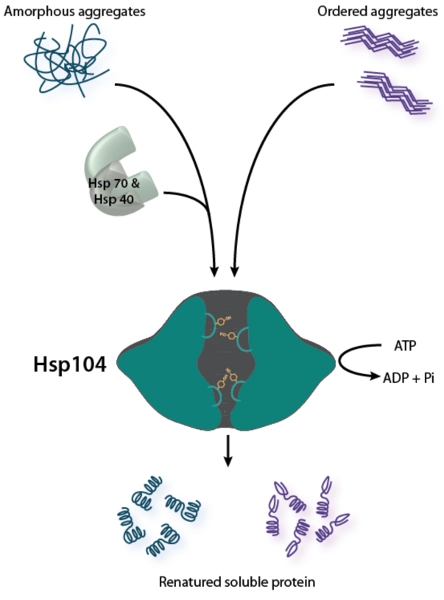
Figura 1. Hsp104 é um disaggregase bifuncional. Desagregação dos agregados desordenado (mostrado à esquerda) requer a cooperação do sistema chaperone Hsp70 (Hsp70 e Hsp40) 2. Remodela Hsp104 ordenou agregados amilóides (mostrado à direita) sem o auxílio de Hsp70 e Hsp40 in vitro, mas Hsp70 e Hsp40 pode melhorar Hsp104 atividade contra amilóide 26,28. Para ambos os tipos de estruturas de agregados, Hsp104 casais hidrólise de ATP a translocação do substrato através de seu canal central para promover a desagregação. Loops tirosina-bearing poros envolver e substrato de transporte através do canal central 49-52.

Figura 2. SDS-PAGE análise de Ni-Sepharose etapa de purificação de afinidade. Lysate, Load Ni, Ni FT e amostras de eluato Ni foram fracionadas por SDS-PAGE usando um 40-20% Tris-HCl 1,0 milímetros Critério de gel (Bio-Rad) e corados Coomassie . Note que nem todos os Hsp104 é capaz de se ligar ao Ni-Sepharose. Ampla Faixa de marcadores de peso molecular (Bio-Rad) são mostrados (esquerda lane).
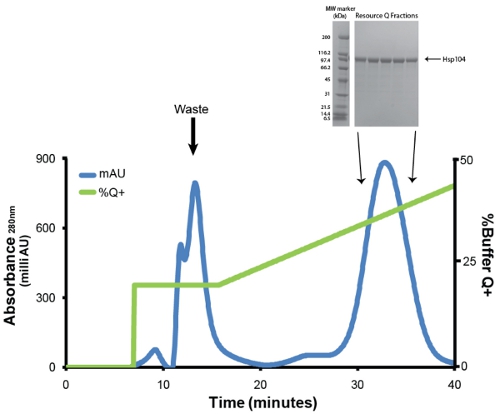
Figura 3. Recurso de purificação Q de Ni-Sepharose eluído. Traço azul representa a absorvância a 280nm traço eo verde representa% buffer Q + (máximo de 50%). O primeiro pico, que é eluído em 20% Q + contém impurezas, produtos de degradação e Hsp104 indevidamente dobrado. O segundo pico e os principais contém Hsp104 correctamente dobrados e ativo. Taxa de fluxo foi 1mL/min. Gradiente de 20-50% Q + é de 30 minutos ou 5 volumes da coluna. Detalhe: frações de pico são resolvidos por SDS-PAGE análise usando um 40-20% Tris-HCl 1,0 milímetros Critério de gel (Bio-Rad) e corados Coomassie. Ampla Faixa de marcadores de peso molecular (Bio-Rad) são mostradas (esquerda).

Figura 4. SDS-PAGE análise de proTEV etapa de clivagem da protease. Seus 6-Hsp104 de purificação Resource Q foi tratado com proTEV protease durante 4 horas a 30 ° C e 16 horas a 4 ° C. Amostras foram fracionadas por SDS-PAGE usando um 40-20% Tris-HCl 1,0 milímetros Critério de gel (Bio-Rad) e corados Coomassie. Note-se que proTEV clivada Hsp104 migra mais rapidamente. TEV protease e Hsp104 uncleaved foram esgotados com Ni-Sepharose, conforme descrito no Passo 3.7. Ampla Faixa de marcadores de peso molecular (Bio-Rad) são mostradas (esquerda).
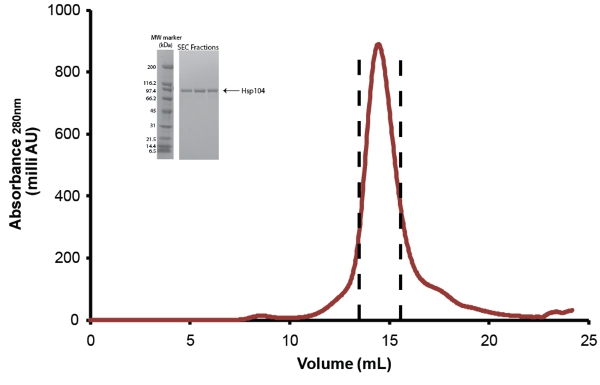
Figura 5. Tamanho-exclusão purificação de Hsp104. Clivadas Hsp104 foi ainda purificada por meio de uma coluna de filtração Superose 6 gel (10/300, GE). = Vazão 0.4ml/min. O pico entre as linhas tracejadas representam frações agrupadas. Detalhe: frações de pico são resolvidos por SDS-PAGE análise usando um 40-20% Tris-HCl 1,0 milímetros Critério de gel (Bio-Rad) e corados Coomassie. Ampla Faixa de marcadores de peso molecular (Bio-Rad) são mostradas (esquerda).
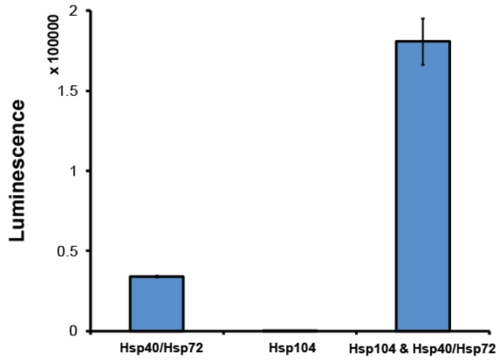
Figura 6. Ensaio de reativação luciferase. Agregados desnaturadas firefly luciferase (50nm) foram incubadas com um Hsp72 e Hsp40 (1 Hm) (ambos dos projetos Assay), Hsp104 (6μM monômero) ou Hsp104, Hsp72 e Hsp40 de 90min a 25 ° C. Luciferase desnaturado só é totalmente reativado na presença de ambos os Hsp104 e Hsp40/Hsp72. Luminescência recuperado é medida em uma Infinito M1000 Leitor de placa (Tecan). Valores representam médias ± EPM (n = 3).
Discussão
Cronograma: Para a atividade Hsp104 máxima recomendamos que o sistema de purificação de todo ser concluída o mais rapidamente possível. No entanto, o número de etapas de purificação torna um calendário exigente, que nem sempre pode ser prático. Se as etapas de purificação são realizadas o mais rapidamente possível, o tempo a partir do final de expressão durante a noite até a 2-4 horas de incubação a 30 ° C com TEV protease é de aproximadamente 9-11 horas. Um lugar potencial para fazer uma paus...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado por uma concessão do NIH (5T32GM008275-22) e um American Heart Association predoctoral comunhão (para EAS); uma bolsa de interface Química Biologia a partir do NIH (2T32GM071339-06A1) (para MED); e subvenções do NIH (1DP2OD002177-01 e NS067354-0110), The Ellison Medical Foundation e The Bill and Melinda Gates Foundation (a JS).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
|---|---|---|---|
| BL21-CodonPlus-RIL células competentes | Stratagene, Agilent Technologies | 230255 | |
| 2XYT caldo | USB | 75864 | |
| Completo, mini, EDTA livre inibidor da protease comprimidos | Roche | 1836170 | |
| A Pepstatin | Sigma | P4265 | |
| Ni-Sepharose 6 Fluxo Rápido | GE Healthcare | 17-5318-02 | |
| Amicon Ultra-15 centrífuga unidades de filtro (MWCO 30.000) | Millipore | UFC903008 | |
| Resource Q - coluna 6ml | GE Healthcare | 17-1179-01 | |
| proTEV Protease | Promega | V6052 | |
| AcTEV Protease | Invitrogen | 12575015 | |
| Superose 6 10/300 GL | GE Healthcare | 17-5172-01 | |
| Hsp40 | Designs ensaio | SPP-400 | |
| Hsp72 | Designs ensaio | ADI-NSP-555 |
Referências
- Erzberger, J. P., Berger, J. M. Evolutionary relationships and structural mechanisms of AAA+ proteins. Annu Rev Biophys Biomol Struct. 35, 93-114 (2006).
- Glover, J. R., Lindquist, S. Hsp104, Hsp70, and Hsp40: A Novel Chaperone System that Rescues Previously Aggregated Proteins. Cell. 94, 73-82 (1998).
- Parsell, D. A., Kowal, A. S., Singer, M. A., Lindquist, S. Protein disaggregation mediated by heat-shock protein Hsp104. Nature. 372, 475-478 (1994).
- Vashist, S., Cushman, M., Shorter, J. Applying Hsp104 to protein-misfolding disorders. Biochem Cell Biol. 88, 1-13 (2010).
- Parsell, D. A., Sanchez, Y., Stitzel, J. D., Lindquist, S. Hsp104 is a highly conserved protein with two essential nucleotide-binding sites. Nature. 353, 270-273 (1991).
- Doyle, S. M., Wickner, S. Hsp104 and ClpB: protein disaggregating machines. Trends Biochem Sci. 34, 40-48 (2009).
- Shorter, J. Hsp104: a weapon to combat diverse neurodegenerative disorders. Neurosignals. 16, 63-74 (2008).
- Glover, J. R., Lum, R. Remodeling of protein aggregates by Hsp104. Protein Pept Lett. 16, 587-597 (2009).
- Mogk, A., Haslberger, T., Tessarz, P., Bukau, B. Common and specific mechanisms of AAA+ proteins involved in protein quality control. Biochem Soc Trans. 36, 120-125 (2008).
- Grimminger-Marquardt, V., Lashuel, H. A. Structure and function of the molecular chaperone Hsp104 from yeast. Biopolymers. 93, 252-276 (2010).
- Sanchez, Y., Lindquist, S. L. HSP104 required for induced thermotolerance. Science. 248, 1112-1115 (1990).
- Sanchez, Y., Taulien, J., Borkovich, K. A., Lindquist, S. Hsp104 is required for tolerance to many forms of stress. Embo J. 11, 2357-2364 (1992).
- Alberti, S., Halfmann, R., King, O., Kapila, A., Lindquist, S. A systematic survey identifies prions and illuminates sequence features of prionogenic proteins. Cell. 137, 146-158 (2009).
- Halfmann, R., Alberti, S., Lindquist, S. Prions, protein homeostasis, and phenotypic diversity. Trends Cell Biol. 20, 125-1233 (2010).
- Shorter, J., Lindquist, S. Prions as adaptive conduits of memory and inheritance. Nat Rev Genet. 6, 435-450 (2005).
- True, H. L., Berlin, I., Lindquist, S. L. Epigenetic regulation of translation reveals hidden genetic variation to produce complex traits. Nature. 431, 184-187 (2004).
- True, H. L., Lindquist, S. L. A yeast prion provides a mechanism for genetic variation and phenotypic diversity. Nature. 407, 477-483 (2000).
- Tyedmers, J., Madariaga, M. L., Lindquist, S. Prion switching in response to environmental stress. PLoS Biol. 6, e294-e294 (2008).
- Chernoff, Y. O., Lindquist, S. L., Ono, B., Inge-Vechtomov, S. G., Liebman, S. W. Role of the chaperone protein Hsp104 in propagation of the yeast prion-like factor [psi+]. Science. 268, 880-884 (1995).
- Halfmann, R., Lindquist, S. Epigenetics in the extreme: prions and the inheritance of environmentally acquired traits. Science. 330, 629-632 (2010).
- Satpute-Krishnan, P., Langseth, S. X., Serio, T. R. Hsp104-dependent remodeling of prion complexes mediates protein-only inheritance. PLoS Biol. 5, e24-e24 (2007).
- Sweeny, E. A., Shorter, J. Prion proteostasis: Hsp104 meets its supporting cast. Prion. 2, 135-140 (2008).
- Lo Bianco, C. Hsp104 antagonizes alpha-synuclein aggregation and reduces dopaminergic degeneration in a rat model of Parkinson disease. J Clin Invest. 118, 3087-3097 (2008).
- Narayanan, S., Walter, S., Reif, B. Yeast prion-protein, sup35, fibril formation proceeds by addition and substraction of oligomers. Chembiochem. 7, 757-765 (2006).
- Savistchenko, J., Krzewska, J., Fay, N., Melki, R. Molecular chaperones and the assembly of the prion Ure2p in vitro. J Biol Chem. 283, 15732-15739 (2008).
- Shorter, J., Lindquist, S. Hsp104 catalyzes formation and elimination of self-replicating Sup35 prion conformers. Science. 304, 1793-1797 (2004).
- Shorter, J., Lindquist, S. Destruction or potentiation of different prions catalyzed by similar Hsp104 remodeling activities. Mol Cell. 23, 425-438 (2006).
- Shorter, J., Lindquist, S. Hsp104, Hsp70 and Hsp40 interplay regulates formation, growth and elimination of Sup35 prions. Embo J. 27, 2712-2724 (2008).
- Doyle, S. M. Asymmetric deceleration of ClpB or Hsp104 ATPase activity unleashes protein-remodeling activity. Nat Struct Mol Biol. 14, 114-122 (2007).
- Wendler, P. Atypical AAA+ subunit packing creates an expanded cavity for disaggregation by the protein-remodeling factor Hsp104. Cell. 131, 1366-1377 (2007).
- Hinault, M. P. Stable alpha-synuclein oligomers strongly inhibit chaperone activity of the Hsp70 system by weak interactions with J-domain co-chaperones. J Biol Chem. 285, 38173-38182 (2010).
- Tipton, K. A., Verges, K. J., Weissman, J. S. In vivo monitoring of the prion replication cycle reveals a critical role for Sis1 in delivering substrates to Hsp104. Mol Cell. 32, 584-591 (2008).
- Bieschke, J., Cohen, E., Murray, A., Dillin, A., Kelly, J. W. A kinetic assessment of the C. elegans amyloid disaggregation activity enables uncoupling of disassembly and proteolysis. Protein Sci1. 8, 2231-2241 (2009).
- Cohen, E., Bieschke, J., Perciavalle, R. M., Kelly, J. W., Dillin, A. Opposing activities protect against age-onset proteotoxicity. Science. 313, 1604-1610 (2006).
- Cohen, E. Reduced IGF-1 signaling delays age-associated proteotoxicity in mice. Cell. 139, 1157-1169 (2009).
- Cushman, M., Johnson, B. S., King, O. D., Gitler, A. D., Shorter, J. Prion-like disorders: blurring the divide between transmissibility and infectivity. J Cell Sci. 23, 1191-11201 (2010).
- Carmichael, J. Bacterial and yeast chaperones reduce both aggregate formation and cell death in mammalian cell models of Huntington's disease. Proc Natl Acad Sci. 97, 9701-9705 (2000).
- Vacher, C., Garcia-Oroz, L., Rubinsztein, D. C. Overexpression of yeast hsp104 reduces polyglutamine aggregation and prolongs survival of a transgenic mouse model of Huntington's disease. Hum Mol Genet. 14, 3425-3433 (2005).
- Liu, Y. H. Heat Shock Protein 104 Inhibited the Fibrillization of Prion Peptide 106-126 and Disassembled Prion peptide 106-126 Fibrils in vitro. Int J Biochem Cell Biol. , (2011).
- Wendler, P., Saibil, H. R. Cryo electron microscopy structures of Hsp100 proteins: crowbars in or out. Biochem Cell Biol. 88, 89-96 (2010).
- Wendler, P. Motor mechanism for protein threading through Hsp104. Mol Cell. 34, 81-92 (2009).
- Lee, S., Sielaff, B., Lee, J., Tsai, F. T. CryoEM structure of Hsp104 and its mechanistic implication for protein disaggregation. Proc Natl Acad Sci. 107, 8135-8140 (2010).
- Parsell, D. A., Kowal, A. S., Lindquist, S. Saccharomyces cerevisiae Hsp104 protein. Purification and characterization of ATP-induced structural changes. J Biol Chem. 269, 4480-4487 (1994).
- Schirmer, E. C., Queitsch, C., Kowal, A. S., Parsell, D. A., Lindquist, S. The ATPase activity of Hsp104, effects of environmental conditions and mutations. J Biol Chem. 273, 15546-15552 (1998).
- Schirmer, E. C., Ware, D. M., Queitsch, C., Kowal, A. S., Lindquist, S. L. Subunit interactions influence the biochemical and biological properties of Hsp104. Proc Natl Acad Sci. 98, 914-919 (2001).
- Hattendorf, D. A., Lindquist, S. L. Cooperative kinetics of both Hsp104 ATPase domains and interdomain communication revealed by AAA sensor-1 mutants. EMBO J. 21, 12-21 (2002).
- Schirmer, E. C., Lindquist, S. Purification and properties of Hsp104 from yeast. Methods Enzymol. 290, 430-444 (1998).
- Hattendorf, D. A., Lindquist, S. L. Analysis of the AAA sensor-2 motif in the C-terminal ATPase domain of Hsp104 with a site-specific fluorescent probe of nucleotide binding. Proc Natl Acad Sci. 99, 2732-2737 (2002).
- Lum, R., Niggemann, M., Glover, J. R. Peptide and protein binding in the axial channel of Hsp104. Insights into the mechanism of protein unfolding. J Biol Chem. 283, 30139-30150 (2008).
- Lum, R., Tkach, J. M., Vierling, E., Glover, J. R. Evidence for an unfolding/threading mechanism for protein disaggregation by Saccharomyces cerevisiae Hsp104. J Biol Chem. 279, 29139-29146 (2004).
- Tessarz, P., Mogk, A., Bukau, B. Substrate threading through the central pore of the Hsp104 chaperone as a common mechanism for protein disaggregation and prion propagation. Mol Microbiol. 68, 87-97 (2008).
- Weibezahn, J. Thermotolerance requires refolding of aggregated proteins by substrate translocation through the central pore of ClpB. Cell. 119, 653-665 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados