Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Очистка Hsp104, белка Disaggregase
В этой статье
Резюме
Здесь мы опишем протокол для очистки высокоактивной Hsp104, hexameric AAA + белка из дрожжей, которые пары гидролиза АТФ с белком дезагрегации. Эта схема использует His6 с метками построить для аффинной очистки от Е. палочки Затем анионообменной хроматографии, His6-теги удаления с протеазы ТРВ, и гель-хроматографии.
Аннотация
Hsp104 is a hexameric AAA+ protein1 from yeast, which couples ATP hydrolysis to protein disaggregation2-10 (Fig. 1). This activity imparts two key selective advantages. First, renaturation of disordered aggregates by Hsp104 empowers yeast survival after various protein-misfolding stresses, including heat shock3,5,11,12. Second, remodeling of cross-beta amyloid fibrils by Hsp104 enables yeast to exploit myriad prions (infectious amyloids) as a reservoir of beneficial and heritable phenotypic variation13-22. Remarkably, Hsp104 directly remodels preamyloid oligomers and amyloid fibrils, including those comprised of the yeast prion proteins Sup35 and Ure223-30. This amyloid-remodeling functionality is a specialized facet of yeast Hsp104. The E. coli orthologue, ClpB, fails to remodel preamyloid oligomers or amyloid fibrils26,31,32.
Hsp104 orthologues are found in all kingdoms of life except, perplexingly, animals. Indeed, whether animal cells possess any enzymatic system that couples protein disaggregation to renaturation (rather than degradation) remains unknown33-35. Thus, we and others have proposed that Hsp104 might be developed as a therapeutic agent for various neurodegenerative diseases connected with the misfolding of specific proteins into toxic preamyloid oligomers and amyloid fibrils4,7,23,36-38. There are no treatments that directly target the aggregated species associated with these diseases. Yet, Hsp104 dissolves toxic oligomers and amyloid fibrils composed of alpha-synuclein, which are connected with Parkinson's Disease23 as well as amyloid forms of PrP39. Importantly, Hsp104 reduces protein aggregation and ameliorates neurodegeneration in rodent models of Parkinson's Disease23 and Huntington's disease38. Ideally, to optimize therapy and minimize side effects, Hsp104 would be engineered and potentiated to selectively remodel specific aggregates central to the disease in question4,7. However, the limited structural and mechanistic understanding of how Hsp104 disaggregates such a diverse repertoire of aggregated structures and unrelated proteins frustrates these endeavors30,40-42.
To understand the structure and mechanism of Hsp104, it is essential to study the pure protein and reconstitute its disaggregase activity with minimal components. Hsp104 is a 102kDa protein with a pI of ~5.3, which hexamerizes in the presence of ADP or ATP, or at high protein concentrations in the absence of nucleotide43-46. Here, we describe an optimized protocol for the purification of highly active, stable Hsp104 from E. coli. The use of E. coli allows simplified large-scale production and our method can be performed quickly and reliably for numerous Hsp104 variants. Our protocol increases Hsp104 purity and simplifies His6-tag removal compared to a previous purification method from E. coli47. Moreover, our protocol is more facile and convenient than two more recent protocols26,48.
протокол
1. Выражение Hsp104
- Плазмиды используются для очистки в E. палочка, pPROEX-HTB-Hsp104, содержит Hsp104 открытым рамки считывания при индуцируемый контролем промотора TRC 26. Плазмиды производит Hsp104 с N-терминал Его 6-теги, которые могут быть удалены TEV расщепления протеазы. Преобразование pPROEX-HTB-Hsp104 в кодон-оптимизированный Е. кишечной BL21-CodonPlus-RIL клетки (Stratagene, Agilent Technologies) с использованием типичных бактериальных процедуры преобразования (например, в соответствии с инструкциями производителя). Важно использовать кодон-оптимизированный Е. палочки штамма, поскольку Hsp104 имеет необычное смещение кодон.
- Привить 100 мл 2XYT культуры (USB. Рецепт: 16 г / л казеина пептона, 10 г / л дрожжевого экстракта, 5 г / л NaCl, рН 7,0) с добавлением 100μg/mL ампициллин и хлорамфеникол 34μg/mL со свежими трансформантов и расти в течение ночи при 37 ° C при встряхивании на 200rpm.
- Привить 10 мл ночной культуры в 6 X 1L 2XYT с 100μg/mL ампициллина и хлорамфеникола в 34μg/mL 2L колб. Встряска на 250rpm при 37 ° С до OD 600 = 0.4-0.6. Стоп тряски и снизить температуру до 15 ° C. Разрешить клетки, чтобы уравновесить невозбужденный в течение 30 минут в инкубаторе, пока не достигнет 15 ° C. После 15 ° C достигается вызывают экспрессию белка путем добавления IPTG до конечной концентрации 1 мм. Резюме встряхивании при 250rpm ночь (12-16 часов).
2. Урожай клеток и Лизис
- Урожай клетки путем центрифугирования (в предварительно охлажденном ротора) при 4000 оборотов в минуту для 20 минут при 4 ° С (мы используем Sorvall RC 3BP + центрифуга). Последующие шаги должны быть выполнены немедленно, потому что Hsp104 активность снижается, когда Е. кишечной клетки заморожены. Более того, все последующие шаги должны выполняться на льду или при температуре 4 ° C.
- Ресуспендируют гранулы ячейку в prechilled (на льду) 10 мл лизирующего буфера (40 мм HEPES-КОН рН 7,4, 500 мм KCl, 20 мМ MgCl 2, 2,5% (м / о) глицерин, 20 мМ имидазол, 5 мкм пепстатина, полный коктейль ингибиторов протеаз (1 ЭДТА без tablet/50mL), и 2 мМ β-меркаптоэтанол).
- Lyse клеток с французской прессе (Emulsiflex) гомогенизатор который использует теплообменник погруженный в ледяной воде. Перед использованием убедитесь, что все клеточные скопления были растворяются. После уравновешивания гомогенизатор с лизис буфера, два проходит через цилиндр с давлением 15,000-18,000 фунтов на квадратный дюйм достаточно для полного лизиса. Если французская пресса не доступен, инкубации с лизоцимом следует с помощью ультразвука можно использовать (см. обсуждение). Сохранить маленький образец лизированных клеток для SDS-PAGE анализа (1 мкл) (лизат на рис. 2).
- Удалить ячейки мусора путем центрифугирования при 16000 оборотов в минуту для 20 минут при 4 ° С (мы используем Sorvall RC5C + centifuge). Сохраните супернатант для следующего шага и сохранить небольшой выборке (1 мкл) супернатанта для SDS-PAGE анализа (Ni нагрузки на рис. 2).
3. Очистка Hsp104
- Смешайте супернатант с шага 2.4 с 12 мл (2 мл Ni-сефарозой бисером на 1л клеток) в размере 50% суспензии лизирующего буфера уравновешенной Ni-сефарозой шариков (GE).
- Поворот образца медленно в течение 3 часов при температуре 4 ° С, что Ni-сефарозой остается равномерно приостановлено и вспенивания сведена к минимуму. Сокращение времени инкубации возможны, но снизится урожайность. При 4 ° С в присутствии ингибиторов протеазы, мало деградации происходит, и 3 часа Ni-сефарозой время инкубации не уменьшается активность конечного продукта. Сбор Ni-сефарозой центрифугированием в течение 2 мин при 4 ° С при 2000 оборотов в минуту (Eppendorf 5810R центрифуги). Сохранить маленький образец супернатанта для SDS-PAGE анализа (1 мкл) и отбросить остальное (Ni Проточный (FT) на рис. 2).
- Вымойте получить Ni-Sepharose с 25 колонке объемы промывочного буфера (40 мм HEPES-КОН рН 7,4, 150 мМ KCl, 20 мМ MgCl 2, 2,5% (м / о) глицерин, 20 мМ имидазол, 2 мМ β-меркаптоэтанол), 5 столбцов объемы промывочного буфера 1 М KCl, чтобы удалить загрязнения связана с электростатическим Hsp104 и 25 колонки объемы промывочный буфер. Сбор Ni-сефарозой после каждого мытья центрифугированием в течение 2 мин при 4 ° С при 2000 оборотов в минуту (Eppendorf 5810R центрифуги). После каждого цикла стирки и центрифугирования, удалите буфер аспирации.
- Для элюирования Hsp104, смешать Ni-Sepharose с 1 мл элюирующего буфера (40 мм HEPES-КОН рН 7,4, 150 мМ KCl, 20 мМ MgCl 2, 2,5% (м / о) глицерина, 350 имидазол, 2 мМ β-меркаптоэтанол) в 1 мл Ni-сефарозой и вращаться при 4 ° С в течение 20 минут. Высокая концентрация имидазола нарушает Ni бисером Его 6 взаимодействия. Удалить Ni-Sepharose с пустыми 1,2 мл спина столбцов (Bio-Rad) центрифугированием в течение 2 мин при 4 ° С при 2000 оборотов в минуту (Eppendorf 5810R центрифуги). Сохранить 1 мкл элюата для SDS-PAGE анализа (Ni элюата на рис. 2). На каждый литр клетки, ~ 15мг Hsp104 получается на этот шаг.
- Буфер обмена элюат в буфер Q (20 мМ Трис-HCl, рН 8, 0,5 мм, ЭДТА, 5 мМ MgCl 2, 50 мМ NaCl) с использованием MWCO 30000 Amicon Ultra (Миляlipore) 15мл центробежные единиц концентратора. Во-первых, протеиновый концентрат до ~ 1,5 мл затем добавить 14.5mL буфера для разбавления Q белка в 10 раз. Повторите 3 раза за буфером обмена. Увеличилась рН и низким содержанием соли гарантирует, что Hsp104 имеет высокий отрицательный заряд.
- Purify Hsp104 через анионообменной хроматографии с использованием буфера Q уравновешенной ресурсов Q 6 мл колонки (GE). Перед инъекцией, белка фильтруется через низкое связывание с белками Millex GP PES Мембранные 0.22μM шприц фильтром (Millipore). У нас работают расход 1mL/min. Смыть слабо связывающие белки с 1 колонка объемом 20% буфера Q + (20 мМ Трис-HCl, рН 8, 0,5 мм, ЭДТА, 5 мМ MgCl 2, 1M NaCl). Элюировать Hsp104 линейным градиентом (20% -50% буфера Q +) в течение 5-ти томах колонку (рис. 3). Сбор 1мл фракции. Hsp104 и большинство вариантов обычно вымывается при температуре ~ 400 мм NaCl (31mS/cm). Сохранить образцы пик фракций (1 мкл) для SDS-PAGE анализа (рис. 3, вставка).
- Чтобы удалить его 6-теги, обмен белков использованием Amicon центробежного концентратора, как описано выше (см. п. 3.5) в расщеплении буфер (20 мМ HEPES-КОН рН 7,4, 140 мм KCl, 10 мМ MgCl и 2). Используйте proTEV протеазы (Promega) или AcTEV протеазы (Invitrogen) в соответствии с инструкциями производителя. Для Hsp104, мы обнаружили, что более высокие отношения TEV протеазы: Hsp104 которые требуются для полного расщепления. Мы используем соотношение 1 протеазы единицу в 12μg Hsp104. Расщепление следует проводить при температуре 30 ° С в течение 2-4 часов, после 16 часов инкубации при 4 ° C. Конечная концентрация Hsp104 должна быть в пределах 20-75 мкм мономера. Разрушающим все оставшиеся His6 с метками Hsp104 и ТРВ протеазы с Ni-сефарозой (GE), добавив Ni-сефарозой более на сумму Hsp104 в реакции расщепления (предположим, бисером может связать 15 мг белка на мл упакованы смолы). Удалить бусин с пустыми столбцами спина (Bio-Rad) путем центрифугирования на 2 мин при 2000 оборотов в минуту при температуре 4 ° C. Сбор образцов до и после расщепления (1 мкл) для SDS-PAGE анализа для обеспечения декольте, и удаление uncleaved белка (рис. 4).
- Биржи в размере исключения буфер (20 мМ HEPES-КОН рН 7,4, 140 мм KCl, 10 мМ MgCl 2, 0,1 мм ЭДТА, 1 мМ DTT) с использованием MWCO 30000 Amicon Ultra (Millipore), как описано в пункте 3.5.
- Далее очистить Hsp104 через гель-хроматографии. Используйте гель-буфера уравновешенной Superose 6 или Superdex 200 столбцов (оба из GE) (рис. 5). Перед инъекцией, белка фильтруется через низкое связывание с белками Millex GP PES Мембранные 0.22μM шприц фильтром (Millipore). За менее чем 10 мг белка, 10/300 размера столбцов (24mL) может быть использован и 0,5 мл фракции собираются. Для образцов больше, чем 10 мг, 12/60 размер столбца (120 мл) должен быть использован и 1 мл фракций собираются. Обратитесь к инструкции производителя для потока и объемы проб должен быть загружен. После очистки Hsp104 фракции объединенных, как показано на рис. 5 и сосредоточены в Amicon Центробежные единицы Концентратор (Millipore). Hsp104 хранится как описано ниже. Из-за потери материала при разделении Hsp104 продуктов деградации и загрязнения Конечный выход очищенного полнометражный Hsp104 составляет ~ 1-3 мг на литр, начиная культуры.
4. Hsp104 Disaggregase активность
- После очистки, это хорошая практика для оценки Hsp104 деятельности в разбивке анализа. Как правило, мы используем люциферазы анализа реактивации 2 (рис. 6). В данном анализе Hsp104 в сочетании с системой шаперона Hsp70 (Hsp70 и Hsp40) disaggregates карбамидо-денатурированного агрегатов люциферазы светляков 2. Растворимый люциферазы катализирует окисление люциферин к oxyluciferin, реакция, которая выпускает свет. Отслеживая люминесценции, относительная реактивации, и, следовательно, разукрупнение, люциферазы может быть определена. Hsp104 должны иметь возможность сотрудничать с синергетически Hsp70 совместно шаперона системы. Количество восстановленных свечения зависит от точного Hsp70: Hsp40 пару использованы. Мы регулярно используют Hsp72 и Hsp40 (Анализ образцов). Как минимум, активный Hsp104 должны производить 5-кратное увеличение в реактивации люциферазы по сравнению с реактивации по Hsp72: Hsp40 в одиночку (рис. 6). Hsp104 препараты, которые не достигли этого уровня активности, отбрасываются.
5. Hsp104 хранения
- Для кратковременного хранения, Hsp104 можно хранить при температуре 4 ° С в гель-буфера. Тем не менее, активность будет снижаться через 2-3 дней при температуре 4 ° С и резко через 1 неделю при температуре 4 ° C. Для разбивки анализов мы рекомендуем Hsp104 следует использовать как можно скорее после очистки. В идеале, Hsp104 следует использовать сразу для анализов амилоида дезагрегации.
- Если белок должен быть сохранен долгосрочный, Hsp104 обменивается на хранение буфер (20 мМ HEPES-КОН рН 7,4, 140 мм KCl, 10 мМ MgCl 2, 0,1 мм ЭДТА, 1 мМ DTT, 10% глицерина (м / о)). 100 мкл аликвоты являются оснастки замораживали в жидком азоте и хранили при температуре -80 ° C. Циклов замораживания-оттаивания существенно сократить Hsp104 деятельностии его следует избегать. Мы рекомендуем медленно оттаивания Hsp104 на льду. Амилоид-disaggregase деятельность будет резко снижаться после 1 месяца при температуре -80 ° C.
6. Представитель Результаты и рисунков:
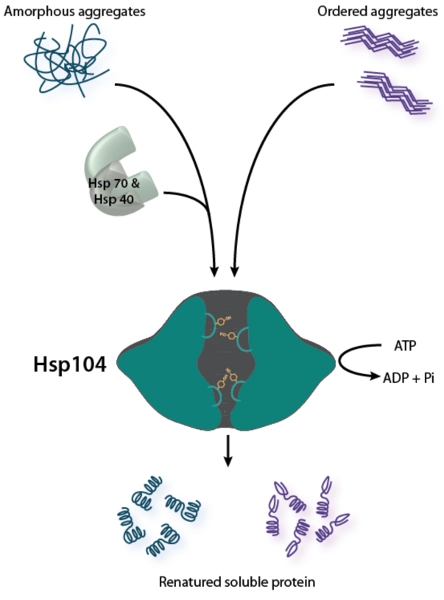
Рисунок 1. Hsp104 является Бифункциональные disaggregase. Разукрупнение неупорядоченных агрегатов (показана слева) требует сотрудничества Hsp70 системы шаперонов (Hsp70 и Hsp40) 2. Hsp104 реконструирует приказал амилоидных агрегатов (показано справа) без помощи Hsp70 и Hsp40 в пробирке, но Hsp70 и Hsp40 может улучшить Hsp104 активностью против амилоида 26,28. Для обоих типов агрегированных структур, Hsp104 пары гидролиз АТФ к подложке транслокации через центральный канал для содействия дезагрегации. Тирозин несущие петли поры привлечь и трансфер подложку через центральный канал 49-52.

Рисунок 2. SDS-PAGE анализа Ni-сефарозе стадии очистки близости. Лизат, Ni нагрузки, Ni FT и образцов Ni элюата фракционировали SDS-страницы с помощью 4-20% Трис-HCl 1,0 Критерий гель (Bio-Rad) и окрашивали Кумасси . Обратите внимание, что не все Hsp104 способен связываться с Ni-сефарозе. Широкий диапазон маркеров молекулярной массы (Bio-Rad), указано (левая полоса).
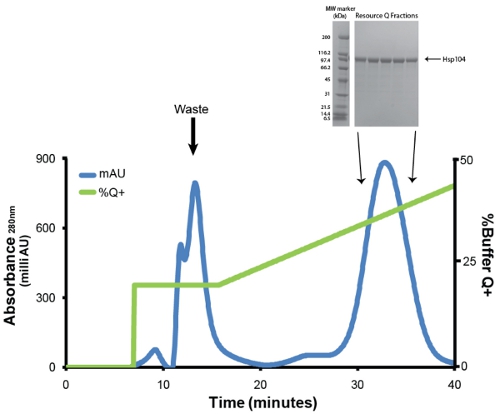
Рисунок 3. Ресурс Q очистки Ni-сефарозе элюата. Синий след представляет оптическую плотность при 280 нм и зеленый след представляет% буфера Q + (максимум на 50%). Первый пик, который элюируется при 20% Q + содержит примесей, продуктов распада и неправильно сложенными Hsp104. Второй и основной пик содержит правильно сложенным и активным Hsp104. Скорость потока была 1ml/min. Градиент с 20-50% Q + на 30 минут или 5-ти томах колонке. Врезка: пик фракций решаются SDS-PAGE анализа с использованием 4-20% Трис-HCl 1,0 Критерий гель (Bio-Rad) и окрашивали Кумасси. Широкий диапазон маркеров молекулярной массы (Bio-Rad) показаны (слева).

Рисунок 4. SDS-PAGE анализа proTEV шаг расщепления протеазы. Его 6-Hsp104 от очистки ресурсов Q обрабатывали proTEV протеазы в течение 4 часов при температуре 30 ° С, а затем 16 часов при 4 ° C. Образцы фракционировали SDS-страницы с помощью 4-20% Трис-HCl 1,0 Критерий гель (Bio-Rad) и окрашивали Кумасси. Обратите внимание, что proTEV расщепляется Hsp104 мигрирует быстрее. TEV протеазы и uncleaved Hsp104 исчерпаны с Ni-сефарозой, как описано в шаге 3.7. Широкий диапазон маркеров молекулярной массы (Bio-Rad) показаны (слева).
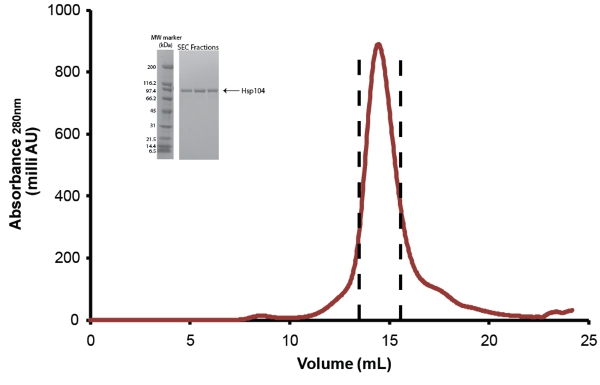
Рисунок 5. Размер-исключения очистки Hsp104. Расколотая Hsp104 очищали с помощью Superose 6 гель-фильтрации столбца (10/300, GE). Расход воздуха = 0.4ml/min. Пик между пунктирными линиями представляет объединенные фракции. Врезка: пик фракций решаются SDS-PAGE анализа с использованием 4-20% Трис-HCl 1,0 Критерий гель (Bio-Rad) и окрашивали Кумасси. Широкий диапазон маркеров молекулярной массы (Bio-Rad) показаны (слева).
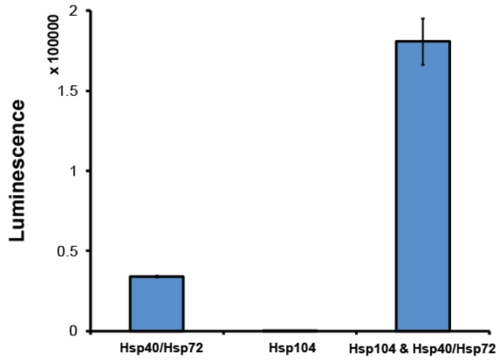
Рисунок 6. Люциферазы анализа реактивации. Денатурированный люциферазы светляков агрегаты (50 нм) инкубировали либо с Hsp72 и Hsp40 (1 мкм) (оба из пробирной образцы), Hsp104 (6 мкм мономера) или Hsp104, Hsp72 и Hsp40 на 90 мин при 25 ° C. Денатурированный люциферазы только полностью возобновлено в присутствии обоих Hsp104 и Hsp40/Hsp72. Восстановленные свечения измеряется на бесконечные M1000 ридер (Tecan). Значения представляют собой средние значения ± SEM (п = 3).
Обсуждение
Сроки: для максимальной активности Hsp104 мы рекомендуем, чтобы вся схема очистки быть завершены как можно быстрее. Тем не менее, число стадий очистки позволяет напряженный график, что не всегда может быть практичным. Если стадий очистки осуществляется в кратчайшие сроки, время от око?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была поддержана грантом NIH (5T32GM008275-22) и Американской ассоциации сердца predoctoral стипендий (на EAS); химия-биология интерфейс стипендий из NIH (2T32GM071339-06A1) (МЭР), а также гранты NIH (1DP2OD002177-01 и NS067354-0110), Эллисон Медицинский фонд и Фонд Билла и Мелинды Гейтс (на JS).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | |
|---|---|---|---|
| BL21-CodonPlus-RIL компетентных клеток | Stratagene, Agilent Technologies | 230255 | |
| 2XYT бульон | USB | 75864 | |
| Полная, мини, ЭДТА без таблетки ингибитор протеазы | Roche | 1836170 | |
| Пепстатина | Сигма | P4265 | |
| Ni-Sepharose 6 Fast Flow | GE Healthcare | 17-5318-02 | |
| Amicon Ультра-15 центробежный фильтр единиц (MWCO 30000) | Millipore | UFC903008 | |
| Ресурс Q - 6 мл колонке | GE Healthcare | 17-1179-01 | |
| proTEV протеазы | Promega | V6052 | |
| AcTEV протеазы | Invitrogen | 12575015 | |
| Superose 6 10/300 GL | GE Healthcare | 17-5172-01 | |
| Hsp40 | Анализ образцов | SPP-400 | |
| Hsp72 | Анализ образцов | ADI-NSP-555 |
Ссылки
- Erzberger, J. P., Berger, J. M. Evolutionary relationships and structural mechanisms of AAA+ proteins. Annu Rev Biophys Biomol Struct. 35, 93-114 (2006).
- Glover, J. R., Lindquist, S. Hsp104, Hsp70, and Hsp40: A Novel Chaperone System that Rescues Previously Aggregated Proteins. Cell. 94, 73-82 (1998).
- Parsell, D. A., Kowal, A. S., Singer, M. A., Lindquist, S. Protein disaggregation mediated by heat-shock protein Hsp104. Nature. 372, 475-478 (1994).
- Vashist, S., Cushman, M., Shorter, J. Applying Hsp104 to protein-misfolding disorders. Biochem Cell Biol. 88, 1-13 (2010).
- Parsell, D. A., Sanchez, Y., Stitzel, J. D., Lindquist, S. Hsp104 is a highly conserved protein with two essential nucleotide-binding sites. Nature. 353, 270-273 (1991).
- Doyle, S. M., Wickner, S. Hsp104 and ClpB: protein disaggregating machines. Trends Biochem Sci. 34, 40-48 (2009).
- Shorter, J. Hsp104: a weapon to combat diverse neurodegenerative disorders. Neurosignals. 16, 63-74 (2008).
- Glover, J. R., Lum, R. Remodeling of protein aggregates by Hsp104. Protein Pept Lett. 16, 587-597 (2009).
- Mogk, A., Haslberger, T., Tessarz, P., Bukau, B. Common and specific mechanisms of AAA+ proteins involved in protein quality control. Biochem Soc Trans. 36, 120-125 (2008).
- Grimminger-Marquardt, V., Lashuel, H. A. Structure and function of the molecular chaperone Hsp104 from yeast. Biopolymers. 93, 252-276 (2010).
- Sanchez, Y., Lindquist, S. L. HSP104 required for induced thermotolerance. Science. 248, 1112-1115 (1990).
- Sanchez, Y., Taulien, J., Borkovich, K. A., Lindquist, S. Hsp104 is required for tolerance to many forms of stress. Embo J. 11, 2357-2364 (1992).
- Alberti, S., Halfmann, R., King, O., Kapila, A., Lindquist, S. A systematic survey identifies prions and illuminates sequence features of prionogenic proteins. Cell. 137, 146-158 (2009).
- Halfmann, R., Alberti, S., Lindquist, S. Prions, protein homeostasis, and phenotypic diversity. Trends Cell Biol. 20, 125-1233 (2010).
- Shorter, J., Lindquist, S. Prions as adaptive conduits of memory and inheritance. Nat Rev Genet. 6, 435-450 (2005).
- True, H. L., Berlin, I., Lindquist, S. L. Epigenetic regulation of translation reveals hidden genetic variation to produce complex traits. Nature. 431, 184-187 (2004).
- True, H. L., Lindquist, S. L. A yeast prion provides a mechanism for genetic variation and phenotypic diversity. Nature. 407, 477-483 (2000).
- Tyedmers, J., Madariaga, M. L., Lindquist, S. Prion switching in response to environmental stress. PLoS Biol. 6, e294-e294 (2008).
- Chernoff, Y. O., Lindquist, S. L., Ono, B., Inge-Vechtomov, S. G., Liebman, S. W. Role of the chaperone protein Hsp104 in propagation of the yeast prion-like factor [psi+]. Science. 268, 880-884 (1995).
- Halfmann, R., Lindquist, S. Epigenetics in the extreme: prions and the inheritance of environmentally acquired traits. Science. 330, 629-632 (2010).
- Satpute-Krishnan, P., Langseth, S. X., Serio, T. R. Hsp104-dependent remodeling of prion complexes mediates protein-only inheritance. PLoS Biol. 5, e24-e24 (2007).
- Sweeny, E. A., Shorter, J. Prion proteostasis: Hsp104 meets its supporting cast. Prion. 2, 135-140 (2008).
- Lo Bianco, C. Hsp104 antagonizes alpha-synuclein aggregation and reduces dopaminergic degeneration in a rat model of Parkinson disease. J Clin Invest. 118, 3087-3097 (2008).
- Narayanan, S., Walter, S., Reif, B. Yeast prion-protein, sup35, fibril formation proceeds by addition and substraction of oligomers. Chembiochem. 7, 757-765 (2006).
- Savistchenko, J., Krzewska, J., Fay, N., Melki, R. Molecular chaperones and the assembly of the prion Ure2p in vitro. J Biol Chem. 283, 15732-15739 (2008).
- Shorter, J., Lindquist, S. Hsp104 catalyzes formation and elimination of self-replicating Sup35 prion conformers. Science. 304, 1793-1797 (2004).
- Shorter, J., Lindquist, S. Destruction or potentiation of different prions catalyzed by similar Hsp104 remodeling activities. Mol Cell. 23, 425-438 (2006).
- Shorter, J., Lindquist, S. Hsp104, Hsp70 and Hsp40 interplay regulates formation, growth and elimination of Sup35 prions. Embo J. 27, 2712-2724 (2008).
- Doyle, S. M. Asymmetric deceleration of ClpB or Hsp104 ATPase activity unleashes protein-remodeling activity. Nat Struct Mol Biol. 14, 114-122 (2007).
- Wendler, P. Atypical AAA+ subunit packing creates an expanded cavity for disaggregation by the protein-remodeling factor Hsp104. Cell. 131, 1366-1377 (2007).
- Hinault, M. P. Stable alpha-synuclein oligomers strongly inhibit chaperone activity of the Hsp70 system by weak interactions with J-domain co-chaperones. J Biol Chem. 285, 38173-38182 (2010).
- Tipton, K. A., Verges, K. J., Weissman, J. S. In vivo monitoring of the prion replication cycle reveals a critical role for Sis1 in delivering substrates to Hsp104. Mol Cell. 32, 584-591 (2008).
- Bieschke, J., Cohen, E., Murray, A., Dillin, A., Kelly, J. W. A kinetic assessment of the C. elegans amyloid disaggregation activity enables uncoupling of disassembly and proteolysis. Protein Sci1. 8, 2231-2241 (2009).
- Cohen, E., Bieschke, J., Perciavalle, R. M., Kelly, J. W., Dillin, A. Opposing activities protect against age-onset proteotoxicity. Science. 313, 1604-1610 (2006).
- Cohen, E. Reduced IGF-1 signaling delays age-associated proteotoxicity in mice. Cell. 139, 1157-1169 (2009).
- Cushman, M., Johnson, B. S., King, O. D., Gitler, A. D., Shorter, J. Prion-like disorders: blurring the divide between transmissibility and infectivity. J Cell Sci. 23, 1191-11201 (2010).
- Carmichael, J. Bacterial and yeast chaperones reduce both aggregate formation and cell death in mammalian cell models of Huntington's disease. Proc Natl Acad Sci. 97, 9701-9705 (2000).
- Vacher, C., Garcia-Oroz, L., Rubinsztein, D. C. Overexpression of yeast hsp104 reduces polyglutamine aggregation and prolongs survival of a transgenic mouse model of Huntington's disease. Hum Mol Genet. 14, 3425-3433 (2005).
- Liu, Y. H. Heat Shock Protein 104 Inhibited the Fibrillization of Prion Peptide 106-126 and Disassembled Prion peptide 106-126 Fibrils in vitro. Int J Biochem Cell Biol. , (2011).
- Wendler, P., Saibil, H. R. Cryo electron microscopy structures of Hsp100 proteins: crowbars in or out. Biochem Cell Biol. 88, 89-96 (2010).
- Wendler, P. Motor mechanism for protein threading through Hsp104. Mol Cell. 34, 81-92 (2009).
- Lee, S., Sielaff, B., Lee, J., Tsai, F. T. CryoEM structure of Hsp104 and its mechanistic implication for protein disaggregation. Proc Natl Acad Sci. 107, 8135-8140 (2010).
- Parsell, D. A., Kowal, A. S., Lindquist, S. Saccharomyces cerevisiae Hsp104 protein. Purification and characterization of ATP-induced structural changes. J Biol Chem. 269, 4480-4487 (1994).
- Schirmer, E. C., Queitsch, C., Kowal, A. S., Parsell, D. A., Lindquist, S. The ATPase activity of Hsp104, effects of environmental conditions and mutations. J Biol Chem. 273, 15546-15552 (1998).
- Schirmer, E. C., Ware, D. M., Queitsch, C., Kowal, A. S., Lindquist, S. L. Subunit interactions influence the biochemical and biological properties of Hsp104. Proc Natl Acad Sci. 98, 914-919 (2001).
- Hattendorf, D. A., Lindquist, S. L. Cooperative kinetics of both Hsp104 ATPase domains and interdomain communication revealed by AAA sensor-1 mutants. EMBO J. 21, 12-21 (2002).
- Schirmer, E. C., Lindquist, S. Purification and properties of Hsp104 from yeast. Methods Enzymol. 290, 430-444 (1998).
- Hattendorf, D. A., Lindquist, S. L. Analysis of the AAA sensor-2 motif in the C-terminal ATPase domain of Hsp104 with a site-specific fluorescent probe of nucleotide binding. Proc Natl Acad Sci. 99, 2732-2737 (2002).
- Lum, R., Niggemann, M., Glover, J. R. Peptide and protein binding in the axial channel of Hsp104. Insights into the mechanism of protein unfolding. J Biol Chem. 283, 30139-30150 (2008).
- Lum, R., Tkach, J. M., Vierling, E., Glover, J. R. Evidence for an unfolding/threading mechanism for protein disaggregation by Saccharomyces cerevisiae Hsp104. J Biol Chem. 279, 29139-29146 (2004).
- Tessarz, P., Mogk, A., Bukau, B. Substrate threading through the central pore of the Hsp104 chaperone as a common mechanism for protein disaggregation and prion propagation. Mol Microbiol. 68, 87-97 (2008).
- Weibezahn, J. Thermotolerance requires refolding of aggregated proteins by substrate translocation through the central pore of ClpB. Cell. 119, 653-665 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены