Method Article
تغليف الخلايا العضلية في هيدروجيل الفايبرين للهندسة الأنسجة القلبية
In This Article
Summary
نحن تصف عزلة العضلية الولدان وإعداد الخلايا للتغليف في بنيات هيدروجيل الليفين للهندسة الأنسجة. نحن تصف طرق لتحليل الأنسجة المهندسة عضلة القلب بعد فترة الثقافة بما في ذلك إنشاء قوة فاعلة على التحفيز الكهربائي وبقاء الخلية ، وتلطيخ immunohistological.
Abstract
زراعة الخلايا في بيئة ثلاثية الأبعاد هيدروجيل هي تقنية هامة لتطوير بنيات للهندسة الأنسجة ، وكذلك دراسة الاستجابات الخلوية في ظل ظروف مختلفة الثقافة في المختبر. بيئة ثلاثية الأبعاد بشكل وثيق ما يحاكي مراقبة الخلايا في الجسم الحي نتيجة لتطبيق من المحفزات الميكانيكية والكيميائية في جميع أبعاد 1. يمكن إما ثلاثي الأبعاد الهلاميات المائية أن تكون مصنوعة من البوليمرات الاصطناعية مثل PEG - DA 2 و 3 PLGA أو عدد من البروتينات التي تحدث بشكل طبيعي مثل الكولاجين 4 ، 5 أو حمض الهيالورونيك الليفين 6،7. يمكن الهلاميات المائية التي تم إنشاؤها من الليفين ، وهو بروتين في الدم طبيعيا تخثر الدم ، تتبلمر لتشكيل شبكة الذي هو جزء من شفاء الجروح في الجسم الطبيعية العمليات 8. الليفين هو خلية للتحلل ذاتي ويحتمل 9 ، مما يجعلها مثالية سقالة مؤقتة للهندسة الأنسجة.
نحن هنا تصف بالتفصيل عزلة العضلية الولدان من الصغار لمدة ثلاثة أيام الجرذ القديمة وإعداد الخلايا للتغليف في بنيات هيدروجيل الليفين للهندسة الأنسجة. myocytes حديثي الولادة هي مصدر الخلايا الشائعة المستخدمة في الدراسات المختبرية لفي تكوين أنسجة القلب والهندسة 4. يتم إنشاء الليفين هلام بواسطة الفيبرينوجين الاختلاط مع ثرومبين الانزيم. ثرومبين يشق fibrinopeptides فرانس برس وFPB من الفيبرينوجين ، وكشف عن مواقع الربط التي تتفاعل مع غيرها من مونومرات 10. هذه التفاعلات تؤدي إلى أحادية في الألياف التي تشكل شبكة هيدروجيل الذاتي التجمع. لأنه لا يمكن ضبط توقيت هذا التفاعل الأنزيمي عن طريق تغيير نسبة ثرومبين إلى الفيبرينوجين ، أو نسبة الكالسيوم إلى ثرومبين ، يمكن للمرء أن يبني حقن القالب مع عدد من الأشكال الهندسية المختلفة 11،12. فإننا قادرون على توليد مزيد من التوافق بين أنسجة الناجم عن الكيفية التي تحد من خلال ثقافة هلام 13.
بعد زراعة الأنسجة والهندسة يبني القلب لمدة أسبوعين في ظل ظروف ثابتة ، بدأت خلايا القلب لاعادة تشكيل وبناء ويمكن أن تولد قوة الانكماش في ظل ظروف سرعة الكهربائية 6. كجزء من هذا البروتوكول ، ونحن أيضا وصف أساليب لتحليل الأنسجة المهندسة عضلة القلب بعد فترة الثقافة بما في ذلك التحليل الوظيفي للقوة النشطة الناتجة عن عضلة القلب بناء على التحفيز الكهربائي ، فضلا عن أساليب لتحديد الجدوى النهائية الخلية (مباشر الميت مقايسة) ، وتلطيخ immunohistological لدراسة مورفولوجية والتعبير النموذجي البروتينات هامة للانكماش (الميوسين السلسلة الثقيلة أو MHC) واقتران الخلوية (43 أو Connexin Cx43) بين myocytes.
Protocol
1. cardiomyocyte العزلة الولدان -- إعداد (قبل يوم)
الحلول التي تم إنشاؤها في هذا القسم : PBS - الجلوكوز الحل ، ووقف وسائل الإعلام.
- يعد حل PBS - الجلوكوز عن طريق إضافة 5 مل البنسلين ستربتوميسين (100 وحدة / مل و 100 ميكروغرام / مل على التوالي) و1،98 غرام من السكر الى 250 مل العقيمة 1X الفوسفات مخزنة المالحة (PBS) ، ويصل حجم 500 مل حل مع إضافية 1X PBS العقيمة.
- إعداد توقف وسائل الاعلام من خلال إضافة 25 مل FBS و 5 مل من البنسلين الستربتوميسين (تركيز نفس النحو الوارد أعلاه) إلى متوسط 250ml العقيمة Dulbecco في التعديل النسر (DMEM) وجلب وحدة التخزين إلى 500 مل مع DMEM معقمة قبل تصفية معقمة من خلال مرشح ميكرون 0.2.
- تعقيم الأدوات الجراحية اللازمة للعزل من قبل التعقيم : أ مرقئ ، # 5 ملقط ، مقص كبير ، المقص الصغير ، والتعامل مع مشرط (# 4).
2. cardiomyocyte العزلة الولدان -- إعداد (يوم الحصاد)
تأكد من الحفاظ على عقم
الحلول المستخدمة في هذا المقطع : PBS - الجلوكوز الحل ، Betadine
- لكل القمامة ، واتخاذ اثنين العقيمة أطباق بتري 100 ملم ، ووضعها في غطاء المحرك وملء مع 10 مل من الجليد ~ الباردة PBS - الجلوكوز. ثم ينبغي أن توضع هذه في دلو الجليد مملوءة الجليد في غطاء الثقافة العقيمة.
- مكان دورق سعة 250 مل مع 30-40 مل من Betadine في غطاء محرك السيارة.
- إضافة 50 مل / لتر من برنامج تلفزيوني ، الجلوكوز إلى ختم ، وزجاجة والمكان الى حمام الماء ° 37 مئوية.
- لكل شخص ، ضع مقاعد البدلاء ماصة underpad على غطاء سطح العمل ووضع على رأس ثنى العقيمة والحرص على عدم لمس منطقة عمل المركز من ثنى العقيمة. تفريغ الأدوات الجراحية و4 × 4 على شاش معقم وثنى دون لمس الصكوك. فتح شفرة معقمة # 20 مشرط وثنى على تفريغ ، ويجري مرة أخرى الحرص على عدم لمس مع قفازات غير معقمة.
- اتخاذ الجراء من السد والمكان في حاوية غامضة ومبهمة ، في مكان الجراء هود
- وضعت على قفازات معقمة
- طي الشاش إلى أرباع ، المشبك مع مرقئ ومكان في دورق Betadine.
- وضع شفرة المشرط على مقبض مشرط وتوضع جانبا.
3. cardiomyocyte العزلة الولدان -- تشريح القلب
الحلول المستخدمة في هذا المقطع : Betadine ، برنامج تلفزيوني ، الجلوكوز الحل
- التقط الجرو في يد غير المهيمنة الخاص بك عن طريق الجلد بين عظام الكتف معسر بين الإبهام والسبابة. باستخدام مقص كبير ، بقطع رأس الجرو في واحد قطع. يجب التأكد من قطع من الجزء الخلفي من المهاجمين الجرو ، لضمان أن قطعت تماما في العمود الفقري.
- مسحة من الجرو في صدره مع الشاش betadine غارقة. تأمين الجرو بواسطة معسر لوحي الكتف معا. أداء بضع الصدر الجزئي لفضح القلب. زيادة الضغوط التي مورست ، وبالتالي إجبار قلب الماضي الأضلاع لتشريح scalpular.
- تشغيل شفرة مشرط وراء القلب الى قطع الأوعية الدموية الكبرى وإزالة القلب. مكان القلب في طبق بتري تحتوي على السكر في برنامج تلفزيوني ، موجود على الجليد.
- كرر الخطوات 1-3 لكل الجرو في القمامة.
4. cardiomyocyte العزلة الولدان -- العزلة العضلية
إنشاء حلول / المستخدمة في هذا المقطع : PBS - الجلوكوز الحل حل كولاجيناز ، ووقف حل
- مرة واحدة وقد تم عزل قلوب ، وإزالة أي بقايا الدم والنسيج الضام من قبل الشطف في الجليد الباردة حل الجلوكوز PBS ، إزالة رأس 1 / 3 من القلب إلى عزل فقط النسيج البطين ومكان في طبق بتري جديدة من البرد والجليد PBS الجلوكوز ، أعدت في وقت سابق.
- فرم بعناية في قلوب ملم مكعب 1 ~ باستخدام مقص وملقط الصغرى و.
- اتخاذ ماصة نقل معقمة ، وقطع رأس باستخدام المقص بحيث فم ماصة هو ~ 3 ملم في القطر. استخدم ماصة لنقل قطع نسيج وجميع من الحل الى 50 مل المخروطية ومكان على الجليد.
- تزن من 15000 وحدة في القمامة من الجراء من النوع الثاني كولاجيناز (وحدات / ملغ يعتمد على الكثير) ومكان في زجاجة من 37 درجة مئوية حرارة PBS الغلوكوز أعدت مسبقا لخلق حل كولاجيناز. تصفية المزيج جيدا ومعقمة في زجاجة منفصلة. المكان مرة أخرى في حمام ماء C ° 37. وضع الحل في وقف حمام الماء ° 37 C كذلك.
- السماح للنسيج مفروم لتستقر في الجزء السفلي من أنبوب الطرد المركزي. إزالة طاف حتى الحجم الكلي هو 10 مل ~. إضافة 7 مل من محلول كولاجيناز إلى أنبوب الطرد المركزي.
- وضع أنبوب مخروطي مع قطعة من النسيج وكولاجيناز إلى رف أنبوب على شاكر المداري داخل الحاضنة 37 درجة مئوية أو الفرن. تحويل شاكر المداري على حوالي 60 دورة في الدقيقة وأغلق الباب. تعيين مؤقت لمدة 7 دقائق. تأكد من وضع البكالوريا كولاجينازك في حمام مائي لإبقائه دافئا.
- عندما يذهب الموقت ، ليصبح مرة أخرى المخروطية في غطاء محرك السيارة. تجلب أيضا كولاجيناز الدافئة والتوقف عن حل في غطاء محرك السيارة. عاير برفق قطعة نسيج 5-7 مرات لتفريقهم. بعد المعايرة ، والسماح القطع لتستقر في القاع (2-3 دقائق). نضح الخروج بأكبر قدر من طاف ممكن يجري حريصا جدا على ألا تمتص قطعة النسيج. بعد ذلك ، إضافة 7 مل من محلول كولاجيناز إلى قطعة النسيج والمكان مرة أخرى في حاضنة على شاكر لمدة 7 دقائق.
- لكل خطوة المتبقية ، يعاير بلطف 10 مرات لتفريق قطع الأنسجة. مرة واحدة في قطعة نسيج تسوية واستخلاص طاف قبالة وأنه جمع في 50 مل منفصلة المخروطية. إضافة 7 مل من كولاجيناز إلى قطع الأنسجة وهضم مرة أخرى لمدة 7 دقائق. إلى أنبوب طاف ، إضافة 10 مل من محلول مع وقف ماصة a المصلية مختلفة بعد كل إضافة من طاف من عملية الهضم.
- تكرار حتى يتم استخدام كافة كولاجيناز (7 خطوات في المجموع).
- بعد الخطوة النهائية الهضم ، واتخاذ المخروطية مع حل وتصفية خلية خلية من خلال غربال 70μm إلى المخروطية الطازجة.
- تدور الخلايا في أسفل 100G لمدة 5 دقائق وresuspend في 20 مل من DMEM لتحسب باستخدام عدادة الكريات ، ومكان الخلايا على الجليد.
- مزيج 50 ميكرولتر مكان الخلايا في حل التريبان الأزرق (75 ميكرولتر التريبان الأزرق ، 125 PBS ميكرولتر) ، وقبل وضع 10 ميكرولتر في عدادة الكريات لفرزها. الخلايا الحية واضحة في حين أن الخلايا الميتة زرقاوان. تتوقع ما يقرب من 3 ملايين الخلايا في الفئران الجرو ، مع بقاء ما يقرب من 80-90 ٪.
5. يبني صب جل الليفين -- التحضير لإنشاء الليفين المواد الهلامية (أحسنت مقدما)
الحلول التي تم إنشاؤها في هذا القسم : الفيبرينوجين حل المخزون ، المخزون ثرومبين الحل ، Pluronics الحل ، وسائل الإعلام بناء عضلة القلب.
- مخزنة إعداد محلول المخزون 33 ملغ / مل من الفيبرينوجين في 20 ملي HEPES عازلة في 0.9 ٪ المالحة بواسطة الفيبرينوجين خلط ببطء في HEPES المالحة أكثر من عدة ساعات إلى 37 درجة مئوية. يسمح الحل لتسوية بين عشية وضحاها في 2-8 درجة مئوية. الحارة الحل إلى 37 درجة مئوية. الحل هو العقيمة التي تمت تصفيتها من خلال سلسلة من الفلاتر على التوالي : 40 ميكرومتر مصافى الخلية ، 0.45 ميكرون مرشحات أعلى زجاجة مع مرشحات قبل الزجاج ، و 0.2 ميكرومتر زجاجة مرشحات الأعلى مع مرشحات قبل الزجاج. الحل هو aliquoted على 1 و 3 مل مل aliquots وتخزينها على -20 درجة مئوية.
- يعد حل سهم يو 25 / مل من ثرومبين بإضافة 500 من U ثرومبين إلى 18 مليلتر من المياه المالحة 0.9 ٪ و 2 مل من الماء منزوع الأيونات عقيمة ، من خلال تصفية العقيمة قسامة ، و 0.2 ميكرومتر في تصفية 500 و 250 ميكرولتر aliquots ميكرولتر وتجميد في -80 درجة مئوية.
- يعد 5 ٪ ث / ت Pluronics F - 127 الحل ، عن طريق تذويب 50 غراما من طراز F - Pluronics 127-700 مل من الماء منزوع الأيونات. يصل حجم ما يصل الى حل مع الماء منزوع الأيونات 1L إضافية. العقيمة مع فلتر تصفية ميكرومتر 0.2. ويمكن استخدام الحل Pluronics تصل إلى ثلاث مرات قبل استبدال عقيمة إذا تمت تصفيتها بعد كل استخدام.
- تعد وسائل الإعلام بناء عضلة القلب من خلال إضافة 10 ٪ مصل الحصان ، 2 ٪ مصل بقري جنيني ، 1 ٪ البنسلين الستربتوميسين ، و 6 ملغ / مل حامض الى أمينوكابرويك DMEM. 50 ميكروغرام / مل من حامض الاسكوربيك و 2 ميكروغرام / مل من الأنسولين في 25 ميكرومتر HEPES حاجة إلى أن تضاف مباشرة قبل التغذية.
- مغزل التجمع من خلال وضع معا one تفلون قضيب واحد تفلون الأكمام ، واثنين من غسالات تفلون مع الشق إزالة لأغراض الحقن ، واثنين من المطاط O - الخواتم (انظر الشكل 2A). الأوتوكلاف قبل الاستخدام.
- تأخذ أغلفة المحاقن 6cc للجزء الخارجي من العفن وأغلفة المحاقن 3cc لاستخدامها الغطاسون ، وإعدادهم من خلال قطع نهايات luer القفل والتعقيم (انظر الشكل 2A).
6. يبني صب جل الليفين -- التحضير لإنشاء المواد الهلامية الليفين (الحق قبل اتخاذ يبني هلام الليفين)
الحلول المستخدمة في هذا القسم حل Pluronics
- معقمة تصفية Pluronics 5 ٪ F - 127 الحل مع 0.2 ميكرون التصفية قبل الاستخدام. مماسك مكان وأغلفة المحاقن في حل Pluronics 5 ٪ في دورق L 1 في غطاء محرك السيارة. ترك أجزاء تمرغ في حل Pluronics لمدة 2-3 ساعات في غطاء محرك السيارة لضمان طلاء كامل. الحل Pluronics المعاطف مماسك ويمنع من هلام الليفين التمسك مماسك.
- بعد حضانة 2-3 ساعة ، من أجل حل Pluronics 5 ٪ مرة أخرى في زجاجة ، والستائر مكان معقم لأسفل على سطح الغطاء وارتداء قفازات معقمة لبناء قوالب.
- وضع مماسك شيدت في أغلفة المحاقن 6 سم مكعب ، وذلك باستخدام حقنة 3cc باعتبارها المكبس لضمان وجود الختم محكم بين طوقية وغسالات التفلون.
7. صب جل الليفين يبني عبر حقن
الحلول التي تم إنشاؤها في هذا القسم حل F ، T حل ، حل الخلية.
- لجعل 1 مل من هلام الليفين (3.3 ملغ / مل تركيز الفيبرينوجين النهائي ، 25 U / مل تركيز ثرومبين النهائي) ، وخلق F حل في أنبوب مخروطي ، وذلك بإضافة 112 ميكروليتر من المخزون الفيبرينوجين إلى 558 ميكرولتر من عيار 20 ملم في مخزن HEPES محلول ملحي 0.9 ٪. في أنبوب مخروطي منفصل ، ايجاد حل T بإضافة 17 ميكرولتر من المخزون ثرومبين ، و 1.3 ميكرولتر من كا ن 2 + + الحل إلى 135 ميكرولتر من DMEM. انظر الجدول رقم 1.
- في أنبوب مخروطي الثالثة ، يعد حل الخلية عن طريق الدوران باستمرار الخلايا وإعادة التعليق الخلايا في حجم ذلك أن تركيز الخلية 29400000 خلية / مل أو 6 مرات تركيز التركيز النهائي المطلوب من الخلايا في بناء
- عندما كنت على استعداد للادلاء الجل الليفين بناء والإعدادية 1 مل حقنة بإبرة 1 ½ بوصة 18G طويلة. وقد إبرة 21G 1 بوصة على استعداد كذلك.
- يتم إنشاء حل الليفين في نسبة 04:01:01 حل F : حل T : حل الخلية. لجعل واحدة من مل هلام ، وإضافة 667 ميكرولتر من محلول F في أنبوب 50 مل نظيفة الطرد المركزي ، تليها 167 ميكرولتر من محلول الخلية ، وأخيرا إضافة 167 ميكرولتر من محلول تي. ماصة لخلط الحل معا والحرص على عدم إدخال الفقاعات. مرة واحدة مختلطة حلول ، بدأت ردود الفعل ، وينبغي أن يتم حقن يبني على الفور.
- أخذ حقنة معدة مسبقا مع الإبرة 18G ، ووضع حل الليفين. الحرص على عدم عكس الحقنة لمنع الفقاعات من الوقوع في الإبرة. استبدال الإبرة بإبرة 18G 21G. اضغط على حقنة برفق لطرد فقاعات الهواء.
- إدراج حقنة في القالب بين سدادة وغلاف التالية الأخدود في تفلون يا الدائري وحقن المحلول في العفن. إمالة العفن مع الأخدود على رأس لضمان تعبئة كاملة. إزالة المحاقن وتستمر لملء قوالب المتبقية. يمكن خلق ما يكفي لملء حل جل قوالب عدة في الوقت نفسه. ومع ذلك ، لأن الحل بسرعة المواد الهلامية ، فمن عادة فكرة جيدة للحد من عدد من يبني حقن في وقت معين إلى 6.
- التفاف في قوالب Parafilm في مجموعات من ثلاثة وضعها في حاضنة أو فرن عند 37 درجة مئوية السماح لاحتضان المواد الهلامية في القوالب لمدة 20 دقائق لإتاحة الوقت لهلام تتبلمر.
- ملء كل جرة الثقافة (Nalgene مباشرة من جانب الجرة) مع 21 مل من المتوسط بناء عضلة القلب لكل بناء. المحاقن المعقمة استخدام سم 3 الغلاف باعتباره المكبس لإجبار مغزل مع بناء في طبق بتري كبير مع DMEM. ثم ضع في جرة بناء العينة. يمكن لكل جرة 16 أوقية تعقد ما يصل إلى 6 يبني ، في حين أن كل جرة أوقية يمكن أن تعقد 4 2.
- المسمار القمم على الجرار ونقلها إلى الحاضنة. داخل الحاضنة ، تخفيف الأغطية الموجودة على الجرار للسماح لتبادل الغاز.
- بعد 24 ساعة ، واتخاذ بيك العقيمة الأسنان ودفع بناء بعيدا عن حلقات تفلون - O بيضاء على طرفي القالب الدائري لضمان التوافق الموحد للبناء (انظر الشكل 2 في نتائج ممثل).
8. تقنيات التحليل (بعد 2 أسابيع في الثقافة) -- تقلص اختبار القوة
الحلول المستخدمة في هذا المقطع : DMEM ، بناء عضلة القلب وسائل الإعلام.
- المشبك لقطات متحركة على الرصاص القادم من منشط للأسلاك كهربائية على في الحمام. السلطة حتى لوحة الحصول على البيانات ، ومولد النبض ، ومحول القوة. وينبغي تشغيل محول قوة إلى الإعداد وركزت 5G. فتح برنامج مخصص LABVIEW الذي يعرض ويحفظ البيانات من محول القوة. خلق جديد ، ملف نص فارغ في المجلد بيانات عن كل عينة.
- مكان DMEM إلى 37 درجة مئوية وحمام ماء إتاحة الوقت لها لالاحماء قبل اختبار يبني. تحسنت مرة واحدة ، ومكان DMEM 37 درجة مئوية في المتوسط حمام من قوة نظام القياس (انظر الشكل 3A).
- إزالة بناء جرة من العينة التي ينزلق بلطف بناء الحلبة من الدعم تفلون مع ملاقط ومكان بناء على آخر معدنية مثبتة في الحمام قياس قوة متوسطة النظام. لا قبضة بناء مع ملاقط! بدلا من ذلك ، استخدام ملاقط لدفع ورفع بناء الخروج من الدعم مغزل.
- مكان الطرف الآخر لبناء أكثر من ذراع وتشديد حتى محول محول يقرأ 0.50V ، (حوالي 1.0 جرام القوة أو 10 millinewtons التوتر)
- حدد ملف نصي للبيانات انكماش القوة التي سيتم تسجيلها في.
- على منشط القلب (النموذجي # S88X ، التكنولوجيات غراس) ، مجموعة من الجهد لنبض 20V (8 / V سم) ، ومدة 6ms ، وبمعدل 1 هرتز.
- بدء سرعة الكهربائية عن طريق الضغط على "الإخراج على / قبالة" الزر
- بدء التسجيل حتى يصبح الموجي العادية.
- إزالة بعناية من بناء الحمام قياس قوة متوسطة النظام ووضعه مرة أخرى إلى متوسطة الثقافة. ثم إزالة DMEM من حمام قياس قوة متوسطة النظام واستبداله DMEM ، طازجة الدافئة لتحليل additعينات IONAL.
- قطع بناء وانبسط بحيث يمكنك قياس الطول والعرض للبناء
- قطع بناء إلى أقسام لاستخدامها في تحليل قياسات إضافية بما في ذلك جدوى ، الأنسجة ، أو قياسات لطخة غربية.
9. تقنيات التحليل (بعد 2 أسابيع في الثقافة) -- لايف الميت الفحص للبقاء (مع الفحص لايف / Invitrogen الميت) 14 :
الحلول المستخدمة في هذا المقطع : EthD - 1 محلول المخزون ، المخزون حل calcein AM PBS
- شطف عينات 3X مع يغسل 5 دقائق في برنامج تلفزيوني.
- إضافة 20 ميكرولتر 2 مم EthD - 1 محلول المخزون إلى 10 مل من برنامج تلفزيوني العقيمة ودوامة لضمان خلط دقيق.
- إضافة 5 ميكرولتر من 4 مم calcein AM stolution الأسهم إلى EthD - 1 الحل. مرة أخرى ، ودوامة لضمان خلط دقيق.
- إضافة حجم كاف من الحل أعلاه لتغطية بناء.
- احتضان مغطاة (لمنع photobleaching من الأصباغ) لمدة 30 دقيقة في درجة حرارة الغرفة.
- إزالة الأصباغ واستبدالها مع برنامج تلفزيوني الدافئة. مراقبة وتسجيل الصور مع المجهر الفلورسنت. هو متحمس Calcein 494 نانومتر من الضوء والضوء تنبعث 517 نانومتر ، بينما إيثيديوم homodimer - 1 نانومتر هو من الضوء ينبعث 528 و 617 نانومتر الخفيفة. انظر الشكل رقم 4 لنتائج العينة.
10. تقنيات التحليل (بعد 2 أسابيع في الثقافة) -- البروتينات المناعية لالعضلية هامة :
الحلول المستخدمة في هذا القسم : برنامج تلفزيوني ، paraformadehyde 4 ٪ في برنامج تلفزيوني ، 5 ٪ المصل حمار في برنامج تلفزيوني ، والأجسام المضادة في برنامج تلفزيوني و 0.1 نانوغرام / مليلتر هويشت 33258 في برنامج تلفزيوني.
- شطف عينات 3X مع يغسل 5 دقائق في برنامج تلفزيوني.
- الإصلاح بارافورمالدهيد مع 4 ٪ في حل برنامج تلفزيوني ، لمدة 2-3 ساعات في 4 درجات مئوية
- شطف عينات 3X مع يغسل 5 دقائق في برنامج تلفزيوني.
- ويمكن الآن أن تكون جزءا لا يتجزأ من العينة ، وملطخة مقطوع وفقا للبروتوكول في الاختيار. الجزء المتبقي من هذا البروتوكول يغطي كامل لبناء تلطيخ التصوير المجهري مع مبائر. علما بأن أوقات الحضانة هي أطول من تلك التي للنسيج مقطوع كما يجب أن يكون هناك مزيد من الوقت لأجسام مضادة لمنتشر في بناء. بالإضافة إلى ذلك ، تجري كافة الخطوات المتبقية في درجة حرارة الغرفة.
- إضافة 0.1 ٪ تريتون - X في برنامج تلفزيوني للعينات لمدة 30 دقيقة لpermeabilize في أغشية الخلايا.
- شطف عينات 3X مع يغسل 10 دقيقة في برنامج تلفزيوني.
- إضافة 5 ٪ المصل حمار في برنامج تلفزيوني على عينات لساعات ونصف الساعة من 1 إلى عرقلة أي ملزم غير محدد من الأجسام المضادة الثانوية للعينات.
- إضافة Connexin 43 (01:50 تمييع) والميوسين السلسلة الثقيلة (1:100 تمييع) الأجسام المضادة الأولية في برنامج تلفزيوني للعينات لمدة 3 ساعات. من أجل تسمية كل من البروتينات على التوالي يجب التأكد من أن الأجسام المضادة الأولية من المضيفين مختلفة (أي الأرنب والفأر).
- شطف عينات 3X مع يغسل 10 دقيقة في برنامج تلفزيوني.
- إضافة مناسبة الأضداد الثانوية fluorescently المسمى في برنامج تلفزيوني لمدة 3 ساعات.
- شطف عينات 3X مع يغسل 10 دقيقة في برنامج تلفزيوني
- قبل التصوير العينات على المجهر مبائر ، إضافة 0.1 نانوغرام / مل هويشت 33258 في برنامج تلفزيوني لمدة 15 دقيقة.
- شطف عينات 3X مع يغسل 10 دقيقة في برنامج تلفزيوني.
- تحليل عينات من التعبير MHC وCx43 بواسطة خلايا التصوير مع المجهر مبائر (انظر الشكل رقم 4 لنتيجة سبيل المثال).
11. النتائج ممثل / النتائج :
وبناء cardiomyocyte الليفين يغطي مبدئيا على كامل عرض القالب (الشكل 2B). لا ينبغي وجود فقاعات في بناء وأنه ينبغي أن ننظر موحدة عبر طول بأكمله. بعد أسبوعين من زراعة ، بناء على العقد إلى حوالي 1 / 4 من العرض الأولي (الشكل 2C).
عندما يتم بناء الايقاع كهربائيا في عادتنا انكماش قوة الجهاز (الشكل 3A) ، يمكن أن تتولد قوة نشل البيانات كما هو موضح في الشكل 3B. ويمكن تحليل الموجي بشكل منفصل في MATLAB (MathWorks) لتحديد القوة ، ومعدل الانكماش ، ومعدل الاسترخاء. ومن المتوقع أن قوات نشل من نحو 1.3 مليون 6.
الجدوى من بناء الخلية يعتمد على عمق بناء ، وذلك بسبب القيود نشر الأوكسجين في بناء. على سطح بناء ، والشكل 4A ، لوحظ ارتفاع قابلية الخلية. مع المجهري متحد البؤر ، الشكل 4B ، يلاحظ وجود هيكل محاذاة للبناء نظرا لسلسلة الميوسين الثقيلة ، MHC ، من المهم للانكماش ، كما هو موضح باللون الأحمر. Connexin 43 ، كما هو موضح باللون الأخضر ، هو أمر ضروري للمزاوجة بين myocytes الخلوية.
الشكل 1 : نظرة عامة على عملية التغليف

الشكل 2 : أ) قطع قالب منفصلة ومجتمعة لخلق المواد الهلامية الليفين. جيئة وذهابااليسار إلى اليمين م : اثنان غسالات التفلون ، واثنين من السيليكون طوقية ، قضيب تفلون ، تفلون أنبوب ، ومغزل الانتهاء ، والغلاف الخارجي للمغزل ، والمكبس و). ب) بناء على القالب فورا بعد طرد من الغلاف الخارجي (يوم 0). ج) بناء على قالب مضغوط (السهم الأحمر) ، وبعد 13 يوما من الثقافة.
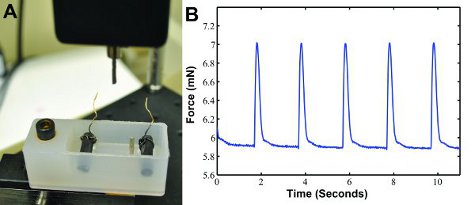
الشكل 3 : أ) قوة انقباض مخصص لنظام قياس قوة شد التسجيل. A محول القوة مع آخر يقيس قوة التقلص وإخراج النتائج في الكمبيوتر. وتحتوي على حمام أقطاب الكربون مع اثنين من أسلاك تربط إلى منشط الكهربائية التي تسير على بناء. الوظيفتين عقد بناء في المكان. ب) نموذج البيانات الموجي نشل القوة المتولدة مع التحفيز الكهربائي عند 0.5 هرتز.
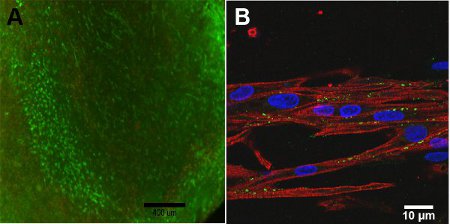
الرقم 4 : مقايسة) لايف / الميت من بناء ، ويوم 13 (شريط النطاق = 400 ميكرون). الأخضر يمثل الخلايا الحية وحمراء تمثل الخلايا الميتة. ب) صورة من سلسلة متحد البؤر الميوسين الثقيلة (الحمراء) ، Connexin 43 (الخضراء) وصمة عار Hoescht النووية (الأزرق) شريط النطاق (= 10 ميكرون).
| F الحل | تي حل | الخلية الحل | |||
| الفيبرينوجين | 112 ميكرولتر | ثرومبين | 17 ميكرولتر | الخلايا في DMEM | ميكرولتر 170 |
| HEPES | 558μl | كاليفورنيا + + | ميكرولتر 1.3 | ||
| DMEM | 152 ميكرولتر | ||||
| مجموع | 670 ميكرولتر | مجموع | ميكرولتر 170 | مجموع | ميكرولتر 170 |
الجدول 1. الفايبرين حلول الجل ، والكميات : 1 مل من هلام.
الفيزيولوجية مخزنة = 33 ملغ / مل الفيبرينوجين في HEPES 20 ملي المالحة : مذكرة
مخزنة HEPES HEPES = 20 ملي المالحة
ثرومبين = 25 U / مل حل في حل كلوريد الصوديوم 0.81 ٪
كاليفورنيا الكالسيوم + + N = 2 كلوريد الحل
Discussion
لتغليف الخلايا العضلية الفئران حديثي الولادة في نتائج المواد الهلامية الليفين في ثلاثية الأبعاد ثابتة وقابلة للحياة في المختبر نموذج لنظام عضلة القلب. الليفين هو مادة بيولوجية المفضل لأنه عندما يتم شرك الخلايا ، فهي تنشط عملية الأيض وقادرة على ضغط ، إعادة عرض وإعادة مصفوفة خارج الخلية التي تنسجم مع أنسجة القلب الأصلي 12. لأن نسمح العضلية لصوتها في هذه البيئة ، وظائفها هو أكثر سمة من عضلة القلب مما يؤدي إلى انكماش قوة أكبر بالمقارنة مع الأنسجة الخواص 6. لتطبيقات علاجية محتملة ، فمن الضروري لتغليف الخلايا ضمن المواد التي تشجع كل من سلامة وظيفة. قدم هنا شرح البروتوكولات وسيلة فعالة ودقيقة لإنشاء شبكة لمراقبة القلب الليفين السلوك خلية في المكروية ثلاثية الأبعاد.
قد تنشأ بعض القضايا المحتملة خلال خلق ثقافة وهذه التركيبات. قضية واحدة محتملة هي صون سلامة الخلية قبل التغليف ، والتي سوف تؤثر تأثيرا كبيرا على وظيفة بناء. وينبغي بذل جهود للحد من موت الخلية بعد العزلة من خلال تقليل الفترة الزمنية الفاصلة بين العزلة والتغليف للخلايا داخل الجل الليفين. وينبغي توفير بنيات وسائل الاعلام كل يوم على جدول زمني صارم. بالإضافة إلى ذلك ، فمن المهم لضمان التجانس في كافة الحلول المستخدمة. إذا كان خليط من الفيبرينوجين ، وخلايا تنتج ثرومبين بيئة غير متجانسة ، وقدرة الخلايا لاعادة تشكيل ECM ، هو عرقلة محتملة زوجين ميكانيكيا والعقد. من المهم أيضا للحيلولة دون تشكيل فقاعات الهواء خلال حقن يبني من أجل منع حصول أعمال شغب في استمرارية النسيج هندسيا. طريقة واحدة للتخفيف من حدة هذه المشكلة هو جذب المزيد من هلام أكثر مما هو مطلوب لجعل بناء في المحاقن وحقن ببطء. أخيرا ، وبمجرد أن وضعت مصفوفة الليفين وكان في مستنبت لمدة 24 ساعة ، فمن الضروري فصل بناء من الجانبين من العفن الدائري لتعزيز الضغط على الخلية من هلام الليفين. الحفاظ على بناء في وسط القالب يسهل تبادل الغاز والمواد الغذائية. قد الانضمام الى جانبي القالب الدائري يعطل أيضا المحاذاة المطلوب الخلوية.
ومن المهم أن نلاحظ أن يستخدم قطع الرأس واعية كأسلوب من euthanization في هذا البروتوكول ، الذي هو وسيلة مقبولة في إطار المبادئ التوجيهية من كل من المعاهد الوطنية للصحة والجمعية الطبية الأمريكية للطب البيطري. ومع ذلك ، فإن بعض المؤسسات يوصي استخدام مخدر تليها قطع الرأس للفئران حديثة الولادة. اخترنا قطع الرأس واعية لأنه يضمن الحد الأدنى من الوقت في ظل ظروف نقص الأوكسجين للأنسجة القلب رفعه / الخلايا. يمكن أن كميات صغيرة نسبيا من نقص الأكسجين يؤدي إلى نقص التروية العضلية والموت المحتمل العضلية ، والتي يمكن أن تؤثر تأثيرا كبيرا على نتائج هذا البروتوكول.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وأيد هذا العمل من قبل المعاهد الوطنية للصحة -- القومي للقلب والرئة والدم المعهد (جائزة # R00HL093358 لLDB).
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | تعليقات |
|---|---|---|---|
| كلوريد الصوديوم | سيغما | S7653 | PBS |
| كلوريد البوتاسيوم | سيغما | P9333 | PBS |
| صوديوم فوسفات ثنائي القاعدة | سيغما | S7907 | PBS |
| فوسفات البوتاسيوم أحادي القاعدة | سيغما | P5655 | PBS |
| جلوكوز | سيغما | G5400 | العزلة |
| مرقئ | أدوات العلوم غرامة | 91308-12 | العزلة |
| غرامة ملاقط | أدوات العلوم غرامة | 11251-20 | العزلة |
| مقص كبير | أدوات العلوم غرامة | 91401-14 | العزلة |
| المقص الصغير | أدوات العلوم غرامة | 91501-09 | العزلة |
| مشرط مقبض | أدوات العلوم غرامة | 10008-13 | العزلة |
| شفرة مشرط | فيشر العلمية | 08-918 - 5A | العزلة |
| ماصة مقاعد البدلاء underpad | VWR | 56617-014 | العزلة |
| معقمة ثنى | فيشر العلمية | GM42526 | العزلة |
| الأوتوكلاف كيس | الصياد | 01-812-54 | العزلة |
| الشاش سادة | فيشر العلمية | 13-761-52 | العزلة |
| betadine | بوردو المنتوجات | 67618-150-01 | العزلة |
| قفازات معقمة | فيشر العلمية | 19-020 | العزلة |
| ماصة معقمة نقل | فيشر العلمية | 9962 | العزلة |
| كولاجيناز | ورثينجتون | CLS2 | العزلة |
| تفلون قضيب 1 / 4 بوصة قطر | ماكماستر ، كار | 8546K11 | الجزء العفن |
| تفلون الانبوب رقم 1 / 4 بوصة ، OD 1 / 2 بوصة | ماكماستر ، كار | 8547K31 | الجزء العفن |
| سيليكون رقم 04/01 O - خاتم بوصة ، OD 1 / 2 بوصة | ماكماستر ، كار | 9396K204 | الجزء العفن |
| تفلون الانبوب 04/01 بوصة رقم ، 5 / 16 بوصة OD | ماكماستر ، كار | 52355K14 | الجزء العفن |
| كيندال المحاقن monoject 6cc | فيشر العلمية | 05-561-41 | الجزء العفن |
| دينار بحريني حقنة 3cc | فيشر العلمية | 309585 | الجزء العفن |
| البقري الفيبرينوجين | سيغما | F8630 | بناء |
| البقري ثرومبين | سيغما | T7513 | بناء |
| 1 م HEPES | سيغما | H0887 | بناء |
| كلوريد الصوديوم | سيغما | S7653 | بناء |
| DMEM | Invitrogen | 10569 | بناء |
| Pluronic F - 127 | سيغما | P2443 | بناء |
| كلوريد الكالسيوم | سيغما | 383147 | بناء |
| 0.2 ميكرون فلتر | فيشر العلمية | SCGVT05RE | بناء |
| مصافى الخلية 40 ميكرون | فيشر العلمية | 22-363-547 | بناء |
| 0.45 ميكرون رأس زجاجة التصفية | كورنينج | 430627 | بناء |
| زجاج قبل التصفية | ميليبور | AP2007500 | بناء |
| 18G 1 1 / 2 بوصة إبرة طويلة | فيشر العلمية | 14-826 - 5D | بناء |
| 21G إبرة 1 بوصة | فيشر العلمية | 14 - 826C | بناء |
| بناء الجرار | فيشر العلمية | 2116 | بناء |
| البنسلين الستربتوميسين | Invitrogen | 15140 | وسائل الاعلام |
| حصان المصل | سيغما | H1138 | وسائل الاعلام |
| مصل بقري جنيني | Invitrogen | 16000 | وسائل الاعلام |
| حمض الأمينوكابرويك | العضوية Acros | 103305000 | وسائل الاعلام |
| حمض الأسكوربيك | سيغما | A5960 | وسائل الاعلام |
| الأنسولين | سيغما | I9278 | وسائل الاعلام |
| بارافورمالدهيد ، و 16 ٪ | الإلكترون المجهر العلوم | 15710 | الأنسجة |
| درجة الحرارة المثلى القطع (أكتوبر) | تيد بيلا | 27050 | الأنسجة |
| 2 - methylbutane | الصياد | 03551-4 | الأنسجة |
| الماوس MYH1/2/4/6 الضد الابتدائي | سانتا كروز التكنولوجيا الحيوية | SC - 32732 | الأنسجة |
| الأرنب Connexin 43 الضد الابتدائي | تكنولوجيا الخلية اشارة | 3512 | الأنسجة |
| Dylight 549 - مترافق حمار المضادة للجسم الفأر الثانوية | جاكسون ImmunoResearch مختبرات | 715-505-151 | الأنسجة |
| Dylight 488 - مترافق Donke المضادة للأرنب الضد الثانوية | جاكسون ImmunoResearch مختبرات | 711-485-152 | الأنسجة |
| أعيش / قتلى مقايسة | Invitrogen | L - 3224 | تحليل |
References
- Stegemann, J. P., Hong, H., Nerem, R. M. Mechanical, biochemical, and extracellular matrix effects on vascular smooth muscle cell phenotype. Journal of applied physiology. 98, 2321-2327 (2005).
- Guarnieri, D. Covalently immobilized RGD gradient on PEG hydrogel scaffold influences cell migration parameters. Acta. 6, 2532-2539 (2010).
- Krebs, . Injectable poly(lactic-co-glycolic) acid scaffolds with in situ pore formation for tissue engineering. Acta. 5, 2847-2859 (2009).
- Zimmermann, W. -. H. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature. 12, 452-458 (2006).
- Chung, C., Burdick, J. A. Influence of Three-Dimensional Hyaluronic Acid Stem Cell Chondrogenesis. Tissue engineering. 15, (2009).
- Black, L. D. Cell-induced alignment augments twitch force in fibrin gel-based engineered myocardium via gap junction modification. Tissue engineering. 15, 3099-3108 (2009).
- Syedain, Z. H., Weinberg, J. S., Tranquillo, R. T. Cyclic distension of fibrin-based tissue constructs: evidence of adaptation during growth of engineered connective tissue. Proceedings of the National Academy of Sciences of the United States of America. 105, 6537-6542 (2008).
- Falvo, M. R., Gorkun, O. V., Lord, S. T. The molecular origins of the mechanical properties of fibrin. Biophysical chemistry. , 152-155 (2010).
- Jockenhoevel, S. Fibrin gel - advantages of a new scaffold in cardiovascular tissue engineering. European journal of cardio-thoracic surgery : official journal of the European Association for Cardio-thoracic Surgery. 19, 424-430 (2001).
- Ryan, E. Structural Origins of Fibrin Clot Rheology. Biophysical Journal. 77, 2813-2826 (1999).
- Williams, C. Cell sourcing and culture conditions for fibrin-based valve constructs. Tissue engineering. 12, 1489-1502 (2006).
- Grassl, E. D., Oegema, T. R., Tranquillo, R. T. A fibrin-based arterial media equivalent. Journal of biomedical materials research. 66 (Part A. , 550-561 (2003).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of biomechanical engineering. 119, 137-145 .
- Invitrogen. . >LIVE/DEAD Viability/Cytotoxicity Kit *for mammalian cells. , (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved