Method Article
Инкапсуляция кардиомиоцитов в Фибрин Гидрогель для сердечной тканевой инженерии
В этой статье
Резюме
Мы описываем изоляции новорожденных кардиомиоцитов и подготовки клеток для инкапсуляции в фибрин гидрогеля конструкции для тканевой инженерии. Мы опишем методы анализа тканей инженерии миокарда после периода культивирования, включая активные силы, возникающей при электрической стимуляции и жизнеспособность клеток и immunohistological окрашивания.
Аннотация
Культивирование клеток в трехмерной среде гидрогеля является важным методом для разработки конструкции для тканевой инженерии, а также изучение клеточных реакций при различных условиях культуры в пробирке. Трехмерной среде более точно имитирует то, что клетки наблюдать в естественных условиях в связи с применением механических и химических раздражителей во всех измерениях 1. Трехмерные гидрогелей могут быть сделаны из синтетических полимеров, таких как PEG-DA 2 и PLGA 3 или число естественных белков, таких как коллаген 4, гиалуроновая кислота 5 или 6,7 фибрина. Гидрогели создан из фибрина, естественных белков свертывания крови, может полимеризоваться с образованием сетки, которая является частью естественного исцеления раны тела процессы 8. Фибрин является клеточная разложению и потенциально аутологичных 9, что делает его идеальным временным эшафот для тканевой инженерии.
Здесь мы опишем подробно изоляция новорожденных кардиомиоцитов из трех дневных крысят и подготовки клеток для инкапсуляции в фибрин гидрогеля конструкции для тканевой инженерии. Новорожденных миоциты общий источник используемой базовой станции для лабораторного исследования в сердечной ткани и формирование инженерной 4. Фибринового геля создается путем смешивания фибриногена с фермента тромбина. Тромбин расщепляет fibrinopeptides РПА и ФПБ из фибриногена, выявление мест связывания, которые взаимодействуют с другими мономерами 10. Эти взаимодействия причиной мономеров самостоятельно собираться в волокна, которые формируют гидрогеля сетки. Потому что сроки этой ферментативной реакции можно регулировать, изменяя отношение к тромбина фибриноген, или соотношение кальция в тромбин, можно литья под давлением конструкции с целым рядом различных геометрий 11,12. Далее мы можем произвести выравнивание в результате ткани по тому, как мы ограничиваем геля во время культура 13.
После культивирования инженерии сердечной ткани конструкций в течение двух недель в статических условиях, клетки сердечной начали переделывать конструкцию и может произвести сокращения силы при электрическом ходить 6. В рамках этого протокола, мы также описаны методы анализа тканей инженерии миокарда после периода культивирования в том числе функциональный анализ активной силы, создаваемой сердечной мышцы построить на электрическую стимуляцию, а также методы определения окончательного жизнеспособности клеток (Live-Dead анализ) и immunohistological окрашивания для изучения экспрессии и морфологии типичных белков важно для сокращения (миозина тяжелой цепи или MHC) и сотовой связи (коннексин 43 или Cx43) между миоцитов.
протокол
1. Новорожденных кардиомиоцитов изоляции - подготовка (накануне)
Решения, созданные в этом разделе: PBS-раствора глюкозы, стоп медиа.
- Подготовка PBS-раствора глюкозы, добавив 5 мл пенициллина стрептомицин (100 ед / мл и 100 мкг / мл соответственно) и 1,98 г глюкозы в 250 мл стерильного 1x фосфатным буферным раствором (PBS) и довести объем раствора до 500 мл с дополнительными стерильные 1x PBS.
- Подготовка стоп медиа, добавив 25 мл ФБС и 5 мл пенициллина стрептомицин (той же концентрации, что и выше) до средних 250 мл стерильного Дульбеко изменения Орла (DMEM) и довести объем до 500 мл стерильного DMEM до стерильной фильтрации через 0,2 мкм фильтр.
- Стерилизовать хирургических инструментов, необходимых для изоляции в автоклаве: кровоостанавливающего, # 5 щипцы, большие ножницы, микро-ножницы и скальпель ручкой (# 4).
2. Новорожденных кардиомиоцитов изоляции - подготовка (день урожая)
Убедитесь, что для поддержания стерильности
Решения, используемые в этом разделе: PBS-раствора глюкозы, Бетадин
- Для каждого помета, возьмите две стерильные 100 мм чашки Петри, поместите их в капот и залить ~ 10 мл ледяной PBS-глюкозы. Они должны быть размещены в ведерке со льдом со льдом в стерильных капот культуры.
- Место 250 мл стакан с 30-40 мл Бетадин в капот.
- Добавьте 50 мл / помет PBS-глюкозы в бутылку, закройте ее и положите в 37 ° С водяной бане.
- Для каждого человека, место абсорбирующего скамейке underpad на рабочую поверхность капота и место стерильную драпировать над тем, чтобы не прикасайтесь к центру работу стерильной драпировки. Дамп хирургических инструментов и 4 х 4 марлевым тампоном на стерильной драпировки, не прикасаясь к инструментам. Открытые стерильные № 20 лезвие скальпеля и свалить на драпировку, снова стараясь не трогать с нестерильных перчаток.
- Возьмите щенка от плотины и поместить в непрозрачный контейнер, место щенка в капоте
- Наденьте стерильные перчатки
- Сложите марлю в четверти, зажим с кровоостанавливающего и поместить в Бетадин стакан.
- Положите лезвие скальпеля на скальпель ручкой и отложите в сторону.
3. Новорожденных кардиомиоцитов изоляции - сердце рассечение
Решения, используемые в этом разделе: Бетадин, PBS-раствора глюкозы
- Возьмите щенка в вашем не доминантной рукой, зажимая кожу между лопатками между большим и указательным пальцами. Использование больших ножниц, обезглавить щенка в одной разреза. Будьте уверены, чтобы вырезать из задней щенка вперед, чтобы позвоночник полностью разорваны.
- Тампон щенка грудь бетадин пропитанной марли. Безопасные щенка, зажимая лопатки вместе. Выполните частичное торакотомия раскрыть сердце. Повышение внешнего давления, тем самым заставляя сердце прошлом ребрами для scalpular рассечение.
- Запуск лезвие скальпеля за сердце, чтобы разорвать крупных сосудов и удалить сердце. Место сердце в чашке Петри содержащие PBS-глюкозы, которая находится на льду.
- Повторите шаги 1-3 для каждого щенка в помете.
4. Новорожденных кардиомиоцитов изоляции - миоцитов изоляции
Решения созданы и б / у в этом разделе: PBS-раствора глюкозы, коллагеназы решение, универсальное решение
- Как только сердца были изолированы, удалить остатки крови и соединительной ткани путем промывки в ледяной раствора глюкозы PBS, снимите верхнюю 1 / 3 от сердца, чтобы выделить только ткани желудочков и положите в чашку Петри свежей ледяной PBS глюкозы, подготовленных ранее.
- Тщательно фарш сердца в ~ 1 кубический мм с помощью микро-ножницы и пинцет.
- Возьмите стерильные пипетки передачи, отрезать кончик с помощью ножниц, чтобы уст пипетки ~ 3 мм в диаметре. Используйте пипетку для передачи ткани кусочки и все решения в 50 мл конические и место на льду.
- Отвешивать 15000 единиц в помете щенков типа II коллагеназы (ЕД / мг в зависимости от лота) и поместите в бутылку 37 ° С нагревается PBS-глюкозы подготовленные ранее для создания коллагеназы решение. Хорошо перемешайте и стерильный фильтр в отдельную бутылку. Место обратно в 37 ° С водяной бане. Место стоп раствора в 37 ° С водяной бане, а также.
- Разрешить измельченной ткани осели на дно центрифуге трубки. Удалить супернатант, пока общий объем составляет ~ 10 мл. Добавить 7 мл коллагеназы решение центрифуге трубки.
- Положите коническую трубку с ткани кусочки и коллагеназы в трубку стойку на орбитальный шейкер внутри 37 ° C инкубаторе или в духовке. Включите орбитальный шейкер, по крайней около 60 оборотов в минуту и закрыть дверь. Поставьте таймер на 7 минут. Убедитесь, что место коллагеназы бактек на водяной бане, чтобы держать это тепло.
- Когда таймер выключается, довести конической обратно в капот. Также принесите теплая коллагеназы и универсальное решение на капот. Аккуратно титровать ткани частей 5-7 раз сломать их. После титрования, позволяют штук оседают на дно (2-3 минуты). Аспирируйте от так много супернатант возможно быть очень осторожными, чтобы не поглощать ткани штук. После этого добавить 7 мл коллагеназы решение ткани кусочки и место обратно в инкубатор на шейкере в течение 7 минут.
- Для каждого оставшегося шаг, осторожно титровать 10 раз, чтобы разрушить ткань произведений. Как только ткань части урегулирования, рисовать супернатант выходные и собрать ее в отдельную 50 мл конические. Добавить 7 мл коллагеназы к ткани кусочки и переварить снова в течение 7 минут. Для супернатант трубки, добавьте 10 мл универсальное решение с различными серологическими пипетки после каждого добавления супернатанта из пищеварения.
- Повторяйте, пока все коллагеназы была использована (7 шагов в общей сложности).
- После последнего шага пищеварения, возьмите с коническими решение клеток и процеживают через сито 70μm клетки в свежих конической.
- Спиновые клетки вниз на 100 г в течение 5 минут и ресуспендируют в 20 мл DMEM для подсчета использования гемоцитометра, и место клетки на льду.
- Место 50 мкл клеток в растворе Голубой Трипан (75 мкл Трипановый синий, 125 мкл PBS), хорошо перемешать до размещения 10 мкл в гемоцитометра для подсчета. Живая клетка ясно, когда мертвые клетки синим. Ожидать около 3 млн. клеток на крысят, с жизнеспособность примерно 80-90%.
5. Кастинг фибринового геля конструкций - подготовка к созданию фибрина гели (сделано заблаговременно)
Решения, созданные в этом разделе: фибриноген маточного раствора, тромбин маточного раствора, Pluronics решение, инфаркт построить средства массовой информации.
- Подготовка 33 мг / мл маточного раствора фибриногена в буфере 20 мМ HEPES в 0,9% солевом медленным смешивания фибриногена в HEPES буферный солевой раствор в течение нескольких часов при температуре 37 ° C. Разрешить решение урегулировать в течение ночи при температуре 2-8 ° C. Теплый раствор до 37 ° C. Решение стерильно фильтруют через ряд последовательных фильтров: 40 мкм ячейки сита, 0,45 мкм бутылку верхней фильтры со стеклом фильтры предварительной очистки, 0,2 мкм бутылку верхней фильтры со стеклом предварительные фильтры. Решение аликвоты в 1 мл и 3 мл аликвоты и хранили при температуре -20 ° C.
- Подготовка 25 Ед / мл маточного раствора тромбина, добавив 500 U тромбина до 18 мл 0,9% физиологического раствора и 2 мл стерильной деионизированной воды, стерильный фильтр, через фильтр 0,2 мкм, аликвоту в 500 мкл и 250 мкл аликвоты и замерзает при -80 ° C.
- Подготовка 5% вес / Pluronics F-127 решение, при растворении 50 г Pluronics F-127 до 700 мл деионизированной воды. Довести объем раствора до 1 л с дополнительной деионизированной водой. Стерильный фильтр с фильтром 0,2 мкм. Решение Pluronics можно использовать до трех раз, прежде чем заменять, если стерильно фильтруют после каждого использования.
- Подготовка инфаркт построить СМИ, добавляя 10% лошадиной сыворотки, 2% эмбриональной телячьей сыворотки, 1% пенициллина стрептомицин, и 6 мг / мл-аминокапроновой кислоты в DMEM. 50 мкг / мл аскорбиновой кислоты и 2 мкг / мл инсулина в 25 мкМ HEPES должны быть добавлены непосредственно перед кормлением.
- Соберите оправки, поставив вместе один тефлоновый стержень, один тефлоновый рукав, два тефлоновых шайбы с насечкой удалены для инъекций целях, и две резиновые уплотнительные кольца (рис. 2а). Автоклав перед использованием.
- Возьмите 6cc корпуса шприца для внешней части плесени и 3CC корпуса шприца для использования в качестве плунжеров, и подготовить их, отрезав Луер-Лок концы и автоклавирование (рис. 2а).
6. Кастинг фибринового геля конструкций - подготовка к созданию фибрина гели (право, прежде чем принимать конструкций фибрина гель)
Решения, используемые в этом разделе: Pluronics решение
- Стерильный фильтр 5% Pluronics F-127 раствор с 0,2 мкм фильтр перед использованием. Место оправки и шприцев корпуса в 5% Pluronics решением в 1 л стакан в капот. Оставьте части замачивание в растворе Pluronics в течение 2-3 часов в капюшоне, чтобы обеспечить полное покрытие. Решение Pluronics пальто оправки и предотвращает фибринового геля от присоединения к оправки.
- После 2-3 часов инкубации, заливают 5% раствор Pluronics обратно в бутылку, место стерильную шторы вниз на поверхность капота и носить стерильные перчатки для построения форм.
- Место построено оправки в 6 корпусах вв шприц, с помощью шприца 3CC как поршень для обеспечения герметичности между уплотнительными кольцами и тефлоновые шайбы.
7. Кастинг фибринового геля конструкций с помощью литья под давлением
Решения, созданные в этом разделе: F решение, Т решение, сотовые решение.
- Для того, чтобы 1 мл геля фибрина (3,3 мг / мл конечной концентрации фибриногена, 25 ед / мл окончательной концентрации тромбина), создайте F раствора в конической трубе, путем добавления 112 мкл фибриногена акции 558 мкл 20 мМ HEPES буфера в 0,9% физиологический раствор. В отдельных конической трубе, создать T решение путем добавления 17 мкл фондовом тромбина, и 1,3 мкл 2 N Са + + раствор до 135 мкл DMEM. См. Таблицу 1.
- В третьей конической трубе, подготовить ячейки решение за счет остановки клеток и ресуспендирования клеток в объеме, так что концентрация ячейки 29400000 клеток / мл или 6 раз концентрация желаемой конечной концентрации клеток в конструкции
- Когда вы будете готовы бросить фибринового геля построить, приготовительные 1 мл шприц с 18G 1 ½ дюйма длиной иглы. У 21G 1 дюйм игла готовы также.
- Решение фибрина создается в 4:01:01 отношение F решение: T решение: ячейка решение. Чтобы сделать одну мл геля, добавьте 667 мкл F раствора в 50 мл чистой центрифужной пробирке, а затем 167 мкл клеточной решение, и, наконец, добавить 167 мкл Т решение. Внесите смешивать раствор вместе будьте осторожны, чтобы не вводить пузыри. После решения смешанной, реакция началась, и инъекция конструкций должно быть сделано немедленно.
- Возьмите заранее подготовленный шприц с иглой 18G и составить фибрина решение. Будьте осторожны, не инвертировать шприц, чтобы предотвратить пузыри от попадания иглы. Замените 18G иглу 21G иглу. Нажмите шприц осторожно, чтобы вытеснить пузырьки воздуха.
- Вставьте шприц в форме между пробкой и корпусом следующий паз в тефлоновым уплотнительным кольцом и вводят раствор в форму. Tilt формы с канавкой на вершине, чтобы обеспечить полное заполнение. Удалите шприц и продолжать устранения остающихся пресс-форм. Достаточно решение гель может быть создан, чтобы заполнить несколько форм, в то же время. Однако, поскольку решение гели быстро, как правило, хорошая идея, чтобы ограничить число конструкции вводили в данный момент времени до 6.
- Оберните форм в парафильмом в группы по три и место в инкубаторе или в духовке при температуре 37 ° C. Разрешить гели для инкубации в формах в течение 20 минут, чтобы дать время гелеобразования для полимеризации.
- Заполните каждую банку культуры (Nalgene прямой стороны банка) с 21 мл инфаркта построить среды на конструкцию. Используйте стерильный шприц 3 куб.см корпус, как поршень, чтобы заставить оправки с построить в большой чашке Петри с DMEM. Затем поместите построить в образец банку. Каждый 16 унций банку может вместить до 6 конструкций, а каждый 4 унции банку может вместить 2.
- Винт крышки на банках и передавать их в инкубатор. Внутри инкубатора, ослабить ограничения на банки для обеспечения газообмена.
- После 24 часов, принимать стерильной зубной выбрать и нажать построить подальше от белого тефлоновые уплотнительные кольца на концах кольца формы для обеспечения равномерного выравнивания построить (см. рисунок 2 в репрезентативных результатов).
8. Анализ методов (через 2 недели в культуре) - тестирование сокращения силу
Решения, используемые в этом разделе: DMEM, инфаркт построить средства массовой информации.
- Зажим крокодил на ближайшие приводят от стимулятора, чтобы провода на электроды в ванну. Включите плате сбора данных, генератор импульсов, и датчик силы. Датчик силы должен быть переключен в настройке 5г и обнуляется. Открытое пользовательской программы LabView, которая отображает и сохраняет данные из датчик силы. Создать новый, пустой текстовый файл в папку данных для каждого образца.
- Место DMEM в 37 ° C водяную баню и дать время для того, чтобы разогреться перед испытанием конструкций. Как только согреться, место 37 ° C DMEM в среду ванну системы измерения силы (рис. 3А).
- Удалить построить по образцу банка, мягко скользящего построить кольцо из тефлона поддержки с помощью пинцета и месте построить более стационарных пунктов металла в системе силы ванны среды измерения. Не сжимайте построить с помощью пинцета! Скорее всего, использовать пинцет, чтобы подтолкнуть и поднять построить прочь оправки поддержки.
- Место другом конце построить свыше датчик руку и затянуть до преобразователя читает 0.50V, (примерно 1,0 грамма силы или 10 мН напряженности)
- Выберите текстовый файл для сокращения силу данных, которые будут записаны в.
- На сердечного стимулятора (Модель № S88X, Grass Technologies), набор импульсов напряжения 20В (8 в / см), 6 мс продолжительность и скорость 1 Гц.
- Начало электрической стимуляции, нажав кнопку "Выход вкл / выкл" Кнопка
- Начать запись до сигнала становится регулярным.
- Осторожно снимите построить по системе силы ванны среды измерения и поместить его обратно в культуральной среде. Затем удалите DMEM из системы силы ванны среду измерения и заменить свежим, теплым DMEM проанализировать additРациональная образцов.
- Вырезать построить и развернуть его так, что вы можете измерить длину и ширину построить
- Вырезать построить на разделы, которые будут использоваться для дополнительных измерений, включая анализ жизнеспособности, гистология, или западной измерений пятно.
9. Анализ методов (через 2 недели в культуре) - Live-Dead Анализ жизнеспособности (с Invitrogen Live / Мертвые Пробирной) 14:
Решения, используемые в этом разделе: EthD-1 маточного раствора, кальцеин AM маточного раствора PBS
- Промыть образцов с 3-кратным 5 минут моет в PBS.
- Добавьте 20 мкл 2 мМ EthD-1 маточного раствора до 10 мл стерильной PBS и вихревые для обеспечения тщательного перемешивания.
- Добавьте 5 мкл 4 мМ кальцеин AM фондовом stolution к EthD-1 решение. Опять же, вихрь для обеспечения тщательного перемешивания.
- Добавьте достаточно объема выше решение, чтобы покрыть конструкцию.
- Инкубируйте покрытием (для предотвращения фотообесцвечивания красителей) в течение 30 минут при комнатной температуре.
- Удалить красителей и заменить теплым PBS. Наблюдать и записывать изображения с флюоресцентного микроскопа. Кальцеин возбуждается 494 нм испускает свет и 517 нм, свет, в то время как этидия гомодимера-1 является 528 нм испускает свет и 617 нм света. См. рисунок 4 для образца результаты.
10. Анализ методов (через 2 недели в культуре) - иммуногистохимии для важных миоцитов белков:
Решения, используемые в этом разделе: PBS, 4% paraformadehyde в ФБР, 5% осла сыворотки в PBS, антител в PBS, 0,1 нг / мл Hoechst 33258 в PBS.
- Промыть образцов с 3-кратным 5 минут моет в PBS.
- Fix с 4% параформальдегида в растворе PBS, в течение 2-3 часов при температуре 4 ° C
- Промыть образцов с 3-кратным 5 минут моет в PBS.
- Образец теперь может быть встроен, секционные и окрашенных в соответствии с протоколом выбора. Оставшаяся часть этого протокола охватывает весь построить окрашивания для работы с изображениями с конфокальной микроскопии. Обратите внимание, что инкубационный раза длиннее, чем у секционного ткани, как там должно быть больше времени на антитела к диффундировать в конструкцию. Кроме того, все остальные действия проводятся при комнатной температуре.
- Добавить 0,1% Triton-X в ФБР, чтобы образцы в течение 30 минут, чтобы permeabilize клеточных мембран.
- Промыть образцов с 3-кратным 10 минут моет в PBS.
- Добавьте 5% сыворотки осла в ФБР, чтобы образцы в течение 1 ½ часа, чтобы блокировать любые неспецифическое связывание вторичного антитела к образцам.
- Добавить коннексин 43 (1:50 разведение) и тяжелой цепи миозина (1:100 разведение) первичных антител в ФБР, чтобы образцы в течение 3 часов. Для того, чтобы маркировать как белки последовательно вы должны убедиться, что первичные антитела из разных хостов (например, кроликов и мышей).
- Промыть образцов с 3-кратным 10 минут моет в PBS.
- Добавить соответствующие флуоресцентно меченых вторичных антител в PBS в течение 3 часов.
- Промыть образцов с 3-кратным 10 минут моет в ФСБ
- Как раз перед изображениями образцов на конфокальной микроскопии, добавить 0,1 нг / мл Hoechst 33258 в PBS в течение 15 минут.
- Промыть образцов с 3-кратным 10 минут моет в PBS.
- Анализ образцов экспрессию МНС и Cx43 по визуализации клеток с конфокальной микроскопии (см. рисунок 4, например, результат).
11. Представитель результаты / итоги:
Кардиомиоцитов фибрина построить первоначально охватывает всю ширину формы (рис. 2В). Нет пузырьки должны существовать в строительство и она должна выглядеть одинаковым по всей длине. После двух недель культивирования, построить контракт на примерно 1 / 4 от первоначальной ширины (рис. 2С).
Когда конструкция электрически ходил в наших пользовательских устройств силы сокращения (рис. 3А), данные дергаться силы могут быть получены как показано на рис 3B. Сигнала могут быть проанализированы отдельно в MATLAB (MathWorks), чтобы определить силу, скорость сжатия, а скорость релаксации. Twitch силы примерно 1,3 млн, как ожидается 6.
Сотовые жизнеспособность построить зависит от глубины построить, из-за диффузионных ограничений кислорода в конструкцию. На поверхности конструкции, на рисунке 4A, высокая жизнеспособность клеток не наблюдается. С конфокальной микроскопии, рисунок 4B, выравнивается структура построить наблюдается из-за тяжелой цепи миозина, МНС, является важным для сокращения, показаны красным цветом. Коннексин 43, показаны зеленым цветом, необходимо для сотовой связью между миоцитов.
Рисунок 1: Обзор процесса инкапсуляции

Рисунок 2:) отдельные и комбинированные формы частей для создания фибрина гели. Froм слева направо: две тефлоновые шайбы, две силиконовые уплотнительные кольца, тефлоновые стержня, тефлоновой трубки, заполненной оправки, внешний корпус для оправки, и поршень). Б) Построить на плесень сразу после выброса из внешнего корпуса (день 0). С) Уплотненный построить на плесень (красная стрелка), после 13 дней культуры.
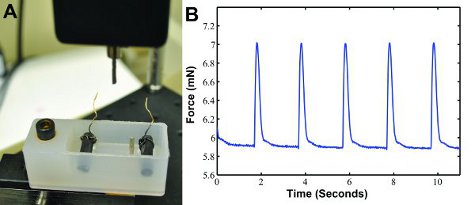
Рисунок 3:) Особый сокращение силы измерительная система для записи силы дергаться. Датчик силы с должности меры сокращения силу, и выводит результат в компьютер. Ванне, содержащей два электрода углерода с проводов подключается к электрическим стимулятором которого шагов построить. Две должности провести построить на месте. B) Пример дергаться данные силу сигнала генерируется электрическая стимуляция с частотой 0,5 Гц.
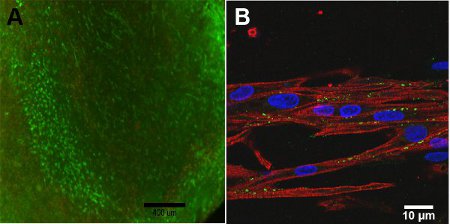
Рисунок 4:) Live / Dead количественное определение построить, день 13 (линейка = 400 мкм). Зеленый представляет живые клетки и красные представляет мертвых клеток. Б) конфокальной изображения миозина тяжелой цепи (красный), коннексин 43 (зеленый) и Hoescht ядерной пятна (синий) (шкалы = 10 мкм).
| F решение | Т решение | Сотовые решения | |||
| Фибриноген | 112 мкл | Тромбин | 17 мкл | Ячейки в DMEM | 170 мкл |
| HEPES | 558μl | Са + + | 1,3 мкл | ||
| DMEM | 152 мкл | ||||
| Общий | 670 мкл | Общий | 170 мкл | Общий | 170 мкл |
Таблица 1. Фибринового геля решения, количество на 1 мл геля.
Примечание: Фибриноген = 33 мг / мл фибриногена в 20 мМ HEPES солевой буфер
HEPES = 20 мМ HEPES солевой буфер
Тромбин = 25 Ед / мл раствора в 0,81% раствор NaCl
Са + + = 2 N раствора хлорида кальция
Обсуждение
Инкапсуляции новорожденных кардиомиоцитов крысы в фибрин результаты гелей в последовательной и жизнеспособные трехмерные в пробирке модель инфаркт системы. Фибрин является предпочтительным биоматериала, потому что когда клетки захватываются, их метаболически активных и способных уплотнения, реконструкции и воссоздания внеклеточного матрикса, который согласуется с нативной ткани сердца 12. Потому что мы позволяем кардиомиоцитов выстроиться в этой среде, их функциональность более характерно для сердечной мышцы, в результате чего большее сжатие силой по сравнению с изотропным тканей 6. Для потенциальных терапевтических применений, необходимо для инкапсуляции клеток в материал, который способствует как жизнеспособность и функциональность. Протоколы, представленные здесь продемонстрировать эффективные и точные средства для создания сети фибрина для контроля сердечной поведение клеток в трехмерном микроокружения.
Несколько потенциальных проблем, возникающих в ходе создания и культуры этих конструкций. Одним из потенциальных вопросом является поддержание жизнеспособности клеток до инкапсуляции, что существенно влияет на функциональность конструкции. Усилия должны быть направлены на пределе гибель клеток после изоляции за счет сокращения времени между изоляцией и инкапсуляции клеток в гель фибрина. Конструкции должны быть предоставлены средства массовой информации каждый день по строгому графику. Кроме того, важно обеспечить однородность во всех решениях используется. Если смесь из фибриногена, тромбина и производит клетки гетерогенной среде, способность клеток реконструировать ECM, механически пары и договор потенциально затруднено. Важно также, чтобы предотвратить образование воздушных пузырьков при инжекции конструкций с целью предотвращения нарушений в преемственности инженерии тканей. Один из способов облегчить этот вопрос привлечь больше геля, чем нужно, чтобы построить в шприц и впрыснуть медленно. Наконец, однажды фибрина матрицу создала и был в питательной среде в течение 24 часов, необходимо отделить построить из сторон кольца формы содействия клеточной уплотнения геля фибрина. Хранение построить в середине формы облегчает газа и питательных обмена. Соблюдение стороны кольца плесень может также нарушить желаемого сотовой выравнивания.
Важно отметить, что сознательное обезглавливание используется как метод euthanization в данном протоколе, который является приемлемым методом в соответствии с руководящими с обеих Национального института здоровья и Американской Ветеринарной Медицинской Ассоциации. Тем не менее, некоторые организации рекомендуют использовать анестезию следует обезглавливание для новорожденных крыс. Мы выбрали сознательное обезглавливание потому что это гарантирует минимальное количество времени в условиях гипоксии для вырезали ткани сердца / клеток. Относительно небольшое количество гипоксия может привести к миоцитов ишемии и потенциально миоцитов смерти, которые могли бы существенно повлиять на результаты этого протокола.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Работа выполнена при поддержке Национального института здравоохранения - Национальный институт сердца, легких и крови институт (премии # R00HL093358 к БОД).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
|---|---|---|---|
| Хлористый натрий | Сигма | S7653 | PBS |
| Хлористый калий | Сигма | P9333 | PBS |
| Натрия фосфат двузамещенный | Сигма | S7907 | PBS |
| Фосфат калия однозамещенный | Сигма | P5655 | PBS |
| Глюкоза | Сигма | G5400 | Изоляция |
| кровоостанавливающий зажим | Инструменты изобразительных наук | 91308-12 | Изоляция |
| штраф пинцет | Инструменты изобразительных наук | 11251-20 | Изоляция |
| большие ножницы | Инструменты изобразительных наук | 91401-14 | Изоляция |
| микро-ножницы | Инструменты изобразительных наук | 91501-09 | Изоляция |
| скальпель ручкой | Инструменты изобразительных наук | 10008-13 | Изоляция |
| лезвие скальпеля | Fisher Scientific | 08-918-5А | Изоляция |
| Абсорбирующие underpad скамейке | VWR | 56617-014 | Изоляция |
| стерильной драпировки | Fisher Scientific | GM42526 | Изоляция |
| автоклаве мешок | Рыболов | 01-812-54 | Изоляция |
| марлевым тампоном | Fisher Scientific | 13-761-52 | Изоляция |
| бетадин | Пердью продукты | 67618-150-01 | Изоляция |
| стерильные перчатки | Fisher Scientific | 19-020 | Изоляция |
| стерильной пипетки передачи | Fisher Scientific | 9962 | Изоляция |
| коллагеназы | Уортингтон | CLS2 | Изоляция |
| Тефлон стержень 1 / 4 дюйма диаметром | McMaster-Карр | 8546K11 | Плесень части |
| Тефлоновые трубки 1 / 4 дюйма ID, 1 / 2 дюйма OD | McMaster-Карр | 8547K31 | Плесень части |
| Силиконовое уплотнительное кольцо 1 / 4 дюйма ID, 1 / 2 дюйма OD | McMaster-Карр | 9396K204 | Плесень части |
| Тефлоновые трубки 1 / 4 дюйма ID, 5 / 16 дюйма OD | McMaster-Карр | 52355K14 | Плесень части |
| Кендалл monoject шприцы 6cc | Fisher Scientific | 05-561-41 | Плесень части |
| BD шприц 3CC | Fisher Scientific | 309585 | Плесень части |
| Говядина Фибриноген | Сигма | F8630 | Строить |
| Бычьего тромбина | Сигма | T7513 | Строить |
| 1 М HEPES | Сигма | H0887 | Строить |
| Хлористый натрий | Сигма | S7653 | Строить |
| DMEM | Invitrogen | 10569 | Строить |
| Pluronic F-127 | Сигма | P2443 | Строить |
| Хлорид кальция | Сигма | 383147 | Строить |
| 0,2 мкм фильтр | Fisher Scientific | SCGVT05RE | Строить |
| 40 микрон фильтры ячейки | Fisher Scientific | 22-363-547 | Строить |
| 0,45 микрона бутылку верхнего фильтра | Гранулирование | 430627 | Строить |
| стекло фильтр предварительной очистки | Millipore | AP2007500 | Строить |
| 18G 1 1 / 2 дюйма длиной иглы | Fisher Scientific | 14-826-5D | Строить |
| 21G 1 дюйм игла | Fisher Scientific | 14-826C | Строить |
| построить банки | Fisher Scientific | 2116 | Строить |
| Пенициллин-стрептомицин | Invitrogen | 15140 | Средства массовой информации |
| лошадиная сыворотка | Сигма | H1138 | Средства массовой информации |
| Фетальной телячьей сыворотки | Invitrogen | 16000 | Средства массовой информации |
| аминокапроновая кислота | Acros Organics | 103305000 | Средства массовой информации |
| аскорбиновая кислота | Сигма | A5960 | Средства массовой информации |
| инсулин | Сигма | I9278 | Средства массовой информации |
| Параформальдегид, 16% | Электронная микроскопия наук | 15710 | Гистология |
| Оптимальная температура резания (ОКТ) | Тед Пелла | 27050 | Гистология |
| 2-метилбутана | Рыболов | 03551-4 | Гистология |
| Мышь MYH1/2/4/6 первичных антител | Санта-Крус биотехнологии | SC-32732 | Гистология |
| Кролик коннексин 43 первичных антител | Сотовые технологии передачи сигналов | 3512 | Гистология |
| Dylight 549-сопряженных осла антимышиным вторичными антителами | Джексон ImmunoResearch лаборатории | 715-505-151 | Гистология |
| Dylight 488-сопряженных Donke анти-кролик вторичными антителами | Джексон ImmunoResearch лаборатории | 711-485-152 | Гистология |
| Live / мертвых анализа | Invitrogen | L-3224 | Анализ |
Ссылки
- Stegemann, J. P., Hong, H., Nerem, R. M. Mechanical, biochemical, and extracellular matrix effects on vascular smooth muscle cell phenotype. Journal of applied physiology. 98, 2321-2327 (2005).
- Guarnieri, D. Covalently immobilized RGD gradient on PEG hydrogel scaffold influences cell migration parameters. Acta. 6, 2532-2539 (2010).
- Krebs, . Injectable poly(lactic-co-glycolic) acid scaffolds with in situ pore formation for tissue engineering. Acta. 5, 2847-2859 (2009).
- Zimmermann, W. -. H. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature. 12, 452-458 (2006).
- Chung, C., Burdick, J. A. Influence of Three-Dimensional Hyaluronic Acid Stem Cell Chondrogenesis. Tissue engineering. 15, (2009).
- Black, L. D. Cell-induced alignment augments twitch force in fibrin gel-based engineered myocardium via gap junction modification. Tissue engineering. 15, 3099-3108 (2009).
- Syedain, Z. H., Weinberg, J. S., Tranquillo, R. T. Cyclic distension of fibrin-based tissue constructs: evidence of adaptation during growth of engineered connective tissue. Proceedings of the National Academy of Sciences of the United States of America. 105, 6537-6542 (2008).
- Falvo, M. R., Gorkun, O. V., Lord, S. T. The molecular origins of the mechanical properties of fibrin. Biophysical chemistry. , 152-155 (2010).
- Jockenhoevel, S. Fibrin gel - advantages of a new scaffold in cardiovascular tissue engineering. European journal of cardio-thoracic surgery : official journal of the European Association for Cardio-thoracic Surgery. 19, 424-430 (2001).
- Ryan, E. Structural Origins of Fibrin Clot Rheology. Biophysical Journal. 77, 2813-2826 (1999).
- Williams, C. Cell sourcing and culture conditions for fibrin-based valve constructs. Tissue engineering. 12, 1489-1502 (2006).
- Grassl, E. D., Oegema, T. R., Tranquillo, R. T. A fibrin-based arterial media equivalent. Journal of biomedical materials research. 66 (Part A. , 550-561 (2003).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of biomechanical engineering. 119, 137-145 .
- Invitrogen. . >LIVE/DEAD Viability/Cytotoxicity Kit *for mammalian cells. , (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены