Method Article
L'encapsulation des cardiomyocytes dans un hydrogel de fibrine pour l'ingénierie du tissu cardiaque
Dans cet article
Résumé
Nous décrivons l'isolement des cardiomyocytes néonataux et la préparation des cellules pour l'encapsulation dans les constructions d'hydrogel de fibrine pour l'ingénierie tissulaire. Nous décrivons des méthodes d'analyse de l'ingénierie tissulaire du myocarde après la période de culture, y compris force active générée lors de la stimulation électrique et la viabilité des cellules et la coloration immunohistochimique.
Résumé
La culture de cellules dans un environnement en trois dimensions d'hydrogel est une technique importante pour développer des constructions pour l'ingénierie tissulaire ainsi que l'étude des réponses cellulaires sous diverses conditions de culture in vitro. L'environnement en trois dimensions de plus près ce qui imite les cellules d'observer in vivo en raison de l'application de stimuli mécaniques et chimiques dans toutes les dimensions 1. Trois dimensions hydrogels peuvent être fabriqués à partir de polymères synthétiques tels que le PEG-DA 2 et 3 ou PLGA un certain nombre de protéines naturelles telles que le collagène 4, 5 d'acide hyaluronique ou de fibrine 6,7. Les hydrogels créés à partir de la fibrine, une protéine du sang d'origine naturelle de la coagulation, peut se polymériser pour former un maillage qui fait partie de la guérison du corps enroulé processus naturels 8. La fibrine est la cellule-dégradables et potentiellement autologue 9, ce qui en fait un idéal d'échafaudage provisoire pour l'ingénierie tissulaire.
Nous décrivons ici en détail l'isolement des cardiomyocytes néonataux de trois chiots jour vieux rat et la préparation des cellules pour l'encapsulation dans les constructions d'hydrogel de fibrine pour l'ingénierie tissulaire. Myocytes néonataux sont une source de cellules couramment utilisées pour les études in vitro la formation des tissus cardiaques et d'ingénierie 4. Fibrine gel est créé par le fibrinogène mélange avec l'enzyme thrombine. La thrombine clive FPA et FPB fibrinopeptides à partir du fibrinogène, révélant les sites de liaison qui interagissent avec d'autres monomères 10. Ces interactions provoquer des monomères de s'auto-assembler en fibres qui forment le maillage d'hydrogel. Parce que le timing de cette réaction enzymatique peut être ajusté en modifiant le rapport de la thrombine au fibrinogène, ou le ratio du calcium à la thrombine, on peut moulage par injection des constructions avec un certain nombre de différentes géométries 11,12. En outre, nous pouvons générer l'alignement du tissu obtenu par la façon dont nous contraindre le gel au cours de la culture 13.
Après culture des constructions conçues tissu cardiaque pendant deux semaines dans des conditions statiques, les cellules cardiaques ont commencé à remodeler le construire et peut générer une force de contraction dans les conditions rythme électrique 6. Dans le cadre de ce protocole, nous avons également décrire les méthodes d'analyse de l'ingénierie tissulaire du myocarde après la période de culture, y compris l'analyse fonctionnelle de la force active générée par le muscle cardiaque construire sur la stimulation électrique, ainsi que des méthodes pour déterminer la viabilité cellulaire finale (Live-Morte dosage) et la coloration immunohistochimique pour examiner l'expression et la morphologie des protéines typiques important pour la contraction (chaînes lourdes de myosine ou CMH) et le couplage cellulaire (connexine 43 ou Cx43) entre les myocytes.
Protocole
1. Néonatale isolement des cardiomyocytes - préparation (la veille)
Solutions créées dans cette section: PBS-glucose solution, arrêter les médias.
- Préparer une solution de PBS-glucose en ajoutant 5 ml de pénicilline-streptomycine (100 unités / ml et 100 pg / ml, respectivement) et 1,98 g de glucose à 250 ml 1x phosphate stérile saline tamponnée (PBS) et porter le volume de solution à 500 ml avec d'autres 1x PBS stérile.
- Préparer arrêter les médias en ajoutant 25 FBS ml et 5 ml de pénicilline-streptomycine (même concentration que ci-dessus) au moyen de 250ml stériles Eagle modifié par Dulbecco (DMEM) et porter le volume à 500 ml avec stérile DMEM avant filtration stérile à travers un filtre de 0,2 micron.
- Stériliser les instruments chirurgicaux nécessaires à l'isolement par autoclavage: un hémostatique, n ° 5 pinces, ciseaux grandes, les micro-ciseaux, et une poignée de scalpel (# 4).
2. Néonatale isolement des cardiomyocytes - préparation (jour de la récolte)
Soyez sûr de maintenir la stérilité
Les solutions utilisées dans cette section: PBS-glucose solution Betadine
- Pour chaque portée, prendre les deux stériles 100 mm boîtes de Pétri, les placer dans la hotte et le remplir d'environ 10 ml de PBS glacé-glucose. Ceux-ci devraient alors être placé dans un seau à glace rempli de glace dans la hotte de culture stérile.
- Placer un bécher de 250 mL avec 30-40 ml d'bétadine dans la hotte.
- Ajouter 50 ml / litre de PBS-glucose dans une bouteille, sceller et le placer dans un bain d'eau à 37 ° C.
- Pour chaque personne, un lieu d'un banc absorbants thibaude sur la surface de travail capot et le lieu d'un champ stérile sur le dessus en faisant attention à ne pas toucher la zone de travail centre de la housse stérile. Dump des instruments chirurgicaux et d'un tampon de gaze de 4 x 4 sur le champ stérile sans toucher les instruments. Ouvrez une lame stérile n ° 20 de scalpel et dumper drapé, à nouveau en faisant attention à ne pas toucher avec les gants non stériles.
- Prenez les chiots à partir du barrage et de mettre dans un récipient opaque, chiots lieu dans la hotte
- Mettre des gants stériles
- Repliez la gaze en quarts, pince à hémostatique et le lieu dans un bécher de Betadine.
- Mettez la lame du scalpel sur la poignée de scalpel et mis de côté.
3. Néonatale isolement des cardiomyocytes - dissection du cœur
Les solutions utilisées dans cette section: Bétadine, PBS-solution de glucose à
- Ramasser le chiot dans votre main non dominante par la peau entre les omoplates pincer entre le pouce et l'index. Utiliser le gros ciseaux, décapiter le chiot dans une coupe. Veillez à couper à l'arrière de l'avant chiot, afin de s'assurer que la colonne vertébrale est complètement sectionné.
- Swab du chiot poitrine avec de la gaze imbibée bétadine. Fixez le chiot en pinçant les omoplates ensemble. Effectuer une thoracotomie partielle pour exposer le cœur. Augmenter la pression appliquée, forçant ainsi le cœur dernières côtes pour la dissection scalpular.
- Exécutez le scalpel derrière le cœur de couper les gros vaisseaux et retirer le cœur. Placez le coeur dans la boîte de Pétri contenant du PBS-glucose qui est sur la glace.
- Répétez les étapes 1-3 pour chaque chiot dans la litière.
4. Néonatale isolement des cardiomyocytes - isolement des myocytes
Solutions créé / utilisé dans cette section: PBS-glucose solution de collagénase solution, solution unique
- Une fois les cœurs ont été isolés, enlever tout le sang résiduel et du tissu conjonctif par rinçage dans une solution glacée de glucose PBS, enlever le haut 1 / 3 de coeur pour isoler uniquement le tissu ventriculaire et la placer dans un plat frais de Pétri avec glacée le glucose du PBS, préparée plus tôt.
- Soigneusement émincer les coeurs dans ~ 1 mm cube en utilisant les ciseaux et les micro-pince.
- Prenez une pipette de transfert stérile, couper la pointe avec des ciseaux de telle sorte que l'embouchure de la pipette est ~ 3 mm de diamètre. Utilisez la pipette pour transférer les morceaux de tissu et de toute la solution en une forme conique de 50 ml et placer sur la glace.
- Peser 15 000 unités par portée de chiots de type II de la collagénase (unités / mg dépend du lot) et le placer dans la bouteille de 37 ° C réchauffé PBS-glucose préparés précédemment pour créer une solution de collagénase. Mélangez bien et filtre stérile dans un flacon séparé. Placer dans le bain à 37 ° C. Placer la solution d'arrêt dans le bain d'eau à 37 ° C ainsi.
- Autoriser le tissu haché pour se déposent au fond du tube à centrifuger. Enlever le surnageant jusqu'à obtenir le volume total est ~ 10 ml. Ajouter 7 ml de solution de collagénase dans le tube à centrifuger.
- Placer le tube conique avec des pièces de tissu et de la collagénase dans un rack tubes sur un agitateur orbital dans un incubateur à 37 ° C ou au four. Tournez le agitateur orbital à environ 60 sur les tours et fermer la porte. Réglez une minuterie pour 7 minutes. Veillez à placer le bac de la collagénasek dans le bain d'eau pour garder au chaud.
- Lorsque la minuterie s'éteint, ramener les coniques dans la hotte. Apportez également la collagénase chaud et la solution d'arrêt dans la hotte. Doucement titrer les morceaux de tissu 5-7 fois pour les briser. Après le titrage, permettre aux morceaux de s'installer au fond (2-3 minutes). Aspirer autant que possible le surnageant étant très attention à ne pas aspirer les morceaux de tissu. Ensuite, ajouter 7 ml de solution de collagénase aux morceaux de tissu et placer de nouveau dans l'incubateur sur l'agitateur pendant 7 minutes.
- Pour chaque étape restante, doucement titrer 10 fois pour briser les morceaux de tissu. Une fois les morceaux de tissu de régler, tirer le surnageant hors tension et le recueillir dans un séparées conique de 50 ml. Ajouter 7 ml de collagénase aux morceaux de tissu et de digérer de nouveau pendant 7 minutes. Pour le tube surnageant, ajouter 10 ml de solution d'arrêt avec une pipette sérologique différent après chaque addition de surnageant de la digestion.
- Répétez jusqu'à ce que tous les collagénase a été utilisée (7 étapes au total).
- Après l'étape de digestion finale, prendre la forme conique avec la solution de cellules et de filtrer à travers un tamis cellulaire 70μm dans de nouveaux conique.
- Spin cellules vers le bas à 100g pendant 5 minutes et remettre en suspension dans 20 ml de DMEM à être comptés à l'aide d'un hémocytomètre, et placer les cellules sur la glace.
- Placer 50 pl de cellules dans une solution bleu Trypan (75 ul bleu Trypan, 125 ul de PBS), bien mélanger avant de les placer dans les 10 ul hémocytomètre pour le comptage. Les cellules vivantes sont claires tandis que les cellules mortes sont bleus. Attendez environ 3 millions de cellules par raton, avec une viabilité d'environ 80-90%.
5. Construit casting gel de fibrine - préparation pour la création de la fibrine gels (bien fait à l'avance)
Solutions créées dans cette section: solution stock fibrinogène, la thrombine solution mère, Pluronics solution, les médias du myocarde construire.
- Préparer une solution à 33 mg / ml de fibrinogène dans HEPES 20 mM tampon saline à 0,9% par le fibrinogène en mélangeant lentement dans la solution saline tamponnée HEPES pendant plusieurs heures à 37 ° C. Laisser la solution reposer une nuit à 2-8 ° C. Chauffer la solution à 37 ° C. La solution est stérile filtrée par une série de filtres consécutifs: 40 crépines cellules um, um 0,45 bouteilles de verre haut avec filtres pré-filtres, et de 0,2 um bouteille en verre haut avec filtres pré-filtres. La solution est répartie dans 1 ml et 3 ml aliquotes et conservés à -20 ° C.
- Préparer une solution stock de 25 U / ml de la thrombine par l'ajout de 500 U de thrombine à 18 ml de solution saline à 0,9% et 2 mL d'eau déminéralisée stérile, filtre stérile à travers un filtre de 0,2 um, partie aliquote dans 500 ul et 250 aliquotes et congeler à -80 ° C.
- Préparer un 5% p / v Pluronics F-127 solution, en dissolvant 50 g de Pluronics F-127 à 700 ml d'eau déminéralisée. Apportez volume de solution à 1L avec de l'eau déminéralisée supplémentaires. Filtre stérile avec filtre de 0,2 um. La solution peut être utilisée Pluronics jusqu'à trois fois avant de remplacer, si filtré stérile après chaque utilisation.
- Préparer myocarde construire des médias par l'ajout de cheval à 10% de sérum, 2% de sérum de veau fœtal, 1% de pénicilline-streptomycine, et 6 mg / ml-aminocaproïque dans DMEM. 50 pg / ml d'acide ascorbique et de 2 pg / ml d'insuline dans HEPES 25 uM ont besoin d'être ajouté immédiatement avant la tétée.
- Assemblez mandrin en mettant ensemble un barreau de Téflon, un manchon en Téflon, deux rondelles en téflon avec une entaille enlevés à des fins d'injection, et de deux joints toriques en caoutchouc (voir figure 2a). Autoclave avant utilisation.
- Prenez étuis à seringue 6cc pour la partie extérieure du moule et étuis à seringue 3cc à être utilisé comme plongeurs, et de les préparer en coupant les extrémités luer-lock et d'autoclavage (voir figure 2a).
6. Construit casting gel de fibrine - préparation pour la création de gels de fibrine (à droite avant d'effectuer les constructions gel de fibrine)
Les solutions utilisées dans cette section: solution Pluronics
- Filtre stérile de 5% Pluronics F-127 solution avec un filtre de 0,2 um avant utilisation. Placez les mandrins et les boîtiers de la seringue dans la solution Pluronics 5% dans un bécher de 1 L dans la hotte. Laisser les pièces tremper dans la solution Pluronics pendant 2-3 heures dans la hotte pour assurer revêtement complet. La solution Pluronics manteaux les mandrins et empêche le gel de fibrine d'adhérer à des mandrins.
- Après l'incubation de 2-3 heures, versez la solution à 5% Pluronics dans la bouteille, placez des champs stériles sur la surface de la hotte et porter des gants stériles pour construire les moules.
- Placez les mandrins construit dans les 6 étuis à seringue cc, en utilisant la seringue 3cc comme un piston pour assurer une étanchéité entre les joints toriques et des rondelles en téflon.
7. Moulage de fibrine gel des constructions par l'intermédiaire de moulage par injection
Solutions créées dans cette section: la solution F, la solution de T, la solution de la cellule.
- Pour faire 1 ml de gel de fibrine (3,3 mg / ml concentration de fibrinogène final, 25 U / ml final thrombine concentration), de créer la solution F dans un tube conique, en ajoutant 112 ul du stock fibrinogène à 558 ul d'HEPES 20 mM de tampon dans 0,9% de solution saline. Dans un tube séparé conique, de créer une solution T en ajoutant 17 ul du stock de thrombine, et 1,3 l de N 2 Ca + solution + à 135 ul de DMEM. Voir le tableau 1.
- Dans un troisième tube conique, préparer une solution de cellule en faisant tourner le bas les cellules et les remettre en suspension les cellules dans un volume de sorte que la concentration des cellules est de 29,4 millions de cellules / ml ou 6 fois la concentration de la concentration finale désirée de cellules dans la construction
- Lorsque vous êtes prêt à jeter la fibrine gel de la construction, la préparation d'une seringue de 1 mL avec un 18G 1 ½ pouce longue aiguille. Avez-une aiguille 21G 1 pouce prête aussi bien.
- La solution de fibrine est créée à un ratio de solution 04:01:01 F: La solution T: solution de cellule. Pour faire un mL de gel, ajouter 667 uL d'une solution de F dans un tube à centrifuger de 50 mL propre, suivie par 167 uL d'une solution de la cellule et, enfin, ajouter 167 ul de la solution T. Pipette pour mélanger ensemble la solution en faisant attention à ne pas introduire de bulles. Une fois les solutions sont mélangés, la réaction a commencé et l'injection des constructions doit être fait immédiatement.
- Prenez la seringue préalablement préparé avec l'aiguille 18G et d'élaborer une solution de fibrine. Prenez soin de ne pas inverser la seringue pour éviter que des bulles de pénétrer dans l'aiguille. Remplacer l'aiguille avec une aiguille 18G 21G. Tap seringue délicatement pour faire sortir les bulles d'air.
- Insérer la seringue dans le moule entre le bouchon et le boîtier suivant la rainure dans le joint torique en téflon et injecter la solution dans le moule. Inclinez le moule avec la rainure sur le dessus pour assurer le remplissage complet. Retirer la seringue et de continuer à remplir les moules restantes. Assez solution de gel peut être créé pour combler plusieurs moules en même temps. Cependant, parce que la solution gélifie rapidement, il est généralement une bonne idée de limiter le nombre de constructions injecté à un moment donné à 6.
- Enveloppez les moules dans Parafilm en groupes de trois et les placer dans l'incubateur ou un four à 37 ° C. Laisser les gels à incuber dans les moules pendant 20 minutes pour laisser le temps de gel à polymériser.
- Remplir chaque bocal culture (Nalgene droites côté jar) avec 21 ml de milieu de construire du myocarde par construire. Utilisez la seringue stérile de 3 cc boîtier comme un piston pour forcer le mandrin avec la construction dans un grand plat de pétri avec du DMEM. Ensuite, placez la construction dans le pot de l'échantillon. Chaque pot 16 oz peut contenir jusqu'à six concepts, tandis que chaque bocal 4 oz peut contenir 2.
- Vissez les bouchons sur les pots et les transférer à l'incubateur. A l'intérieur de l'incubateur, desserrer les bouchons sur les pots de permettre l'échange de gaz.
- Après 24 heures, prenez un pick stériles dentaires et pousser le concept loin de la blanche téflon joints toriques sur les extrémités du moule anneau pour assurer un alignement uniforme de la construction (voir la figure 2 en résultats représentatifs).
8. Les techniques d'analyse (après 2 semaines de culture) - tests force de contraction
Les solutions utilisées dans cette section: DMEM, infarctus construire des médias.
- Serrer la pince crocodile sur le plomb provenant du stimulateur aux fils sur les électrodes dans le bain. Mettez la carte d'acquisition de données, générateur d'impulsions, et capteur de force. Le capteur de force doit être activée à la mise en 5g et remis à zéro. Ouvrez un programme personnalisé qui affiche LabView et enregistre les données du capteur de force. Créer un nouveau fichier texte vide dans le dossier de données pour chaque échantillon.
- Placez dans le DMEM à 37 ° C bain-marie et laissez du temps pour se réchauffer avant de tester les constructions. Une fois réchauffé, placez 37 ° C dans le bain DMEM moyennes du système de mesure de la force (voir figure 3A).
- Retirez le construire à partir du pot d'échantillon en glissant doucement l'anneau de construire d'un soutien en téflon avec des pincettes et le lieu de la construire sur le poteau de métal fixée dans le bain mesure de la force moyenne du système. Ne tenez pas le construire avec la pince à épiler! Plutôt, utilisez la pince à épiler pour pousser et soulever la construction hors de l'appui du mandrin.
- Placez l'autre extrémité de la construction sur le bras du transducteur et serrer jusqu'à ce que le capteur lit 0.50V, (environ 1,0 grammes vigueur ou 10 millinewtons de tension)
- Sélectionnez le fichier texte pour les données de la force de contraction d'être enregistrées en.
- Sur le stimulateur cardiaque (Modèle # S88X, Technologies Grass), régler la tension de l'impulsion à 20V (8 V / cm), durée 6 ms et un taux de 1 Hz.
- Démarrez le rythme électrique en appuyant sur la "sortie ON / OFF" bouton
- Démarrez l'enregistrement jusqu'à la forme d'onde devient régulière.
- Retirez délicatement la construction de la salle de bain mesure de la force moyenne du système et le replacer dans le milieu de culture. Ensuite, retirer le DMEM du bain mesure de la force moyenne du système et remplacer avec des produits frais, chaud DMEM à analyser additéchantillons ional.
- Couper le construire et le dérouler de telle sorte que vous pouvez mesurer la longueur et la largeur de la construction
- Couper la construction en sections pour être utilisé pour des mesures supplémentaires, y compris l'analyse de viabilité, l'histologie, ou les mesures western blot.
9. Les techniques d'analyse (après 2 semaines de culture) - Live-Morte d'analyse pour la viabilité (avec Invitrogen Live / Dead Assay) 14:
Les solutions utilisées dans cette section: EthD-1 solution de stock, stock de calcéine AM solution de PBS
- Rincer les échantillons avec 3x lave 5 minutes dans du PBS.
- Ajouter 20 ul de 2 mM EthD-1 solution stock à 10 ml de PBS stérile et le vortex pour bien mélanger.
- Ajouter 5 ul de 4 mM calcéine AM stolution actions à EthD-1 solution. Encore une fois, vortex pour assurer un mélange complet.
- Ajouter un volume suffisant de la solution ci-dessus pour couvrir les construire.
- Incuber couvert (pour éviter photoblanchiment des colorants) pendant 30 minutes à température ambiante.
- Retirez les colorants et les remplacer par des chaudes du PBS. Observer et enregistrer les images avec un microscope à fluorescence. Calcéine est excité par la lumière 494 nm et émet 517 nm de lumière, tandis que d'éthidium homodimère-1 est de 528 nm et émet la lumière la lumière 617 nm. Voir Figure 4 pour les résultats de l'échantillon.
10. Les techniques d'analyse (après 2 semaines de culture) - immunohistochimie pour d'importantes protéines myocytes:
Les solutions utilisées dans cette section: PBS, 4% en paraformadehyde PBS, sérum d'âne de 5% dans du PBS, les anticorps en PBS, 0,1 ng / ml dans le PBS Hoechst 33258.
- Rincer les échantillons avec 3x lave 5 minutes dans du PBS.
- Fixer avec du paraformaldéhyde 4% dans une solution de PBS, pendant 2-3 heures à 4 ° C
- Rincer les échantillons avec 3x lave 5 minutes dans du PBS.
- L'échantillon peut maintenant être intégré, sectionnées et colorées selon le protocole de choix. La portion restante de ce protocole couvre toute coloration de construire pour l'imagerie par microscopie confocale. Notez que le temps d'incubation est plus longue que celle des tissus sectionnés comme il doit être plus de temps pour les anticorps de diffuser dans la construction. En outre, toutes les étapes restantes sont réalisées à température ambiante.
- Ajouter 0,1% de Triton-X dans du PBS pour les échantillons pendant 30 minutes pour perméabiliser les membranes cellulaires.
- Rincer les échantillons avec 3x lave 10 minutes dans du PBS.
- Ajouter le sérum d'âne de 5% dans du PBS pour les échantillons pendant 1 heure et demie pour bloquer toute liaison non spécifique de l'anticorps secondaire pour les échantillons.
- Ajouter la connexine 43 (dilution 1:50) et chaînes lourdes de myosine (dilution 1:100) anticorps primaires dans du PBS pour les échantillons pendant 3 heures. Afin de marquer les deux protéines consécutivement, vous devez vous assurer que les anticorps primaires sont de différents hôtes (lapin savoir et la souris).
- Rincer les échantillons avec 3x lave 10 minutes dans du PBS.
- Ajouter la fluorescence appropriée des anticorps secondaires marqués dans du PBS pendant 3 heures.
- Rincer les échantillons avec 3x lave 10 minutes dans du PBS
- Juste avant l'imagerie des échantillons sur le microscope confocal, ajouter 0,1 ng / ml dans le PBS Hoechst 33258 pendant 15 minutes.
- Rincer les échantillons avec 3x lave 10 minutes dans du PBS.
- Analyser l'expression des échantillons de CMH et Cx43 par imagerie des cellules avec un microscope confocal (Voir Figure 4 pour un résultat par exemple).
11. Les résultats représentatifs / résultats:
Les cardiomyocytes de fibrine construire couvre initialement toute la largeur du moule (figure 2B). Pas de bulles doit exister dans le construire et il devrait ressembler uniforme sur toute la longueur. Après deux semaines de culture, le contrat de construire à environ 1 / 4 de la largeur initiale (figure 2C).
Lorsque la construction est électriquement rythme dans notre dispositif de contraction vigueur personnalisé (figure 3A), les données vigueur contraction peut être généré comme indiqué dans la figure 3B. La forme d'onde peuvent être analysés séparément dans MATLAB (The MathWorks) pour déterminer la force, la vitesse de contraction, et le taux de relaxation. Forces Twitch d'environ 1,3 mN sont attendus 6.
La viabilité des cellules de la construction dépend de la profondeur de la construction, en raison des limitations de diffusion de l'oxygène dans la construction. Sur la surface de la construction, la figure 4A, la viabilité cellulaire élevée est observée. Avec la microscopie confocale, la figure 4B, la structure alignée de la construction est observée en raison de la chaînes lourdes de myosine, CMH, est important pour la contraction, représentée en rouge. Connexine 43, représenté en vert, est nécessaire pour le couplage cellulaire entre les myocytes.
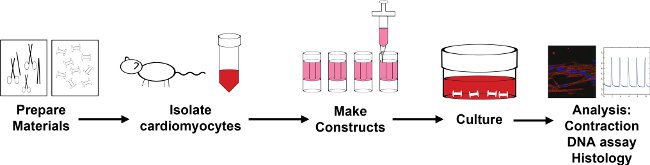
Figure 1: Vue d'ensemble du processus d'encapsulation

Figure 2: Une des pièces) moule séparés et combinés pour créer des gels de fibrine. From à gauche à droite: deux rondelles en téflon, deux joints toriques en silicone, une tige en téflon, un tube en téflon, un mandrin terminé, l'enveloppe extérieure du mandrin, et le piston). B) construire le moule immédiatement après l'éjection de l'enveloppe extérieure (jour 0). C) construire compactée sur le moule (flèche rouge), après 13 jours de culture.
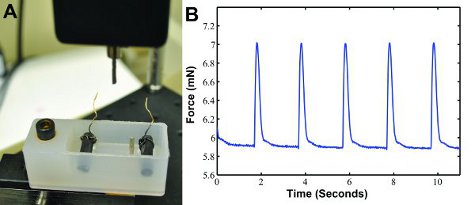
Figure 3: A) le système de mesure personnalisés contraction vigueur pour la force contraction enregistrement. Un capteur de force avec un poste de mesurer la force de contraction et de sorties des résultats dans un ordinateur. Un bain contenant deux électrodes de carbone avec des fils se connecte à un stimulateur électrique qui arpente la construire. Les deux postes organiser la construction en place. B) L'échantillon de données contraction vigueur onde générée par la stimulation électrique à 0,5 Hz.
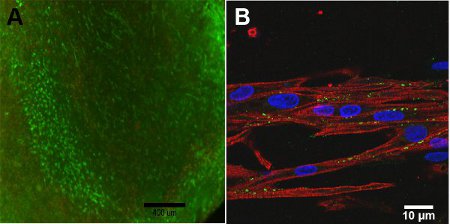
Figure 4: Un test) Live / Dead de construire, jour 13 (échelle = 400 um). Le vert représente les cellules vivantes et le rouge représente les cellules mortes. B) image confocale des chaînes lourdes de myosine (rouge), la connexine 43 (vert) et Hoescht colorant nucléaire (bleu) barre d'échelle (= 10 m).
| Solution F | Solution T | Solution Cellulaire | |||
| Fibrinogène | 112 ul | La thrombine | 17 ul | Les cellules dans du DMEM | 170 ul |
| HEPES | 558μl | Ca + + | 1,3 ul | ||
| DMEM | 152 ul | ||||
| Total des | 670 ul | Total des | 170 ul | Total des | 170 ul |
Tableau 1. Fibrine solutions de gel, les quantités pour 1 ml de gel.
Remarque: Le fibrinogène = 33 mg / ml de fibrinogène dans HEPES 20 mM saline tamponnée
HEPES = 20 mM HEPES solution saline tamponnée
La thrombine = 25 U / ml solution à 0,81% de solution de NaCl
Ca + + = 2 N solution de chlorure de calcium
Discussion
L'encapsulation des cardiomyocytes de rat nouveau-né dans les résultats des gels de fibrine dans une approche cohérente et viable en trois dimensions dans le modèle in vitro du système du myocarde. La fibrine est un biomatériau préféré parce que quand les cellules sont piégées, elles sont métaboliquement actif et capable de compactage, de remodelage et de recréer une matrice extracellulaire qui est compatible avec les tissus du cœur natif 12. Parce que nous permettent les cardiomyocytes de s'aligner dans cet environnement, leur fonctionnalité est plus caractéristique du muscle cardiaque résultant en grande force de la contraction par rapport aux tissus isotrope 6. Pour des applications thérapeutiques potentielles, il est nécessaire d'encapsuler des cellules au sein d'un matériau qui favorise à la fois la viabilité et la fonctionnalité. Les protocoles présentés ici démontrent un moyen efficace et précis pour la création d'un réseau de fibrine pour contrôler le comportement des cellules cardiaques dans un microenvironnement tridimensionnel.
Quelques problèmes potentiels peuvent survenir lors de la création et la culture de ces constructions. Un problème potentiel est le maintien de la viabilité cellulaire avant d'encapsulation, qui affectera considérablement la fonctionnalité de la construire. Des efforts devraient être faits pour limiter la mort cellulaire suite à l'isolement en réduisant le délai entre l'isolement et l'encapsulation des cellules à l'intérieur du gel de fibrine. Construit devraient être fournis les médias tous les autres jours sur un calendrier strict. En outre, il est important d'assurer l'homogénéité dans l'ensemble des solutions utilisées. Si le mélange de fibrinogène, la thrombine et les cellules produisent un environnement hétérogène, la capacité des cellules à remodeler l'ECM, mécaniquement couple et du contrat est potentiellement obstrué. Il est également important pour éviter la formation de bulles d'air lors de l'injection des constructions afin d'éviter des perturbations dans la continuité de l'ingénierie tissulaire. Une façon de pallier ce problème est attirer plus de gel que nécessaire pour faire la construction dans la seringue et injecter lentement. Enfin, une fois la matrice de fibrine s'est fixé et a été en milieu de culture pendant 24 heures, il est indispensable de détacher le construire à partir des côtés du moule de bague de promouvoir la compaction des cellules à base de gel de fibrine. Garder la construction au milieu du moule facilite l'échange de gaz et des nutriments. L'adhésion à des côtés du moule anneau peut aussi perturber l'alignement désiré cellulaire.
Il est important de noter que la décapitation conscient est utilisé comme méthode d'euthanasie dans ce protocole, qui est une méthode acceptable en vertu des directives à la fois du National Institutes of Health et de l'American Veterinary Medical Association. Toutefois, certaines institutions recommandent l'utilisation d'anesthésie suivie par décapitation pour les rats néonatals. Nous avons choisi la décapitation consciente parce qu'elle garantit le minimum de temps dans des conditions hypoxiques pour le tissu cardiaque excisée / cellules. Quantités relativement faibles de l'hypoxie peut entraîner une ischémie des myocytes et la mort potentiellement myocytes, ce qui pourrait affecter significativement les résultats de ce protocole.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Ce travail a été soutenu par le National Institutes of Health - National Heart, Lung and Blood Institute (Prix # R00HL093358 au LDB).
matériels
| Name | Company | Catalog Number | Comments |
| Nom de réactif | Société | Numéro de catalogue | Commentaires |
|---|---|---|---|
| Le chlorure de sodium | Sigma | S7653 | PBS |
| Le chlorure de potassium | Sigma | P9333 | PBS |
| Phosphate disodique | Sigma | S7907 | PBS |
| Phosphate de potassium monobasique | Sigma | P5655 | PBS |
| Le glucose | Sigma | G5400 | Isolement |
| hémostatique | Outils Fine Science | 91308-12 | Isolement |
| fines pinces | Outils Fine Science | 11251-20 | Isolement |
| gros ciseaux | Outils Fine Science | 91401-14 | Isolement |
| micro-ciseaux | Outils Fine Science | 91501-09 | Isolement |
| Manche de bistouri | Outils Fine Science | 10008-13 | Isolement |
| bistouri lame | Fisher Scientific | 08 à 918-5A | Isolement |
| Thibaude banc Absorbant | VWR | 56617-014 | Isolement |
| champ stérile | Fisher Scientific | GM42526 | Isolement |
| Sac autoclave | Fisher | 01-812-54 | Isolement |
| tampon de gaze | Fisher Scientific | 13-761-52 | Isolement |
| bétadine | Produits de Purdue | 67618-150-01 | Isolement |
| des gants stériles | Fisher Scientific | 19-020 | Isolement |
| pipette de transfert stérile | Fisher Scientific | 9962 | Isolement |
| collagénase | Worthington | CLS2 | Isolement |
| Teflon tige 1 / 4 pouce de diamètre | McMaster-Carr | 8546K11 | Partie de moule |
| ID tube en téflon 1 / 4 pouce, 1 / 2 pouce OD | McMaster-Carr | 8547K31 | Partie de moule |
| Silicone O-Ring ID 1 / 4 pouce, 1 / 2 pouce OD | McMaster-Carr | 9396K204 | Partie de moule |
| Tube en téflon 1 / 4 pouces ID, 5 / 16 pouces OD | McMaster-Carr | 52355K14 | Partie de moule |
| Kendall seringues Monoject 6cc | Fisher Scientific | 05-561-41 | Partie de moule |
| BD seringue 3cc | Fisher Scientific | 309585 | Partie de moule |
| Fibrinogène Bovin | Sigma | F8630 | Construire des |
| Thrombine bovine | Sigma | T7513 | Construire des |
| 1 M HEPES | Sigma | H0887 | Construire des |
| Chlorure de sodium | Sigma | S7653 | Construire des |
| DMEM | Invitrogen | 10569 | Construire des |
| Pluronic F-127 | Sigma | P2443 | Construire des |
| Chlorure de calcium | Sigma | 383147 | Construire des |
| 0,2 micron | Fisher Scientific | SCGVT05RE | Construire des |
| Crépines de cellules de 40 microns | Fisher Scientific | 22-363-547 | Construire des |
| Filtre de 0,45 microns bouchon de bouteille | Corning | 430627 | Construire des |
| de verre pré-filtre | Millipore | AP2007500 | Construire des |
| 18G 1 1 / 2 pouce de long aiguilles | Fisher Scientific | 14 à 826-5D | Construire des |
| Aiguille 21G 1 pouce | Fisher Scientific | 14-826C | Construire des |
| construire des jarres | Fisher Scientific | 2116 | Construire des |
| Pénicilline-streptomycine | Invitrogen | 15140 | Médias |
| sérum de cheval | Sigma | H1138 | Médias |
| Sérum fœtal bovin | Invitrogen | 16000 | Médias |
| l'acide aminocaproïque | Acros Organics | 103305000 | Médias |
| l'acide ascorbique | Sigma | A5960 | Médias |
| l'insuline | Sigma | I9278 | Médias |
| Paraformaldéhyde, 16% | Sciences Electron Microscopy | 15710 | Histologie |
| Température de coupe optimale (PTOM) | Ted Pella | 27050 | Histologie |
| 2-méthylbutane | Fisher | 03551-4 | Histologie |
| Souris MYH1/2/4/6 anticorps primaire | Santa Cruz Biotechnology | SC-32732 | Histologie |
| Lapin connexine 43 anticorps primaire | Technologie signalisation cellulaire | 3512 | Histologie |
| Dylight 549-conjugué âne anti-souris anticorps secondaire | Jackson ImmunoResearch Laboratories | 715-505-151 | Histologie |
| Dylight 488-conjugué Donke anticorps anti-lapin secondaire | Jackson ImmunoResearch Laboratories | 711-485-152 | Histologie |
| Live / Dead test | Invitrogen | L-3224 | Analyse |
Références
- Stegemann, J. P., Hong, H., Nerem, R. M. Mechanical, biochemical, and extracellular matrix effects on vascular smooth muscle cell phenotype. Journal of applied physiology. 98, 2321-2327 (2005).
- Guarnieri, D. Covalently immobilized RGD gradient on PEG hydrogel scaffold influences cell migration parameters. Acta. 6, 2532-2539 (2010).
- Krebs, . Injectable poly(lactic-co-glycolic) acid scaffolds with in situ pore formation for tissue engineering. Acta. 5, 2847-2859 (2009).
- Zimmermann, W. -. H. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature. 12, 452-458 (2006).
- Chung, C., Burdick, J. A. Influence of Three-Dimensional Hyaluronic Acid Stem Cell Chondrogenesis. Tissue engineering. 15, (2009).
- Black, L. D. Cell-induced alignment augments twitch force in fibrin gel-based engineered myocardium via gap junction modification. Tissue engineering. 15, 3099-3108 (2009).
- Syedain, Z. H., Weinberg, J. S., Tranquillo, R. T. Cyclic distension of fibrin-based tissue constructs: evidence of adaptation during growth of engineered connective tissue. Proceedings of the National Academy of Sciences of the United States of America. 105, 6537-6542 (2008).
- Falvo, M. R., Gorkun, O. V., Lord, S. T. The molecular origins of the mechanical properties of fibrin. Biophysical chemistry. , 152-155 (2010).
- Jockenhoevel, S. Fibrin gel - advantages of a new scaffold in cardiovascular tissue engineering. European journal of cardio-thoracic surgery : official journal of the European Association for Cardio-thoracic Surgery. 19, 424-430 (2001).
- Ryan, E. Structural Origins of Fibrin Clot Rheology. Biophysical Journal. 77, 2813-2826 (1999).
- Williams, C. Cell sourcing and culture conditions for fibrin-based valve constructs. Tissue engineering. 12, 1489-1502 (2006).
- Grassl, E. D., Oegema, T. R., Tranquillo, R. T. A fibrin-based arterial media equivalent. Journal of biomedical materials research. 66 (Part A. , 550-561 (2003).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of biomechanical engineering. 119, 137-145 .
- Invitrogen. . >LIVE/DEAD Viability/Cytotoxicity Kit *for mammalian cells. , (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon