Method Article
Verkapselung von Kardiomyozyten in einer Fibrin-Hydrogel für Cardiac Tissue Engineering
In diesem Artikel
Zusammenfassung
Wir beschreiben die Isolierung von neonatalen Kardiomyozyten und die Vorbereitung der Zellen für die Verkapselung in Fibrin-Hydrogel-Konstrukte für das Tissue Engineering. Wir beschreiben Methoden zur Analyse der Gewebezüchtung Myokard nach der Kultur Zeitraum einschließlich der aktiven Kraft auf elektrische Stimulation und die Lebensfähigkeit der Zellen und immunhistologische Färbung erzeugt.
Zusammenfassung
Kultivieren von Zellen in einer dreidimensionalen Umgebung Hydrogel ist eine wichtige Technik für die Entwicklung Konstrukte für das Tissue Engineering sowie dem Studium zellulärer Reaktionen unter verschiedenen Kulturbedingungen in vitro. Die dreidimensionalen Umgebung genauer imitiert, was die Zellen in vivo beobachten, durch die Anwendung von mechanischen und chemischen Reizen in allen Dimensionen 1. Dreidimensionale Hydrogele können entweder aus synthetischen Polymeren wie PEG-DA 2 und PLGA 3 oder eine Reihe von natürlich vorkommenden Proteinen wie Kollagen 4, Hyaluronsäure 5 oder Fibrin 6,7 vorgenommen werden. Hydrogele aus Fibrin, einem natürlich vorkommenden Blutgerinnungsproteins, erstellt wurden, können polymerisieren zu einem Netz, das Teil des körpereigenen natürlichen Wundheilung 8 ist zu bilden. Fibrin ist Zell-abbaubar und potenziell autologen 9, ist damit ein idealer temporäre Gerüst für das Tissue Engineering.
Hier haben wir im Detail beschreiben die Isolierung von neonatalen Kardiomyozyten aus drei Tage alten neugeborenen Ratten und die Vorbereitung der Zellen für die Verkapselung in Fibrin-Hydrogel-Konstrukte für das Tissue Engineering. Neonatal Myozyten sind eine häufige Quelle für Zellen in vitro-Studien im Herzgewebe Bildung und Technik 4 verwendet. Fibrin-Gel wird durch Mischen von Fibrinogen mit dem Enzym Thrombin erstellt. Thrombin spaltet Fibrinopeptide FpA und FpB aus Fibrinogen und enthüllt Bindungsstellen, die mit anderen Monomeren 10 zusammenwirken. Diese Wechselwirkungen führen die Monomere in Fasern, die das Hydrogel Mesh Form selbst zusammen. Da der Zeitpunkt für diese enzymatische Reaktion, indem das Verhältnis von Thrombin, Fibrinogen oder das Verhältnis von Calcium zu Thrombin eingestellt werden kann, kann man Spritzgießwerkzeug Konstrukte mit einer Reihe von unterschiedlichen Geometrien 11,12. Weiterhin können wir die Ausrichtung der resultierenden Gewebe, wie wir beschränken das Gel während der Kultur 13 erzeugen.
Nach Kultivierung der technisch Herzgewebe Konstrukte für zwei Wochen unter statischen Bedingungen, die Herzzellen begonnen, das Konstrukt umgestalten und kann eine Kontraktion Kraft unter elektrischer Stimulation Bedingungen 6 zu erzeugen. Als Teil dieses Protokoll, beschreiben wir auch Methoden zur Analyse der Gewebezüchtung Myokard nach der Kultur Zeitraum einschließlich der funktionalen Analyse der aktiven Kraft des Herzmuskels erzeugt bauen auf elektrische Stimulation, sowie Methoden zur Bestimmung der endgültigen Lebensfähigkeit der Zellen (Live-Dead assay) und immunhistologische Färbung, um den Ausdruck und die Morphologie der typischen Proteine wichtig für die Kontraktion (Myosin Heavy Chain oder MHC) und zellulären Kopplung (Connexin 43 oder Cx43) zwischen Myozyten zu untersuchen.
Protokoll
1. Neonatal Kardiomyozyten isoliert - Vorbereitung (am Vortag)
Lösungen in diesem Abschnitt erstellt: PBS-Glucose-Lösung, stop Medien.
- Bereiten Sie eine PBS-Glukose-Lösung durch Zugabe von 5 ml Penicillin-Streptomycin (100 Einheiten / ml und 100 ug / ml) und 1,98 g Glucose in 250 ml 1x steriler Phosphat-gepufferter Salzlösung (PBS) und bringen Volumen der Lösung auf 500 ml mit zusätzlicher sterile 1x PBS.
- Bereiten Sie stoppen Medien durch Zugabe von 25 ml FBS und 5 ml Penicillin-Streptomycin (gleiche Konzentration wie oben) bis 250ml sterile Dulbecco modifiziertem Eagle-Medium (DMEM) und bringen Sie die Lautstärke auf 500 ml mit sterilem DMEM vor sterile Filtration über einen 0,2-Mikrometer-Filter.
- Sterilisieren chirurgische Instrumente für die Isolierung durch Autoklavieren erforderlich: a hemostat, Nr. 5 Pinzetten, große Schere, Mikro-Schere und Skalpell Griff (# 4).
2. Neonatal Kardiomyozyten isoliert - Vorbereitung (Tag der Ernte)
Achten Sie darauf, um die Sterilität zu erhalten
Lösungen in diesem Abschnitt verwendet: PBS-Glucoselösung, Betadine
- Für jeden Wurf, nehmen Sie die zwei sterilen 100 mm Petrischalen, legen Sie sie in der Kapuze und füllen sich mit ~ 10 ml eiskaltem PBS-Glucose. Diese sollten dann in einem Eiskübel mit Eis in der sterilen Kultur Haube gefüllt platziert werden.
- Legen Sie ein 250 mL Becherglas mit 30-40 ml Betadine in die Haube.
- 50 ml / Wurf von PBS-Glukose in eine Flasche, Dichtung und stecken in einem 37 ° C Wasserbad.
- Für jede Person, saugfähiges Bank auf der Motorhaube Arbeitsfläche underpad Ort und einem sterilen Tuch auf und achten nicht auf die Mitte Arbeitsbereich der sterilen Tuch zu berühren. Dump der chirurgischen Instrumente und eine 4 x 4 Gaze auf den sterilen Tuch ohne Berührung der Instrumente. Öffnen Sie eine sterile Nr. 20 Skalpell und Dump auf drapieren, wieder darauf achten, nicht mit nicht-sterilen Handschuhen berühren.
- Nehmen Sie den Welpen aus dem Damm und in einen undurchsichtigen Behälter legen Welpen in die Haube
- Anlegen von sterilen Handschuhen
- Falten Sie die Gaze in Quarten, mit hemostat und in einen Becher Betadine Klemme.
- Legen Sie die Skalpell auf das Skalpell Griff und beiseite stellen.
3. Neonatal Kardiomyozyten isoliert - Herz Dissektion
Lösungen in diesem Abschnitt verwendet: Betadine, PBS-Glucoselösung
- Nehmen Sie den Welpen in Ihrer nicht-dominanten Hand durch Kneifen der Haut zwischen den Schulterblättern zwischen Daumen und Zeigefinger. Mit der großen Schere, enthaupten die Welpen in einem Schnitt. Achten Sie darauf, von der Rückseite des Welpen nach vorne geschnitten, um sicherzustellen, dass die Wirbelsäule vollständig durchtrennt ist.
- Swab der Welpe die Brust mit der betadine getränkte Gaze. Sichern Sie den Welpen durch Kneifen der Schulterblätter zusammen. Führen teilweise Thorakotomie das Herz aussetzen. Erhöhen Anpressdruck, wodurch zwangsläufig das Herz hinter der Rippen für scalpular Dissektion.
- Führen Sie das Skalpell hinter dem Herzen der großen Gefäße zu durchtrennen und entfernen das Herz. Legen Sie das Herz in der Petrischale mit PBS-Glukose, die auf dem Eis ist.
- Wiederholen Sie die Schritte 1-3 für jeden Welpen im Wurf.
4. Neonatal Kardiomyozyten isoliert - Myozyten Isolation
Lösungen erstellt / in diesem Abschnitt verwendet: PBS-Glucoselösung, Kollagenase-Lösung, Stop-Lösung
- Sobald die Herzen isoliert wurden, entfernen Sie alle verbleibenden Blut und Bindegewebe durch Spülen in eiskaltem PBS Glucose-Lösung, entfernen Sie die obere 1 / 3 des Herzens, um nur die ventrikuläre Gewebe und in einen frischen Petrischale mit eiskaltem isolieren PBS Glukose, vorbereitet früher.
- Sorgfältig mince die Herzen in ~ 1 Kubikmeter mm mit dem Mikro-Schere und Pinzette.
- Werfen Sie einen sterilen Transferpipette, schneiden Sie die Spitze mit einer Schere, so dass die Mündung der Pipette ist ~ 3 mm im Durchmesser. Verwenden Sie die Pipette auf die Gewebestücke und die gesamte Lösung in einen 50 ml konische und auf Eis zu übertragen.
- Abwiegen 15.000 Einheiten pro Wurf von Welpen vom Typ II Kollagenase (Einheiten / mg ist abhängig von der Menge) aufnehmen und in die Flasche von 37 ° C erwärmt PBS-Glucose zuvor Kollagenase-Lösung erstellen vorbereitet. Gut mischen und sterile Filter in einer separaten Flasche. Legen Sie wieder in das 37 ° C Wasserbad. Legen Sie die Stopp-Lösung in die 37 ° C Wasserbad sowie.
- Lassen Sie das zerkleinerte Gewebe auf den Grund des Zentrifugenröhrchen begleichen. Entfernen Sie den Überstand bis das Gesamtvolumen beträgt ~ 10 mL. Add 7 ml Kollagenase-Lösung, die Zentrifugenröhrchen.
- Legen Sie die konische Röhre mit der Gewebestücke und die Kollagenase in ein Rohr Rack auf einem Schüttler in einem 37 ° C Inkubator oder im Ofen. Drehen Sie den Orbitalschüttler auf etwa 60 Umdrehungen pro Minute und die Tür schließen. Stellen Sie einen Timer für 7 Minuten. Achten Sie darauf, die Kollagenase bac Ortk in das Wasserbad, damit es warm.
- Wenn der Timer aktiviert wird, bringen die konische zurück in die Kapuze. Auch bringen die warme Kollagenase und Stopp-Lösung in der Motorhaube. Vorsichtig titrieren die Gewebestücke 5-7 mal, um sie aufzubrechen. Nach Titration, damit die Stücke auf den Grund (2-3 Minuten) zu begleichen. Absaugen so viel von der Überstand wie möglich, sehr vorsichtig nicht zu saugen die Gewebestücke. Anschließend werden 7 ml Kollagenase-Lösung, um das Gewebe Stücke schneiden und wieder in den Inkubator auf dem Schüttler für 7 Minuten.
- Für jeden weiteren Schritt, sanft werden 10-mal zum Aufbrechen der Gewebestücke. Sobald die Gewebestücke niederzulassen, ziehen den Überstand ab und sammeln sie in einem separaten 50 ml konisch. Add 7 ml Kollagenase auf die Gewebestücke und verdauen wieder für 7 Minuten. Zu dem Überstand Rohr, 10 ml Stop-Lösung mit einer anderen serologischen Pipette nach jeder Zugabe von Überstand aus der Verdauung.
- Wiederholen, bis alle der Kollagenase verwendet wurde (7 Stufen insgesamt).
- Nach der endgültigen Verdauung Schritt, nehmen Sie die konische mit der Zell-Lösung und filtriert durch 70μm Zellsieb die frische konisch.
- Spin Zellen nach unten auf 100g für 5 Minuten und resuspendieren in 20 ml DMEM gezählt unter Verwendung eines Hämocytometers werden, und legen Sie die Zellen auf Eis.
- Platz 50 ul der Zellen in eine Trypanblau-Lösung (75 ul Trypanblau, 125 ul PBS), gut mischen, bevor Sie 10 pl in der Zählkammer zum Zählen. Lebende Zellen sind klar, während tote Zellen blau sind. Erwarten Sie etwa 3 Millionen Zellen pro Jungtier, mit einer Tragfähigkeit von ca. 80-90%.
5. Casting Fibringel Konstrukte - Vorbereitung für die Erstellung von Fibringele (weit im Voraus geschehen)
Lösungen in diesem Abschnitt erstellt: Fibrinogen-Stammlösung, Thrombin-Stammlösung, Pluronics Lösung, Myokardinfarkt konstruieren Medien.
- Bereiten Sie eine 33 mg / ml Stammlösung von Fibrinogen in 20 mM HEPES-Puffer in 0,9% iger Kochsalzlösung durch langsames Mischen Fibrinogen in der HEPES gepuffert über mehrere Stunden Kochsalzlösung bei 37 ° C. Lassen Sie die Lösung über Nacht absetzen bei 2-8 ° C. Wärmen Sie die Lösung auf 37 ° C. Die Lösung wird steril filtriert durch eine Reihe von aufeinander folgenden Filter: 40 um Zelle Siebe, 0,45 um Flasche top-Filter mit Glas Vorfilter und 0,2 &mgr; Flasche Aufsatzfilter mit Glas Vorfilter. Die Lösung wird in 1 ml und 3 ml Aliquots aliquotiert und bei -20 ° C.
- Bereiten Sie eine 25 U / ml Stammlösung von Thrombin durch Zugabe von 500 U Thrombin zu 18 ml 0,9% iger Kochsalzlösung und 2 ml sterilem, deionisiertem Wasser, sterile Filter, durch einen 0,2 um Filter, Aliquot in 500 ul und 250 ul Aliquots und frieren bei -80 ° C.
- Bereiten Sie eine 5% w / v Pluronics F-127-Lösung, die durch Auflösen von 50 g Pluronics F-127 bis 700 mL VE-Wasser. Bringt Volumen der Lösung bis zu 1L mit zusätzlichen deionisiertem Wasser. Sterilfilter mit 0,2 um-Filter. Die Pluronics Lösung kann bis zu dreimal verwendet werden, bevor ausgetauscht werden, wenn nach jedem Gebrauch sterilfiltriert.
- Bereiten myokardialen konstruieren Medien durch Zugabe von 10% Pferdeserum, 2% fötalem Rinderserum, 1% Penicillin-Streptomycin und 6 mg / mL-Aminocapronsäure in DMEM. 50 ug / ml Ascorbinsäure und 2 pg / ml Insulin in 25 uM HEPES müssen sofort vor der Fütterung ergänzt werden.
- Montieren Dorn, indem zusammen ein Teflon-Rührstäbchen, einem Teflon-Buchse, zwei Teflon-Scheiben mit einer Kerbe für Injektionszwecke entfernt, und zwei Gummi-O-Ringe (siehe Abbildung 2a). Autoclave vor dem Gebrauch.
- Nehmen Sie 6 cc Spritze Gehäuse für die äußere Teil der Form und 3cc Spritze Gehäuse als Stempel verwendet werden, und bereiten sie durch das Abschneiden der Luer-Lock-Enden und Autoklavieren (siehe Abbildung 2a).
6. Casting Fibringel Konstrukte - Vorbereitung für die Erstellung von Fibringele (rechts, bevor sie das Fibrin-Gel-Konstrukte)
Lösungen in diesem Abschnitt verwendet: Pluronics Lösung
- Sterilfilter die 5% Pluronics F-127-Lösung mit einer 0,2 um-Filter vor dem Gebrauch. Legen Sie Dorne und Spritze Gehäuse in 5% Pluronics Lösung in einem 1 L Becherglas in der Motorhaube. Lassen Sie die Teile Einweichen in der Pluronics Lösung für 2-3 Stunden in der Haube, um eine vollständige Beschichtung zu gewährleisten. Die Pluronics Lösung beschichtet die Dorne und verhindert, dass die Fibrin-Gel an der Einhaltung der Dornen.
- Nach der 2-3 stündigen Inkubation, gießen Sie die 5% Pluronics Lösung in die Flasche zurück, legen sterilen Tüchern nach unten auf die Oberfläche der Motorhaube und trage sterile Handschuhe an den Formen zu konstruieren.
- Legen Sie die konstruiert Dorne in den 6 cc Spritze Gehäuse, mit dem 3cc Spritze als Kolben, um eine gute Abdichtung zwischen der O-Ringe und Teflon Unterlegscheiben zu gewährleisten.
7. Casting Fibringel Konstrukte durch Spritzgießen
Lösungen in diesem Abschnitt erstellt: F-Lösung, T-Lösung, Zell-Lösung.
- Um 1 ml Fibringel (3,3 mg / mL letzten Fibrinogenkonzentration, 25 U / mL letzten Thrombin-Konzentration), erstellen Sie F-Lösung in einem konischen Rohr, indem 112 ul der Fibrinogen-Aktie auf 558 ul 20 mM HEPES-Puffer in 0,9% iger Kochsalzlösung. In einem separaten konischen Rohr, erstellen Sie eine T-Lösung durch Zugabe 17 ul des Thrombin-Lager, und 1,3 ul 2 N Ca + +-Lösung zu 135 ul DMEM. Siehe Tabelle 1.
- In einem dritten konischen Rohr, bereiten eine Zelle Lösung indem sie zum Stillstand der Zellen und Resuspension der Zellen in einem Volumen, so dass die Konzentration der Zelle 29,4 Mio. Zellen / ml oder 6-fache Konzentration der gewünschten Endkonzentration von Zellen in das Konstrukt
- Wenn Sie bereit sind, die Fibringel konstruieren, prep einer 1 ml Spritze mit einer 18G 1 ½ Zoll lange Nadel gegossen werden. Have a 21G 1 inch Nadel bereit sowie.
- T-Lösung: Cell-Lösung Das Fibrin Lösung wird bei einem 4:1:1-Verhältnis von F-Lösung geschaffen. Um ein ml Gel, fügen Sie 667 ul von F-Lösung in ein sauberes 50 ml-Zentrifugenröhrchen, um 167 ul der Zell-Lösung und schließlich add 167 ul von T-Lösung. Pipette zur Lösung vermischen man aufpassen, nicht zu Blasen führen. Sobald Lösungen gemischt werden, ist die Reaktion gestartet und die Injektion der Konstrukte sollte sofort erfolgen.
- Nehmen Sie die zuvor vorbereiteten Spritze mit der 18G Nadel und erarbeiten Fibrin-Lösung. Achten Sie darauf, nicht auf die Spritze auf Luftblasen nicht in die Nadel zu verhindern umzukehren. Ersetzen 18G Nadel mit einer 21G Nadel. Tippen Spritze sanft zu zwingen, alle Luftblasen.
- Legen Spritze in der Form zwischen dem Anschlag und dem Gehäuse nach der Nut in der Teflon-O-Ring und injizieren Sie die Lösung in der Form. Kippen Sie die Form mit der Nut auf der Oberseite, um eine vollständige Füllung zu versichern. Entfernen Sie die Spritze und sich auf die verbleibenden Formen füllen. Genug Gel-Lösung erstellt werden, um mehrere Formen zur gleichen Zeit zu füllen. Da jedoch die Lösung Gele schnell, es ist generell eine gute Idee, um die Anzahl der Konstrukte zu einem bestimmten Zeitpunkt zu 6 injiziert zu begrenzen.
- Wickeln Sie die Formen in Parafilm in Gruppen von drei und in den Inkubator oder im Ofen bei 37 ° C. Lassen Sie die Gele in die Formen für 20 Minuten inkubieren, damit das Gel Zeit zu polymerisieren.
- Füllen Sie jede Kultur jar (Nalgene straight-Seite jar) mit 21 mL der myokardialen konstruieren Medium pro Konstrukt. Verwenden Sie die sterile 3 cc Spritze Gehäuse, so wie ein Stempel auf den Dorn mit dem Konstrukt Kraft in eine große Petrischale mit DMEM. Dann legen Sie das Konstrukt in die Probe jar. Jede 16 Unzen Glas kann bis zu 6 Konstrukte halten, während jede 4 Unzen jar 2 halten können.
- Schrauben Sie den Deckel auf die Gläser und übertragen Sie sie in den Inkubator. Im Inneren des Inkubators, lösen Sie die Kappen an den Gläsern für den Gasaustausch ermöglichen.
- Nach 24 Stunden dauern sterile Zahnstocher und schieben Sie den weg zu konstruieren aus der weißen Teflon O-Ringe an den Enden der Ringform, um eine einheitliche Ausrichtung der Konstruktion zu gewährleisten (siehe Abbildung 2 in repräsentative Ergebnisse).
8. Analyse-Techniken (nach 2 Wochen in Kultur) - Schrumpfkraft Tests
Lösungen in diesem Abschnitt verwendet: DMEM, Myokardinfarkt konstruieren Medien.
- Klemmen Sie die Krokodilklemmen an der Leine aus dem Stimulator, um die Drähte an den Elektroden in der Badewanne. Schalten Sie den Messkarte, Impulsgeber und Kraftaufnehmer. Der Kraftaufnehmer sollten die 5g Einstellung eingeschaltet und auf Null gesetzt. Öffnen Sie eine benutzerdefinierte LabView-Programm, und zeigt speichert die Daten aus dem Kraftaufnehmer. Erstellen Sie eine neue, leere Textdatei in den Ordner Data für jede Probe.
- Legen Sie DMEM in die 37 ° C Wasserbad und genügend Zeit für das Aufwärmen vor dem Test die Konstrukte. Einmal erwärmt, statt 37 ° C DMEM in das Medium Bad der Kraftmessung (siehe Abbildung 3A).
- Entfernen Sie das Konstrukt aus der Probe jar durch Schieber vorsichtig das Konstrukt Ring aus Teflon mit einer Pinzette und Ort des Konstrukts über die feste Metall Schreiben Sie in die Kraft-Messsystem Medium Bad. Nicht Griff das Konstrukt mit der Pinzette! Vielmehr nutzen die Pinzette zu schieben und heben das Konstrukt aus der Dorn abstützen.
- Legen Sie das andere Ende des Konstrukts über den Wandler Arm und ziehen, bis der Wandler liest 0.50V, (etwa 1,0 Gramm Kraft oder 10 Millinewton der Spannung)
- Wählen Sie die Textdatei für die Kontraktionskraft Daten in aufgezeichnet werden.
- Auf der Herzstimulator (Model # S88X, Grass Technologies), stellen Sie die Impulsspannung bis 20V (8 V / cm), 6 ms Dauer und einer Rate von 1 Hz.
- Starten Sie die elektrische Stimulation durch Drücken der "Output on / off"-Taste
- Starten Sie die Aufnahme, bis Wellenform wird regulär.
- Entfernen Sie vorsichtig das Konstrukt aus der Kraft-Messsystem Medium Bad und legen Sie sie zurück in Kulturmedium. Dann entfernen Sie die DMEM aus der Kraft-Messsystem Medium Bad und ersetzen mit frischen, warmen DMEM addit analysierenional Proben.
- Cut das Konstrukt und rollen es so, dass man die Länge und Breite des Konstrukts messen
- Schneiden Sie das Konstrukt in Abschnitte für die weitere Analyse-Messungen einschließlich Lebensfähigkeit, Histologie, oder Western-Blot-Messungen eingesetzt werden.
9. Analyse-Techniken (nach 2 Wochen in Kultur) - Live-Dead-Assay für die Lebensfähigkeit (mit Invitrogen Live / Dead Assay) 14:
Lösungen in diesem Abschnitt verwendet: EthD-1-Stammlösung, Calcein AM Stammlösung PBS
- Spülen Proben mit 3x 5 Minuten Waschen in PBS.
- Add 20 ul 2 mM EthD-1-Stammlösung auf 10 ml steriler PBS und Wirbel für eine gute Durchmischung zu gewährleisten.
- Add 5 ul 4 mM Calcein AM Lager stolution zu EthD-1-Lösung. Wieder zu einem Wirbel eine gute Durchmischung.
- Add genug Volumen der obigen Lösung, um das Konstrukt zu decken.
- Inkubieren abgedeckt (um zu verhindern Ausbleichen der Farbstoffe) für 30 Minuten bei Raumtemperatur.
- Entfernen Sie die Farbstoffe und ersetzen mit warmem PBS. Beobachten und Aufnehmen von Bildern mit einem Fluoreszenzmikroskop. Calcein wird durch 494 nm-Licht angeregt und emittiert 517 nm Licht, während Ethidium Homodimer-1 wird von 528 nm und emittiert 617 nm Licht. Siehe Abbildung 4 für die Probenvorbereitung Ergebnisse.
10. Analyse-Techniken (nach 2 Wochen in Kultur) - Immunhistochemie für wichtige Myozyten Proteine:
Lösungen in diesem Abschnitt verwendet: PBS, 4% paraformadehyde in PBS, 5% Esel-Serum in PBS, Antikörper in PBS, 0,1 ng / mL Hoechst 33258 in PBS.
- Spülen Proben mit 3x 5 Minuten Waschen in PBS.
- Fix mit 4% Paraformaldehyd in PBS-Lösung, für 2-3 Stunden bei 4 ° C
- Spülen Proben mit 3x 5 Minuten Waschen in PBS.
- Die Probe kann nun eingebettet werden geschnitten und gefärbt nach dem Protokoll der Wahl. Der verbleibende Teil dieses Protokoll deckt gesamte Konstrukt Färbung für die Bildgebung mit der konfokalen Mikroskopie. Beachten Sie, dass die Inkubationszeit länger als die für geschnittene Gewebe, wie es braucht, um mehr Zeit für die Antikörper werden in den Bau diffus. Darüber hinaus sind alle weiteren Schritte bei Raumtemperatur durchgeführt.
- Add 0,1% Triton-X in PBS, um die Proben für 30 Minuten, um die Zellmembranen permeabilisiert.
- Spülen Sie die Proben mit 3x 10 Minuten Waschen in PBS.
- Add 5% Esel-Serum in PBS, um die Proben für 1 ½ Stunden, um alle nicht-spezifische Bindung des sekundären Antikörpers zu den Proben zu blockieren.
- Add Connexin 43 (1:50 Verdünnung) und Myosin Heavy Chain (1:100 Verdünnung) Primärantikörper in PBS, um die Proben für 3 Stunden. Um beide Proteine Etikett nacheinander müssen Sie sicherstellen, dass der primäre Antikörper von verschiedenen Hosts (dh Kaninchen und Maus) sind.
- Spülen Sie die Proben mit 3x 10 Minuten Waschen in PBS.
- Fügen Sie die entsprechenden fluoreszenzmarkierten Sekundärantikörper in PBS für 3 Stunden.
- Spülen Sie die Proben mit 3x 10 Minuten Waschen in PBS
- Kurz vor der Abbildung der Proben auf dem konfokalen Mikroskop, fügen 0,1 ng / ml Hoechst 33258 in PBS für 15 Minuten.
- Spülen Sie die Proben mit 3x 10 Minuten Waschen in PBS.
- Analysieren Sie die Proben Expression von MHC und Cx43 durch bildgebende die Zellen mit einem konfokalen Mikroskop (siehe Abbildung 4 zum Beispiel Ergebnis).
11. Repräsentative Ergebnisse / Ergebnisse:
Die Kardiomyozyten Fibrin konstruieren zunächst deckt die gesamte Breite der Form (Abbildung 2B). Keine Blasen sollten in das Konstrukt existieren, und es sollte der Blick über die gesamte Länge gleichmäßig. Nach zwei Wochen der Kultivierung, das Konstrukt Vertrag auf ca. 1 / 4 der ursprünglichen Breite (Abbildung 2C).
Wenn das Konstrukt elektrisch stimulierten ist in unserer Custom Kontraktionskraft Gerät (Abbildung 3A), kann Zuckungskraft Daten erzeugt, wie in 3B gezeigt werden. Die Wellenform kann separat in MATLAB (MathWorks) analysiert werden, um die Kraft, die Rate der Kontraktion, und die Geschwindigkeit der Erholung festzustellen. Twitch Kräfte von ca. 1,3 mN sind 6 erwartet.
Die Lebensfähigkeit der Zellen des Konstrukts ist abhängig von der Tiefe des Konstrukts durch die Diffusion Einschränkungen von Sauerstoff in den Bau. Auf der Oberfläche des Konstrukts, Abbildung 4A ist eine hohe Lebensfähigkeit der Zellen beobachtet. Mit der konfokalen Mikroskopie, 4B, ist die Ausrichtung Struktur des Konstrukts beobachtet aufgrund der Myosin Heavy Chain, MHC, ist für die Kontraktion, in rot dargestellt wichtig. Connexin 43, in grün dargestellt, ist notwendig für die zelluläre Kopplung zwischen Myozyten.
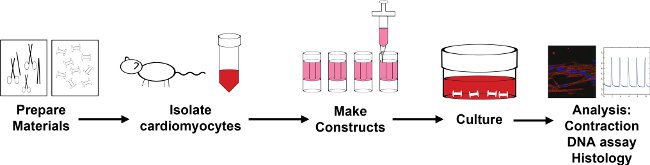
Abbildung 1: Übersicht über die Verkapselung

Abbildung 2: A) Separate und kombinierte Formteile für die Erstellung von Fibringele. From links nach rechts: zwei Teflon Unterlegscheiben, zwei Silikon O-Ringe, eine Teflon-Stab, ein Teflon-Rohr, ein ausgefülltes Dorn, das äußere Gehäuse für den Dorn, und der Kolben). B) auf die Form sofort Construct nach dem Auswerfen aus dem äußeren Gehäuse (Tag 0). C) verdichtet bauen auf die Form (roter Pfeil), nach 13 Tagen Kultur.
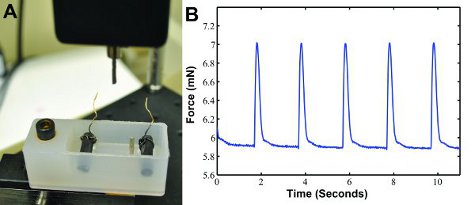
Abbildung 3: A) Custom Kontraktionskraft Messsystem zur Erfassung Zuckungskraft. Ein Kraftaufnehmer mit einem post-Maßnahmen die Kontraktionskraft und gibt die Ergebnisse in einen Computer. Ein Bad mit zwei Kohlenstoff-Elektroden mit Drähten verbindet sich mit einem elektrischen Stimulator, die Schritte des Konstrukts. Die beiden Ämter zu dem Konstrukt vorhanden. B) Beispiel Zuckungskraft Signaldaten mit elektrischer Stimulation bei 0,5 Hz erzeugt.
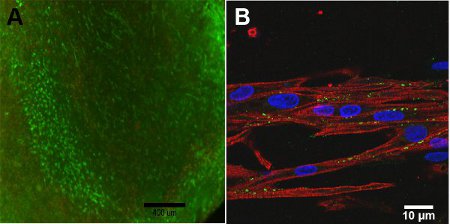
Abbildung 4: A) Live / Dead Assay zu konstruieren, Tag 13 (Maßstab = 400 um). Grün steht für die lebenden Zellen und rot steht für die toten Zellen. B) Konfokale Bild von Myosin Heavy Chain (rot), Connexin 43 (grün) und Hoechst Kernfärbung (blau) (Maßstab = 10 pm).
| F-Lösung | T-Lösung | Cell-Lösung | |||
| Fibrinogen | 112 ul | Thrombin | 17 ul | Zellen in DMEM | 170 &mgr; l |
| HEPES | 558μl | Ca + + | 1,3 ul | ||
| DMEM | 152 ul | ||||
| Gesamt | 670 ul | Gesamt | 170 &mgr; l | Gesamt | 170 &mgr; l |
Tabelle 1. Fibrin-Gel-Lösungen, die Mengen für 1 ml Gel.
Hinweis: Fibrinogen = 33 mg / mL Fibrinogen in 20 mM HEPES gepufferte Saline
HEPES = 20 mM HEPES-gepufferter Kochsalzlösung
Thrombin = 25 U / ml-Lösung in 0,81% NaCl-Lösung
Ca + + = 2 N Kalziumchlorid-Lösung
Diskussion
Die Verkapselung von neugeborenen Ratten Kardiomyozyten in Fibringele Ergebnisse in einer konsistenten und tragfähigen dreidimensionalen in vitro Modell des myokardialen Systems. Fibrin ist ein bevorzugter Biomaterial, weil, wenn die Zellen eingeschlossen sind, sie metabolisch aktiv und in der Lage Verdichten, Umbau und Neuerstellung einer extrazellulären Matrix, die mit einheimischen Herzgewebe 12 ist sind. Weil wir die Herzmuskelzellen, sich in diesem Umfeld ausrichten zu können, ist ihre Funktion charakteristischer des Herzmuskels, was zu größeren Kontraktion Kraft zu isotropen Gewebe 6 verglichen. Für potenzielle therapeutische Anwendungen ist es notwendig, Zellen in einem Material, das sowohl die Lebensfähigkeit und Funktionalität fördert kapseln. Die Protokolle hier vorgestellten zeigen eine effiziente und genaue Mittel zur Schaffung eines Fibrin-Netzwerk, um Herzzellen Verhalten in einer dreidimensionalen Mikroumgebung kontrollieren.
Ein paar mögliche Probleme können bei der Erstellung und Kultur dieser Konstrukte entstehen. Ein mögliches Problem ist die Erhaltung der Lebensfähigkeit der Zellen vor der Verkapselung, welche erhebliche Auswirkungen auf die Funktionalität des Konstrukts. Anstrengungen sollten unternommen werden, um den Zelltod nach der Trennung durch eine Verringerung der Zeit zwischen der Isolierung und der Kapselung der Zellen innerhalb des Fibringel zu begrenzen. Konstrukte sollten die Medien zur Verfügung gestellt werden jeden zweiten Tag auf einem strengen Zeitplan. Darüber hinaus ist es wichtig, um die Homogenität in allen verwendeten Lösungen zu gewährleisten. Wenn die Mischung von Fibrinogen, Thrombin und Zellen erzeugt eine heterogene Umgebung, die Fähigkeit der Zellen an die ECM-Umgestaltung, ist mechanisch zu koppeln und Vertrag möglicherweise behindert. Es ist auch wichtig, um die Bildung von Luftblasen bei der Injektion der Konstrukte zu vermeiden, um Störungen in der Kontinuität der gezüchteten Gewebe zu verhindern. Ein Weg, um dieses Problem zu lindern ziehen mehr Gel als notwendig, um das Konstrukt in die Spritze zu machen und injizieren langsam. Schließlich, nachdem die Fibrinmatrix gesetzt hat und hat in Kulturmedium für 24 Stunden, ist es wichtig, das Konstrukt von den Seiten der Ringform zu lösen, um die Zell-basierte Verdichtung des Fibringel fördern. Keeping das Konstrukt in der Mitte der Form erleichtert Gas-und Stoffaustausch. Die Einhaltung der Seiten der Ringform kann auch stören die gewünschte zelluläre Ausrichtung.
Es ist wichtig zu beachten, dass bewusste Enthauptung als Methode der euthanization in diesem Protokoll, das eine akzeptable Methode nach den Richtlinien sowohl von der National Institutes of Health und der American Veterinary Medical Association ist, verwendet wird. Allerdings empfehlen einige Institutionen Betäubung Nutzung durch Enthauptung neugeborenen Ratten folgten. Wir haben bewusst Enthauptung gewählt, weil es die minimale Menge an Zeit, sorgt unter hypoxischen Bedingungen für die ausgeschnittenen Herzen Gewebe / Zellen. Relativ kleine Mengen von Hypoxie kann zu Ischämie und potenziell Myozyten Tod, der erheblich beeinflussen könnten die Ergebnisse dieses Protokoll Myozyten.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
National Heart, Lung and Blood Institute (Award # R00HL093358 zu LDB) - Diese Arbeit wurde von den National Institutes of Health unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenz | Firma | Katalog-Nummer | Kommentare |
|---|---|---|---|
| Kochsalz | Sigma | S7653 | PBS |
| Kaliumchlorid | Sigma | P9333 | PBS |
| Natriumdihydrogenphosphat | Sigma | S7907 | PBS |
| Kaliumphosphat einbasischen | Sigma | P5655 | PBS |
| Glucose | Sigma | G5400 | Isolation |
| hemostat | Feine Science Tools | 91308-12 | Isolation |
| feinen Pinzette | Feine Science Tools | 11251-20 | Isolation |
| große Schere | Feine Science Tools | 91401-14 | Isolation |
| Mikro-Schere | Feine Science Tools | 91501-09 | Isolation |
| Skalpellgriff | Feine Science Tools | 10008-13 | Isolation |
| Skalpell | Fisher Scientific | 08 bis 918-5A | Isolation |
| Absorbent Bank underpad | VWR | 56617-014 | Isolation |
| sterilen Tuch | Fisher Scientific | GM42526 | Isolation |
| Autoklavierbeutel | Fischer | 01-812-54 | Isolation |
| Gaze | Fisher Scientific | 13-761-52 | Isolation |
| betadine | Purdue Produkte | 67618-150-01 | Isolation |
| sterile Handschuhe | Fisher Scientific | 19-020 | Isolation |
| sterile Transferpipette | Fisher Scientific | 9962 | Isolation |
| Kollagenase | Worthington | CLS2 | Isolation |
| Teflonstab 1 / 4 Zoll Durchmesser | McMaster-Carr | 8546K11 | Das Formteil |
| Teflonschlauch 1 / 4 Zoll-ID, 1 / 2 Zoll OD | McMaster-Carr | 8547K31 | Das Formteil |
| Silikon O-Ring 1 / 4 Zoll-ID, 1 / 2 Zoll OD | McMaster-Carr | 9396K204 | Das Formteil |
| Teflonschlauch 1 / 4 Zoll-ID, 5 / 16 Zoll OD | McMaster-Carr | 52355K14 | Das Formteil |
| Kendall Monoject Spritzen 6cc | Fisher Scientific | 05-561-41 | Das Formteil |
| BD Spritze 3cc | Fisher Scientific | 309585 | Das Formteil |
| Bovine Fibrinogen | Sigma | F8630 | Konstruieren |
| Bovine Thrombin | Sigma | T7513 | Konstruieren |
| 1 M HEPES | Sigma | H0887 | Konstruieren |
| Kochsalz | Sigma | S7653 | Konstruieren |
| DMEM | Invitrogen | 10569 | Konstruieren |
| Pluronic F-127 | Sigma | P2443 | Konstruieren |
| Kalziumchlorid | Sigma | 383147 | Konstruieren |
| 0,2 Mikron-Filter | Fisher Scientific | SCGVT05RE | Konstruieren |
| 40 Mikron Zelle Siebe | Fisher Scientific | 22-363-547 | Konstruieren |
| 0,45-Mikron-Bottle Top-Filters | Corning | 430627 | Konstruieren |
| Glas-Vorfilter | Millipore | AP2007500 | Konstruieren |
| 18G 1 1 / 2 Zoll lange Nadel | Fisher Scientific | 14 bis 826-5D | Konstruieren |
| 21G 1 inch Nadel | Fisher Scientific | 14-826C | Konstruieren |
| konstruieren Gläser | Fisher Scientific | 2116 | Konstruieren |
| Penicillin-Streptomycin | Invitrogen | 15140 | Medien |
| Pferdeserum | Sigma | H1138 | Medien |
| Rinderfötenserum | Invitrogen | 16000 | Medien |
| Aminocapronsäure | Acros Organics | 103305000 | Medien |
| Askorbinsäure | Sigma | A5960 | Medien |
| Insulin | Sigma | I9278 | Medien |
| Paraformaldehyd, 16% | Electron Microscopy Sciences | 15710 | Histologie |
| Optimale Schnittqualität Temperatur (OCT) | Ted Pella | 27050 | Histologie |
| 2-Methylbutan | Fischer | 03551-4 | Histologie |
| Maus MYH1/2/4/6 Primärantikörper | Santa Cruz Biotechnology | SC-32732 | Histologie |
| Kaninchen Connexin 43 Primärantikörper | Cell Signaling Technology | 3512 | Histologie |
| DyLight 549-konjugierten Esel-anti-Maus-sekundären Antikörper | Jackson ImmunoResearch Laboratories | 715-505-151 | Histologie |
| DyLight 488-konjugierten Donke Anti-Kaninchen-Sekundärantikörper | Jackson ImmunoResearch Laboratories | 711-485-152 | Histologie |
| Live / Dead Assay | Invitrogen | L-3224 | Analyse |
Referenzen
- Stegemann, J. P., Hong, H., Nerem, R. M. Mechanical, biochemical, and extracellular matrix effects on vascular smooth muscle cell phenotype. Journal of applied physiology. 98, 2321-2327 (2005).
- Guarnieri, D. Covalently immobilized RGD gradient on PEG hydrogel scaffold influences cell migration parameters. Acta. 6, 2532-2539 (2010).
- Krebs, . Injectable poly(lactic-co-glycolic) acid scaffolds with in situ pore formation for tissue engineering. Acta. 5, 2847-2859 (2009).
- Zimmermann, W. -. H. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature. 12, 452-458 (2006).
- Chung, C., Burdick, J. A. Influence of Three-Dimensional Hyaluronic Acid Stem Cell Chondrogenesis. Tissue engineering. 15, (2009).
- Black, L. D. Cell-induced alignment augments twitch force in fibrin gel-based engineered myocardium via gap junction modification. Tissue engineering. 15, 3099-3108 (2009).
- Syedain, Z. H., Weinberg, J. S., Tranquillo, R. T. Cyclic distension of fibrin-based tissue constructs: evidence of adaptation during growth of engineered connective tissue. Proceedings of the National Academy of Sciences of the United States of America. 105, 6537-6542 (2008).
- Falvo, M. R., Gorkun, O. V., Lord, S. T. The molecular origins of the mechanical properties of fibrin. Biophysical chemistry. , 152-155 (2010).
- Jockenhoevel, S. Fibrin gel - advantages of a new scaffold in cardiovascular tissue engineering. European journal of cardio-thoracic surgery : official journal of the European Association for Cardio-thoracic Surgery. 19, 424-430 (2001).
- Ryan, E. Structural Origins of Fibrin Clot Rheology. Biophysical Journal. 77, 2813-2826 (1999).
- Williams, C. Cell sourcing and culture conditions for fibrin-based valve constructs. Tissue engineering. 12, 1489-1502 (2006).
- Grassl, E. D., Oegema, T. R., Tranquillo, R. T. A fibrin-based arterial media equivalent. Journal of biomedical materials research. 66 (Part A. , 550-561 (2003).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of biomechanical engineering. 119, 137-145 .
- Invitrogen. . >LIVE/DEAD Viability/Cytotoxicity Kit *for mammalian cells. , (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten