Method Article
Encapsulamento de Cardiomyocytes em um hidrogel de fibrina para engenharia de tecidos cardíacos
Neste Artigo
Resumo
Descrevemos o isolamento de cardiomiócitos neonatal e na preparação das células para encapsulamento em construções de hidrogel de fibrina para engenharia de tecidos. Descrevemos métodos para analisar a engenharia de tecidos do miocárdio após o período de cultura, incluindo a força ativa gerada com a estimulação elétrica e viabilidade celular e coloração imuno.
Resumo
A cultura de células em um ambiente de hidrogel tridimensional é uma técnica importante para o desenvolvimento de construções para a engenharia de tecidos, bem como estudar as respostas celulares em condições diversas da cultura in vitro. O ambiente tridimensional reproduz com mais exatidão o que as células observar in vivo devido à aplicação de estímulos mecânicos e químicos em todas as dimensões 1. Tridimensional hidrogéis podem ser feitas a partir de polímeros sintéticos como PEG-DA 2 e PLGA 3 ou um número de proteínas que ocorrem naturalmente, como o colágeno 4, 5 ou ácido hialurônico fibrina 6,7. Hidrogéis criado a partir de fibrina, uma proteína do sangue que ocorre naturalmente coagulação, pode polimerizar para formar uma malha que é parte da cura do corpo ferida processos naturais 8. Fibrina é célula-degradáveis e potencialmente autólogo 9, tornando-se um andaime ideal temporário para engenharia de tecidos.
Aqui nós descrevemos em detalhe o isolamento dos cardiomiócitos neonatal a partir de três dias os filhotes de rato velho e preparação das células para encapsulamento em construções de hidrogel de fibrina para engenharia de tecidos. Miócitos neonatal são uma fonte de células comuns utilizados para estudos in vitro na formação de tecido cardíaco e engenharia 4. Fibrina gel é criado pela mistura do fibrinogênio com a trombina enzima. A trombina cliva fibrinopeptídeos FPA e FPB de fibrinogênio, revelando os sítios de ligação que interagem com outros monómeros 10. Essas interações causam os monômeros para auto-montar em fibras que formam a malha de hidrogel. Porque o timing dessa reação enzimática pode ser ajustado alterando a relação de trombina ao fibrinogênio, ou a razão de cálcio para a trombina, pode-se molde de injeção constrói com um número de diferentes geometrias 11,12. Além disso podemos gerar o alinhamento do tecido resultante da forma como restringir o gel durante a cultura 13.
Após o cultivo da engenharia construções de tecido cardíaco durante duas semanas sob condições estáticas, as células cardíacas começaram a remodelar a construir e pode gerar uma força de contração em condições de estimulação elétrica 6. Como parte deste protocolo, também descrevem métodos para analisar a engenharia de tecidos do miocárdio após o período de cultura, incluindo a análise funcional da força ativa gerada pelo músculo cardíaco construir sobre a estimulação elétrica, bem como métodos para determinar a viabilidade celular final (Live-Morto ensaio) e coloração imuno para examinar a expressão de proteínas e morfologia típica importante para a contração (Miosina Cadeia Pesada ou MHC) e acoplamento celular (Conexina 43 ou Cx43) entre os miócitos.
Protocolo
1. Isolamento de cardiomiócitos neonatais - preparação (dia anterior)
Soluções criadas nesta seção: PBS Glucose-solução, parar de mídia.
- Prepare uma solução de PBS-glicose, adicionando 5 mL de penicilina-estreptomicina (100 unidades / ml e 100 mg / ml, respectivamente) e 1,98 g de glicose para 250 ml 1x fosfato estéril salina tamponada (PBS) e trazer volume da solução a 500 ml com adicional estéril 1x PBS.
- Prepare parada de mídia, adicionando 25 ml FBS e 5 ml de penicilina-estreptomicina (mesma concentração acima) para Médio Modificado 250ml estéril Dulbecco Águia (DMEM) e levar o volume para 500 ml com DMEM estéril antes da filtragem estéril através de um 0,2 micron filtro.
- Esterilizar os instrumentos cirúrgicos necessários para o isolamento em autoclave: uma pinça hemostática, # 5 pinças, tesouras grandes, micro-tesoura, bisturi e uma alça (# 4).
2. Isolamento de cardiomiócitos neonatais - preparação (dia da colheita)
Certifique-se de manter a esterilidade
Soluções utilizadas nesta seção: PBS-glicose solução Betadine,
- Para cada ninhada, tomar as duas estéreis de 100 pratos petri milímetros, coloque-os no capô e preencha com ~ 10 mL de glicose PBS-gelada. Estes devem, então, ser colocado em um balde de gelo cheio de gelo no capô cultura estéril.
- Coloque um copo de 250 ml com 30-40 mL de Betadine para a capa.
- Adicionar 50 mL / litro de PBS-glicose dentro de uma garrafa de vedação, e coloque em banho-maria a 37 ° C.
- Para cada pessoa, lugar um banco absorvente underpad na superfície de trabalho capô e coloque uma cortina estéril em cima tomando cuidado para não tocar na área de trabalho centro da cortina estéril. Despejar os instrumentos cirúrgicos e um 4 x 4 para gaze estéril a cortina sem tocar os instrumentos. Abra uma lâmina estéril # 20 bisturi e despejo em armar, novamente tomando cuidado para não tocar com as luvas não estéreis.
- Pegue os filhotes a partir da barragem e coloque em um recipiente opaco, filhotes colocar na capa
- Calçar luvas estéreis
- Dobre a gaze em quartos, com pinça hemostática e coloque em copo Betadine.
- Coloque a lâmina de bisturi para a alça bisturi e reserve.
3. Isolamento de cardiomiócitos neonatais - Dissecção do coração
Soluções utilizadas nesta seção: Betadine, a solução de PBS-glicose
- Pegar o filhote em sua mão não-dominante por beliscar a pele entre as omoplatas entre o polegar eo dedo indicador. Usando a tesoura grande, decapitar o filhote em uma corte. Certifique-se de corte da parte de trás para a frente filhote, para garantir que a coluna está completamente cortada.
- Swab peito do cachorro com a gaze embebida betadine. Segura o cachorro apertando as omoplatas juntos. Toracotomia parcial para expor o coração. Aumentar a pressão aplicada, forçando o coração passado as costelas para dissecção scalpular.
- Executar a lâmina de bisturi atrás do coração para cortar os grandes vasos e remover o coração. Coloque o coração na placa de Petri contendo PBS-glicose que está no gelo.
- Repita os passos 1-3 para cada filhote da ninhada.
4. Isolamento de cardiomiócitos neonatais - Isolamento dos miócitos
Soluções criadas / utilizadas nesta seção: PBS-glicose solução solução de colagenase, parar de solução
- Uma vez que os corações foram isolados, remover qualquer resíduo de sangue e tecido conjuntivo, enxaguando em gelada solução de glicose PBS, remover a parte superior 1 / 3 do coração para isolar somente o tecido ventricular e coloque em um prato de petri fresca com gelado PBS glicose, preparado anteriormente.
- Cuidadosamente mince os corações em um milímetro cúbico ~ usando o micro-tesouras e pinças.
- Dê uma pipeta de transferência estéril, cortou a ponta com uma tesoura para que a boca da pipeta é de aproximadamente 3 mm de diâmetro. Use a pipeta para transferir as peças de tecido e toda a solução em um 50 ml e colocar no gelo.
- Pesar 15 mil unidades por ninhada de filhotes de colagenase tipo II (unidades / mg é dependente do lote) e coloque dentro da garrafa de 37 ° C aquecidos PBS-glicose previamente preparado para criar uma solução de colagenase. Misture bem e filtrar em um frasco estéril separado. Coloque de volta para o banho-maria 37 ° C. Coloque a solução de parada para o banho-maria 37 ° C também.
- Permitir que o tecido picada em repouso para a parte inferior do tubo de centrifugação. Remover o sobrenadante até o volume total é de aproximadamente de 10 mL. Adicionar 7 ml de solução de colagenase ao tubo de centrífuga.
- Colocar o tubo cônico com as peças de tecido e os colagenase em um rack de tubos em um agitador orbital no interior de uma incubadora de 37 ° C ou forno. Ligue o agitador orbital em aproximadamente 60 rpm e feche a porta. Define um contador para 7 minutos. Certifique-se de colocar o bac colagenasek para o banho de água para mantê-lo aquecido.
- Quando o temporizador se apaga, trazer de volta cônico no capô. Também trazer a colagenase morna e parar de solução dentro do capuz. Delicadamente os pedaços de tecido titular 5-7 vezes para quebrá-las para cima. Após a titulação, permitir que as peças para resolver a parte inferior (2-3 minutos). Aspirar fora tanto do sobrenadante possível de ser muito cuidadosos para não sugar os pedaços de tecido. Em seguida, adicionar 7 ml de solução de colagenase para as peças de tecido e coloque de volta na incubadora no agitador por 7 minutos.
- Para cada etapa restante, delicadamente titular 10 vezes, para quebrar os pedaços de tecido. Uma vez que as peças de tecido resolver, desenhe o sobrenadante fora e recolhê-la em um de 50 ml em separado cônico. Adicionar 7 ml de colagenase para as peças de tecido e digerir novamente por 7 minutos. Ao tubo sobrenadante, adicionar 10 mL de solução de paragem com uma pipeta diferente sorológicos após cada adição do sobrenadante da digestão.
- Repita até que todos os colagenase tem sido usado (7 etapas no total).
- Após a etapa de digestão final, levar o cônica com a solução da célula e filtrar através de peneira de 70μm em células cônicas fresco.
- Spin-baixo em células 100g por 5 minutos e ressuspender em 20 ml de DMEM a ser contados em hemocitômetro, e coloque as células no gelo.
- Coloque 50 ul das células em uma solução azul Trypan (75 mL Trypan Blue, 125 mL PBS), misturar bem antes de colocar 10 ml no hemocitômetro para a contagem. Células vivas são claras, enquanto as células mortas são azuis. Esperar aproximadamente 3 milhões de células por crias, com uma viabilidade de aproximadamente 80-90%.
5. Fundição de fibrina constrói gel - preparação para a criação de fibrina géis (feito com bastante antecedência)
Soluções criadas nesta seção: solução de fibrinogênio de ações, trombina solução estoque, Pluronics solução, a mídia do miocárdio construir.
- Prepare uma solução estoque 33 mg / mL de fibrinogênio em 20 mM tampão HEPES em 0,9% por fibrinogênio lentamente a mistura para a solução salina tamponada com HEPES durante várias horas a 37 ° C. Permitir que a solução para resolver durante a noite a 2-8 ° C. Aquecer a solução a 37 ° C. A solução é estéril filtrado através de uma série de filtros consecutivos: 40 filtros mM celular, garrafa 0,45 mM filtros superior com vidro pré-filtros, e 0,2 mM garrafa de vidro com filtros de topo de pré-filtros. A solução é aliquotado em 1 mL e 3 mL alíquotas e armazenadas a -20 ° C.
- Prepare uma solução estoque 25 U / mL de trombina, adicionando 500 U de trombina a 18 mL de solução salina 0,9% e 2 mL de água deionizada estéril, através de um filtro estéril 0,2 m de filtro alíquota, em 500 mL e 250 mL e congelar alíquotas na -80 ° C.
- Prepare a 5% w / v Pluronics solução F-127, dissolvendo-se 50 g de Pluronics F-127-700 mL de água deionizada. Traga volume da solução até 1 litro com água deionizada adicionais. Filtro estéril com 0,2 mM de filtro. A solução Pluronics pode ser usado até três vezes antes de trocar se estéril filtrada após cada utilização.
- Prepare miocárdio construir meios de comunicação, adicionando 10% soro de cavalo, 2% soro fetal bovino, 1% de penicilina-estreptomicina, e 6 mg / mL-aminocapróico em DMEM. 50 mg / ml de ácido ascórbico e 2 mg / ml de insulina em 25 mM HEPES precisam ser adicionados imediatamente antes da alimentação.
- Montar mandril reunindo uma barra revestida de teflon, uma manga de teflon, duas arruelas de teflon com um entalhe removidos para fins de injeção, e dois anéis de borracha (ver Figura 2a). Autoclave antes de usar.
- Tome tripas seringa 6cc para a parte externa do molde e tripas 3cc seringa para ser usado como êmbolos, e prepará-los, cortando as extremidades luer-lock e autoclave (ver Figura 2a).
6. Fundição de fibrina constrói gel - preparação para a criação de gel de fibrina (à direita antes de fazer as construções de gel de fibrina)
Soluções utilizadas nesta seção: solução Pluronics
- Filtro estéril a 5% Pluronics F-127 com uma solução 0,2 m de filtro antes de usar. Mandris lugar e tripas seringa 5% solução Pluronics num copo L 1 no capô. Deixe as peças de imersão na solução Pluronics por 2-3 horas no capô para garantir revestimento completo. A solução Pluronics reveste os mandris e evita que o gel de fibrina de aderir ao mandris.
- Após a incubação de 2-3 horas, despeje a 5% solução Pluronics de volta para a garrafa, coloque campos estéreis sobre a superfície do capô e usar luvas estéreis para a construção de moldes.
- Coloque o mandris construído no 6 tripas seringa cc, utilizando a seringa 3cc como um êmbolo para assegurar uma boa vedação entre os o-rings e arruelas de teflon.
7. Fundição de fibrina gel constrói através de moldagem por injeção
Soluções criadas nesta seção: solução F, T solução, solução da célula.
- Para fazer 1 mL de gel de fibrina (3,3 mg / mL concentração de fibrinogênio final, 25 U / mL finais de concentração de trombina), crie F solução em um tubo cônico, pela adição de 112 mL do estoque de fibrinogênio a 558 mL de tampão HEPES 20 mM em solução salina 0,9%. Em um tubo cônico separadas, crie uma solução T, adicionando 17 mL do estoque de trombina, e 1,3 mL de 2 N + Ca + solução a 135 mL de DMEM. Ver Tabela 1.
- Em um tubo cônico terceiro, preparar uma solução de células girando as células e ressuspender as células em um volume de modo que a concentração de celular é 29400000 cel / mL ou 6 vezes a concentração da concentração final desejada de células na construção
- Quando estiver pronto para lançar o gel de fibrina construir, preparar uma seringa de 1 mL com uma agulha de 1 ½ polegadas 18G longa. Tem uma agulha 21G 1 polegada pronto também.
- A solução de fibrina é criado em uma proporção de 04:01:01 F solução: solução T: solução da célula. Para fazer uma mL de gel, adicione 667 mL de solução F em um tubo de centrífuga de 50 mL limpo, seguido por 167 mL da solução de célula e, finalmente, adicionar 167 ml de solução-T. Pipeta para misturar a solução, juntamente com cuidado para não introduzir bolhas. Uma vez que as soluções são misturadas, a reação já começou ea injeção das construções deve ser feito imediatamente.
- Pegue a seringa previamente preparada com a agulha 18G e elaborar solução de fibrina. Tome cuidado para não inverter a seringa para evitar bolhas de entrar na agulha. Substituir a agulha 18G com uma agulha de 21G. Toque suavemente seringa para forçar as bolhas de ar.
- Inserir seringa no molde entre a tampa ea carcaça após o sulco no Teflon O-ring e injetar a solução no molde. Incline o molde com a ranhura na parte superior para segurar o enchimento completo. Retire a seringa e continuar a preencher moldes restantes. Solução de gel suficiente pode ser criado para preencher diversos moldes, ao mesmo tempo. No entanto, porque a solução gel rapidamente, é geralmente uma boa idéia para limitar o número de construções injetado em um dado momento a 6.
- Enrole os moldes em Parafilm em grupos de três e colocar na incubadora ou um forno a 37 ° C. Deixe o gel para incubar nos moldes por 20 minutos para permitir que o tempo de gel para polimerizar.
- Encha cada frasco de cultura (Nalgene jar straight-lado) com 21 mL de meio de construção do miocárdio por construir. Use a seringa estéril cc 3 invólucro como um êmbolo para forçar o mandril com a construção em uma grande placa de Petri com meio DMEM. Em seguida, coloque a construir dentro do frasco da amostra. Cada frasco 16 onças pode conter até seis construções, enquanto que cada frasco de 4 onças pode conter 2.
- Parafuso as capas dos frascos e transferi-los para a incubadora. Dentro da incubadora, afrouxar as tampas nos frascos para permitir a troca gasosa.
- Após 24 horas, tome uma pick estéril dental e empurre a construir fora do teflon branco anéis nas extremidades do molde do anel para garantir o alinhamento uniforme da construção (ver Figura 2 em resultados representativos).
8. Técnicas de análise (após 2 semanas de cultura) - testes de força de contração
Soluções utilizadas nesta seção: DMEM, infarto construir meios de comunicação.
- Prender o jacaré na liderança vinda do estimulador para os fios dos eletrodos no banho. Ligar a placa de aquisição de dados, gerador de pulso, e transdutor de força. O transdutor de força devem ser transferidos para a definição de 5g e zerado. Abrir um programa LabView personalizado que exibe e grava os dados do transdutor de força. Criar um novo arquivo de texto vazio na pasta de dados para cada amostra.
- DMEM lugar no banho-maria 37 ° C e dar tempo para ele se aquecer antes de testar as construções. Depois de aquecida, coloque 37 ° C no banho DMEM meio do sistema de medição de força (ver Figura 3A).
- Remova a construção do frasco da amostra, deslizando o anel de Teflon construir apoio, com uma pinça e coloque a construir ao longo dos pós de metal fixas na força de banho de meio de medição do sistema. Não segure a construção com a pinça! Em vez disso, use a pinça para empurrar e levantar a construir fora do apoio mandril.
- Coloque a outra extremidade da construção do transdutor sobre o braço e aperte até o transdutor lê 0.50V, (aproximadamente 1,0 gramas ou 10 millinewtons força de tensão)
- Selecione o arquivo de texto para os dados da força de contração a ser gravado em.
- Sobre o estimulador cardíaco (Model # S88X, Tecnologias Grass), definir a tensão de pulso para 20V (8 V / cm), duração de 6ms, e uma taxa de 1 Hz.
- Iniciar o ritmo elétrico pressionando a "saída on / off" botão
- Começar a gravar, até de forma de onda torna-se regular.
- Remova cuidadosamente a construção da força de banho de meio de medição do sistema e colocá-lo de volta ao meio de cultura. Em seguida, retire o DMEM da força de banho de meio de medição do sistema e substituir por novas, DMEM quente para analisar additamostras ional.
- Corte a construir e desenrolá-la de modo que você pode medir o comprimento ea largura da construção
- Corte a construir em seções a serem utilizados para medições de análises adicionais, incluindo a viabilidade, histologia, ou medições western blot.
9. Técnicas de análise (após 2 semanas de cultura) - Live-Dead Ensaio para a viabilidade (com Invitrogen Assay Live / Dead) 14:
Soluções utilizadas nesta seção: EthD-1 solução estoque, calceína AM ações solução PBS
- Enxágüe amostras com lavagens 3x 5 minutos em PBS.
- Adicionar 20 l de 2 mM EthD-1 solução estoque a 10 mL de PBS estéril e vortex para assegurar a mistura completa.
- Adicionar 5 mL de 4 mM calceína AM stolution ações para EthD-1 solução. Mais uma vez, vortex para garantir mistura completa.
- Adicionar volume suficiente da solução acima para cobrir a construção.
- Incubar coberta (para evitar fotodegradação dos corantes) por 30 minutos em temperatura ambiente.
- Remover os corantes e substituir com PBS quente. Observar e registrar imagens com um microscópio fluorescente. Calceína está animado por 494 nm de luz e emite luz 517 nm, enquanto homodímero de etídio-1 é de 528 nm de luz e emite luz 617 nm. Veja a Figura 4 para os resultados da amostra.
10. Técnicas de análise (após 2 semanas de cultura) - imunohistoquímica para proteínas importantes miócito:
Soluções utilizadas nesta seção: PBS, paraformadehyde 4% em PBS, soro burro de 5% em PBS, anticorpos em PBS, 0,1 ng / mL Hoechst 33258 em PBS.
- Enxágüe amostras com lavagens 3x 5 minutos em PBS.
- Fix com paraformaldeído 4% em solução PBS, por 2-3 horas a 4 ° C
- Enxágüe amostras com lavagens 3x 5 minutos em PBS.
- A amostra pode agora ser incorporado, seccionados e corados de acordo com o protocolo de escolha. A parte restante deste protocolo cobre manchas construir toda para geração de imagens em microscopia confocal. Note-se que os tempos de incubação são mais longos do que para o tecido seccionado como é necessário que haja mais tempo para os anticorpos para difundir para a construção. Além disso, todas as demais etapas são conduzidas à temperatura ambiente.
- Adicionar 0,1% Triton-X em PBS às amostras durante 30 minutos para permeabilizar as membranas celulares.
- Lave as amostras com lavagens 3x 10 minutos em PBS.
- Adicionar soro burro de 5% em PBS para as amostras de 1 hora e meia para bloquear qualquer ligação não específica do anticorpo secundário para as amostras.
- Adicionar Conexina 43 (01:50 diluição) e miosina Cadeia Pesada (diluição 1:100) em PBS anticorpos primários para as amostras de 3 horas. Para rotular ambas as proteínas consecutivamente você deve se certificar de que os anticorpos primários são de diferentes hospedeiros (ie de coelho e rato).
- Lave as amostras com lavagens 3x 10 minutos em PBS.
- Adicione o apropriado fluorescente etiquetado anticorpos secundários em PBS por 3 horas.
- Lave as amostras com lavagens 3x 10 minutos em PBS
- Pouco antes de imagens das amostras no microscópio confocal, adicionar 0,1 ng / ml Hoechst 33258 em PBS por 15 minutos.
- Lave as amostras com lavagens 3x 10 minutos em PBS.
- Analisar a expressão amostras de MHC e Cx43 por imagem das células com um microscópio confocal (veja a Figura 4 para o resultado exemplo).
11. Resultados representativos / Resultados:
Os cardiomiócitos de fibrina construir inicialmente cobre toda a largura do molde (Figura 2B). Não deve existir bolhas na construção e deve ficar uniforme em todo o comprimento. Após duas semanas de cultivo, o contrato de construção de aproximadamente 1 / 4 da largura inicial (Figura 2C).
Quando a construção é eletricamente acelerado em nosso dispositivo de costume da força de contração (Figura 3A), os dados de força de contração pode ser gerado, como mostrado na Figura 3B. A forma de onda pode ser analisado separadamente no MATLAB (MathWorks) para determinar a força, a taxa de contração, ea taxa de relaxamento. Forças contração de aproximadamente 1,3 mN são esperados 6.
Viabilidade celular da construção depende da profundidade da construção, devido às limitações de difusão de oxigênio para o construir. Sobre a superfície da construção, a Figura 4A, alta viabilidade celular é observado. Com microscopia confocal, a Figura 4B, a estrutura alinhada da construção é observada devido à miosina de cadeia pesada, MHC, é importante para a contração, mostrado em vermelho. Conexina 43, mostrados em verde, é necessário para o acoplamento celular entre os miócitos.
Figura 1: Visão geral do processo de encapsulamento

Figura 2: A) peças do molde separado e combinados para criar géis de fibrina. From esquerda para a direita: duas anilhas de teflon, silicone dois o-rings, uma haste de teflon, um tubo de Teflon, um mandril concluído, o invólucro exterior para o mandril e do êmbolo). B) Construa no molde imediatamente após a ejeção do invólucro exterior (dia 0). C) construir compactado no molde (seta vermelha), após 13 dias de cultura.
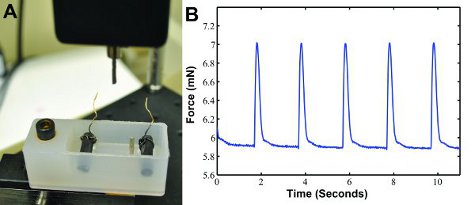
Figura 3: A) personalizado contração sistema de medição de força para a força de contração de gravação. Um transdutor de força com um post mede a força de contração e produz os resultados em um computador. Um banho contendo dois eletrodos de carbono com fios se conecta a um estimulador elétrico que passos da construção. Os dois posts segurar a construir no lugar. B) Amostra twitch dados waveform força gerada com a estimulação elétrica a 0,5 Hz.
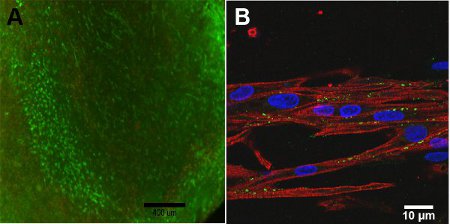
Figura 4: Um ensaio) Live / Dead of construir, dia 13 (Barra de escala = 400 mm). Verde representa as células vivas e vermelha representa as células mortas. B) Imagem Confocal de Miosina Cadeia Pesada (vermelho), Conexina 43 (verde) e Hoescht nuclear mancha (azul) barra de escala (= 10 mm).
| Solução F | Solução de T | Solução celular | |||
| Fibrinogênio | 112 mL | Trombina | 17 mL | Células em DMEM | 170 mL |
| HEPES | 558μl | Ca + + | 1,3 mL | ||
| DMEM | 152 mL | ||||
| Total | 670 mL | Total | 170 mL | Total | 170 mL |
Tabela 1. Soluções de fibrina gel, quantidades para 1 mL de gel.
Nota: O fibrinogênio = 33 Fibrinogênio mg / mL em 20 mM HEPES buffered Saline
HEPES = 20 mM HEPES solução salina tamponada
Trombina solução = 25 U / mL em solução de 0,81% NaCl
Ca + + = 2 N solução de cloreto de cálcio
Discussão
O encapsulamento dos cardiomiócitos de rato neonatal no resultado de fibrina géis de forma consistente e viável tridimensional in vitro modelo do sistema do miocárdio. Fibrina é um biomaterial preferido porque quando as células são aprisionadas, elas são metabolicamente ativa e capaz de compactação, remodelação e recriando uma matriz extracelular que é consistente com o tecido do coração nativo 12. Porque nós permitimos que os cardiomiócitos a alinhar-se neste ambiente, sua funcionalidade é mais característico do músculo cardíaco, resultando em maior força de contração em comparação com tecidos isotrópico 6. Para potenciais aplicações terapêuticas, é necessário encapsular células dentro de um material que promove tanto a viabilidade e funcionalidade. Os protocolos aqui apresentados demonstram uma forma eficiente e precisa para a criação de uma rede de fibrina para controlar o comportamento de células cardíacas em um microambiente tridimensional.
Alguns problemas potenciais podem surgir durante a criação ea cultura dessas construções. Um potencial problema é a manutenção da viabilidade celular antes de encapsulamento, o que irá afectar significativamente a funcionalidade da construção. Esforço deve ser feito para limitar a morte celular após o isolamento, reduzindo o tempo entre o isolamento eo encapsulamento das células dentro do gel de fibrina. Construções deve ser fornecida mídia todos os dias em um horário rigoroso. Além disso, é importante para assegurar a homogeneidade em todas as soluções utilizadas. Se a mistura de fibrinogênio, trombina e células produz um ambiente heterogêneo, a capacidade das células para remodelar o ECM, mecanicamente casal e contrato é potencialmente obstruído. Também é importante para prevenir a formação de bolhas de ar durante a injeção das construções, a fim de evitar perturbações na continuidade da engenharia de tecidos. Uma maneira de aliviar esta questão é chamar mais gel do que é necessário para fazer a construção com a seringa e injetar lentamente. Por último, uma vez que a matriz de fibrina definiu e foi em meio de cultura por 24 horas, é essencial destacar a construir a partir dos lados do molde do anel para promover a compactação baseada em células do gel de fibrina. Mantendo a construir no meio do molde facilita a troca de gases e nutrientes. Aderência para os lados do molde do anel podem também romper o alinhamento desejado celular.
É importante notar que a decapitação consciente é usado como método de eutanásia neste protocolo, que é um método aceitável no âmbito das orientações de ambos os Institutos Nacionais de Saúde ea Associação Médica Americana Veterinária. No entanto, algumas instituições recomendam usar anestésico seguido por decapitação em ratos neonatal. Nós escolhemos a decapitação consciente porque garante a quantidade mínima de tempo sob condições de hipóxia para o tecido do coração extirpado / células. Quantidades relativamente pequenas de hipóxia pode levar à isquemia e morte dos miócitos potencialmente miócito, que poderiam afetar significativamente os resultados deste protocolo.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado pelos Institutos Nacionais de Saúde - National Heart Lung, and Blood Institute (Award # R00HL093358 a LDB).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
|---|---|---|---|
| Cloreto de sódio | Sigma | S7653 | PBS |
| Cloreto de potássio | Sigma | P9333 | PBS |
| Fosfato de sódio dibásico | Sigma | S7907 | PBS |
| Fosfato de potássio monobásico | Sigma | P5655 | PBS |
| Glicose | Sigma | G5400 | Isolamento |
| hemostat | Multa Ferramentas Ciência | 91308-12 | Isolamento |
| pinça fina | Multa Ferramentas Ciência | 11251-20 | Isolamento |
| tesouras grandes | Multa Ferramentas Ciência | 91401-14 | Isolamento |
| micro-tesoura | Multa Ferramentas Ciência | 91501-09 | Isolamento |
| lidar com bisturi | Multa Ferramentas Ciência | 10008-13 | Isolamento |
| lâmina de bisturi | Fisher Scientific | 08-918-5A | Isolamento |
| Underpad banco absorvente | VWR | 56617-014 | Isolamento |
| drape estéril | Fisher Scientific | GM42526 | Isolamento |
| saco de autoclave | Pescador | 01-812-54 | Isolamento |
| compressa de gaze | Fisher Scientific | 13-761-52 | Isolamento |
| betadine | Purdue Produtos | 67618-150-01 | Isolamento |
| luvas estéreis | Fisher Scientific | 19-020 | Isolamento |
| pipeta de transferência estéril | Fisher Scientific | 9962 | Isolamento |
| colagenase | Worthington | CLS2 | Isolamento |
| Teflon haste 1 / 4 polegada de diâmetro | McMaster-Carr | 8546K11 | Parte do molde |
| Teflon ID tubo 1 / 4 de polegada, OD 1 / 2 polegada | McMaster-Carr | 8547K31 | Parte do molde |
| Silicone O-Ring ID 1 / 4 de polegada, OD 1 / 2 polegada | McMaster-Carr | 9396K204 | Parte do molde |
| Teflon tubo de 1 / 4 ID polegadas, 5 / 16 polegadas OD | McMaster-Carr | 52355K14 | Parte do molde |
| Seringas Kendall monoject 6cc | Fisher Scientific | 05-561-41 | Parte do molde |
| BD seringa 3cc | Fisher Scientific | 309585 | Parte do molde |
| Fibrinogênio bovino | Sigma | F8630 | Construir |
| A trombina bovina | Sigma | T7513 | Construir |
| 1 M HEPES | Sigma | H0887 | Construir |
| Cloreto de sódio | Sigma | S7653 | Construir |
| DMEM | Invitrogen | 10569 | Construir |
| PLURONIC F-127 | Sigma | P2443 | Construir |
| Cloreto de cálcio | Sigma | 383147 | Construir |
| 0,2 micron filtro | Fisher Scientific | SCGVT05RE | Construir |
| 40 micron filtros celular | Fisher Scientific | 22-363-547 | Construir |
| 0,45 micron filtro de tampa de garrafa | Corning | 430627 | Construir |
| de vidro pré-filtro | Millipore | AP2007500 | Construir |
| 18G 1 1 / 2 polegada de comprimento agulha | Fisher Scientific | 14-826-5D | Construir |
| 21G agulha de 1 polegada | Fisher Scientific | 14-826C | Construir |
| construção de frascos | Fisher Scientific | 2116 | Construir |
| Penicilina-estreptomicina | Invitrogen | 15140 | Mídia |
| soro de cavalo | Sigma | H1138 | Mídia |
| Soro fetal bovino | Invitrogen | 16000 | Mídia |
| ácido aminocapróico | Acros Organics | 103305000 | Mídia |
| ácido ascórbico | Sigma | A5960 | Mídia |
| insulina | Sigma | I9278 | Mídia |
| Paraformaldeído, 16% | Microscopia Eletrônica de Ciências | 15710 | Histologia |
| Temperatura de corte ideal (OCT) | Ted Pella | 27050 | Histologia |
| 2-metilbutano | Pescador | 03551-4 | Histologia |
| Anticorpo primário do mouse MYH1/2/4/6 | Santa Cruz Biotechnology | SC-32732 | Histologia |
| Coelho Conexina 43 anticorpo primário | Tecnologia de sinalização celular | 3512 | Histologia |
| Dylight 549-burro conjugado anticorpo anti-rato-secundário | Jackson Laboratories ImmunoResearch | 715-505-151 | Histologia |
| Dylight 488-conjugados de anticorpos anti-coelho Donke secundário | Jackson Laboratories ImmunoResearch | 711-485-152 | Histologia |
| Vivo / morto ensaio | Invitrogen | L-3224 | Análise |
Referências
- Stegemann, J. P., Hong, H., Nerem, R. M. Mechanical, biochemical, and extracellular matrix effects on vascular smooth muscle cell phenotype. Journal of applied physiology. 98, 2321-2327 (2005).
- Guarnieri, D. Covalently immobilized RGD gradient on PEG hydrogel scaffold influences cell migration parameters. Acta. 6, 2532-2539 (2010).
- Krebs, . Injectable poly(lactic-co-glycolic) acid scaffolds with in situ pore formation for tissue engineering. Acta. 5, 2847-2859 (2009).
- Zimmermann, W. -. H. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature. 12, 452-458 (2006).
- Chung, C., Burdick, J. A. Influence of Three-Dimensional Hyaluronic Acid Stem Cell Chondrogenesis. Tissue engineering. 15, (2009).
- Black, L. D. Cell-induced alignment augments twitch force in fibrin gel-based engineered myocardium via gap junction modification. Tissue engineering. 15, 3099-3108 (2009).
- Syedain, Z. H., Weinberg, J. S., Tranquillo, R. T. Cyclic distension of fibrin-based tissue constructs: evidence of adaptation during growth of engineered connective tissue. Proceedings of the National Academy of Sciences of the United States of America. 105, 6537-6542 (2008).
- Falvo, M. R., Gorkun, O. V., Lord, S. T. The molecular origins of the mechanical properties of fibrin. Biophysical chemistry. , 152-155 (2010).
- Jockenhoevel, S. Fibrin gel - advantages of a new scaffold in cardiovascular tissue engineering. European journal of cardio-thoracic surgery : official journal of the European Association for Cardio-thoracic Surgery. 19, 424-430 (2001).
- Ryan, E. Structural Origins of Fibrin Clot Rheology. Biophysical Journal. 77, 2813-2826 (1999).
- Williams, C. Cell sourcing and culture conditions for fibrin-based valve constructs. Tissue engineering. 12, 1489-1502 (2006).
- Grassl, E. D., Oegema, T. R., Tranquillo, R. T. A fibrin-based arterial media equivalent. Journal of biomedical materials research. 66 (Part A. , 550-561 (2003).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of biomechanical engineering. 119, 137-145 .
- Invitrogen. . >LIVE/DEAD Viability/Cytotoxicity Kit *for mammalian cells. , (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados