Method Article
Kalp Doku Mühendisliği Fibrin Hidrojel kardiyomiyositlerinin Kapsülleme
Bu Makalede
Özet
Biz yenidoğan kardiyomiyositlerde izolasyonu ve doku mühendisliği için fibrin hidrojel yapıları kapsülleme hücrelerin hazırlanması açıklar. Biz elektrik stimülasyonu ve hücre canlılığı ve immünohistolojik boyama üzerine oluşturulan etkin bir güç de dahil olmak üzere kültür süre sonra doku mühendislik miyokardın analiz yöntemleri açıklanmaktadır.
Özet
Üç boyutlu hidrojel ortamda kültür hücreleri, doku mühendisliği yapıları geliştirmek ve bunun yanı sıra, çeşitli in vitro kültür koşullar altında hücresel yanıtları eğitim için önemli bir tekniktir. Üç boyutlu ortamda hücrelerin daha yakından gözlemlemek tüm boyutları 1 mekanik ve kimyasal uyaranlara uygulama nedeniyle, in vivo olarak ne taklit eder. Üç boyutlu hidrojeller ya PEG-DA, 2 ve PLGA 3 ya da doğal olarak meydana gelen proteinler, kolajen 4, hyaluronik asit 5 veya fibrin 6,7 gibi bir dizi olarak sentetik polimerler yapılabilir. Fibrin, doğal olarak meydana gelen kan pıhtılaşma proteini, oluşturulan Hidrojeller, vücudun doğal yara iyileşmesi 8 süreçleri bir parçası olan bir ağ oluşturmak için polimerize . Fibrin doku mühendisliği için ideal bir geçici iskele yapımı, hücre parçalanabilir ve 9 potansiyel otolog.
Burada üç gün eski sıçan yavrularının ve fibrin doku mühendisliği için hidrojel yapıları kapsülleme hücreleri hazırlık yenidoğan kardiyomiyositlerinin izolasyon detaylı olarak açıklanmaktadır. Yenidoğan miyositler kalp dokusu oluşumu ve mühendislik 4 in vitro çalışmalarda kullanılan ortak bir hücre kaynağı. Fibrin jel enzim trombin ile karıştırılarak fibrinojen tarafından oluşturulur. Trombin, fibrinojen, diğer monomerlerin 10 ile etkileşim bağlayıcı siteleri ifşa fibrinopeptides FPA ve FPB keser . Bu etkileşimler monomerlerin hidrojel örgü oluşturan liflerin içine kendini monte neden olur. Fibrinojen için trombin oranı değiştiren, ya da trombin kalsiyum oranı bu enzimatik reaksiyon zamanı ayarlanabilir olduğundan, tek enjeksiyon bir dizi farklı geometrileri 11,12 yapıları kalıp yapabilirsiniz. Ayrıca biz 13 kültür sırasında jel sınırlamak nasıl ortaya çıkan doku uyumuna üretebilirsiniz.
Kültür için tasarlanmış kardiyak doku yapıları statik koşullar altında iki hafta sonra kalp hücrelerinin yapı modelini yenilemeye başladı ve 6 elektrik pacemaker koşulları altında bir daralma güç oluşturabilir. Bu protokolün bir parçası olarak, biz de miyokardın fonksiyonel kalp kası tarafından üretilen etkin bir güç analizi (Canlı-Dead son hücre canlılığını belirlemek için elektrik stimülasyonu gibi yöntemler üzerine inşa dahil olmak üzere kültür süre sonra doku mühendisliği analiz yöntemleri tanımlamak assay) ve daralma (miyozin ağır zincir veya MHC) ve miyositler arasında hücresel kaplin (43 veya Cx43 Konneksin) için önemli tipik proteinlerin ifade ve morfolojisini incelemek immünohistolojik boyama.
Protokol
1. Yenidoğan kardiyomiyosit izolasyon - Hazırlık (gün önce)
Bu bölümde oluşturulan Çözümler: PBS-Glukoz çözeltisi, medya durdurun.
- Penisilin-streptomisin (100 ünite / ml ve 100 mg / ml) ve 1.98 g glukoz 250 ml 1x steril fosfat tamponlu salin (PBS) 5 ml ekleyerek bir PBS-glukoz çözeltisi hazırlayın ve ek hacmi 500 ml çözüm getirmek steril PBS 1x.
- 250ml steril Dulbecco'nun Kullanıcı Modifiye Kartal Kullanıcı Orta (DMEM) 25 ml FBS ve penisilin-streptomisin 5 ml (yukarıda olduğu gibi aynı konsantrasyon) ekleyerek durdurmak ortamı hazırlayın ve bir 0.2 mikron filtre ile steril filtreleme önce steril DMEM ile 500 ml hacmi getirmek.
- Otoklavlayarak izolasyonu için gerekli cerrahi aletler sterilize: hemostat # 5 forseps, büyük makas, mikro-makas, neşter sapı (# 4).
2. Yenidoğan kardiyomiyosit izolasyon - Hazırlık (hasat gün)
Kısırlık korumak için emin olun
Bu bölümde kullanılan Çözümleri: PBS-glukoz çözeltisi, Betadine
- Her çöp için, iki steril 100 mm petri kaplarına Kaputun koyun ve buz PBS-glukoz ~ 10 ml ile doldurun. Bunlar daha sonra steril kültür kaputu buz dolu bir buz kovası içinde yer almalıdır.
- Kaputun Betadine 30-40 ml ile 250 ml beher yerleştirin.
- 37 ° C su banyosu içine bir şişe, mühür ve yerine 50 mL / çöp PBS-şekeri ekleyin.
- Her bir kişi için, kaput çalışma yüzeyine underpad emici bir tezgah yeri ve steril steril örtüyü merkezi çalışma alanı dokunmamaya dikkat ederek bir üst örtüyü yere. Aletlerin dokunmadan steril örtüyü üzerine cerrahi aletler ve 4 x 4 gazlı bez dökümü. Tekrar non-steril eldiven ile dokunmamaya dikkat ederek, örtüyü üzerine steril bir # 20 neşter bıçak ve dökümü açın.
- Kaputun opak konteyner, yer yavrular içine baraj yeri ve yavrular çekin
- Steril eldiven giyin
- Dörtte içine gazlı bez katlayın, Betadine behere hemostat ve yer ile kelepçe.
- Neşter bıçak neşter sapı üzerine koyun ve bir kenara koyun.
3. Yenidoğan kardiyomiyosit izolasyonu - kalp diseksiyonu
Bu bölümde kullanılan Çözümleri: Betadine, PBS-glukoz çözüm
- Non-dominant el başparmak ve işaret parmağı arasında kürek kemikleri arasındaki kıstırma cilt tarafından yavru Pick up. Büyük makas kullanarak, bir kesim, yavru başını kesmek. Yavru ileri geri kesmek için, omurganın tamamen kesilmiş olduğundan emin olmak için emin olun.
- Swab betadin batırılmış gazlı bez ile yavru göğüs. Omuzunuzun kısma yavru sabitleyin. Kalp maruz kısmi torakotomi gerçekleştirin. Böylece scalpular diseksiyon için kaburga geçmiş kalbi zorlayarak, uygulanan basınç artırın.
- Kalp, büyük damarlar sever ve kalp kaldırmak için arkasında neşter bıçak çalıştırın. Kalp buz üzerine PBS-glukoz içeren petri yerleştirin.
- Çöp her yavru için 1-3 arasındaki adımları tekrarlayın.
4. Yenidoğan kardiyomiyosit izolasyon - miyosit izolasyon
Bu bölümde kullanılan / Çözümler: PBS-glukoz çözeltisi, kollajenaz çözüm, çözüm durdurmak
- Kalpleri izole edildikten sonra, buz gibi soğuk PBS glukoz çözeltisi durulama herhangi bir kalıntı kan ve bağ dokusu kaldırmak, buz gibi taze bir petri içine sadece ventrikül yeri doku ve izole etmek için kalbin üst 1 / 3 kaldırmak PBS glikoz, önceden hazırlanmış.
- Mikro-makas ve forseps kullanarak ~ 1 metreküp mm dikkatle kalpleri kıyma.
- , Steril bir transfer pipeti pipetin ağız çapı 3 mm, böylece makas kullanarak ucu kesilmiş. 50 ml konik ve buz üzerinde yer çözüm doku parçaları ve tüm aktarmak için pipet kullanın.
- 37 şişeye tip II kollajenaz yavrular, çöp başına 15.000 birim (ünite / mg çok bağlıdır) ve yer tartılır ° C PBS-glukoz kollajenaz çözüm oluşturmak için önceden hazırlanmış ısıttı. Ayrı bir şişeye iyi ve steril filtre karıştırın. 37 ° C su banyosu içine yerleştirin. Stop çözüm de 37 ° C su banyosu içine yerleştirin.
- Kıyılmış doku santrifüj tüpüne alt yerleşmek için izin verin. Toplam hacim 10 ml kadar süpernatantı. 7 ml santrifüj tüpüne kollajenaz çözüm ekleyin.
- Konik tüp doku parçaları ve bir tüp 37 ° C inkübatör veya fırın içinde bir orbital çalkalayıcı rafın içine kollajenaz koyun. Yaklaşık 60 rpm'de orbital çalkalayıcı açın ve kapağını kapatın. 7 dakika için bir zamanlayıcı ayarlayın. Kollajenaz bac yere emin olun.k sıcak tutmak için su banyosu içine.
- Zamanlayıcı çaldığında, kaput içine konik geri getirmek. Ayrıca sıcak kollajenaz kaput haline getirmek ve çözüm durdurmak. Yavaşça doku parçaları, onları yıkmak için 5-7 kez titre. Titrasyon yapıldıktan sonra parçalar altındaki (2-3 dakika) yerleşmek için izin verir. Doku parçalarını emmek için çok dikkatli olmak kadar süpernatant mümkün aspire. Daha sonra, 7 ml kollajenaz çözüm doku parçaları ekleyin ve 7 dakika çalkalayıcı kuvöz içine geri koyun.
- Kalan her adım için, yavaşça doku parçalarını kırmak için 10 kat titre. Sonra doku parçaları, yerleşmek süpernatantı çekişi ve ayrı bir 50 ml konik toplamak. Kollajenaz, 7 ml doku parçaları ekleyin ve 7 dakika için tekrar sindiremez. Supernatant tüp için, sindirim süpernatant her eklenmesinden sonra farklı bir serolojik pipet yardımıyla 10 ml durak çözüm ekleyin.
- Kollajenaz (toplam 7 adım) kadar tekrarlayın.
- Son sindirim adımdan sonra, taze konik 70μm hücre elekten hücre çözümü ve filtre ile konik alır.
- 5 dakika 100g hücreleri aşağı Spin ve hemasitometre kullanarak sayılabilir DMEM 20 ml tekrar süspansiyon ve buz üzerinde hücreleri yer.
- Yeri Tripan Blue çözüm (75 ul Tripan Mavi, 125 ul PBS) içine hücrelerin 50 ul, sayım için 10 ul hemasitometre yerleştirmeden önce iyice karıştırın. Canlı hücreleri, ölü hücreler mavi ise açıktır. Yaklaşık% 80-90 oranında bir canlılığı ile yavru sıçan başına yaklaşık 3 milyon hücre bekliyoruz.
5. Döküm fibrin jel oluşturur fibrin jeller (önceden yapılır) oluşturmak için hazırlık
Çözümler Bu bölümde oluşturulan, fibrinojen stok solüsyonu, trombin stok çözüm, Pluronics çözüm, miyokard inşa medya .
- Hepes içine yavaş yavaş karıştırma fibrinojen tuzlu% 0.9, 20 mM HEPES tamponu fibrinojen 33 mg / ml stok solüsyonu hazırlayın 37 birkaç saat içinde tamponlu salin ° C Çözüm 2-8 gecede yerleşmek için izin ver ° C 37 ° C'ye kadar çözüm Sıcak Çözüm steril bir dizi ardışık filtreler süzgecinden: 40 mikron hücre süzgeçler, 0.45 mikron şişe cam ön filtreler ile filtreler, ve 0.2 mikron şişe cam ön filtreler ile üst filtreler. Çözüm 1 ml ve 3 ml alikotları aliquoted ve -20 ° C'de saklanır
- 0.2 mikron filtre, bir kısım üzerinden 500 ul ve 250 ul alikotları ve donma içine trombin 500 U 18 mL% 0.9 serum fizyolojik ve 2 mL steril deiyonize su, steril filtre ekleyerek trombin 25 U / mL stok çözelti hazırlayın -80 ° C
- 50 Pluronics F-127 g, 700 mL deiyonize su eriterek,% 5 w / v Pluronics F-127 çözümü hazırlayın. Ek deiyonize su ile çözüm hacim 1L getirin. Steril filtre 0.2 mikron filtre ile. Pluronics çözümü, her kullanımdan sonra steril süzülmüş değiştirmeden önce üç kez kullanılabilir.
- % 10 at serumu,% 2 fetal sığır serumu,% 1 penisilin-streptomisin ve 6 mg / mL-aminocaproic asit DMEM içine ekleyerek miyokard inşa ortamı hazırlayın. 50 mcg / ml askorbik asit ve 2 mcg / ml insülin 25 mcM Hepes beslemeden önce hemen eklenmesi gerekir.
- Mandrel birlikte bir teflon çubuk, bir teflon kol, enjeksiyon amaçları için çıkarılan bir çentik ile iki teflon pullar ve iki lastik O-ring (bkz. Şekil 2a) koyarak birleştirin. Kullanmadan önce Otoklav.
- Dış parçası için kalıp ve pistonları olarak kullanılmak üzere 3cc'lik şırınga muhafazaları 6cc şırınga gazino alın ve Luer-lock uçlarını keserek ve otoklav (bkz. Şekil 2a) hazırlamak.
6. Döküm fibrin jel oluşturur fibrin jeller oluşturmak için hazırlık (sağ fibrin jel oluşturur yapmadan önce)
Bu bölümde kullanılan Çözümleri: Pluronics çözüm
- Steril filtre% 5 Pluronics kullanmadan önce filtre 0.2 mikron ile F-127 çözümü. 1 L beher% 5 kaputu Pluronics çözüm içine yerleştirin Milleri ve şırınga kılıflar. Kaputun 2-3 saat için Pluronics çözüm iliklerine parçaları tam bir kaplama sağlamak için bırakın. Pluronics çözümü kat Milleri ve fibrin jel Şemsiyeler yapışmasını önler.
- 2-3 saat inkübasyondan sonra, tekrar şişeye% 5 Pluronics çözüm dökün, kaputun yüzey steril örtüler yerde ve kalıplar oluşturmak için steril eldiven giyin.
- O-ring ve Teflon pullar arasında sıkı bir mühür sağlamak için bir piston gibi 3cc'lik şırınga kullanarak, inşa Milleri 6 cc şırınga kılıflar içine yerleştirin.
7. Döküm fibrin jel enjeksiyon yoluyla yapıları
Çözümler Bu bölümde oluşturulur: F çözüm, T çözüm, hücre çözümü.
- 1 ml (3.3 mg / ml son fibrinojen, 25 U / mL son trombin konsantrasyonu) fibrin jel yapmak için, 20 mM HEPES Tampon 558 ul fibrinojen stokunun 112 ul ekleyerek, konik bir tüp F çözüm oluşturmak % 0.9 salin solüsyonu. Ayrı bir konik tüp, trombin stokunun 17 ul ve 2 N Ca 1.3 ul ekleyerek T çözüm oluşturmak + + DMEM 135 ul çözüm. Tablo 1'e bakınız.
- Üçüncü bir konik tüp olarak inşa hücre konsantrasyonu, 29,4 milyon hücre / mL ya da 6 kez hücre istenilen nihai konsantrasyon konsantrasyon olduğunu, böylece bir birim hücreleri aşağı iplik ve hücrelerin resuspending bir hücre çözümü hazırlamak
- Fibrin jel yapısı, hazırlık 18G 1 ½ inç uzunluğunda iğne ile 1 ml şırınga atmak için hazır olduğunuzda. 21G 1 inç iğne de hazır bulundurun.
- Hücre çözümü fibrin çözüm: T çözüm: F çözüm 04:01:01 oranında oluşturulur. Bir mL jel yapmak için, 167 hücre çözümü mcL, ve son olarak 167 ul T çözüm temiz bir 50 ml santrifüj tüp, 667 F çözüm mcL ekleyin. Pipet kabarcıkları tanıtmak için dikkatli olmak birlikte çözüm karıştırmak için. Çözümler karıştırılır sonra, reaksiyon başlamış ve yapıları enjeksiyon derhal yapılmalıdır.
- 18G iğne ile önceden hazırlanmış şırınga alın ve fibrin çözüm hazırlamak. Şırınga, iğne biniyorlar kabarcıklarını engellemek için ters değil dikkat edin. 18G iğne 21G iğne ile değiştirin. Şırınga hava kabarcıkları çıkmaya zorlamak için hafifçe dokunun.
- Teflon O-ring oluk aşağıdaki stoper ve gövde arasında kalıp içine şırınga takın ve çözüm kalıp içine enjekte edilir. Tam dolum sigortalamak için üstüne oluk kalıp yatırın. Şırınga çıkarın ve kalan kalıp doldurmak için devam edin. Yeterli jel solüsyonu, aynı zamanda çeşitli kalıplar doldurmak için oluşturulabilir. Çözüm hızla jel Ancak, genellikle 6 ila belirli bir zaman enjekte yapıları sayısını sınırlamak için iyi bir fikir.
- 37 üç grupları ve inkübatör veya fırın yer Parafilm kalıpları sarın ° C, jeller, jel süresi polimerize izin, 20 dakika boyunca kalıpları inkübe izin ver.
- 21 ml başına miyokard yapı inşa orta her kültür kavanoz (Nalgene düz tarafı kavanoz) doldurun. DMEM ile büyük bir petri içine inşa mandrel zorlamak için bir piston gibi gövde 3 cc steril şırınga kullanın. Sonra inşa örnek kavanoza yerleştirin. Her 4 oz kavanoz 2 basılı tutabilirsiniz Her 16 oz kavanoz, 6 yapıları tutabilir.
- Kavanoz kapakları Vida ve inkübatör aktarabilirsiniz. Inkübatör içinde, gaz değişimi için izin kavanoz kapaklarını gevşetin.
- 24 saat sonra, steril bir diş al ve (Şekil 2 temsilcisi sonuçları) inşa tekdüze uyum sağlamak için halka kalıp ucunda beyaz teflon O-ring uzak inşa itin.
8. Analiz teknikleri (2 hafta sonra kültür) - kasılma gücü testi
Bu bölümde kullanılan Çözümleri: DMEM, miyokard inşa medya.
- Kurşun banyo elektrotlar stimülatör kablolara gelen timsah tutturun. Veri toplama tahtası, darbe jeneratörü ve kuvvet dönüştürücü güç verin. Kuvvet dönüştürücü 5g ayar anahtarlı ve zeroed olmalıdır. Kuvvet dönüştürücü verileri görüntüler ve kaydeder özel bir LabView programını açın. Her numune için veri klasöründe yeni bir boş metin dosyası oluşturun.
- DMEM 37 ° C su banyosu içine yerleştirin ve yapıları test etmeden önce ısınmak için zaman tanıyın. Isındı sonra, 37 ° C DMEM kuvvet ölçüm sistemi orta hamamı (bkz. Şekil 3A).
- Örnek kavanoz inşa hafifçe cımbız ile Teflon destek yapı halkasını çıkarın ve kuvvet ölçüm sistemi orta banyosunda sabit metal yazılan üzerinde inşa yerleştirin. Cımbız ile inşa tutmayın! Aksine, itmek için cımbız kullanın ve mandrel destek inşa kaldırın.
- Transdüser kolu üzerinde inşa diğer ucunu yerleştirin ve transdüser 0.50V okur kadar (yaklaşık 1.0 gram kuvvet veya gerginlik 10 millinewtons), sıkın
- Kaydedilebilir kasılma gücü veriler için metin dosyasını seçin.
- Kardiyak stimülatör (Model # S88X Grass Technologies), 20V (8 V / cm), 6ms süresi ve 1 Hz bir oranda darbe gerilimini ayarlamak.
- "Açma / kapama düğmesi çıktı" acil elektrik pacemaker Başlat
- Dalga şekli düzenli hale gelinceye kadar kaydetmeye başlayın.
- Kuvvet ölçüm sistemi orta banyo dikkatlice inşa kaldırmak ve kültür ortamı içine yerleştirin. Sonra kuvvet ölçüm sistemi orta banyo DMEM kaldırmak ve addit analiz etmek için taze, sıcak DMEM ile değiştirinional örnekleri.
- Kesme ve yapı, yapı, uzunluk ve genişlik ölçmek, böylece o Penis
- Canlılığı, histoloji, ya da western blot ölçümleri de dahil olmak üzere ek bir analiz ölçümleri için kullanılmak üzere inşa bölüme kesin.
9 - Analiz teknikleri (2 hafta sonra kültür) - canlılığı için Canlı Dead Assay (Invitrogen Ölü / Canlı Testi) 14:
Bu bölümde kullanılan Çözümleri: EthD-1 stok solüsyonu, Calcein AM stok solüsyonu PBS
- Örnekleri PBS içinde 3x 5 dakika yıkama ile durulayın.
- Tam karıştırma sağlamak için 2 mM 10 ml steril PBS ve vorteks EthD-1 stok solüsyonu 20 ul ekleyin.
- Calcein EthD-1 çözümü AM stok stolution 4 mM 5 ul ekleyin. Yine, iyice karışmasını sağlamak için vorteks.
- Yapı karşılamak için yukarıdaki çözüm yeterli hacim ekleyin.
- Oda sıcaklığında 30 dakika inkübe edin (boyalar photobleaching önlemek için) kaplı.
- Boyaları çıkarın ve sıcak PBS ile değiştirin. Gözlemleyin ve floresan mikroskobu ile görüntüleri kaydetmek. Calcein ethidium homodimer-1, 528 nm ışığı ve 617 nm ışık yayar, 494 nm ışık heyecanlı ve 517 nm ışık yayar. Örnek sonuçları için Bkz: Şekil 4.
10 Analiz teknikleri (2 hafta sonra kültür) - önemli miyosit proteinler için immünhistokimya:
Bu bölümde kullanılan Çözümleri: PBS, PBS içinde% 4 paraformadehyde, PBS içinde,% 5 eşek, serum, PBS, 0.1 ng / ml Hoechst 33.258 PBS içinde antikorlar .
- Örnekleri PBS içinde 3x 5 dakika yıkama ile durulayın.
- 4 PBS solüsyonunda 2-3 saat% 4 paraformaldehid Fix ° C
- Örnekleri PBS içinde 3x 5 dakika yıkama ile durulayın.
- Örnek seçim protokole göre kesitli ve lekeli, gömülü olabilir. Bu protokolün kalan kısmı konfokal mikroskobu ile görüntüleme için tüm yapı boyama kapsar. Yapı içine diffüz antikorları için daha fazla zamana ihtiyaç var gibi inkübasyon sürelerinde kesitli doku için daha uzun olduğunu unutmayın. Buna ek olarak, kalan adımları tüm oda sıcaklığında yapılmaktadır.
- Hücre zarları permeabilize 30 dakika örnekleri PBS içinde% 0.1 Triton-X ekleyin.
- Örnekleri PBS içinde 3x 10 dakikalık yıkama ile durulayın.
- Örnekleri ikincil antikor herhangi bir non-spesifik bağlama engellemek için 1 ½ saat örnekleri PBS içinde% 5 eşek serum ekleyin.
- Konneksin 43 (1:50 seyreltme) ve miyozin ağır zincir (1:100 seyreltme) 3 saat örnekleri PBS primer antikorlar ekleyin. Size iki proteinleri etiket sırasına göre primer antikorlar farklı bilgisayarlardan (yani tavşan ve fare) olduğundan emin olmak gerekir.
- Örnekleri PBS içinde 3x 10 dakikalık yıkama ile durulayın.
- 3 saat PBS içinde uygun floresan etiketli sekonder antikor ekleyin.
- PBS içinde 3x 10 dakikalık yıkama örnekleri durulayın
- Sadece görüntüleme önce konfokal mikroskop örnekleri, 15 dakika için 0.1 ng / ml PBS Hoechst 33.258 ekleyin.
- Örnekleri PBS içinde 3x 10 dakikalık yıkama ile durulayın.
- Konfokal mikroskop ile görüntüleme hücreleri (örneğin sonuç için Bkz: Şekil 4) tarafından MHC ve Cx43 örnekleri ifade analiz edin.
11. Temsilcisi sonuçları / Çıktıları:
Kardiyomiyosit fibrin inşa başlangıçta tüm kalıp genişliği (Şekil 2B) kapsar. Kabarcıkları yapı var ve tüm uzunluğu boyunca homojen görünmelidir. Kültür iki hafta sonra, ilk genişliği (Şekil 2C) yaklaşık 1 / 4 yapı sözleşme.
Şekil 3B gösterildiği gibi inşa bizim özel kasılma gücü cihazı (Şekil 3A) elektrikle tempolu, seğirme gücü verileri oluşturulabilir. Dalga şekli, kuvveti, kasılma hızı ve gevşeme oranı belirlemek için MATLAB (MathWorks) ayrı ayrı analiz edilebilir. Yaklaşık 1.3 mN Twitch kuvvetleri 6 bekleniyor.
Hücre canlılığı, yapı, yapı içine oksijen difüzyon sınırlamaları nedeniyle yapı derinliği, bağlıdır. Yapı yüzeyi, Şekil 4A, yüksek hücre canlılığı görülmektedir. Konfokal mikroskopi, Şekil 4B, daralma, kırmızı ile gösterilen yapı hizalanır yapısı için önemli, miyozin ağır zincir, MHC nedeniyle görülmektedir. Yeşil gösterilen Konneksin 43, miyositler arasında hücresel bağlantı için gerekli.
Şekil 1: Genel Bakış sürecinden

Şekil 2: A) fibrin jeller oluşturmak için ayrı ayrı ve kombine kalıp parçaları. From soldan sağa: iki teflon contalar, iki silikon o-ringler, Teflon çubuk, bir teflon tüp, tamamlanmış bir malafa mili için, dış gövde ve piston). B) hemen sonra dış gövde (gün 0) ejeksiyon kalıp üzerinde oluşturun. 13 gün sonra kültür kalıp C) Sıkıştırılmış bir yapı (kırmızı ok).
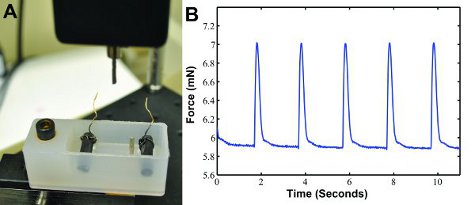
Şekil 3: A) kayıt seğirme gücü için Özel daralma kuvvet ölçüm sistemi. Bir yazı ile bir kuvvet dönüştürücü kasılma gücü ölçer ve bir bilgisayara sonuçları verir. Teller ile iki karbon elektrot içeren bir banyo adım inşa elektrik stimülatörü bağlanır. Iki yerde inşa tutun. B) Örnek seğirme gücü dalga formu veri, 0,5 Hz elektrik stimülasyonu ile oluşturulan.
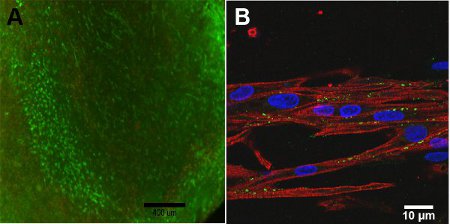
Şekil 4: A) 13 gün (ölçek bar = 400 mm) inşa, Live / Dead test. Yeşil, canlı hücreleri temsil eder ve kırmızı ölü hücreleri temsil eder. B) miyozin ağır zincir (kırmızı), Konneksin 43 (yeşil) ve Hoescht nükleer leke (mavi) (ölçek bar = 10 mikron) Konfokal Resim.
| F çözüm | T çözüm | Hücre Çözüm | |||
| Fibrinojen | 112 ul | Trombin | 17 ul | DMEM içinde hücreler | Ul 170 |
| Hepes | 558μl | Ca + + | Ul 1.3 | ||
| DMEM | 152 ul | ||||
| Toplam | 670 ul | Toplam | Ul 170 | Toplam | Ul 170 |
Tablo 1. 1 ml jel Fibrin jel çözümleri, miktarları.
Not: 20 mM HEPES Fibrinojen = 33 mg / ml Fibrinojen Tuzlu tamponlu
Hepes = 20 mM HEPES tamponlu salin
Trombin = 25 U / ml 0.81% NaCl çözeltisi
Ca + + = 2 N Kalsiyum Klorür çözüm
Tartışmalar
Miyokard sistemi in vitro model tutarlı ve uygulanabilir bir üç boyutlu fibrin jeller sonuçları yenidoğan sıçan kardiyomiyositlerde kapsülleme. Hücreleri sürüklenmiş, metabolik olarak aktif ve doğal kalp dokusu 12 ile uyumlu bir ekstrasellüler matriks remodeling, sıkıştırma ve yeniden yeteneğine çünkü Fibrin tercih edilen bir biyomateryal. Kardiyomiyositlerde bu ortamda kendilerini hizalamak için izin verdiği için, kendi işlevselliği, izotropik dokuların 6 ile karşılaştırıldığında daha büyük kasılma gücü ile sonuçlanan kalp kasının daha karakteristik. Potansiyel terapötik uygulamalar için, canlılığı ve işlevsellik hem de teşvik eden bir malzeme içinde hücreleri kapsüllemek için gerekli. Protokolleri fibrin ağ oluşturarak bir üç boyutlu mikroçevresinin kardiyak hücre davranışını kontrol etmek için verimli ve doğru yolu göstermek sundu.
Birkaç olası sorunları bu yapıları oluşturma ve kültür sırasında ortaya çıkabilir. Bir yapı işlevselliği önemli ölçüde etkileyecek önce kapsülleme hücre canlılığı bakım, olası sorunu. Çaba, izolasyon ve fibrin jel içindeki hücrelerin kapsülleme arasındaki süreyi azaltarak yalıtım hücre ölümü sınırlamak için yapılmalıdır. Oluşturur sıkı bir zamanlamaya göre her gün medya sağlanmalıdır. Buna ek olarak, kullanılan tüm çözümler homojenliği sağlamak için önemlidir. Fibrinojen, trombin ve hücrelerin karışımı heterojen bir ortam oluşturur, ECM bozulmasina hücrelerinin yeteneği, mekanik çift ve sözleşme potansiyel tıkalı. , Mühendislik doku devamlılığı bozuklukları önlemek için yapıları enjeksiyon sırasında hava kabarcıklarının oluşumunu önlemek için ayrıca önemlidir. Bu sorunu hafifletmek için bir yolu, enjektörün içine inşa yapmak ve yavaş yavaş enjekte etmek için gerekli olandan daha fazla jel beraberliktir. Son olarak, bir kez fibrin matriks kurdu ve 24 saat boyunca kültür ortamı olmuştur, fibrin jel hücre tabanlı sıkıştırma teşvik etmek için halka kalıbın kenarlarından inşa ayırmak için esastır. Kalıp ortasında inşa tutulması, gaz ve besin alışverişi kolaylaştırır. Halka kalıp iki bağlılık da istenilen hücre hizalama bozabilir.
Sağlık ve Veteriner Hekimler Birliği Amerikan Ulusal Sağlık Enstitüleri kuralları uyarınca kabul edilebilir bir yöntemdir bu protokolü euthanization yöntemi, bu bilinçli dekapitasyon olarak kullanılır dikkat etmek önemlidir. Ancak, bazı kurumlar, yenidoğan sıçanlar için dekapitasyon anestezi kullanımı tavsiye ederiz. Hipoksik koşullar altında eksize kalp doku / hücreler için zaman az miktarda olması nedeniyle bilinçli dekapitasyon seçtiniz. Nispeten küçük miktarda hipoksi, iskemi ve bu protokol sonuçlarını önemli ölçüde etkileyecek potansiyel miyosit ölüm, miyosit yol açabilir.
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Ulusal Kalp, Akciğer ve Kan Enstitüsü (Ödül # R00HL093358 için LDB) - Bu çalışma Ulusal Sağlık Enstitüleri tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | Yorumlar |
|---|---|---|---|
| Sodyum klorür | Sigma | S7653 | PBS |
| Potasyum klorür | Sigma | P9333 | PBS |
| Sodyum fosfat dibazik | Sigma | S7907 | PBS |
| Potasyum fosfat tekbazlı | Sigma | P5655 | PBS |
| Glikoz | Sigma | G5400 | Izolasyon |
| hemostat | Güzel Bilim Araçları | 91308-12 | Izolasyon |
| ince cımbız | Güzel Bilim Araçları | 11251-20 | Izolasyon |
| büyük makas | Güzel Bilim Araçları | 91401-14 | Izolasyon |
| mikro-makas | Güzel Bilim Araçları | 91501-09 | Izolasyon |
| bisturi sapı | Güzel Bilim Araçları | 10008-13 | Izolasyon |
| neşter bıçak | Fisher Scientific | 08-918-5A | Izolasyon |
| Emici tezgah underpad | VWR | 56617-014 | Izolasyon |
| steril örtüyü | Fisher Scientific | GM42526 | Izolasyon |
| otoklav torbası | Balıkçı | 01-812-54 | Izolasyon |
| gazlı bezle | Fisher Scientific | 13-761-52 | Izolasyon |
| betadin | Purdue Ürünler | 67618-150-01 | Izolasyon |
| steril eldiven | Fisher Scientific | 19-020 | Izolasyon |
| steril transferi pipet | Fisher Scientific | 9962 | Izolasyon |
| kollajenaz | Worthington | CLS2 | Izolasyon |
| Teflon çubuk 1 / 4 inç çapında | McMaster-Carr | 8546K11 | Kalıp parçası |
| Teflon tüp, 1 / 4 inç ID, 1 / 2 inç OD | McMaster-Carr | 8547K31 | Kalıp parçası |
| Silikon O-Ring 1 / 4 inç kimliği, 1 / 2 inç OD | McMaster-Carr | 9396K204 | Kalıp parçası |
| Teflon tüp 1 / 4 inç kimliği, 5 / 16 inç OD | McMaster-Carr | 52355K14 | Kalıp parçası |
| Kendall monoject şırınga 6cc | Fisher Scientific | 05-561-41 | Kalıp parçası |
| BD şırınga 3cc | Fisher Scientific | 309585 | Kalıp parçası |
| Sığır Fibrinojen | Sigma | F8630 | Kurmak |
| Sığır Trombin | Sigma | T7513 | Kurmak |
| 1 M Hepes | Sigma | H0887 | Kurmak |
| Sodyum klorür | Sigma | S7653 | Kurmak |
| DMEM | Invitrogen | 10569 | Kurmak |
| Pluronic F-127 | Sigma | P2443 | Kurmak |
| Kalsiyum Klorür | Sigma | 383147 | Kurmak |
| 0.2 mikronluk filtre | Fisher Scientific | SCGVT05RE | Kurmak |
| 40 mikron hücre süzgeçler | Fisher Scientific | 22-363-547 | Kurmak |
| 0.45 mikron şişe top filtre | Corning | 430627 | Kurmak |
| cam ön filtre | Millipore | AP2007500 | Kurmak |
| 18G 1 1 / 2 inç uzunluğunda iğne | Fisher Scientific | 14-826-5D | Kurmak |
| 21G 1 inç iğne | Fisher Scientific | 14-826C | Kurmak |
| kavanoz inşa | Fisher Scientific | 2116 | Kurmak |
| Penisilin-streptomisin | Invitrogen | 15140 | Medya |
| at serumu | Sigma | H1138 | Medya |
| Fetal sığır serumu | Invitrogen | 16000 | Medya |
| aminocaproic asit | Acros Organics | 103305000 | Medya |
| askorbik asit | Sigma | A5960 | Medya |
| insülin | Sigma | I9278 | Medya |
| Paraformaldehit,% 16 | Elektron Mikroskopi Bilimler | 15710 | Histoloji |
| Optimal kesme sıcaklığı (OCT) | Ted Pella | 27050 | Histoloji |
| 2-methylbutane | Balıkçı | 03551-4 | Histoloji |
| Fare MYH1/2/4/6 birincil antikor | Santa Cruz Biyoteknoloji | SC-32.732 | Histoloji |
| Tavşan Konneksin 43 primer antikor | Hücre Sinyal Teknolojisi | 3512 | Histoloji |
| Dylight 549-konjuge eşek anti-fare sekonder antikoru | Jackson ImmunoResearch Laboratuvarları | 715-505-151 | Histoloji |
| Dylight 488-konjuge Donke anti-tavşan ikincil antikor | Jackson ImmunoResearch Laboratuvarları | 711-485-152 | Histoloji |
| Ölü / Canlı tahlil | Invitrogen | L-3224 | Analiz |
Referanslar
- Stegemann, J. P., Hong, H., Nerem, R. M. Mechanical, biochemical, and extracellular matrix effects on vascular smooth muscle cell phenotype. Journal of applied physiology. 98, 2321-2327 (2005).
- Guarnieri, D. Covalently immobilized RGD gradient on PEG hydrogel scaffold influences cell migration parameters. Acta. 6, 2532-2539 (2010).
- Krebs, . Injectable poly(lactic-co-glycolic) acid scaffolds with in situ pore formation for tissue engineering. Acta. 5, 2847-2859 (2009).
- Zimmermann, W. -. H. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature. 12, 452-458 (2006).
- Chung, C., Burdick, J. A. Influence of Three-Dimensional Hyaluronic Acid Stem Cell Chondrogenesis. Tissue engineering. 15, (2009).
- Black, L. D. Cell-induced alignment augments twitch force in fibrin gel-based engineered myocardium via gap junction modification. Tissue engineering. 15, 3099-3108 (2009).
- Syedain, Z. H., Weinberg, J. S., Tranquillo, R. T. Cyclic distension of fibrin-based tissue constructs: evidence of adaptation during growth of engineered connective tissue. Proceedings of the National Academy of Sciences of the United States of America. 105, 6537-6542 (2008).
- Falvo, M. R., Gorkun, O. V., Lord, S. T. The molecular origins of the mechanical properties of fibrin. Biophysical chemistry. , 152-155 (2010).
- Jockenhoevel, S. Fibrin gel - advantages of a new scaffold in cardiovascular tissue engineering. European journal of cardio-thoracic surgery : official journal of the European Association for Cardio-thoracic Surgery. 19, 424-430 (2001).
- Ryan, E. Structural Origins of Fibrin Clot Rheology. Biophysical Journal. 77, 2813-2826 (1999).
- Williams, C. Cell sourcing and culture conditions for fibrin-based valve constructs. Tissue engineering. 12, 1489-1502 (2006).
- Grassl, E. D., Oegema, T. R., Tranquillo, R. T. A fibrin-based arterial media equivalent. Journal of biomedical materials research. 66 (Part A. , 550-561 (2003).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of biomechanical engineering. 119, 137-145 .
- Invitrogen. . >LIVE/DEAD Viability/Cytotoxicity Kit *for mammalian cells. , (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır