A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تعديل الخميرة اثنين والهجين نظام لتحديد البروتينات التفاعل مع عامل النمو Progranulin
In This Article
Summary
عدلت أننا الخميرة تقليدية ثنائية مختلطة الفرز ، وأداة فعالة في تحديد الجينية التفاعل البروتين. هذا التعديل تقصير ملحوظ في العملية ، ويقلل من عبء العمل ، والأهم من ذلك ، ويقلل من عدد من ايجابيات كاذبة. بالإضافة إلى ذلك ، هذا النهج هو استنساخه وموثوق بها.
Abstract
Progranulin (PGRN) ، المعروف أيضا باسم السلائف epithelin granulin (تقرير الآفاق الاقتصادية العالمية) ، هو 593 - الأحماض الأمينية autocrine عامل النمو. ومن المعروف PGRN أن تلعب دورا حاسما في مجموعة متنوعة من العمليات الفسيولوجية والأمراض ، بما في ذلك مرحلة التطور الجنيني المبكر ، والتئام الجروح 1 ، والتهاب 2 ، 3 ، 4 والدفاع المضيف. وظائف PGRN أيضا كعامل عصبية 5 ، والطفرات في الجينات PGRN مما أدى إلى فقدان جزئي للقضية PGRN الخرف الجبهي بروتين 6 ، 7. وقد أدت الدراسات التي أجريناها مؤخرا إلى عزل PGRN كهيئة تنظيمية مهمة للتنمية وتدهور الغضروف 11/08. على الرغم من PGRN ، اكتشفت منذ ما يقرب من عقدين من الزمن ، ويلعب دورا حاسما في العديد من الظروف الفسيولوجية والمرضية ، والجهود المبذولة لاستغلال تصرفات PGRN وفهم الآليات التي تشارك تعرقلت بشكل كبير من خلال عدم قدرتنا على تحديد مستقبله ملزمة (ق). لمعالجة هذه المشكلة ، قمنا بتطوير مودىالنهج القائم fied الخميرة اثنين الهجين (MY2H) على الأكثر استخداما GAL4 نظام 2 - الهجينة القائمة. بالمقارنة مع شاشة تقليدية ثنائية مختلطة الخميرة ، MY2H تقصير كبير في عملية الشاشة ويقلل من عدد الحيوانات المستنسخة إيجابية كاذبة. بالإضافة إلى ذلك ، هذا النهج هو استنساخه وموثوق بها ، ونحن قد استخدمت هذا النظام بنجاح في عزل البروتينات الملزمة الطعم المختلفة ، بما في ذلك قناة أيون 12 ، المصفوفة خارج الخلية البروتين 10 و 13 و 14 عامل النمو. في هذه الورقة ، ونحن تصف هذا الإجراء MY2H التجريبي في التفاصيل باستخدام PGRN كمثال والتي أدت إلى تحديد TNFR2 كما مستقبلات first PGRN المرتبطة معروفة 14 و 15.
Protocol
1. معلومات أساسية
الخميرة نظام هجين اثنين هي تقنية قوية الجينية المستخدمة لاكتشاف بروتين تفاعلات البروتين 16 و 17. عدة أنواع من النظم المختلطة - 2 ، مثل به lexa الأنظمة المستندة ، ونظام التوظيف الاستغاثة ، والبكتيريا أو الخلايا الثديية المستندة 2 الهجينة ، والتجارية المتاحة ، فإن هذه الورقة تركز تحديدا على التعديلات المدخلة على أساس GAL4 الأكثر استخداما الخميرة 2 - الهجين النظام. لفترة وجيزة ، يرتكز الأسلوب على خصائص الخميرة GAL4 البروتين الذي يتكون من المجالات المسؤولة عن التنشيط فصل الحمض النووي ملزمة والنسخي. وأعرب عن البروتين الطعم والانصهار في مجال الحمض النووي ملزم GAL4 (DNA - دينار بحريني) ، في حين يتم التعبير عن البروتينات فريسة اندماج في مجال التنشيط GAL4 (AD). التفاعل بين الطعم والبروتينات الانصهار فريسة يؤدي إلى التنشيط الترانسكربتي من GAL4 ملزم المواقع التي تحتوي على جينات مراسل التي تندمج في ز الخميرةenome. ويتجلى مبدأ Y2H في الشكل. ويلخص (1) وإجراء التجارب في الشكل. 2.
2. المواد المطلوبة والحلول
- YPD متوسطة النمو (مزيج من ببتون ، خلاصة الخميرة ، وسكر العنب في النسب المثلى لزراعة معظم سلالات الجعوية السكيراء).
- الحد الأدنى من قواعد SD (الحد الأدنى من المعرفة التركيبية (SD) وتشمل قاعدة القواعد النيتروجينية الخميرة ، سلفات الأمونيوم ، ومصدر الكربون ، وسكر العنب ، ويمكن أن يضاف التسرب (DO) ملاحق قاعدة SD الحد الأدنى لإجراء الاصطناعية ، والمتوسطة التي تفتقر إلى تعريف محدد المواد الغذائية).
- ليو / - التربتوفان التسرب (DO) ملحق (التي تحتوي على كل الأحماض الأمينية الأساسية باستثناء يسين والتربتوفان)
- -His/-Leu/-Trp/-Ura التسرب (DO) الملحق (التي تحتوي على كل الأحماض الأمينية الأساسية باستثناء يسين ، التربتوفان ، الحامض الاميني ، واليوراسيل)
- مرق لوريا (LB) (تريبتون 10 غرام / لتر ، واستخراج خميرة 5 جم / لتر ، كلوريد الصوديوم 5 غ / لتر)
- Xغال (5 - 4 - برومو كلورو - 3 - β - indolyl - D - galactopyranoside) الحل : أعد بمثابة 20 ملغ / مل محلول المخزون في N ، N - ثنائي ميثيل الفورماميد
- 10X TE (100 ملي تريس ، حمض الهيدروكلوريك (7.5 درجة الحموضة) ، و 10 ملي EDTA ، تعقيمها)
- Sonicated الرنجة أو سمك السلمون الحمض النووي الحيوانات المنوية ، مسلوق (10 ملغ / مل)
- 10X LiAc (1 خلات الليثيوم M ، تعقيمها)
- 50 ٪ PEG - 3350 الحل ، فلتر تعقيم
- 3 الأمينية - 1 ، 2 ، 4 - Triazole (3AT)
- الكاناميسين
- أمبيسيلين
- ELECTROMAX الخلايا DH5α
- Z العازلة : 16.1 ز Na2HPO4 7H2O (أو 8،52 ز اللامائية) ، 5.5 غرام NaH2PO4 H2O (أو 4.8 ganhydrous) ، 0،75 ز بوكل ، 0،246 ز MgSO4 7H2O (أو 0،12 ز اللامائية) ، يذوب في الماء 1 لتر ، تعقيمها المقطر وتعديلها ل الحموضة 7.0.
3. جيل الطعم (pDBLeu - PGRN)
تم استنساخ إتجاهي ترميز جزء [كدنا] PGRN تفتقر إشارة الببتيد (aa21 - 588) في مواقع سال أنني ، وليس من ناقلات pDBLeu (بروكويست للنظام هجين اثنين ، Invitrogen)الحفاظ على قراءة الترجمة الإطار نفسه بوصفه المجال الحمض النووي لتوليد GAL4 تجليد pDBLeu - PGRN.
- [كدنا] تضخيم شظية من PGRN المذكورة أعلاه بواسطة PCR باستخدام بادئات قليل النوكليوتيد تهدف الى احتواء المواقع تقييد (سال لي في 5'end وليس لي في 3'end) للسماح في الإطار الانصهار.
- هلام تنقية للمنتج PCR ، مع هضم نوكليازات الاقتطاع الداخلية سال الأول وليس الأول.
إعداد DB pDBLeu بواسطة ناقلات الهضم قيود مزدوجة مع endonucleases نفس القيد. - Ligate جزء PGRN التقييد في ناقلات pDBLeu الخطي وتتحول DH5α مع اختيار LB عند 25 ميكروغرام / مل الكاناميسين +.
- التحقق من تصحيح للبناء بواسطة تسلسل الحمض النووي.
4. التحول صغيرة الحجم من الطعم البلازميد
- تلقيح 5 مل من YPD مع مستعمرة Mav203 (Invitrogen) ، بين عشية وضحاها في زعزعة 30 درجة مئوية.
- تمييع الثقافة بين عشية وضحاها في 50 مل من YPD. تنمو وظيفةitional 2-4 ساعات.
- بيليه الخلايا في 3000 دورة في الدقيقة لمدة 5 دقائق على RT. Resuspend على بيليه في 40 مل من المياه ، وتعقيمها المقطر.
- إعادة بيليه الخلايا. Resuspend في 2 مل من محلول الأول ، في احتضان RT 10 دقيقة.
الحل الأول : 0.5 مل 10xLiAc ، 0.5 مل 10xTE ، 4 مل H 2 O - صرف الحمض النووي للأنابيب : 2-3 ميكرولتر من pDBLeu - PGRN (0.25μg/μl) و 10 ميكرولتر من التشويه والتحريف ، المنفصمة السلمون الحمض النووي الحيوانات المنوية (10μg/μl). إضافة خلايا الخميرة 100μl ، مزيج جيد.
- إضافة مزيج 700μl حل ثانيا ، حسنا. احتضان عند 30 درجة مئوية لمدة 30 دقيقة. الحل الثاني : 0.2 مل 10xLiAc ، 0.2 مل 10xTE و 1.6 مل من 50 ٪ PEG3350.
- الصدمة الحرارية في درجة حرارة 42 درجة مئوية لمدة 15 دقيقة.
- بيليه لمدة 2 دقيقة. تجاهل طاف. Resuspend على بيليه في 200 ميكروليتر المياه وتعقيمها المقطر.
- تعليق لوحة على SD - لوي الصفائح مع التخفيفات المتسلسلة. احتضان لوحة في 30 درجة مئوية لمدة 2-3 أيام.
5. التحقق من صحة الطعم
قبل تنفيذ نعمش الشاشة ثنائية مختلطة ، اختبار pDBLeu - PGRN لتفعيل الذات وتحديد مستويات التعبير الجيني القاعدية من مراسل HIS3. هذا الاختبار يحدد ما إذا كان الطعم تفعيل النسخ وما إذا كان يمكن تحييد الذاتي التنشيط بواسطة مثبطات. 3 الأمينية - 1 ، 2 ، 4 - triazole (3 - AT) هو المانع التنافسية للمنتج وHIS3 الجينات يمكن أن تستخدم لمعايرة مستوى الحد الأدنى من التعبير HIS3 اللازمة للنمو على الحامض الاميني التي تعاني من نقص وسائل الإعلام.
- تحويل pDBLeu - PGRN الى سلالة Mav203 الخميرة ، لوحة التحول على SD - لوي لوحات ، واحتضان ل48-72 ساعة عند 30 درجة مئوية.
- التصحيح من كل المستعمرات التحول باستخدام المسواك تعقيمها على SD - اللو ، صاحب اللوحات التي تحتوي على 3 - AT بتركيزات تصل إلى 10 ملم ، 25 ملم ، 50 ملم ، 75 ملم ، و 100 مم. 3 - AT هو المانع التنافسية للانزيم HIS3 والطعم الوحيد الذي يحمل الذاتي التنشيط سوف تكون قادرة على النمو في وجود AT - 3.
- سلالات الطعم التي تنمو على لوحات containiنانوغرام 100 مم 3 - AT ليست مناسبة للاستخدام في شاشة ثنائية مختلطة. لالطعوم التي يمكن استخدامها ، واستخدام أقل تركيز AT - 3 الذي يمنع نمو الخلايا. في كثير من الحالات ، يتم استخدام 25 ملم من AT - 3 للفحص.
6. [كدنا] مكتبة الفرز
وقدم pDBLeu - PGRN البلازميد في MaV203 باستخدام التحول على نطاق صغير كما هو موضح أعلاه. أن أعرض pPC86 مكتبة (Invitrogen) في MaV203 (pDBLeu - PGRN) ، وصف الإجراء أدناه يعطي عادة ~ 4 × 10 4 مستعمرات مع 0.5 ميكروغرام من الحمض النووي البلازميد المكتبة. وبالتالي ، سيكون 2.5 × 10 6 transformants الخميرة تتطلب ~ 30.0 ميكروغرام pPC86 - DNA [كدنا] مكتبة البلازميد ، والتحولات 25 ، 10 وخمسين سنتيمترا لوحات (SD - لوي ، صاحب التربتوفان - AT - أورا +3).
- إعداد العدد المناسب من +3 SD - اللو ، التربتوفان ، صاحب أورا - 10 - AT لوحات الطول (50 لهذا الإجراء أدناه). أيضا بإعداد أربعة على الأقل 10 سم ، ولوي - SD - التربتوفان لوحات لتقدير عدد transformants.
- تحويل إلى المكتبةوصف MaV203 تحتوي pDBLeu - PGRN وفقا للإجراءات أدناه.
- تعليق العديد من المستعمرات المعزولة MaV203 (pDBLeu - PGRN) في 100μl ~ المياه وتعقيمها المقطر ونشرها على لوحة لوي SD - 10 - سم. كرر الإجراء لوحة SD - ليو الثاني. لوحات لاحتضان كل من 18-24 ساعة عند 30 درجة مئوية.
- تتخلص تماما ووقف الخلايا في 10 مل من الماء ، تعقيمها المقطر. إضافة تعليق حجم كاف من الخلايا إلى 500 مل من المتوسط YPD السائل في قارورة لإعطاء OD 600 من ~ 0.1.
- تحقق من أن التطوير التنظيمي هو ~ 0.1 بعد التلقيح.
- هزة في 30 درجة مئوية حتى تصل إلى 600 OD ~ 0.4.
- إعداد العذبة :
- 110 مل 1X TE / LiAc من خلال الجمع بين الشركة المصرية للاتصالات 11 مل 10X ، 11 مل LiAc 10X ، و 88 مل من الماء تعقيمها.
- 16 مل PEG / LiAc من خلال الجمع بين 1.6 TE 10X مل و 1.6 مل LiAc 10X ، و 12.8 مل 50 ٪ PEG 3350.
- بيليه الخلايا في 3000g لمدة 5 دقائق في درجة حرارة الغرفة.
- تجاهل رانه supernatants وبلطف resuspend الكرية التي pipetting صعودا وهبوطا في 100 مل ماء ، المقطر تعقيمها في درجة حرارة الغرفة.
- ز الطرد المركزي في 3000 لمدة 5 دقائق في درجة حرارة الغرفة.
- تجاهل طاف للخلايا وطرد resuspend الكرية الخلية في 50 مل من محلول TE / LiAc 1X.
- ز الطرد المركزي في 3000 لمدة 5 دقائق في درجة حرارة الغرفة.
- إزالة supernatants وresuspend وبيليه في الحجم النهائي من 2.5 مل حل TE / LiAc 1X.
- تنفيذ 25 التحولات. الجمع بين 2.5 الخلايا مل ، 125 ميكروليتر (10μg/μl) التشويه والتحريف ، المنفصمة الحمض النووي الحيوانات المنوية السلمون ، و 30 مكتبة ميكروغرام [كدنا]. المزيج بلطف pipetting صعودا وهبوطا. إضافة 15 مل PEG / LiAc الحل والمزيج بلطف. قسامة تعقيمها الى 25 microcentrifuge أنابيب 1.5 مل من كل 700 ميكروليتر.
- احتضان لمدة 30 دقيقة في حمام المياه 30 درجة مئوية.
- الصدمة الحرارية لمدة 15 دقيقة في حمام المياه رقم 42 C.
- الطرد المركزي في 6000 لز 1 دقيقة في درجة حرارة الغرفة. إزالة بعناية فائقةعائم. resuspend بلطف كل بيليه في 400 ميكروليتر المياه وتعقيمها قبل المقطر pipetting صعودا وهبوطا.
- لوحة ال 200 ميكروليتر من خليط تحول كل واحد على تحويل 10 سم ، ولوي - SD - التربتوفان أورا صاحب - AT - +3 (3AT التركيز : 25 ملم) لوحات باستخدام شريط الانتشار ، تعقيمها حتى 25 1.5 مل أنابيب microcentrifuge يمكن أن تجعل لوحات 50 (SD - لوي ، صاحب التربتوفان - AT - أورا +3).
- احتضان لوحات لمدة 5-10 أيام حتى 30 درجة مئوية.
- لتقدير كفاءة التحول من رد الفعل ، والتخفيفات المسلسل رد فعل واحد (1:40 ؛ 1:400 و 1:4000) ومطلي على اللو - SD - التربتوفان وحة. بعد حضانة لمدة 3 أيام في 30 درجة مئوية ، ويتم حساب عدد من المستعمرات والعدد الإجمالي للtransformants المحسوبة.
7. X - غال مقايسة
- نقل المستعمرات لوحة YPD ؛ احتضان عند 30 درجة مئوية خلال الليل.
- تقريب مكان غشاء النتروسليلوز على لوحة YPD ؛ تأكد من عدم وجود فقاعات الغشاء وبين لوحة YPD. بعد 1-2 دقائق ، يا أماهيتم نقل جميع المستعمرات كه تأكد لأغشية (ورق النيتروسليلوز).
- مكان الجانب مستعمرة غشاء حتى في زورق مصنوعة من ورق رقائق الألومنيوم.
- وضع الغشاء في النيتروجين السائل ، وانتظر عشرين ثانية ، ويغرق في النيتروجين السائل لبضع دقائق.
- تأخذ بها غشاء لذوبان الجليد.
- في غضون ذلك المزيج كاشف التالية :
1.5ml Z العازلة
20μl X - غال (20 ملغ / مل) - انخفاض Z العازلة / X - غال في طبق بتري ، ومكان whatman الورق على أعلى من ذلك.
- المكان بعناية ورقة النيتروسليلوز على رأس ورقة whatman.
- احتضان في المستعمرات حتى 37 درجة زرقاء تظهر.
8. Retransformation مقايسة
وينبغي أن البروتينات الانصهار فريسة (AD - Y) المعزولة من الفرز مكتبة الإبقاء على التفاعل مع بروتين التحام الطعم (DB - X) لحمل جينات التقرير ، وretransformation من الحيوانات المستنسخة الفريسة والطعم في بناء مزيد من الخميرة ويمكن القضاء على ايجابيات كاذبة وتسهيل إضافةitional التحليل.
- عزل DNA البلازميد من سلالات الخميرة التي تحتوي على بروتينات التفاعل المحتمل.
- تحويل الحمض النووي في الخلايا DH5α كولاي ، لوحة التحولات على LB +100 ميكروغرام / مل لوحات الأمبيسيلين لعزل انتقائي مكتبة pPC86 - [كدنا] ، واحتضان بين عشية وضحاها في 37 درجة مئوية.
- اختيار عدة مستعمرات من لوحة لوضع حيز LB +100 ميكروغرام / مل مرق أمبيسيلين.
- إعداد وفحص الحمض النووي miniprep عن طريق التحليل القيد المزدوج مع أنني لا سال ، وأولا
- شارك في تحويل فريسة البلازميد والطعم البلازميد في MaV203 ، لوحة للمخاليط التحول على اللو - SC - التربتوفان لوحات ، واحتضان لمدة 2-3 أيام حتى 30 درجة مئوية.
- اختيار ثلاث مستعمرات مختلفة من لوحة لوي - SC - التربتوفان ، نفذ X - غال الفحص.
9. تسلسل وتحليل المعلومات البيولوجية
تسلسل الحمض النووي البلازميد التي تم عزلها من الحيوانات المستنسخة من المرجح إيجابية حقيقية ، قارن هذه المتتاليات لتلك الموجودة في بنك الجينات باستخدام جيش تحرير بلوشستانST البرنامج ، وتحديد تلك الحيوانات المستنسخة اثنين الهجينة التي تتوافق مع الجينات المعروفة. وأظهرت بيانات التسلسل ان اثنين من ايجابيات الحصول على 12 أعلاه كانت الخلية TNFR2 السطحية (TNFRSF1B/CD120b ؛ انضمام NM_130426 #). بالإضافة إلى ذلك ، تم التحقق من التفاعل بين PGRN TNFR وباستخدام مختلف المقايسات التفاعل البروتين البروتين ، بما في ذلك في المختبر الصلبة مرحلة الفحص ملزمة ، شركة مناعي ، التحليل السطحي بالرنين مأكل ، والتدفق الخلوي مقايسة 14.
10. ممثل النتائج
هو مبين في الرسم البياني للفحص في الشكل. 3. سيتم الحصول عليها عادة 50-100 المرشحين استنساخ إيجابية في هذه الخطوة. كنا في البداية 54 مرشحا معزولة استنساخ الإيجابية بين 2.5 مليون transformants فرزهم مع PGRN الطعم. وتم التحقق من المرشحين ثم استنساخ إيجابية عن طريق أداء X - غال مقايسة. عادة ، يتم إزالة ما يقرب من 50 ٪ استنساخ ايجابية كاذبة عبر X - غال مقايسة. حصلنا على 23 استنساخ إيجابية صريحة آتش في هذه الخطوة من أجل الطعم PGRN (الشكل 4). Retransformation من الحيوانات المستنسخة بناء الفريسة والطعم الخميرة في قضاء مزيد من ايجابيات كاذبة والحيوانات المستنسخة التي تنشط جينات لا تزال تمثل مراسل المرجح ايجابيات صحيح. عادة ، ستتم إزالة ما يقرب من 50 ٪ المرشحين استنساخ إيجابية. نحن في نهاية المطاف معزولة 12 استنساخ الإيجابية التي تتفاعل مع PGRN في الخميرة.
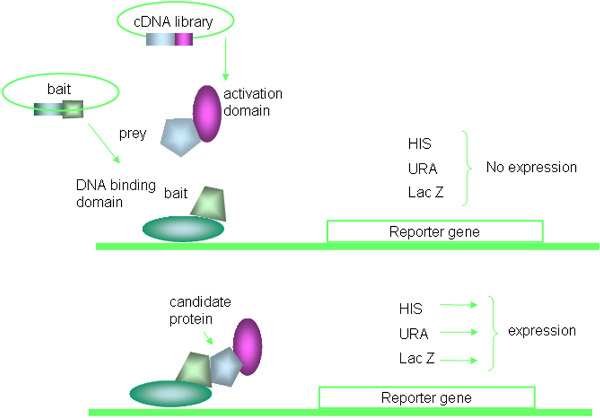
الشكل 1. المبدأ من الخميرة نظام هجين اثنين

الشكل 2. خط أنابيب لتحديد الشركاء بروتين ملزمة باستخدام الخميرة نظام هجين اثنين

الشكل 3. مخطط تدفق الخميرة الفرز ثنائي هجين المكتبة.rge.jpg "الهدف =" _blank "> اضغط هنا لعرض النسخة الكاملة الحجم لهذه الصورة.

الشكل 4. بيتا غالاكتوزيداز فحص المرشحين استنساخ إيجابية. ونقلت والحيوانات المستنسخة ، الإيجابية التي تم الحصول عليها من المكتبة لوحة الشاشة YPD والمحتضنة في 30 درجة مئوية خلال الليل ؛ باء ، تم نقل جميع المستعمرات على لوحة YPD لأغشية النيتروسليلوز ، وأجرى بيتا غالاكتوزيداز مقايسة.
Access restricted. Please log in or start a trial to view this content.
Discussion
وقد ثبت الخميرة ثنائي هجين الفرز لتكون أداة فعالة في تحديد التفاعل البروتين 16 و 17. بالمقارنة مع الطرق الأخرى لتحديد البروتين الملزمة الشركاء ، مثل رقائق شارك في تنقية البروتين والبيوكيميائية ، والخميرة ثنائي النظام الهجين هو نهج الحساسة الجينية التي يمكن استخ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وقد تم تمويل هذا العمل عن طريق منح البحوث K01AR053210 المعاهد الوطنية للصحة ، R01AR061484 ومنحة من مؤسسة الصدفية الوطنية.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| اسم الكاشف | شركة | فهرس العدد | |
| بروكويست نظام هجين اثنين | Invitrogen | 10835 | |
| YPD نمو متوسطة | Clontech | 630409 | |
| YPD آجار متوسطة | Clontech | 630410 | |
| الحد الأدنى من قاعدة SD آغار | Clontech | 630412 | |
| اللو - DO الملحق | Clontech | 630414 | |
| -Leu/-Trp DO الملحق | Clontech | 630417 | |
| -His/-Leu/-Trp/-Ura DO الملحق | Clontech | 630425 | |
| 3 - 1 - الأمينية ،2،4 - Triazole (3AT) | سيغما الدريخ | A8056 | |
| مرق لوريا (LB) | سيغما الدريخ | L3022 | |
| X - غال | Invitrogen | 15520-034 | |
| Sonicated الحمض النووي الحيوانات المنوية سالمون | Stratagene | 201190 | |
| أمبيسيلين | AMRESCO | 0339 | |
| الكاناميسين سلفات | Invitrogen | 11815-024 | |
| الكفاءة Subcloning ™ ™ DH5α خلايا المختصة | Invitrogen | 18265-017 | |
| Trizma ® قاعدة | سيغما الدريخ | T6066 | |
| خلات الليثيوم | سيغما الدريخ | L4158 | |
| Ethylenediaminetetraacetic حمض | سيغما الدريخ | ED | |
| النيتروسليلوز الغشائية | بيو راد | 162-0115 | |
| 10 سم ، وطبق بتري | ITI العلمية | CT - 903 | |
| حاضنة (30 درجة مئوية) | ATR (Ecotron) |
References
- He, Z. Progranulin is a mediator of the wound response. Nat. Med. 9, 225-229 (2003).
- Kessenbrock, K. Proteinase 3 and neutrophil elastase enhance inflammation in mice by inactivating antiinflammatory progranulin. J. Clin. Invest. 118, 2438-2447 (2008).
- Zhu, J. Conversion of proepithelin to epithelins: roles of SLPI and elastase in host defense and wound repair. Cell. 111, 867-878 (2002).
- Yin, F. Exaggerated inflammation, impaired host defense, and neuropathology in progranulin-deficient mice. J. Exp. Med. 207, 117-128 (2010).
- Van Damme, P. Progranulin functions as a neurotrophic factor to regulate neurite outgrowth and enhance neuronal survival. J. Cell. Biol. 181, 37-41 (2008).
- Baker, M. Mutations in progranulin cause tau-negative frontotemporal dementia linked to chromosome 17. Nature. 442, 916-919 (2006).
- Cruts, M. Null mutations in progranulin cause ubiquitin-positive frontotemporal dementia linked to chromosome 17q21. Nature. 442, 920-924 (2006).
- Guo, F. Granulin-epithelin precursor binds directly to ADAMTS-7 and ADAMTS-12 and inhibits their degradation of cartilage oligomeric matrix protein. Arthritis Rheum. 62, 2023-2036 (2010).
- Feng, J. Q. Granulin epithelin precursor: a bone morphogenic protein 2-inducible growth factor that activates Erk1/2 signaling and JunB transcription factor in chondrogenesis. FASEB. J. 24, 1879-1892 (2010).
- Xu, K. Cartilage oligomeric matrix protein associates with granulin-epithelin precursor (GEP) and potentiates GEP-stimulated chondrocyte proliferation. J. Biol. Chem. 282, 11347-11355 (2007).
- Liu, C. J. The role of ADAMTS-7 and ADAMTS-12 in the pathogenesis of arthritis. Nat. Clin. Pract. Rheumatol. 5, 38-45 (2009).
- Liu, C., Dib-Hajj, S. D., Waxman, S. G. Waxman, S.G. Fibroblast growth factor homologous factor 1B binds to the C terminus of the tetrodotoxin-resistant sodium channel rNav1.9a (NaN). J. Biol. Chem. 276, 18925-18933 (2001).
- Liu, C. J. ADAMTS-7: a metalloproteinase that directly binds to and degrades cartilage oligomeric matrix protein. FASEB. J. 20, 988-990 (2006).
- Tang, W. The Growth Factor Progranulin Binds to TNF Receptors and Is Therapeutic Against Inflammatory Arthritis in Mice. Science. 332, 478-484 (2011).
- Wu, H., Siegel, R. M. Progranulin Resolves Inflammation. Science. 332, 427-428 (2011).
- Hollenberg, S. M. Identification of a new family of tissue-specific basic helix-loop-helix proteins with a two-hybrid system. Mol. Cell. Biol. 15, 3813-3822 (1995).
- Vojtek, A. B., Hollenberg, S. M., Cooper, J. A. Mammalian Ras interacts directly with the serine/threonine kinase Raf. Cell. 74, 205-214 (1993).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved