このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
成長因子Progranulinと相互作用するタンパク質を識別するように変更酵母ツーハイブリッドシステム
要約
我々は、従来の酵母ツーハイブリッドスクリーニング、タンパク質相互作用の同定に効果的な遺伝的なツールを変更しました。この変更は著しく、プロセスを短縮する作業負荷を軽減、そして最も重要なのは、偽陽性の数を減らします。さらに、このアプローチは、再現性と信頼性です。
要約
またgranulin epithelin前駆体(GEP)として知られているProgranulin(PGRN)は、、593アミノ酸のオートクリン増殖因子です。 PGRNは、初期胚発生、創傷治癒1、炎症2、3、および宿主防御4を含む生理と病気のプロセス、さまざまな重要な役割を果たすことが知られている。神経栄養因子5、PGRNタンパク質の原因と前頭側頭型認知症6、7の部分的な損失をもたらすPGRN遺伝子の変異としてPGRNも機能します。私たちの最近の研究では、軟骨の開発と劣化8月11日の重要な調節因子としてPGRNの分離につながっている。 PGRNは、ほぼ二十年前に発見されたものの、、複数の生理学的および病理学的条件にPGRNのアクションを活用し、関与するメカニズムを理解する努力を大幅に結合受容体(複数可)を識別するために、私たちの無力によって妨げられているが決定的な役割を果たしている。この問題に対処するために、我々は修正を開発fied酵母ツーハイブリッド(MY2H)が最も一般的に使用されるGAL4ベースの2 - ハイブリッドシステムに基づくアプローチ。従来の酵母ツーハイブリッドスクリーンと比較して、MY2Hは劇的に画面のプロセスを短縮し、偽陽性クローンの数を減らすことができます。さらに、このアプローチは、再現性と信頼性であり、そして我々が正常にイオンチャネル12、細胞外マトリックスタンパク質10、13、および成長因子14を含む様々なベイトの結合タンパク質を、単離することにこのシステムを採用している。本稿では、最初に知られてPGRN関連受容体14,15としてTNFR2の同定につながった例として、PGRNを用いて詳細にこのMY2H実験手順を説明します。
プロトコル
1。背景情報
酵母ツーハイブリッドシステムは、タンパク質-タンパク質相互作用16、17を発見するのに使用される強力な遺伝学的手法です。などのLexA -ベースのシステム、SOSの募集システム、および細菌または哺乳類細胞ベースの2 - ハイブリッドとして2 - ハイブリッドシステム、、いくつかの種類が市販されている、この論文では特に、最も一般的に使用されるGAL4ベースの変更に焦点を当てて酵母2 - ハイブリッドシステム。簡単に言えば、法はDNA結合および転写活性化に関与する分離可能なドメインから構成される酵母のGAL4タンパク質の性質に基づいています。獲物のタンパク質がGAL4活性化ドメイン(AD)への融合体として発現している間、baitタンパク質は、GAL4 DNA結合ドメイン(DNA - BD)の融合として表現されます。餌と獲物の融合タンパク質間の相互作用は、酵母のGに統合されているレポーター遺伝子を含むGAL4結合部位の転写アクティベーションにつながるenome。 Y2Hの原理を図に示します。 1と実験手順を図にまとめられている。 2。
2。必要な材料とソリューション
- YPD培地(ペプトンのブレンド、酵母エキス、およびほとんどのサッカロマイセスセレビシエ菌を成長させるための最適な割合でブドウ糖)。
- 最小限の合成定義(SD)塩基は酵母窒素塩基、硫酸アンモニウム、及び炭素源を含む最小のSDベース(、デキストロース。ドロップアウト(DO)サプリメントは、指定を欠く合成、定義された培地を作るためのMinimal SD Baseに追加することができます。栄養素)。
- レイ/ - Trpをドロップアウト(DO)サプリメント(ロイシンおよびトリプトファンを除く全ての必須アミノ酸を含む)
- -His/-Leu/-Trp/-Uraドロップアウト(DO)サプリメント(ロイシン、トリプトファン、ヒスチジン、およびウラシルを除くすべての必須アミノ酸を含む)
- ルリア培地(LB)(トリプトン10g / L、酵母エキス5g / L、塩化ナトリウムを5g / L)
- X- ギャル(5 - ブロモ-4 - クロロ-3 - インドリル-β- D -ガラクトピラノシド)ソリューション:Nで20 mg / mlのストック溶液として調製し、N -ジメチルホルムアミド
- 10X TE(100mMトリス- HCl(pH 7.5)を、10mMのEDTA、オートクレーブ処理したもの)
- 超音波処理したニシンやサケ精子DNA、ゆで(10 mg / ml)を
- 10X LiAc(1 M酢酸リチウム、オートクレーブ処理したもの)
- 50%PEG - 3350ソリューション、フィルター滅菌
- 3 - アミノ-1、2、4 - トリアゾール(3AT)
- カナマイシン
- アンピシリン
- ELECTROMAXDH5α細胞
- Zバッファ:16.1グラムNa2HPO4 7H2O(または8.52グラム無水)、H2O 5.5グラムリン酸二水素ナトリウム(または4.8 ganhydrous)、0.75グラムのKCl、0.246グラム硫酸マグネシウム7H2O(または0.12グラム無水)、1リットルのオートクレーブ、蒸留水に溶解して調整pH 7.0の。
3。餌の世代(pDBLeu - PGRN)
シグナルペプチド(aa21 - 588)を欠いているcDNA断片のエンコーディングPGRNは、方向的に、pDBLeuベクトルのSalI -をNot I部位(ProQuestのツーハイブリッドシステム、Invitrogen)にクローニングしたpDBLeu - PGRNを生成するためのGAL4 DNA結合ドメインと同様の翻訳読み枠を保持。
- インフレーム融合を可能にする制限部位を(3'末端サル5'末端にIおよびNot I)を含むように設計されたオリゴヌクレオチドプライマーを用いたPCRにより、上記のPGRNのcDNA断片を増幅する。
- ゲルPCR産物を精製し、制限付きダイジェストはSalIとはI.エンドヌクレアーゼ
同一の制限エンドヌクレアーゼによる二重制限消化によりDBベクトルpDBLeuを準備します。 - 線形化pDBLeuベクターに制限PGRN断片をライゲーションし、25μg/ mlのLB +カナマイシンのための選択とDH5αに変身。
- DNAシークエンシングでは構成要素の修正を確認してください。
4。プラスミド餌の小スケール変換
- Mav203(Invitrogen社)のコロニーをYPDの5 mlを接種し、30℃一晩振とう℃を
- YPD 50mlに一晩培養を希釈する。アドインを拡大itional 2〜4時間。
- 室温で5分間3000rpmでペレットは、細胞。オートクレーブ、蒸留水40mlにペレットを再懸濁する。
- 再ペレット細胞。私は、RTで10分間でインキュベート溶液2mlに再懸濁します。
溶液I:0.5ミリリットル10xLiAc、0.5ミリリットル10xTE、4ミリリットルH 2 O - pDBLeu - PGRNの2-3μL(0.25μg/μl)と変性剪断サケ精子DNA(10μg/μl)10μlの:チューブにDNAを分注する。 100μlの酵母細胞を追加して、よく混ぜる。
- 700μl溶液IIを追加、よく混ぜる。 30℃で30分間インキュベートします。 II液:0.2ミリリットル10xLiAc、0.2ミリリットル10xTE、1.6ミリリットル50パーセントPEG3350。
- 42℃のヒートショック℃で15分間。
- 2分間ペレット。上清を捨てる。 200μlのオートクレーブ、蒸留水でペレットを再懸濁する。
- 段階希釈によるSD - Leuのプレート上にサスペンションプレート。 2〜3日、30℃でインキュベートする。
5。餌の検証
いやを行う前に自己活性化し、HIS3レポーター遺伝子の基底発現レベルを決定するためのSTツーハイブリッドスクリーニング、テストpDBLeu - PGRN。このテストでは、餌が転写を活性化するかどうかと自己活性化は阻害剤によって中和することができるかどうかを決定します。 3 -アミノ-1、2、4 -トリアゾール(3 - AT)は、HIS3 -遺伝子産物の競合阻害剤であり、ヒスチジン欠乏培地での増殖に必要なHIS3の発現の最小レベルを滴定するために使用することができます。
- 酵母Mav203ひずみ、プレートSD - Leuのプレートに変換にpDBLeu - PGRNを変換し、そして30℃で48〜72時間インキュベート℃に
- にオートクレーブつまようじを使用して、各形質転換からのパッチのコロニーSD - LEU -彼の10mMの濃度で3 - ATを含むプレート、25mMの、50mMの、75mMの、及び100mM。 - AT 3は3 - ATの存在下で増殖できるようになるHIS3酵素と自己活性化を示す唯一の餌の競合的阻害剤です。
- プレートcontainiに成長する餌株NGの100mM 3 - ATは、ツーハイブリッドスクリーンでの使用には適していません。使用できる餌のために、最低3 - AT濃度の細胞増殖を阻害します。多くの場合、3 - ATの25mMのスクリーニングに使用されます。
6。 cDNAライブラリーのスクリーニング
プラスミドpDBLeu - PGRNは、上述したように小規模の変換を使用してMaV203に導入される。 MaV203(pDBLeu - PGRN)にpPC86 -ライブラリ(Invitrogen)を導入するため、手順は以下のとおり、通常、プラスミドライブラリーDNAの0.5μgで〜4 × 10 4コロニーが得られます。したがって、2.5 × 10 6の酵母形質転換体は、〜30.0μgのpPC86 - cDNAライブラリープラスミドDNA、25の変換、五十10cmのプレート(SD - Leuの- TRP -彼の浦3 AT)が必要になります。
- プレート(下の手順のための50)に10cmのSD - Leuの- TRP -彼の浦3の適切な数を準備します。また、形質転換体の数を推定するために少なくとも4つの10cmのSD - LEU - Trpプレートを準備。
- ライブラリへの変換下記の手順に従ってpDBLeu - PGRNを含むMaV203。
- 〜100μlのオートクレーブ、蒸留水でMaV203のいくつかの単離されたコロニー(pDBLeu - PGRNを)中断して、10cmのSD - Leuのプレートの上にそれらを広げ。第二SD - Leuの板のための手順を繰り返します。 30℃で18〜24時間の両方のプレートをインキュベート℃に
- 削ると完全に10ミリリットルオートクレーブ、蒸留水で細胞を懸濁する。 〜0.1のOD 600を与えるためにフラスコ内の液体YPD培地500mlに細胞懸濁液の十分なボリュームを追加します。
- ODは、接種後〜0.1であることを確認してください。
- OD 600が約0.4に達するまで30℃で振とうする。
- 新鮮な準備:
- 11ミリリットル10X TE、11ミリリットル10X LiAc、および88ミリリットルオートクレーブ水を組み合わせることにより、110ミリリットル1 × TE / LiAc。
- 1.6ミリリットル10X TE、1.6ミリリットル10X LiAc、および12.8ミリリットルの50%PEG - 3350を組み合わせることで、16ミリリットルPEG / LiAc。
- 室温で5分間、3000グラムで、細胞を回収します。
- tを捨てる彼は清と穏やかに、室温で100ミリリットルオートクレーブ、蒸留水でピペッティングでペレットを再懸濁します。
- 室温で5分間3000gで遠心する。
- 遠心分離細胞の上清を捨て、50 mlの1X TE / LiAc溶液中で細胞ペレットを再懸濁します。
- 室温で5分間3000gで遠心する。
- 上清を取り除くと2.5 mlの1X TE / LiAc溶液の最終体積でペレットを再懸濁します。
- 25の変換を実行します。 2.5ミリリットルの細胞、125μlの(10μg/μl)変性剪断サケ精子DNA、および30μgのcDNAライブラリーを組み合わせる。ピペッティングにより穏やかに混合。 15ミリリットルPEG / LiAcソリューションを加え、穏やかに混ぜる。 700μlを各25オートクレーブした1.5 mlのマイクロ遠心チューブに分注し。
- 30 ° Cの水浴中で30分間インキュベート。
- 42℃の水浴中で15分間熱ショック。
- 室温で1分間6,000 × gで遠心する。慎重にスーパーを削除する上清。優しく上下にピペッティングすること400μlのオートクレーブ、蒸留水でそれぞれのペレットを再懸濁します。
- プレートシングル10cmのSD - Leuの- TRP -彼の浦3 AT(3AT濃度:25mM)を上に各形質転換から200μlの形質転換混合物スプレッドのバーを使用してプレートには、その25は、1.5 mlのマイクロ遠心チューブに50プレートを作ることができるオートクレーブ(SD - Leuの- TRP -彼の浦+3 AT)。
- 30℃で5-10日間培養する℃を
- 反応の形質転換効率を推定するために、一つの反応(1:40、1:400と1:4000)の連続希釈液をSD - Leuの- TRPプレート上にプレーされています。 30℃で3日間Cインキュベートした後、コロニー数を計数し、形質転換体の総数が計算されます。
7。 X - galアッセイ
- YPDプレートにコロニーを移し、30℃で一晩。
- 場所は、YPDプレート上にニトロセルロース膜を丸め、膜とYPDプレートの間に気泡がないことを確認してください。 1〜2分、MA後のKEは、必ずすべてのコロニーは、膜(ニトロセルロース紙)に転送されます。
- アルミ箔の紙で作られたボートで膜のコロニー側を上に置きます。
- 液体窒素中にメンブレンを入れ、数分のために液体窒素中に20秒、と水没を待つ。
- 雪解けに膜を取り出して。
- 一方、以下の試薬を混ぜる。
1.5ミリリットルZバッファ
20μlのX - galを(20 mg / ml)を - その上に場所ワットマン濾紙、ペトリ皿の中でZバッファー/ X - galを削除します。
- ワットマン濾紙の上にニトロセルロース紙を慎重に置きます。
- 青色のコロニーが現れるまで37℃でインキュベートする。
8。再変換アッセイ
ライブラリーのスクリーニングから単離された獲物の融合タンパク質(AD - Y)は、酵母に餌の融合タンパク質との相互作用(DB - X)レポートの遺伝子を誘導するために、そして獲物のクローンと餌の構造の再変換を維持する必要がありますさらに偽陽性を排除し、追加を容易にすることができますitional分析。
- 潜在的に相互作用するタンパク質を含む酵母菌株からプラスミドDNAを単離する。
- 大腸菌にDNAを変換DH5α細胞を、プレートLB 100μg/ mlのアンピシリンプレート上での変換が選択的にpPC86 - cDNAライブラリーを分離し、37℃で一晩インキュベートする℃まで
- LB 100μg/ mlのアンピシリンをスープに入れてプレートからいくつかのコロニーを選択してください。
- ミニプレップDNAを準備およびSal IおよびNot Iで二重制限分析により確認し
- 共同変換、MaV203に獲物がプラスミドと餌プラスミドプレートSC - LEU - Trpプレート上で形質転換混合物、および30℃で2-3日インキュベート℃に
- SC - Leuの- TRPプレートから3つの異なるコロニーを選択、X - galアッセイを行います。
9。シーケンシングとバイオインフォマティクス解析
シーケンス可能性が真の陽性クローンから単離されたプラスミドDNAは、BLAを使用してGenBankのものにこれらのシーケンスを比較するSTプログラム、および既知の遺伝子に対応するこれら二つのハイブリッドクローンを識別する。配列データは、上記で得られた12陽性の二つが細胞表面TNFR2(;アク#NM_130426 TNFRSF1B/CD120b)であることを示した。さらに、PGRNとTNFRとの間の相互作用は、インビトロ固相結合アッセイ、共免疫沈降法、表面プラズモン共鳴分析、およびフローサイトメトリーアッセイ14を含む様々なタンパク質-タンパク質相互作用アッセイを、使用して検証した。
10。代表的な結果
スクリーニングのフローチャートを図で説明されています。 3。通常は50から100までの正のクローンの候補者は、この段階で得られます。我々は、最初にPGRN餌でスクリーニング250万形質転換体のうち54陽性クローンの候補を単離した。陽性クローンの候補は、X - galアッセイを行うことにより検証した。通常は、約50%の偽陽性クローンは、X - galアッセイを介して削除されます。私たちは、率直な23の陽性クローンを得 PGRNの餌( 図4)のためのこのステップでATES。獲物のクローンと酵母に餌の構造の再変換は、さらに、まだレポーター遺伝子は、おそらく真の陽性を表すアクティブに偽陽性とクローンを排除する。通常は、約50%の陽性クローンの候補が削除されます。我々は最終的に酵母におけるPGRNと相互作用する12個の陽性クローンを単離した。
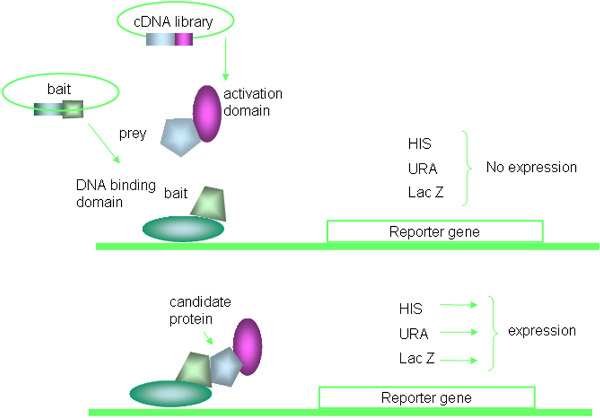
図酵母ツーハイブリッドシステム1。原理

図2酵母ツーハイブリッドシステムを用いたタンパク質結合パートナーを同定するのパイプライン

スクリーニング酵母ツーハイブリッドライブラリの図3。フローチャート。rge.jpg"ターゲット="_blank">この画像のフルサイズバージョンを表示するにはここをクリックしてください。

陽性クローンの候補の図4。β-ガラクトシダーゼアッセイ。ライブラリ画面から得られる、陽性クローンをYPDプレートに移し、30℃で一晩インキュベートした; Bは、YPDプレート上のすべてのコロニーをニトロセルロース膜に転写し、β-ガラクトシダーゼアッセイは、実施した。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
酵母ツーハイブリッドスクリーニングは、タンパク質の相互作用16、17を同定する際に有効なツールであることが証明されている。このような生化学的共精製とプロテインチップなどの蛋白質 - 結合パートナーを同定するための他のアプローチと比較して、酵母ツーハイブリッドシステムは、比較的単純な実験でコード配列の非常に高い数字をスクリーニングに用いることが?...
Access restricted. Please log in or start a trial to view this content.
開示事項
利害の衝突は宣言されません。
謝辞
この作品は、NIHの研究助成K01AR053210、R01AR061484と国立乾癬財団からの助成金によって賄われていた。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | |
| ProQuestのツーハイブリッドシステム | インビトロジェン | 10835 | |
| YPD培養液 | クロンテック | 630409 | |
| YPD寒天培地 | クロンテック | 630410 | |
| 最小限のSD寒天ベース | クロンテック | 630412 | |
| - Leuのは、サプリメントのDO | クロンテック | 630414 | |
| -Leu/-Trp DOの補足 | クロンテック | 630417 | |
| -His/-Leu/-Trp/-Ura DOの補足 | クロンテック | 630425 | |
| 3 - アミノ-1,2,4 - トリアゾール(3AT) | シグマアルドリッチ | A8056 | |
| ルリア培地(LB) | シグマアルドリッチ | L3022 | |
| X - Galを | インビトロジェン | 15520-034 | |
| 超音波処理サケ精子DNA | ストラタジーン | 201190 | |
| アンピシリン | AMRESCO | 0339 | |
| 硫酸カナマイシン | インビトロジェン | 11815-024 | |
| サブクローニングの効率™DH5α™コンピテントセル | インビトロジェン | 18265-017 | |
| Trizma ®ベース | シグマアルドリッチ | T6066 | |
| リチウム酢酸 | シグマアルドリッチ | L4158 | |
| エチレンジアミン四酢酸 | シグマアルドリッチ | ED | |
| ニトロセルロース膜 | Bio - Rad社 | 162-0115 | |
| 10cmのペトリ皿 | ITIサイエンティフィック | CT - 903 | |
| インキュベーター(30℃) | ATR(Ecotron) |
参考文献
- He, Z. Progranulin is a mediator of the wound response. Nat. Med. 9, 225-229 (2003).
- Kessenbrock, K. Proteinase 3 and neutrophil elastase enhance inflammation in mice by inactivating antiinflammatory progranulin. J. Clin. Invest. 118, 2438-2447 (2008).
- Zhu, J. Conversion of proepithelin to epithelins: roles of SLPI and elastase in host defense and wound repair. Cell. 111, 867-878 (2002).
- Yin, F. Exaggerated inflammation, impaired host defense, and neuropathology in progranulin-deficient mice. J. Exp. Med. 207, 117-128 (2010).
- Van Damme, P. Progranulin functions as a neurotrophic factor to regulate neurite outgrowth and enhance neuronal survival. J. Cell. Biol. 181, 37-41 (2008).
- Baker, M. Mutations in progranulin cause tau-negative frontotemporal dementia linked to chromosome 17. Nature. 442, 916-919 (2006).
- Cruts, M. Null mutations in progranulin cause ubiquitin-positive frontotemporal dementia linked to chromosome 17q21. Nature. 442, 920-924 (2006).
- Guo, F. Granulin-epithelin precursor binds directly to ADAMTS-7 and ADAMTS-12 and inhibits their degradation of cartilage oligomeric matrix protein. Arthritis Rheum. 62, 2023-2036 (2010).
- Feng, J. Q. Granulin epithelin precursor: a bone morphogenic protein 2-inducible growth factor that activates Erk1/2 signaling and JunB transcription factor in chondrogenesis. FASEB. J. 24, 1879-1892 (2010).
- Xu, K. Cartilage oligomeric matrix protein associates with granulin-epithelin precursor (GEP) and potentiates GEP-stimulated chondrocyte proliferation. J. Biol. Chem. 282, 11347-11355 (2007).
- Liu, C. J. The role of ADAMTS-7 and ADAMTS-12 in the pathogenesis of arthritis. Nat. Clin. Pract. Rheumatol. 5, 38-45 (2009).
- Liu, C., Dib-Hajj, S. D., Waxman, S. G. Waxman, S.G. Fibroblast growth factor homologous factor 1B binds to the C terminus of the tetrodotoxin-resistant sodium channel rNav1.9a (NaN). J. Biol. Chem. 276, 18925-18933 (2001).
- Liu, C. J. ADAMTS-7: a metalloproteinase that directly binds to and degrades cartilage oligomeric matrix protein. FASEB. J. 20, 988-990 (2006).
- Tang, W. The Growth Factor Progranulin Binds to TNF Receptors and Is Therapeutic Against Inflammatory Arthritis in Mice. Science. 332, 478-484 (2011).
- Wu, H., Siegel, R. M. Progranulin Resolves Inflammation. Science. 332, 427-428 (2011).
- Hollenberg, S. M. Identification of a new family of tissue-specific basic helix-loop-helix proteins with a two-hybrid system. Mol. Cell. Biol. 15, 3813-3822 (1995).
- Vojtek, A. B., Hollenberg, S. M., Cooper, J. A. Mammalian Ras interacts directly with the serine/threonine kinase Raf. Cell. 74, 205-214 (1993).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved