A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
عزل الخلايا الدبقية الصغيرة الابتدائية المختلطة من زراعات الخلايا الغروية من المواليد الجدد الجرذ أنسجة المخ
In This Article
Summary
عزل الخلايا الدبقية الصغيرة الأولية من عدم التجانس الخلوية من الدماغ ضروري للتحقيق في دورها في كل الظروف الفسيولوجية والمرضية. هذا البروتوكول يصف العزلة الميكانيكية والمختلطة تقنية زراعة الخلايا التي توفر عائدات عالية ونقاء عالية، وقابلة للحياة خلايا دبقية صغيرة الرئيسي لل في المختبر الدراسة والتطبيقات المصب.
Abstract
Microglia account for approximately 12% of the total cellular population in the mammalian brain. While neurons and astrocytes are considered the major cell types of the nervous system, microglia play a significant role in normal brain physiology by monitoring tissue for debris and pathogens and maintaining homeostasis in the parenchyma via phagocytic activity 1,2. Microglia are activated during a number of injury and disease conditions, including neurodegenerative disease, traumatic brain injury, and nervous system infection 3. Under these activating conditions, microglia increase their phagocytic activity, undergo morpohological and proliferative change, and actively secrete reactive oxygen and nitrogen species, pro-inflammatory chemokines and cytokines, often activating a paracrine or autocrine loop 4-6. As these microglial responses contribute to disease pathogenesis in neurological conditions, research focused on microglia is warranted.
Due to the cellular heterogeneity of the brain, it is technically difficult to obtain sufficient microglial sample material with high purity during in vivo experiments. Current research on the neuroprotective and neurotoxic functions of microglia require a routine technical method to consistently generate pure and healthy microglia with sufficient yield for study. We present, in text and video, a protocol to isolate pure primary microglia from mixed glia cultures for a variety of downstream applications. Briefly, this technique utilizes dissociated brain tissue from neonatal rat pups to produce mixed glial cell cultures. After the mixed glial cultures reach confluency, primary microglia are mechanically isolated from the culture by a brief duration of shaking. The microglia are then plated at high purity for experimental study.
The principle and protocol of this methodology have been described in the literature 7,8. Additionally, alternate methodologies to isolate primary microglia are well described 9-12. Homogenized brain tissue may be separated by density gradient centrifugation to yield primary microglia 12. However, the centrifugation is of moderate length (45 min) and may cause cellular damage and activation, as well as, cause enriched microglia and other cellular populations. Another protocol has been utilized to isolate primary microglia in a variety of organisms by prolonged (16 hr) shaking while in culture 9-11. After shaking, the media supernatant is centrifuged to isolate microglia. This longer two-step isolation method may also perturb microglial function and activation. We chiefly utilize the following microglia isolation protocol in our laboratory for a number of reasons: (1) primary microglia simulate in vivo biology more faithfully than immortalized rodent microglia cell lines, (2) nominal mechanical disruption minimizes potential cellular dysfunction or activation, and (3) sufficient yield can be obtained without passage of the mixed glial cell cultures.
It is important to note that this protocol uses brain tissue from neonatal rat pups to isolate microglia and that using older rats to isolate microglia can significantly impact the yield, activation status, and functional properties of isolated microglia. There is evidence that aging is linked with microglia dysfunction, increased neuroinflammation and neurodegenerative pathologies, so previous studies have used ex vivo adult microglia to better understand the role of microglia in neurodegenerative diseases where aging is important parameter. However, ex vivo microglia cannot be kept in culture for prolonged periods of time. Therefore, while this protocol extends the life of primary microglia in culture, it should be noted that the microglia behave differently from adult microglia and in vitro studies should be carefully considered when translated to an in vivo setting.
Protocol
1. تشريح من المواليد الجدد الجرذ أنسجة المخ
- البرد ليبوفيتز لL-15 وسائل الإعلام مكيفة (ليبوفيتز L-15 + 0.1٪ BSA + 1٪ القلم / بكتيريا) إلى 4 درجة مئوية. وسائل الإعلام ثقافة الدافئة (DMEM + 10٪ + 1٪ FBS البنسلين / الستربتومايسين عقار) إلى 37 درجة مئوية. إعداد 4 60x15 ملم أطباق بتري مع مل 4-5 من وسائل الإعلام L-15 مكيفة على الجليد. تعقيم جميع الأدوات الجراحية مع الإيثانول بنسبة 100٪.
- شطف P2 الجراء الراب الوليد مع الايثانول 70٪. (ويمكن استخدام الفئران الوليدة حديثي الولادة الذين تتراوح أعمارهم بين P1-P5 في هذا البروتوكول.)
- قطع رأس بسرعة فأر الجرو مع مقص حاد عقيم وإسقاط رئيس فورا إلى إيثانول 70٪. تكرار لما مجموعه الفئران الوليدة 5 ثم نقل إلى رؤساء محلول ملحي.
- إزالة دماغ كامل من رؤساء ومكان في طبق بيتري مع 4-5 مل L-15 حل (ليبوفيتز L-15 + 0.1٪ BSA + 1٪ القلم / بكتيريا) على الجليد.
- كرر الإجراءات 1،2-1،4 لالجراء المتبقية في القمامة.
- إزالة السحايا من الدماغ ونقل قصرired أنسجة المخ (أي القشرة، المخيخ والمخ كله، وما إلى ذلك) في طبق بيتري جديد مع مل 4-5 من حل-15 L (ليبوفيتز L-15 + 0.1٪ BSA + 1٪ القلم / بكتيريا) على الجليد.
2. إعداد المختلطة السكان الخلايا الغروية
- بدون نسيج الدماغ مع مقص أو شفرة 1، نقل الأنسجة مع ماصة 10 مل إلى 50 مل أنبوب معقم مخروطي.
- منبذة المخروطية في 2500 إطار التعاون الإقليمي لمدة 5 دقائق في 4 درجات مئوية.
- نضح طاف. إضافة مل 4-5 من وسائل الإعلام L-15 الطازجة (ليبوفيتز L-15 + 0.1٪ + 1٪ BSA القلم / بكتيريا).
- ماصة النسيج صعودا ونزولا 10 مرات مع ماصة معقمة 10 مل.
- وضع مصفاة الخلية (مسام ميكرون 100) على أنبوب جديد 50 مل مخروطي. ماصة النسيج صعودا وهبوطا مرة واحدة مع ماصة معقمة و 5 مل مع ماصة مطاردة لمصفاة الخلية، والاستغناء عن المواد من خلال مصفاة الخلية في أنبوب مخروطي الشكل.
- شطف مصفاة مع خلية 4-5 مل من وسائل الإعلام L-15 الطازجة (ليبوفيتز L-15 + BS 0.1٪قلم + 1٪ / بكتيريا).
- منبذة مخروطي مع خلايا توتر في 2500 إطار التعاون الإقليمي لمدة 5 دقائق في 4 درجات مئوية.
3. طلاء وصيانة مختلط زراعات الخلايا الغروية
- لكل دماغ الفئران الجرو معالجتها، وإعداد 1 T-75 قارورة معقمة وذلك بإضافة 12 مل من وسائل الإعلام ثقافة (DMEM + 10٪ + 1٪ FBS البنسلين / الستربتومايسين عقار) في كل قارورة.
- نضح طاف من الخلايا مكعبات وإضافة 5-6 مل من وسائل الإعلام ثقافة لبيليه الخلية. ماصة صعودا ونزولا 10 مرات مع ماصة 10 مل.
- نقل حجم مساو من التعليق على كل قارورة خلية T-75.
- احتضان القوارير في حاضنة ثاني أكسيد الكربون 2 5٪ عند 37 درجة مئوية ليصبح المجموع 1-3 أسابيع.
- وينبغي أن قوارير حضنت 1 لمدة 5 أيام، و في اليوم الخامس، تحل محل وسائل الإعلام في ثقافة كل قارورة مع 12 مل من وسائل الإعلام الجديدة والعودة إلى الحاضنة. ثم، كل 3 أيام، تحل محل وسائل الإعلام مكيفة في كل قارورة مع 12 مل من وسائل الإعلام الجديدة لتحقيق التقاء. يجب أن يكون هذا فعلشمال شرق بعناية فائقة دون لمس الجزء السفلي من القوارير حيث الخلايا تعلق.
4. العزلة والتصفيحات من الخلايا الدبقية الصغيرة الابتدائية
- بعد الثقافات الدبقية المختلطة هي متكدسة تماما، وإزالة قوارير من الحاضنة وتغطية مباراة دولية مع قارورة parafilm لمنع تبادل الغازات مع الهواء البيئية.
- هز قوارير في 100 RPS (معمل رفيق SI-600، Jeio تك) لمدة 1 ساعة على 37 درجة مئوية.
- جمع وسائل الاعلام من كل قوارير مع ماصة 10 مل دون تعطيل طبقة نجمية على سطح القارورة. وضع وسائل الإعلام في أنابيب مخروطية 50 مل. إضافة وسائط جديدة للقوارير ودوارق العودة إلى الحاضنة.
- منبذة أنابيب مخروطية الشكل في 2500 إطار التعاون الإقليمي لمدة 5 دقائق في 4 درجات مئوية.
- نضح طاف من جميع الأنابيب المخروطية. الكريات الخلية مرتفعة الخلايا الدبقية الصغيرة نقاء. Resuspend الكريات في 1 مل من الخلايا الدبقية الصغيرة الطلاء وسائل الاعلام (FES DMEM + 10٪ + 1٪ البنسلين / الستربتومايسين عقار).
- حساب كثافة خلية في وسائل الإعلام باستخدام معلق1 عدادة الكريات.
- إضافة حجم مناسب من وسائل الإعلام تصفيح الخلايا الدبقية الصغيرة لتحقيق 2 × 10e5 الخلايا في كثافة مل. لوحة بالشكل المناسب لتحليل تجريبي.
- تسمح الخلايا الدبقية الصغيرة لنعلق بين عشية وضحاها.
5. ممثل النتائج
وصف بروتوكول أعلى نتائج في الثقافات نقاء الخلايا الدبقية الصغيرة الأولية عالية. على النحو الذي يحدده المناعية لخلايا البلاعم علامة / الخلايا الدبقية الصغيرة الخاصة (Iba1)، مطلي الثقافات الخلايا الدبقية الصغيرة هي> نقي بنسبة 90٪ (الشكل 2). وبالإضافة إلى ذلك، وتلطيخ لعلامات خلية نجمية، oligodendrocyte والخلايا العصبية محدد يوضح الحد الأدنى من التلوث (الشكل 2). بعد تأسيس مختلط الثقافات الخلية الدبقية، يمكن عزل الخلايا الدبقية الصغيرة التي تهز تصل إلى 4 مرات متتالية. وعزل الخلايا الدبقية الصغيرة الأولية تعطي ما يقرب من 2.2 X 106 خلية / مل أو حوالي 9 ملايين الخلايا لكل 10 قوارير والعائد المتوقع يتناقص مع كل شاء المتعاقبةكه. وقد استخدمت الخلايا الدبقية الصغيرة المعزولة بواسطة هذه الطريقة بنجاح لتحقيق القدرة البلعمة، وظيفة مثل انتاج اكسيد النتريك، والسمية العصبية (الشكل 3) 13-14.
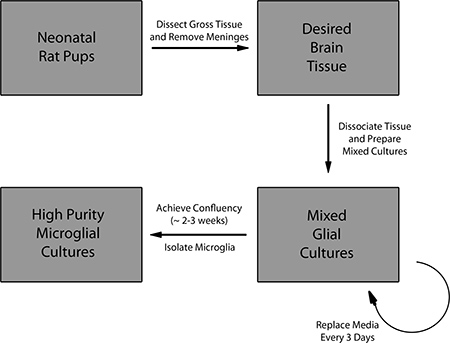
الشكل 1. نظرة عامة على بروتوكول لإعداد مختلط الثقافات الخلية الدبقية وعزل الخلايا الدبقية الصغيرة الأولية.
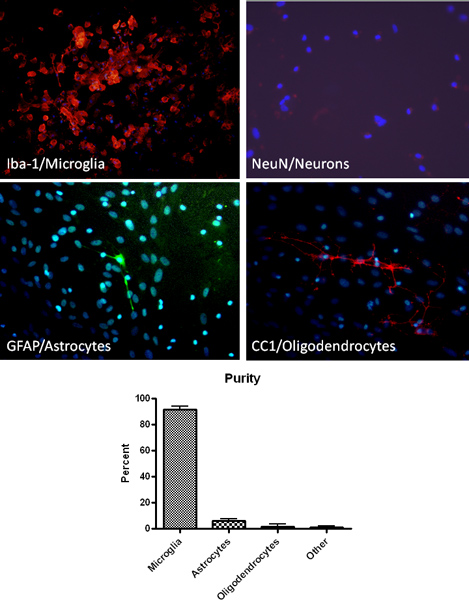
الشكل 2. عزل الخلايا الدبقية الصغيرة عالية النقاء النحو الذي تتحقق منه تحليل المناعى باستخدام الخلايا الدبقية الصغيرة (إيبا-1، الحمراء)، نجمية (GFAP والأخضر)، الخلايا العصبية (NeuN، أحمر) وoligodendrocyte (CC1، أحمر) بعلامات محددة. ويظهر أيضا لتلطيخ الحمض النووي للخلايا في ثقافة بواسطة دابي (الأزرق).
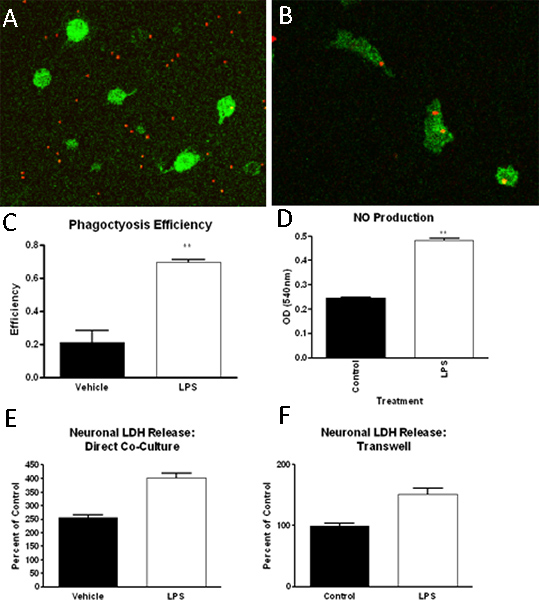
الشكل 3. عزل الخلايا الدبقية الصغيرة في طريقة descriوقد استخدمت سرير في عدد من الفحوص، بما في ذلك، ولكن ليس على سبيل الحصر، فحوصات البلعمة، المقايسات وظيفة والدراسات العصبية. في هذه الدراسات، وجدنا أن الخلايا الدبقية الصغيرة (إيبا-1 إيجابي، والأخضر)، عند تعرضها للسيطرة على (A) أو LPS (B) وسائل الاعلام المعالجة، وزيادة البلعمة بهم من الخرز اللاتكس fluorescently المسمى (الحمراء)، التي يمكن قياسها كميا ( C). كذلك، يمكن أن LPS (1ng/ml) علاج زيادة انتاج اكسيد النيتريك في الخلايا الدبقية الصغيرة (D). أخيرا، عبر كل من transwell إدخالها وفصل أو مباشرة الثقافات الخلايا الدبقية الصغيرة، الخلايا العصبية، فقد وجدنا أن الخلايا الدبقية الصغيرة حضنت مع LPS يمكن أن تحفز الخلايا العصبية موت الخلايا التي تقاس الديهيدروجينيز اللاكتات (LDH) اطلاق سراح (E، F).
Discussion
في حين يستخدم بصورة روتينية على هذا البروتوكول لإنتاج الخلايا الدبقية الصغيرة نقية وصحية للتجارب البحثية، وإمعان النظر في الجوانب الفنية خلال المراحل الحاسمة من الإجراء الحد من التقلبات في الخلايا الدبقية الصغيرة المعزولة. الأول، أثناء تشريح أنسجة الدماغ من الفئر...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
بتمويل من برنامج جماعية في جامعة الخدمات النظامية.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | تعليقات |
| 60 مم × 15 مم أطباق بتري | فيشر العلامة التجارية | 0875713A | |
| مقص حاد تشريح | أدوات العلم غرامة | 14094-11 | |
| دومون # 7B ملقط القياسية نصائح، منحنية، 11cm | أدوات العلم غرامة | 11270-20 | |
| دومون # 5 ملقط القياسية نصائح، على التوالي، 11 سم | أدوات العلم غرامة | 11251-10 | |
| 50 مل من أنابيب الطرد المركزي مخروطي | VWR | 89039-656 | |
| 5 الماصات مل المصلية | جرينير بيو واحد | 606180 | |
| 10 مل الماصات المصلية | جرينير بيو واحد | 607180 | |
| 100 ميكرون خلية النايلون معقم مصفاة | صقر | 35-2360 | |
| 75 سم 2 قوارير زراعة الأنسجة | كورنينج | 430641 | |
| Dulbecco والمتوسطة الأساسية الدنيا (DMEM) | Gibco (إينفيتروجن) | 31053-028 | |
| ليبوفيتز لL-15 متوسطة | Gibco (إينفيتروجن) | 11415064 | |
| مصل بقري جنيني | Gibco (إينفيتروجن) | 16000-036 | |
| الجنين فرسي المصل | الصياد | SH3007402 | |
| البنسلين الستربتوميسين | Gibco (إينفيتروجن) | 15140163 | |
| 100٪ الإيثانول | شركة وارنر جراهام | 64-17-5 | |
| مخزنة فوسفات حل، 10X المالحة، ودرجة الحموضة 7.4 | جودة البيولوجي، المؤتمر الوطني العراقي. | 119-069-131 | 1X في الماء، ومعقم مقطر |
| أكياس واقية | VWR | 14220-028 | |
| Haemocytometer | Hausser العلمية | 1492 | |
| 6 كذلك لوحات ثقافة الخلية مع سطح cellBIND | كورنينج | 3335 |
References
- Ransohoff, R. M., Perry, V. H. Microglial physiology: unique stimuli, specialized responses. Annu. Rev. Immunol. 27, 119-145 (2009).
- Raivich, G., Bohatschek, M., Kloss, C. U., Werner, A., Jones, L. L., Kreutzberg, G. W. Neuroglial activation repertoire in the injured brain: graded response, molecular mechanisms and cues to physiological function. Brain Res. Brain Res. Rev. 30, 77-105 (1999).
- Loane, D. J., Byrnes, K. R. Role of microglia in neurotrauma. Neurotherapeutics. 7, 245-265 (2010).
- Glass, C. K., Saijo, K., Winner, B., Marchetto, M. C., Gage, F. H. Mechanisms underlying inflammation in neurodegeneration. Cell. 140, 918-934 (2010).
- Pocock, J. M., Liddle, A. C. Microglial signalling cascades in neurodegenerative disease. Prog. Brain Res. 132, 555-565 (2001).
- Block, M. L., Hong, J. S. Chronic microglial activation and progressive dopaminergic neurotoxicity. Biochem. Soc. Trans. 35, 1127-1132 (2007).
- Barger, S. W., Basile, A. S. Activation of microglia by secreted amyloid percursor protein evokes release of glutamate by cystine exchange and attenuates synpatic function. J. Neurochem. 76, 846-854 (2001).
- Ni, M., Aschner, M. Neonatal rat primary microglia: isolation, culturing, and selected applications. Curr. Protoc. Toxicol. Chapter 12, Unit 12.17 (2010).
- Hassan, N. F., Rifat, S., Campbell, D. E., McCawley, L. J., Douglas, S. D. Isolation and flow cytometric characterization of newborn mouse brain-derived microglia maintained in vitro. J. Leukoc. Biol. 50, 86-92 (1991).
- Hassan, N. F., Prakash, K., Chehimi, J., McCawley, L. J., Douglas, S. D. Isolation and characterization of newborn rabbit brain-derived microglia. Clin. Immunol. Immunopathol. 59, 426-435 (1991).
- Hassan, N. F., Campbell, D. E., Rifat, S., Douglas, S. D. Isolation and characterization of human fetal brain-derived microglia in in vitro culture. Neuroscience. 41, 149-158 (1991).
- Frank, M. G., Wieseler-Frank, J. L., Watkins, L. R., Maier, S. F. Rapid isolation of highly enriched and quiescent microglia from adult rat hippocampus: immunophenotypic and functional characteristics. J. Neurosci. Methods. 151, 121-130 (2006).
- Byrnes, K. R., Stoica, B., Loane, D. J., Riccio, A., Davis, M. I., Faden, A. I. Metabotropic glutamate receptor 5 activation inhibits microglial associated inflammation and neurotoxicity. Glia. 57, 550-560 (2009).
- Loane, D. J., Stoica, B. A., Pajoohesh-Ganji, A., Byrnes, K. R., Faden, A. I. Activation of metabotropic glutamate receptor 5 modulates microglial reactivity and neurotoxicity by inhibiting NADPH oxidase. J. Biol. Chem. 284, 15629-15639 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved