Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Primäre Mikroglia Isolation vom gemischten Zellkulturen von Gliazellen Neonatal Rattenhirngewebe
In diesem Artikel
Zusammenfassung
Isolieren primären Mikroglia aus der zellulären Heterogenität des Gehirns ist wichtig, um deren Rolle bei physiologischen und pathologischen Bedingungen zu untersuchen. Dieses Protokoll beschreibt eine mechanische Isolation und gemischten Zellkultur-Technik, die eine hohe Ausbeute und hoher Reinheit liefert, lebensfähigen primären Mikrogliazellen für In-vitro- Studien-und Downstream-Anwendungen.
Zusammenfassung
Mikroglia-Konto für ca. 12% der gesamten Zellpopulation im Gehirn von Säugetieren. Während Neuronen und Astrozyten die wichtigsten Zelltypen des Nervensystems angesehen werden, spielen eine bedeutende Rolle Mikroglia im normalen Gehirn-Physiologie durch die Überwachung Gewebe für Schmutz und Krankheitserregern und Aufrechterhaltung der Homöostase im Parenchym über Phagozytoseaktivität 1,2. Mikroglia sind während einer Reihe von Verletzungen und Krankheiten, einschließlich neurodegenerativer Erkrankungen, traumatische Hirnverletzung, und das Nervensystem Infektion 3 aktiviert. Unter diesen aktivierenden Bedingungen, erhöhen die Mikroglia Phagozytenaktivität, unterzogen morpohological und proliferative Veränderungen und aktiv sezernieren reaktiven Sauerstoff und Stickstoff Arten, entzündungsfördernde Zytokine und Chemokine, oft Aktivieren eines parakrine oder autokrine Schleife 4-6. Da diese Mikrogliazellen Antworten auf Krankheitsentstehung beitragen, neurologischen Erkrankungen, gezielter Forschung auf microglia gerechtfertigt ist.
Aufgrund der zellulären Heterogenität des Gehirns, ist es technisch schwierig, eine ausreichende Mikroglia Probenmaterial mit hoher Reinheit zu erhalten während der in vivo-Experimente. Aktuelle Forschungen über die neuroprotektiven und neurotoxischen Funktionen von Mikroglia erfordern eine technische Routine-Methode, um konsequent zu generieren rein und gesund Mikroglia mit ausreichenden Ertrag für das Studium. Wir präsentieren, in Text und Video, ein Protokoll zur reinen primären Mikroglia aus gemischten Glia Kulturen zu isolieren für eine Vielzahl von nachgelagerten Anwendungen. Kurz gesagt, nutzt diese Technik dissoziierten Hirngewebe von neugeborenen Ratten Welpen zu gemischten Glia-Zellkulturen zu produzieren. Nachdem die gemischten Kulturen glialen Konfluenz erreichen, werden die primären Mikroglia mechanisch von der Kultur durch eine kurze Dauer Schütteln isoliert. Die Mikroglia sind dann in hoher Reinheit für die experimentelle Untersuchung überzogen.
Das Prinzip und das Protokoll dieser Methodik wurdenin der Literatur beschrieben 7,8. Darüber hinaus werden alternative Methoden zur primären Mikroglia isolieren gut beschrieben 12.09. Homogenisierte Hirngewebe kann durch Dichtegradientenzentrifugation getrennt werden, um primäre Mikroglia 12 ergibt. Jedoch ist die Zentrifugation von mittlerer Länge (45 Min.) und kann eine Zellschädigung und Aktivierung sowie verursachen angereicherten Mikroglia und anderen zellulären Populationen führen. Ein anderes Protokoll wurde verwendet, um primäre Mikroglia in einer Vielzahl von Organismen zu isolieren durch längeres (16 Stunden), während Schütteln in Kultur 9-11. Nach dem Schütteln wird das Medium Überstand zentrifugiert, um Mikroglia zu isolieren. Diese längere Zwei-Schritt-Isolierung Verfahren kann auch stören Mikroglia-Funktion und Aktivierung. Wir nutzen vor allem die folgenden Mikroglia Isolation Protokoll in unserem Labor für eine Reihe von Gründen: (1) primäre Mikroglia in vivo simulieren Biologie treuer als verewigt Nagetier Mikroglia-Zelllinien, (2) Nominalen mechanischen Störungen minimiert potenzielle Zellfunktionsstörungen oder Aktivierung, und (3) ausreichende Ausbeute ohne Durchgang der gemischten Gliazellen Kulturen erhalten werden.
Es ist wichtig zu beachten, dass dieses Protokoll Hirngewebe von Neugeborenen verwendet Rattenjungen Mikroglia isolieren und dass die Verwendung von älteren Ratten zu isolieren Mikroglia wesentlich beeinflussen können die Ausbeute, Aktivierungsstatus und funktionellen Eigenschaften von isolierten Mikroglia. Es gibt Hinweise darauf, dass Altern mit Mikroglia Dysfunktion, erhöhte Neuroinflammation und neurodegenerativen Erkrankungen verknüpft ist, so haben frühere Studien Mikroglia ex vivo Erwachsenen verwendet werden, um ein besseres Verständnis der Rolle der Mikroglia bei neurodegenerativen Erkrankungen, wo Altern ist wichtiger Parameter. Jedoch können ex vivo Mikroglia in Kultur nicht für längere Zeit aufbewahrt werden. Daher, während dieses Protokoll verlängert die Lebensdauer der primären Mikroglia in Kultur ist darauf hinzuweisen, dass die Mikroglia d verhaltenifferently aus adulten Mikroglia und in-vitro-Studien sollte sorgfältig abgewogen werden, wenn zu einem In-vivo-Einstellung übersetzt.
Protokoll
1. Dissection of Neonatal Rattenhirngewebe
- Frost Leibovitz L-15 konditionierten Medien (Leibowitz L-15 + 0,1% BSA + 1% Pen / Strep) auf 4 ° C Warm Kulturmedium (DMEM + 10% FBS + 1% Penicillin / Streptomycin) auf 37 ° C Bereiten Sie vier Petrischalen 60x15 mm mit 4-5 ml der konditionierten L-15 Medien auf dem Eis. Sterilisieren Sie alle chirurgischen Instrumente mit 100% Ethanol.
- Spülen Sie die P2 neugeborenen Welpen Rap mit 70% Ethanol. (Neonatal Rattenjungen zwischen P1-P5 Jahren können in diesem Protokoll verwendet werden.)
- Schnell enthaupten ein Jungtier mit einer sterilen scharfen Schere und legen Sie den Kopf sofort in 70% Ethanol. Wiederholen Sie dies für insgesamt 5 Rattenjungen dann übertragen Köpfe in Kochsalzlösung.
- Entfernen Sie die ganze Gehirne aus den Köpfen und Ort in eine Petrischale mit 4 - 5 ml L-15-Lösung (Leibowitz L-15 + 0,1% BSA + 1% Pen / Strep) auf Eis.
- Wiederholen Sie die Prozeduren von 1,2 bis 1,4 für die restlichen Welpen im Wurf.
- Entfernen Sie die Meningen des Gehirns und übertragen die desIRED Hirngewebe (dh Kortex, Kleinhirn ganze Gehirn, etc.) in eine neue Petrischale mit 5.4 ml L-15-Lösung (Leibowitz L-15 + 0,1% BSA + 1% Pen / Strep) auf Eis.
2. Herstellung von gemischten Zellpopulation
- Ohne schädliche Hirngewebe mit einer Schere oder einem Messer, übertragen das Gewebe mit einer 10 ml Pipette in ein steriles 50 ml konischen Röhrchen.
- Zentrifuge bei 2500 RCF konischen für 5 min bei 4 ° C
- Absaugen des Überstandes. Fügen Sie 4-5 ml frischem L-15-Medien (Leibowitz L-15 + 0,1% BSA + 1% Pen / Strep).
- Pipette Gewebe nach oben und unten 10 Mal mit einem sterilen 10 ml Pipette.
- Legen Sie eine Zelle Sieb (100 um Poren) auf ein frisches 50 ml konischen Röhrchen. Pipette Gewebe nach oben und unten einmal mit einer sterilen 5 ml Pipette und mit der Pipette bündig mit der Zelle Sieb, verzichtet das Material durch die Zelle Sieb in das konische Röhre.
- Spülen Sie die Zelle Sieb mit 4-5 ml frischem L-15-Medien (Leibowitz L-15 + 0,1% BSA + 1% Pen / Strep).
- Zentrifugieren konisch mit gespannten Zellen bei 2.500 RCF für 5 min bei 4 ° C
3. Plating und Wartung von Mixed Gliazelle Kulturen
- Für jedes Jungtier Gehirn verarbeitet werden, bereiten 1 sterile T-75-Kolben durch Zugabe von 12 ml Kulturmedium (DMEM + 10% FBS + 1% Penicillin / Streptomycin) in jeden Kolben.
- Den Überstand von den pelletierten Zellen und fügen 5-6 ml Kulturmedium zu dem Zellpellet. Und Abpipettieren 10 Mal mit einer 10 ml Pipette.
- Übertragen Sie ein gleiches Volumen an Zellsuspension zu jedem T-75-Kolben.
- Inkubieren Flaschen in einem 5% CO 2-Inkubator bei 37 ° C für insgesamt 1-3 Wochen.
- Flaschen sollten zunächst für 5 Tage bebrütet werden, und am fünften Tag, ersetzen Sie die Kulturmedien in jeder Flasche mit 12 ml frisches Medium und zurück in den Inkubator. Dann, alle 3 Tage, ersetzen Sie die konditionierten Medien in jeder Flasche mit 12 ml frisches Medium bis zur Konfluenz zu erreichen. Diese werden muss tunne sehr sorgfältig ohne den Boden berührt der Kolben in dem die Zellen anhaften.
4. Isolierung und Beschichtung von primären Mikroglia
- Nach gemischten Glia-Kulturen vollständig konfluent sind, entfernen Flaschen aus dem Inkubator und decken Kolben Kappen mit Parafilm den Gasaustausch mit der Umgebungsluft zu verhindern.
- Schüttelkolben bei 100 rps (Lab Companion SI-600, Jeio Tech) für 1 Stunde bei 37 ° C
- Sammeln Medien aus allen Kolben mit einer 10 ml Pipette, ohne dass der Astrozyten Schicht auf der Kolbenoberfläche. Legen Sie die Medien in 50 ml konischen Röhrchen. Fügen Sie frisches Medium zu den Kolben und Flaschen zurück in den Inkubator.
- Zentrifuge konische Röhrchen bei 2500 RCF für 5 min bei 4 ° C
- Absaugen des Überstandes aus allen konischen Röhrchen. Die Zellpellets sind hochreine Mikroglia-Zellen. Resuspendieren Pellets in 1 ml der Mikroglia Plattierung (DMEM + 10% FES + 1% Penicillin / Streptomycin).
- Zählen Sie die Zelldichte in den Medien mit resuspendierteneinem Hämocytometer.
- Setzen Sie einen passenden Volumen von Mikroglia Plattierungsmedien um ein 2 x 10e5 Zellen pro ml Dichte zu erreichen. Platte als geeignet für experimentelle Analyse.
- Erlauben Sie Mikroglia über Nacht zu befestigen.
5. Repräsentative Ergebnisse
Die oben beschriebenen Protokoll Ergebnisse in hoher Reinheit primären Kulturen Mikroglia. Durch immunhistochemische für einen Makrophagen / Mikroglia-Zell-spezifische Marker (Iba1) bestimmt, sind vernickelt Mikroglia Kulturen> 90% (Abbildung 2). Zusätzlich, Anfärbung von Astrozyten, Oligodendrozyten und Neuronen-spezifische Marker Zelle zeigt minimale Kontamination (Abbildung 2). Nach der Gründung gemischten Glia-Zellkulturen, können Mikroglia durch Schütteln bis zu 4 aufeinander folgenden Zeitpunkten isoliert werden. Der anfängliche Isolation Mikroglia wird nachgeben etwa 2,2 x 106 Zellen / ml oder etwa 9 Millionen Zellen pro 10 Flaschen und dem erwarteten Ertrag verringert sich mit jedem weiteren shake. Mikrogliazellen mit dieser Methode isoliert wurden erfolgreich zur Phagozytose Fähigkeit, Funktion wie die Produktion von Stickoxid, und neuronale Toxizität (Abbildung 3) 13 bis 14 untersuchen verwendet.
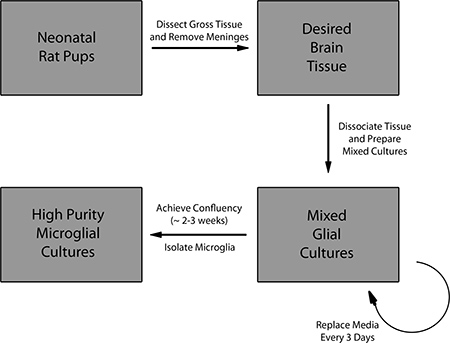
1. Übersicht des Protokolls zur Herstellung von gemischten Kulturen Gliazellen und Isolierung der primären Mikroglia.
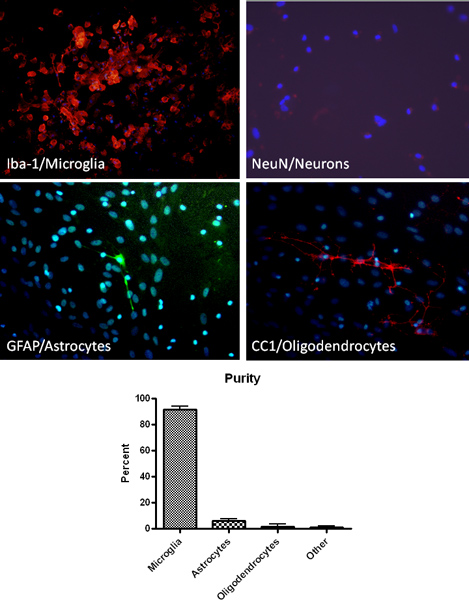
Abbildung 2. Isolierung von hochreiner Mikroglia als durch immunhistochemische Analyse unter Verwendung von Mikroglia (Iba-1, rot), Astrozyten (GFAP, grün), Neuron (NeuN, rot) und Oligodendrozyten nachgewiesen (CC1, rot) spezifische Marker. Die Färbung für DNA von Zellen in Kultur durch DAPI (blau) wird ebenfalls angezeigt.
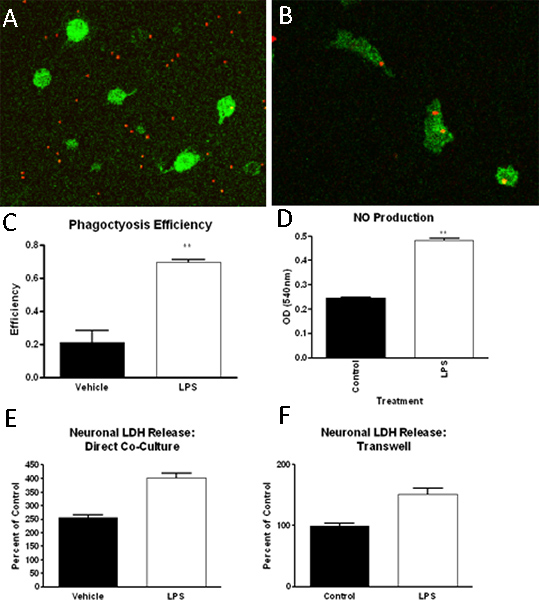
Abbildung 3. Mikroglia isoliert in der Methode beschrieBett in einer Reihe von Tests, einschließlich verwendet worden, aber nicht beschränkt auf, Phagozytose Assays,-Assays und Neurotoxizität beschränkt. In diesen Studien haben wir gefunden, dass Mikroglia (Iba-1-positiven, grün), bei Bestrahlung mit steuern (A) oder LPS (B) behandelten Medien, die Erhöhung des Phagozytose von fluoreszenzmarkierten Latexkügelchen (rot), die quantifiziert werden kann ( C). Ferner kann LPS (1ng/ml) Behandlung zu erhöhen die Produktion von Stickoxid in Mikroglia (D). Schließlich sowohl über Transwell-Einsatz-getrennt oder direkt Mikroglia-Neuron-Kulturen, haben wir festgestellt, dass Mikroglia mit LPS kann neuronalen Zelltod induzieren wie von Lactatdehydrogenase (LDH) Freisetzung (E, F) gemessen.
Diskussion
Während dieses Protokoll routinemäßig benutzt wird, um reines und gesundes Mikroglia Experimente für die Forschung zu produzieren, wird sorgfältige Prüfung der technischen Aspekte bei der kritischen Teile des Verfahrens die Variabilität zu minimieren in dem isolierten Mikroglia. Erstens, während der Präparation von Hirngewebe aus neugeborenen Ratten Welpen, arbeitet in einer zeitgemäßen Weise ist notwendig, um hypoxische und ischämische Schädigung des Gewebes zu minimieren. Es ist jedoch auch wichtig, um di...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Gefördert durch das Programm an der intramuralen Uniformed Services University.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| 60 mm x 15 mm Petrischalen | Marke Fisher | 0875713A | |
| Sharp Präparierscheren | Fine Science Tools | 14094-11 | |
| Dumont # 7b Pinzette-Standard-Spitzen, gebogen, 11cm | Fine Science Tools | 11270-20 | |
| Dumont Nr. 5 Zangen-Standard-Spitzen, gerade, 11 cm | Fine Science Tools | 11251-10 | |
| 50 ml konischen Zentrifugenröhrchen | VWR | 89039-656 | |
| 5 ml serologischen Pipetten | Grenier Bio One | 606180 | |
| 10 ml serologischen Pipetten | Grenier Bio One | 607180 | |
| 100 um sterile Nylon Zellsieb | Falke | 35-2360 | |
| 75 cm 2 Zellkulturflaschen | Corning | 430641 | |
| Dulbeccos Minimal Essential Medium (DMEM) | Gibco (Invitrogen) | 31053-028 | |
| Leibovitz L-15-Medium | Gibco (Invitrogen) | 11415064 | |
| Fötales Rinderserum | Gibco (Invitrogen) | 16000-036 | |
| Fetale Pferdeserum | Fischer | SH3007402 | |
| Penicillin-Streptomycin | Gibco (Invitrogen) | 15140163 | |
| 100% Ethanol | Die Warner Graham Company | 64-17-5 | |
| Phosphat-gepufferte Kochsalzlösung, 10X, pH 7,4 | Quality Biological, Inc. | 119-069-131 | 1X in sterilem, destilliertem Wasser |
| Biohazard Taschen | VWR | 14220-028 | |
| Hämocytometer | Hausser Scientific | 1492 | |
| 6-well-Zellkulturplatten mit Cellbind Oberfläche | Corning | 3335 |
Referenzen
- Ransohoff, R. M., Perry, V. H. Microglial physiology: unique stimuli, specialized responses. Annu. Rev. Immunol. 27, 119-145 (2009).
- Raivich, G., Bohatschek, M., Kloss, C. U., Werner, A., Jones, L. L., Kreutzberg, G. W. Neuroglial activation repertoire in the injured brain: graded response, molecular mechanisms and cues to physiological function. Brain Res. Brain Res. Rev. 30, 77-105 (1999).
- Loane, D. J., Byrnes, K. R. Role of microglia in neurotrauma. Neurotherapeutics. 7, 245-265 (2010).
- Glass, C. K., Saijo, K., Winner, B., Marchetto, M. C., Gage, F. H. Mechanisms underlying inflammation in neurodegeneration. Cell. 140, 918-934 (2010).
- Pocock, J. M., Liddle, A. C. Microglial signalling cascades in neurodegenerative disease. Prog. Brain Res. 132, 555-565 (2001).
- Block, M. L., Hong, J. S. Chronic microglial activation and progressive dopaminergic neurotoxicity. Biochem. Soc. Trans. 35, 1127-1132 (2007).
- Barger, S. W., Basile, A. S. Activation of microglia by secreted amyloid percursor protein evokes release of glutamate by cystine exchange and attenuates synpatic function. J. Neurochem. 76, 846-854 (2001).
- Ni, M., Aschner, M. Neonatal rat primary microglia: isolation, culturing, and selected applications. Curr. Protoc. Toxicol. Chapter 12, Unit 12.17 (2010).
- Hassan, N. F., Rifat, S., Campbell, D. E., McCawley, L. J., Douglas, S. D. Isolation and flow cytometric characterization of newborn mouse brain-derived microglia maintained in vitro. J. Leukoc. Biol. 50, 86-92 (1991).
- Hassan, N. F., Prakash, K., Chehimi, J., McCawley, L. J., Douglas, S. D. Isolation and characterization of newborn rabbit brain-derived microglia. Clin. Immunol. Immunopathol. 59, 426-435 (1991).
- Hassan, N. F., Campbell, D. E., Rifat, S., Douglas, S. D. Isolation and characterization of human fetal brain-derived microglia in in vitro culture. Neuroscience. 41, 149-158 (1991).
- Frank, M. G., Wieseler-Frank, J. L., Watkins, L. R., Maier, S. F. Rapid isolation of highly enriched and quiescent microglia from adult rat hippocampus: immunophenotypic and functional characteristics. J. Neurosci. Methods. 151, 121-130 (2006).
- Byrnes, K. R., Stoica, B., Loane, D. J., Riccio, A., Davis, M. I., Faden, A. I. Metabotropic glutamate receptor 5 activation inhibits microglial associated inflammation and neurotoxicity. Glia. 57, 550-560 (2009).
- Loane, D. J., Stoica, B. A., Pajoohesh-Ganji, A., Byrnes, K. R., Faden, A. I. Activation of metabotropic glutamate receptor 5 modulates microglial reactivity and neurotoxicity by inhibiting NADPH oxidase. J. Biol. Chem. 284, 15629-15639 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten