需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
初级小胶质细胞的分离,从新生大鼠脑组织胶质细胞混合文化
摘要
隔离初级小胶质细胞的大脑细胞的异质性是必不可少的,以调查他们在生理和病理条件下的作用。本协议描述了机械隔离和混合细胞培养技术,提供高产量和高纯度的,可行的初级小胶质细胞在体外学习和下游应用。
摘要
小胶质细胞在哺乳动物的脑细胞的总人口约12%的帐户。虽然神经元和神经胶质细胞被认为是神经系统的主要类型的细胞,小胶质细胞发挥 显著作用,在正常脑组织的生理组织碎片和病原体监测和维持动态平衡通过吞噬活性1,2实质。小胶质细胞被激活过程中的损伤和疾病的条件,包括神经退行性疾病,脑外伤,中枢神经系统感染3。这些活化条件下,增加小胶质细胞的吞噬活性,经过morpohological和增殖的变化,积极分泌活性氧和氮物种,促炎性趋化因子和细胞因子,往往激活旁分泌或自分泌环4-6。由于这些小胶质细胞反应在神经系统疾病的发病机制的研究主要集中在microglia保证。
由于大脑细胞的异质性,这是技术上的困难,具有纯度高,在体内实验中获得足够的小胶质细胞的样品材料。小胶质细胞的神经保护和神经功能的研究现状,需要常规的技术方法始终产生足够的产量为研究的纯洁和健康的小胶质细胞。我们提出,在文字和视频,从混合胶质文化的隔离纯初级小胶质细胞的各种下游应用协议。简单地说,这种技术采用分离新生幼鼠脑组织生产混合胶质细胞培养。混合胶质细胞培养达到汇合后,小胶质细胞主要是机械分离的文化由摇晃的时间很短。小胶质细胞,然后镀上高纯度的实验研究。
这种方法的原理和协议在文献7,8所述。此外,隔离初级小胶质细胞的替代方法有很好的描述9-12。匀浆脑组织可通过密度梯度离心分离,产生初级小胶质细胞12。然而,离心是适中的长度(45分钟),并可能会导致细胞损伤和激活,以及,导致富含胶质细胞和其他细胞群。另一个协议已动用隔离初级小胶质细胞的各种生物通过长时间的晃动,而在文化9-11(16小时)。摇动后,媒体上清离心分离小胶质细胞。这不再两步分离方法也可能干扰小胶质细胞的功能和激活。我们主要是利用以下的小胶质细胞的分离协议在我们的实验室有许多原因:(1)初级小胶质细胞在体内的生物学模拟更忠实,比永生的灭鼠小胶质细胞株(2)额定机械破坏,最大限度地减少潜在的细胞功能障碍或激活,(3)没有足够的产量可以通过混合胶质细胞培养获得。
重要的是要注意该协议使用新生幼鼠脑组织小胶质细胞分离和使用旧的大鼠,分离小胶质细胞可以显着影响产量,激活状态,孤立的小胶质细胞的功能特性。有证据表明,老龄化与小胶质细胞功能障碍,增加神经发炎和神经退行性病变的联系,所以以前的研究都采用体外成人小胶质细胞小胶质细胞在神经退行性疾病中的作用更好地了解地方老龄化是一个重要参数。但是,小胶质细胞体外不能被保存在长时间的文化。因此,虽然该协议扩展了初级小胶质细胞中的文化生活,也应注意到,小胶质细胞的行为ðifferently从成人的胶质细胞和体外研究时,应慎重考虑翻译体内设置。
研究方案
1。新生大鼠脑组织解剖
- 寒意莱博维茨的L-15条件培养基(莱博维茨的L-15 + 0.1%BSA + 1%笔/ STREP)至4°C。温暖的培养基(DMEM培养基+ 10%胎牛血清+ 1%青霉素/链霉素)至37°C。准备4-5毫升条件的L-15冰媒体4 60x15毫米培养皿。 100%的酒精消毒所有的手术工具。
- 用70%乙醇冲洗P2新生儿说唱幼仔。 (P1〜P5之间的新生大鼠岁的幼崽,可用于在该协议)。
- 迅速斩首老鼠幼犬用无菌锋利的剪刀,并立即下降到70%的乙醇头的。共有5幼鼠重复,然后转移到盐水首脑。
- 整个大脑从元首和放入培养皿中,有4 - 5毫升L - 冰(15解决莱博维茨的L-15 + + 1%,0.1%BSA笔/链球菌)。
- 重复程序1.2 - 1.4在垃圾其余幼仔。
- 从脑脊膜和转移DESIRED脑组织进入一个新的Petri菜用4-5毫升的L-15的解决方案( 即皮层,小脑,全脑等)(莱博维茨的L-15 + 0.1%BSA + 1%的PEN /链球菌)在冰上。
2。制备混合胶质细胞群
- 在不损害脑组织,用剪刀或刀片,10毫升吸管组织转移到无菌的50毫升锥形管。
- 在4°C离心5分钟在2500离心力的锥形
- 吸上清。莱博维茨的L-15 +新鲜的L-15介质中加入4-5毫升(0.1%BSA + 1%笔/链球菌)。
- 吸取组织上下用无菌10毫升的移液器10倍。
- 放置到一个新的50毫升锥形管一个细胞过滤器(100微米的孔)。吸取组织上下无菌5毫升吸管和吸管冲洗细胞过滤一次,免除通过细胞进入锥形管过滤材料。
- 细胞过滤冲洗4-5毫升新鲜的L-15媒体(莱博维茨的L-15 + 0.1%BS+ 1%笔/链球菌)。
- 5分钟紧张的细胞离心圆锥形在2500离心力4°C。
3。混合胶质细胞培养的电镀和维护
- 对于每个小狗大鼠脑处理,准备1无菌的T-75瓶,加入12毫升培养基(DMEM培养基+ 10%FBS + 1%青霉素/链霉素),将每个烧瓶。
- 从颗粒细胞吸上清,加5-6毫升培养基细胞沉淀。吸取向上和向下10毫升吸管10倍。
- 等量细胞悬液转移到每个T-75瓶。
- 在37°C孵育为1-3周总在5% 二氧化碳培养箱瓶。
- 应首先培养瓶为5天,第五天,将在每个烧瓶文化媒体与新媒体的12毫升,并返回到孵化器。然后,每3天更换空调在每个烧瓶媒体12毫升新鲜媒体实现合流。这必须做NE非常仔细地在细胞附着在烧瓶底部不接触。
4。初级小胶质细胞的分离和电镀
- 后混合胶质文化的完全融合,从孵化器中删除瓶和瓶封口膜覆盖的上限,以防止气体交换与环境空气。
- 1小时摇匀瓶100 RPS(实验室助理,Jeio科技SI-600)在37°C。
- 收集了10毫升吸管所有瓶瓶表面上不破坏胶质细胞层的媒体。媒体将在50 ml锥形管。添加新媒体的保温瓶和回报瓶孵化。
- 5分钟离心锥管在2500离心力4°C。
- 所有锥形管吸出上清液。细胞颗粒高纯度的小胶质细胞。 1毫升的小胶质细胞电镀媒体(DMEM培养基+ 10%的FES + 1%青霉素/链霉素)重悬浮颗粒。
- 在媒体使用的再悬浮细胞密度计数1血细胞计数。
- 加入适当体积小胶质细胞的电镀媒体,以实现一个2×10e5细胞密度每毫升。板作为适当的实验分析。
- 让小胶质细胞附着在一夜之间。
5。代表结果
上述结果,在高纯度的初级小胶质细胞培养协议。巨噬细胞/小胶质细胞特异性标志物(Iba1)免疫组化确定,镀金的小胶质细胞培养> 90%纯( 图2)。此外,星形胶质细胞,少突胶质细胞和神经细胞特异性标志物的染色表明最小的污染( 图2)。建立混合胶质细胞培养后,小胶质细胞可以通过摇晃起来,以连续4次被隔离。最初的小胶质细胞的分离,将产生约2.2×106细胞/毫升或每10瓶和预期产量约900万细胞减少与每一个连续的沙柯。通过这种方法分离的小胶质细胞已成功地用于研究细胞的吞噬能力,如产生一氧化氮的功能,神经毒性( 图3)13-14。
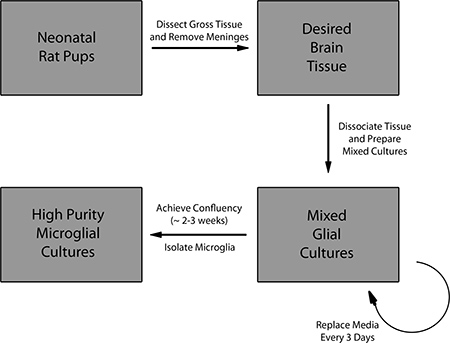
图1。准备混合胶质细胞培养和初级小胶质细胞的分离协议概述。
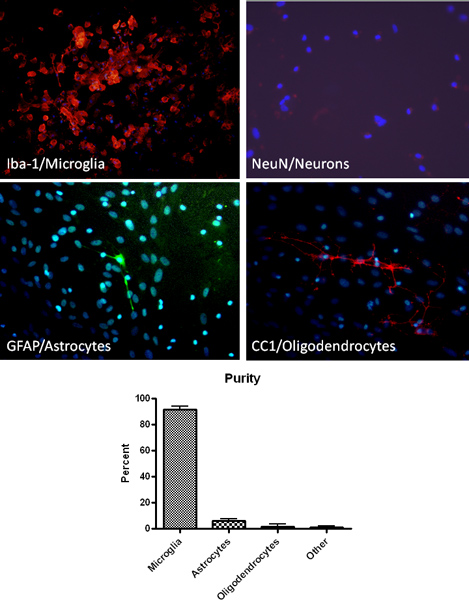
图2。使用(IBA-1,红色),小胶质细胞,星形胶质细胞(GFAP,绿色),神经元(NeuN染色,红色)和胶质细胞的免疫组织化学分析验证的高纯度的小胶质细胞的分离(CC1的,红色)的特异性标志。还表现在培养细胞用DAPI(蓝色)的DNA染色。
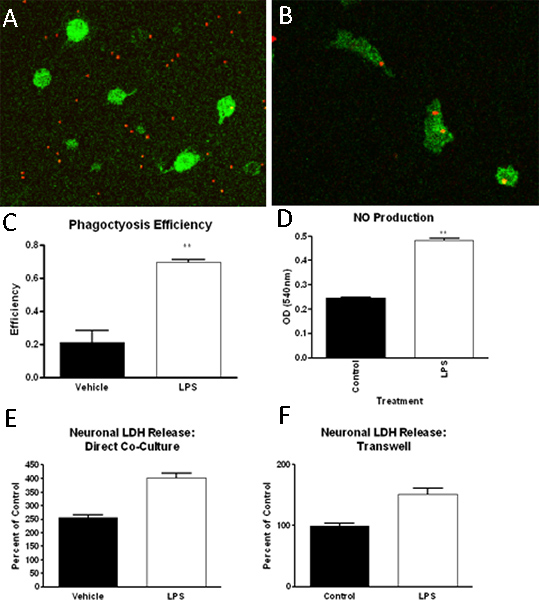
图3。小胶质细胞分离方法descri已用在床的检测,包括但不限于,吞噬功能检测,功能检测和神经毒性研究。在这些研究中,我们发现,小胶质细胞(IBA-1阳性,绿色),当暴露控制(A)或脂多糖(二)对待媒体,提高他们的荧光标记的乳胶珠(红色),可量化的吞噬功能( C)此外,LPS(1ng/ml)治疗可以增加小胶质细胞的一氧化氮(四)生产。最后,通过同时Transwell小插入分隔或直接的小胶质细胞,神经元的文化,我们已经发现,小胶质细胞培养与LPS可以诱导神经细胞死亡,乳酸脱氢酶(LDH)释放(,E,F)。
讨论
虽然此协议经常用来生产纯净和健康的小胶质细胞的研究实验,在程序的关键部件的技术方面的慎重考虑,将尽量减少在孤立的小胶质细胞的变化。首先,是要尽量减少缺氧和缺血性脑损伤的组织,在新生幼鼠脑组织工作,及时清扫。然而,同样重要的是从大脑中彻底清除脑膜覆盖在解剖,因为在场的脑膜将有助于显着的成纤维细胞污染,由于这些培养条件下的快速增殖率。
披露声明
没有利益冲突的声明。
致谢
在统一服务大学的校内计划资助。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论 |
| 60毫米×15毫米培养皿 | 费希尔品牌 | 0875713A | |
| 夏普解剖剪刀 | 罚款科学工具 | 14094-11 | |
| 杜蒙#7B钳标准提示,弯曲,11厘米 | 罚款科学工具 | 11270-20 | |
| 杜蒙#5镊子标准的提示,直,11厘米 | 罚款科学工具 | 11251-10 | |
| 50毫升锥形离心管 | 厂商VWR | 89039-656 | |
| 5毫升血清移液器 | 格雷尼尔生物一 | 606180 | |
| 10毫升血清移液器 | 格雷尼尔生物一 | 607180 | |
| 100微米无菌尼龙细胞过滤器 | 鹘 | 35-2360 | |
| 75厘米2组织培养瓶 | 康宁 | 430641 | |
| Dulbecco的最低基本培养基(DMEM培养基) | Gibco公司(Invitrogen公司) | 31053-028 | |
| 莱博维茨的L-15培养基 | Gibco公司(Invitrogen公司) | 11415064 | |
| 胎牛血清 | Gibco公司(Invitrogen公司) | 16000-036 | |
| 胎儿马血清 | 费舍尔 | SH3007402 | |
| 青霉素链霉素 | Gibco公司(Invitrogen公司) | 15140163 | |
| 100%的乙醇 | 华纳格雷厄姆公司 | 64-17-5 | |
| 磷酸盐缓冲盐溶液,10X,pH值7.4 | 质量生物学,INC。 | 119-069-131 | 1X在无菌蒸馏水 |
| 生化危机袋 | 厂商VWR | 14220-028 | |
| 血球 | 豪塞尔科学 | 1492 | |
| 6井细胞与cellBIND表面培养皿 | 康宁 | 3335 |
参考文献
- Ransohoff, R. M., Perry, V. H. Microglial physiology: unique stimuli, specialized responses. Annu. Rev. Immunol. 27, 119-145 (2009).
- Raivich, G., Bohatschek, M., Kloss, C. U., Werner, A., Jones, L. L., Kreutzberg, G. W. Neuroglial activation repertoire in the injured brain: graded response, molecular mechanisms and cues to physiological function. Brain Res. Brain Res. Rev. 30, 77-105 (1999).
- Loane, D. J., Byrnes, K. R. Role of microglia in neurotrauma. Neurotherapeutics. 7, 245-265 (2010).
- Glass, C. K., Saijo, K., Winner, B., Marchetto, M. C., Gage, F. H. Mechanisms underlying inflammation in neurodegeneration. Cell. 140, 918-934 (2010).
- Pocock, J. M., Liddle, A. C. Microglial signalling cascades in neurodegenerative disease. Prog. Brain Res. 132, 555-565 (2001).
- Block, M. L., Hong, J. S. Chronic microglial activation and progressive dopaminergic neurotoxicity. Biochem. Soc. Trans. 35, 1127-1132 (2007).
- Barger, S. W., Basile, A. S. Activation of microglia by secreted amyloid percursor protein evokes release of glutamate by cystine exchange and attenuates synpatic function. J. Neurochem. 76, 846-854 (2001).
- Ni, M., Aschner, M. Neonatal rat primary microglia: isolation, culturing, and selected applications. Curr. Protoc. Toxicol. Chapter 12, Unit 12.17 (2010).
- Hassan, N. F., Rifat, S., Campbell, D. E., McCawley, L. J., Douglas, S. D. Isolation and flow cytometric characterization of newborn mouse brain-derived microglia maintained in vitro. J. Leukoc. Biol. 50, 86-92 (1991).
- Hassan, N. F., Prakash, K., Chehimi, J., McCawley, L. J., Douglas, S. D. Isolation and characterization of newborn rabbit brain-derived microglia. Clin. Immunol. Immunopathol. 59, 426-435 (1991).
- Hassan, N. F., Campbell, D. E., Rifat, S., Douglas, S. D. Isolation and characterization of human fetal brain-derived microglia in in vitro culture. Neuroscience. 41, 149-158 (1991).
- Frank, M. G., Wieseler-Frank, J. L., Watkins, L. R., Maier, S. F. Rapid isolation of highly enriched and quiescent microglia from adult rat hippocampus: immunophenotypic and functional characteristics. J. Neurosci. Methods. 151, 121-130 (2006).
- Byrnes, K. R., Stoica, B., Loane, D. J., Riccio, A., Davis, M. I., Faden, A. I. Metabotropic glutamate receptor 5 activation inhibits microglial associated inflammation and neurotoxicity. Glia. 57, 550-560 (2009).
- Loane, D. J., Stoica, B. A., Pajoohesh-Ganji, A., Byrnes, K. R., Faden, A. I. Activation of metabotropic glutamate receptor 5 modulates microglial reactivity and neurotoxicity by inhibiting NADPH oxidase. J. Biol. Chem. 284, 15629-15639 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。