Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Первичная изоляция Микроглия из смешанного глиальных клеточных культур из тканей новорожденных мозга крысы
В этой статье
Резюме
Изоляция первичной микроглии с сотового неоднородность мозга необходимо исследовать их роль как в физиологических и патологических состояниях. Этот протокол описывает механической изоляции, смешанная техника культуры клеток, что обеспечивает высокую производительность и высокую чистоту, жизнеспособных первичных клеток микроглии для В пробирке Исследования и последующих приложений.
Аннотация
Microglia account for approximately 12% of the total cellular population in the mammalian brain. While neurons and astrocytes are considered the major cell types of the nervous system, microglia play a significant role in normal brain physiology by monitoring tissue for debris and pathogens and maintaining homeostasis in the parenchyma via phagocytic activity 1,2. Microglia are activated during a number of injury and disease conditions, including neurodegenerative disease, traumatic brain injury, and nervous system infection 3. Under these activating conditions, microglia increase their phagocytic activity, undergo morpohological and proliferative change, and actively secrete reactive oxygen and nitrogen species, pro-inflammatory chemokines and cytokines, often activating a paracrine or autocrine loop 4-6. As these microglial responses contribute to disease pathogenesis in neurological conditions, research focused on microglia is warranted.
Due to the cellular heterogeneity of the brain, it is technically difficult to obtain sufficient microglial sample material with high purity during in vivo experiments. Current research on the neuroprotective and neurotoxic functions of microglia require a routine technical method to consistently generate pure and healthy microglia with sufficient yield for study. We present, in text and video, a protocol to isolate pure primary microglia from mixed glia cultures for a variety of downstream applications. Briefly, this technique utilizes dissociated brain tissue from neonatal rat pups to produce mixed glial cell cultures. After the mixed glial cultures reach confluency, primary microglia are mechanically isolated from the culture by a brief duration of shaking. The microglia are then plated at high purity for experimental study.
The principle and protocol of this methodology have been described in the literature 7,8. Additionally, alternate methodologies to isolate primary microglia are well described 9-12. Homogenized brain tissue may be separated by density gradient centrifugation to yield primary microglia 12. However, the centrifugation is of moderate length (45 min) and may cause cellular damage and activation, as well as, cause enriched microglia and other cellular populations. Another protocol has been utilized to isolate primary microglia in a variety of organisms by prolonged (16 hr) shaking while in culture 9-11. After shaking, the media supernatant is centrifuged to isolate microglia. This longer two-step isolation method may also perturb microglial function and activation. We chiefly utilize the following microglia isolation protocol in our laboratory for a number of reasons: (1) primary microglia simulate in vivo biology more faithfully than immortalized rodent microglia cell lines, (2) nominal mechanical disruption minimizes potential cellular dysfunction or activation, and (3) sufficient yield can be obtained without passage of the mixed glial cell cultures.
It is important to note that this protocol uses brain tissue from neonatal rat pups to isolate microglia and that using older rats to isolate microglia can significantly impact the yield, activation status, and functional properties of isolated microglia. There is evidence that aging is linked with microglia dysfunction, increased neuroinflammation and neurodegenerative pathologies, so previous studies have used ex vivo adult microglia to better understand the role of microglia in neurodegenerative diseases where aging is important parameter. However, ex vivo microglia cannot be kept in culture for prolonged periods of time. Therefore, while this protocol extends the life of primary microglia in culture, it should be noted that the microglia behave differently from adult microglia and in vitro studies should be carefully considered when translated to an in vivo setting.
протокол
1. Препарирование ткани мозга новорожденных крыс
- Холод Лейбовиц в L-15 условных СМИ (Лейбовиц L-15 + 0.1% BSA + 1% Pen / Strep) до 4 ° C. Теплый питательных сред (DMEM + 10% FBS + 1% пенициллин / стрептомицин) до 37 ° C. Подготовка 4 60x15 мм чашки Петри с 4-5 мл условно L-15 средств массовой информации на льду. Стерилизовать всех хирургических инструментов со 100% этанола.
- Промойте P2 новорожденных щенков рэп с 70% этанола. (Новорожденных крысят в возрасте от P1-P5 может быть использована в данном протоколе.)
- Быстро обезглавить крысу щенка стерильными острыми ножницами и удалить голову сразу на 70% этанола. Повторите эти действия для в общей сложности 5 крысят затем передать голову в физиологический раствор.
- Удалить все мозги из головы и место в чашку Петри с 4 - 5 мл L-15 решением (Лейбовиц L-15 + 0.1% BSA + 1% Pen / Strep) на льду.
- Повторите процедуры 1,2 - 1,4 для остальных щенков в помете.
- Удалить из оболочек головного мозга и передавать деIRED ткани головного мозга (например, кора головного мозга, мозжечок, весь мозг, и т.д.) в новую чашку Петри с 4-5 мл L-15 решением (Лейбовиц L-15 + 0.1% BSA + 1% Pen / Strep) на льду.
2. Подготовка смешанной популяции клеток глии
- Без повреждения мозговой ткани с помощью ножниц или лезвия, передает ткани с 10 мл пипетки на 50 мл стерильной коническую трубку.
- Центрифуга коническая в 2500 RCF в течение 5 мин при 4 ° C.
- Аспирируйте супернатант. Добавить 4-5 мл свежего L-15 средств массовой информации (Лейбовиц L-15 + 0.1% BSA + 1% Pen / Strep).
- Внесите ткань вверх и вниз 10 раз стерильной пипеткой 10 мл.
- Поставьте клетку фильтр (100 мкм поры) на новый 50 мл коническую трубку. Внесите ткань вверх и вниз один раз стерильной пипеткой 5 мл, с пипеткой вплотную к клетке сито, отказаться от материала через ячейку фильтр в конической трубе.
- Промойте ячейки фильтра с 4-5 мл свежего L-15 средств массовой информации (Лейбовиц L-15 + 0.1% BS+ 1% Pen / Strep).
- Центрифуга коническая с напряженными клеток в 2500 RCF в течение 5 мин при 4 ° C.
3. Покрытие и обслуживания смешанных глиальных культурах клеток
- Для каждого крысят мозг обработки приготовления 1 стерильный Т-75 колбу, добавляя 12 мл культуральной среды (DMEM + 10% FBS + 1% пенициллин / стрептомицин) в каждую колбу.
- Аспирируйте супернатант из гранулированных клеток и добавить 5-6 мл культуральной среды в осадок клеток. Пипетировать вверх и вниз 10 раз с 10 мл пипетки.
- Передача равный объем клеточной суспензии для каждого Т-75 колбу.
- Инкубируйте колбы в 5% СО 2 инкубатор при 37 ° С в течение всего 1-3 недели.
- Фляги должны быть сначала выдерживают в течение 5 дней, а на пятый день, заменить культуру средств массовой информации в каждую колбу с 12 мл свежей среды и вернуться в инкубаторе. Затем каждые 3 дня, заменить условный СМИ в каждую колбу с 12 мл свежей среды для достижения слияния. Это необходимо делатьпе очень осторожно, не касаясь дна колбы, где клетки придают.
4. Изоляция и покрытие первичных Микроглия
- После смешанной глиальных культурах полностью сливающиеся, удалите колбы из инкубатора и охватывают колбы с крышками для предотвращения парафильмом газообмен с окружающего воздуха.
- Встряхнуть колбы на 100 оборотов в секунду (Лаборатория Companion SI-600, Jeio Tech) в течение 1 часа при температуре 37 ° C.
- Сбор средств массовой информации из всех колбы с 10 мл пипетки, не нарушая астроцитов слоя на поверхности колбы. Место СМИ в 50 мл конические пробирки. Добавить свежие СМИ колб и возвращения колбы в инкубатор.
- Центрифуга конических труб в 2500 RCF в течение 5 мин при 4 ° C.
- Аспирируйте супернатант из всех конических труб. Сотовые гранулы клеток микроглии высокой чистоты. Ресуспендируйте гранул в 1 мл микроглии покрытие СМИ (DMEM + 10% FES + 1% пенициллин / стрептомицин).
- Подсчитайте плотность клеток в средах с помощью ресуспендированногогемоцитометра.
- Добавить соответствующий объем средства массовой информации микроглии покрытие для достижения 2-х 10e5 клеток на мл плотности. Пластина по мере необходимости для экспериментального анализа.
- Позвольте микроглии приложить на ночь.
5. Представитель Результаты
Протокол, описанный выше результаты в высокой степени чистоты первичных культур микроглии. Как определяется иммуногистохимии для макрофагов / микроглии клетки специфического маркера (Iba1), покрытие культур микроглии составляет> 90% чистой (рис. 2). Кроме того, для окрашивания астроцитов, олигодендроцитов и нейронов клетки специфических маркеров свидетельствует о минимальном загрязнении (рис. 2). После создания смешанных культурах клеток глии, микроглии могут быть выделены путем встряхивания до 4 раз подряд. Начальная изоляции микроглии даст примерно 2,2 х 106 клеток / мл или около 9 миллионов клеток на 10 колб и ожидаемую доходность уменьшается с каждым последующим шаке. Микроглия изолированы с помощью этого метода были успешно использованы для исследования фагоцитоза способности, функции, такие как продукцию оксида азота и токсичности нейронов (рис. 3) 13-14.
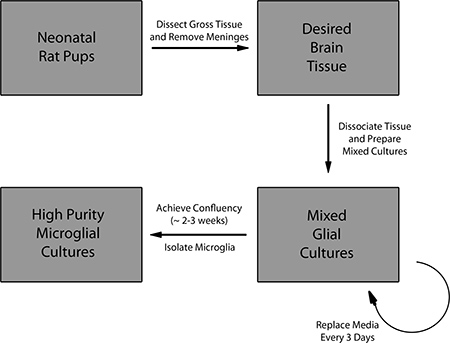
Рисунок 1. Обзор протокола для подготовки смешанных культурах клеток глии и изоляции первичной микроглии.
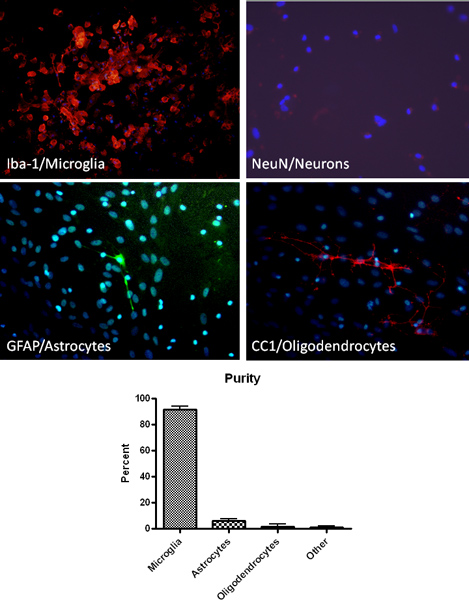
Рисунок 2. Изоляция высокой чистоты микроглии, что подтверждается иммуногистохимического анализа с использованием микроглии (МБА-1, красный), астроцитов (GFAP, зеленый), нейронов (NeuN, красный) и олигодендроцитов (СС1, красный) специфических маркеров. Окрашивание ДНК клеток в культуре DAPI (синий) также показано на рисунке.
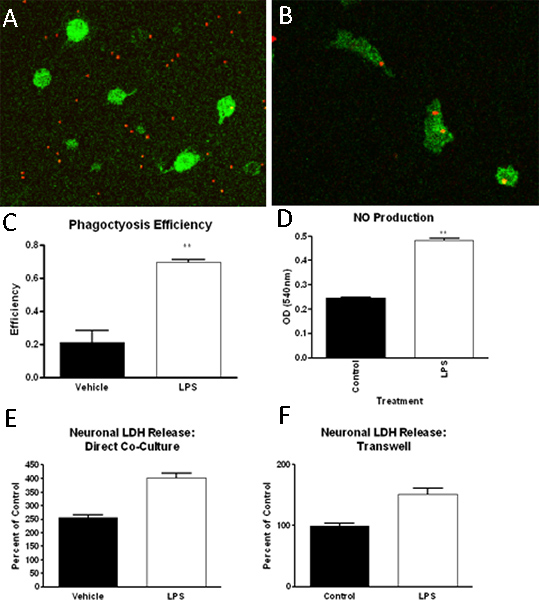
Рисунок 3. Микроглия изолированы в методе ОПИСАНИЕкровати были использованы в ряде тестов, в том числе, но не ограничиваясь, фагоцитоз анализы, анализы функции и нейротоксичность исследований. В этих исследованиях мы обнаружили, что микроглии (МБА-1 позитивное, зеленый), при воздействии на управление (A) или LPS (B) рассматривается средствами массовой информации, повышение их фагоцитоз флуоресцентно меченных бисером латекса (красные), которые можно количественно ( C). Кроме того, ЛПС (1ng/ml) лечение может увеличить производство азотной окиси в микроглии (D). Наконец, как через Transwell вставки разделенных или прямой микроглии-нейронных культур, мы обнаружили, что микроглии инкубируют с LPS может вызывать гибель нейронов, как измеряется лактатдегидрогеназы (ЛДГ), выпуск (E, F).
Обсуждение
В то время как этот протокол обычно используется для получения чистого и здорового микроглии для научных экспериментов, тщательного изучения технических аспектов в критических частях процедура позволит свести к минимуму различия в изолированных микроглии. Во-первых, во время рассеч?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Финансируется очной программы в силовых университета Services.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
| 60 мм х 15 мм чашки Петри | Фишер бренда | 0875713A | |
| Sharp рассечение ножницами | Изобразительных средств наук | 14094-11 | |
| Дюмон # 7b щипцы стандарта советы, изогнутые, 11см | Изобразительных средств наук | 11270-20 | |
| Дюмон # 5 щипцы стандарта советы, прямой, 11 см | Изобразительных средств наук | 11251-10 | |
| 50 мл конические пробирки | VWR | 89039-656 | |
| 5 мл серологических пипеток | Гренье Био один | 606180 | |
| 10 мл серологических пипеток | Гренье Био один | 607180 | |
| 100 мкм стерильный фильтр клетки нейлона | Сокол | 35-2360 | |
| 75 см 2 колбах культуры тканей | Гранулирование | 430641 | |
| Минимальный необходимый Дульбекко среде (DMEM) | Гибко (Invitrogen) | 31053-028 | |
| L-15 Лейбовиц в среду | Гибко (Invitrogen) | 11415064 | |
| Эмбриональной телячьей сыворотки | Гибко (Invitrogen) | 16000-036 | |
| Плод лошадей сыворотки | Рыбак | SH3007402 | |
| Пенициллин, стрептомицин | Гибко (Invitrogen) | 15140163 | |
| 100% этанола | Компания Warner Грэм | 64-17-5 | |
| Фосфатный буферный солевой раствор, 10X, рН 7,4 | Качество биологических, вкл. | 119-069-131 | 1X в стерильной дистиллированной воды |
| Biohazard сумки | VWR | 14220-028 | |
| Гемоцитометра | Хауссер Научные | 1492 | |
| 6-и клеточных культур пластин с поверхностью cellBIND | Гранулирование | 3335 |
Ссылки
- Ransohoff, R. M., Perry, V. H. Microglial physiology: unique stimuli, specialized responses. Annu. Rev. Immunol. 27, 119-145 (2009).
- Raivich, G., Bohatschek, M., Kloss, C. U., Werner, A., Jones, L. L., Kreutzberg, G. W. Neuroglial activation repertoire in the injured brain: graded response, molecular mechanisms and cues to physiological function. Brain Res. Brain Res. Rev. 30, 77-105 (1999).
- Loane, D. J., Byrnes, K. R. Role of microglia in neurotrauma. Neurotherapeutics. 7, 245-265 (2010).
- Glass, C. K., Saijo, K., Winner, B., Marchetto, M. C., Gage, F. H. Mechanisms underlying inflammation in neurodegeneration. Cell. 140, 918-934 (2010).
- Pocock, J. M., Liddle, A. C. Microglial signalling cascades in neurodegenerative disease. Prog. Brain Res. 132, 555-565 (2001).
- Block, M. L., Hong, J. S. Chronic microglial activation and progressive dopaminergic neurotoxicity. Biochem. Soc. Trans. 35, 1127-1132 (2007).
- Barger, S. W., Basile, A. S. Activation of microglia by secreted amyloid percursor protein evokes release of glutamate by cystine exchange and attenuates synpatic function. J. Neurochem. 76, 846-854 (2001).
- Ni, M., Aschner, M. Neonatal rat primary microglia: isolation, culturing, and selected applications. Curr. Protoc. Toxicol. Chapter 12, Unit 12.17 (2010).
- Hassan, N. F., Rifat, S., Campbell, D. E., McCawley, L. J., Douglas, S. D. Isolation and flow cytometric characterization of newborn mouse brain-derived microglia maintained in vitro. J. Leukoc. Biol. 50, 86-92 (1991).
- Hassan, N. F., Prakash, K., Chehimi, J., McCawley, L. J., Douglas, S. D. Isolation and characterization of newborn rabbit brain-derived microglia. Clin. Immunol. Immunopathol. 59, 426-435 (1991).
- Hassan, N. F., Campbell, D. E., Rifat, S., Douglas, S. D. Isolation and characterization of human fetal brain-derived microglia in in vitro culture. Neuroscience. 41, 149-158 (1991).
- Frank, M. G., Wieseler-Frank, J. L., Watkins, L. R., Maier, S. F. Rapid isolation of highly enriched and quiescent microglia from adult rat hippocampus: immunophenotypic and functional characteristics. J. Neurosci. Methods. 151, 121-130 (2006).
- Byrnes, K. R., Stoica, B., Loane, D. J., Riccio, A., Davis, M. I., Faden, A. I. Metabotropic glutamate receptor 5 activation inhibits microglial associated inflammation and neurotoxicity. Glia. 57, 550-560 (2009).
- Loane, D. J., Stoica, B. A., Pajoohesh-Ganji, A., Byrnes, K. R., Faden, A. I. Activation of metabotropic glutamate receptor 5 modulates microglial reactivity and neurotoxicity by inhibiting NADPH oxidase. J. Biol. Chem. 284, 15629-15639 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены