A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
والثقافة الخلية العصبية الأولية نظام لدراسة فيروس العقبول البسيط الكمون وإعادة تنشيط
In This Article
Summary
بروتوكول يصف نظام فعال وقابلة للتكرار نموذج لدراسة فيروس الهربس البسيط نوع 1 (HSV-1) الكمون وتنشيط. الفحص توظف متجانسة الثقافات الخلايا العصبية متعاطف، ويسمح للتشريح الجزيئية للفيروس الخلايا العصبية التفاعلات باستخدام مجموعة متنوعة من الأدوات بما في ذلك تدخل الجيش الملكي النيبالي والتعبير من البروتينات المؤتلف.
Abstract
فيروس الهربس البسيط نوع 1 (HSV-1) يضع العدوى الكامنة مدى الحياة في الخلايا العصبية الطرفية. هذا خزان كامن هو مصدر الأحداث المتكررة التي تكفل إعادة تنشيط النقل وتسهم في المرض السريري. الأدوية المضادة للفيروسات الحالية لا تؤثر على خزان كامنة وأنه لا توجد لقاحات. في حين أن تفاصيل الجزيئي للتكرار التحللي هي جيدة تتميز، وآليات السيطرة على كمون في الخلايا العصبية لا تزال بعيدة المنال. مشتق من فهمنا الحالي للكمون من الدراسات المجراة في استخدام النماذج الحيوانية الصغيرة، التي لا غنى عنها لتحديد الاحتياجات الجينات الفيروسية ودور الاستجابات المناعية. ومع ذلك، فإنه من المستحيل التمييز بين آثار محددة على علاقة الفيروسات الخلايا العصبية من عواقب وأعم من العدوى بوساطة خلايا المناعة أو الدعم غير العصبية في الحيوانات الحية. وبالإضافة إلى ذلك، التجارب على الحيوانات غير مكلفة، وتستغرق وقتا طويلا، ومحدودة من حيث الخيارات المتاحة لمعالجة مضيفالعمليات. للتغلب على هذه القيود، وهناك حاجة ماسة إلى نظام الخلايا العصبية فقط أن يستنسخ في خصائص الجسم الحي من الكمون وإعادة تنشيط لكنه لم يقدم فوائد زراعة الأنسجة من حيث التجانس وسهولة الوصول إليها.
نحن هنا يقدم في المختبر باستخدام نموذج مثقف الخلايا العصبية متعاطف الأولية من العقد الفئران عنق الرحم متفوقة (SCG) (الشكل 1) لدراسة HSV-1 الكمون وتنشيط يلائم معظم إن لم يكن كل من المعايير المطلوبة. بعد القضاء على الخلايا غير العصبية، يصاب شبه متجانسة TrkA + الثقافات الخلايا العصبية مع HSV-1 في وجود الأسيكلوفير (ACV) لقمع تكرار التحللي. التالية ACV إزالة، غير منتجة HSV-1 الإصابات التي تعرض بأمانة وضعت بصمات بكفاءة مقبولة من الكمون. والجدير بالذكر أن mRNAs التحللي، والبروتينات، والفيروسات المعدية تصبح غير قابلة للكشف، حتى في حالة عدم وجود اختيار، ولكن استتار المصاحب لنص (LAT) صريحةايون استمرت في نوى الخلايا العصبية. تتم المحافظة على الجينوم الفيروسي في عدد نسخة من متوسط 25 في الخلايا العصبية، ويمكن أن يكون ذلك حافزا لتكرار منتجة عن طريق التداخل مع PI3-كيناز / AKT إشارات أو انسحاب بسيط من عامل نمو الأعصاب 1. والمؤتلف HSV-1 EGFP ترميز تنصهر في Us11 بروتين فيروسي التحللي يوفر وظيفية، في الوقت الحقيقي وعلامة للحصول على النسخ الناتجة عن إعادة تنشيط أن كميا بسهولة. بالإضافة إلى العلاج الكيميائي، ويمكن منهجيات الوراثية مثل تسليم الحمض النووي الريبي التدخل أو الجينات النواقل lentiviral تطبيقها بنجاح على نظام السماح للدراسات الآلية التي من الصعب جدا، إن لم يكن مستحيلا، في الحيوانات. وباختصار، فإن SCG المستندة إلى HSV-1 كمون / تنشيط نظام يوفر قوية، وأداة ضرورية لكشف الآليات الجزيئية التي تتحكم في HSV1 الكمون وتنشيط الخلايا العصبية في، لغزا محيرا منذ وقت طويل في علم الفيروسات التي قد تقدم حلا رؤى جديدة لتطوير علاجات جديدة هدف تيكان كامنا خزان هربس.
Protocol
1. العزلة والثقافة من الخلايا العصبية SCG من أجنة الفئران
لتوفير سياق مفيد لفهم هذا البروتوكول، ومناقشة شاملة للأدب في وقت سابق ان وضع أساليب للثقافة العصبية SCG، بما في ذلك أساسا لثقافة SCG في المختبر، ركائز لوحة طلاء، ومكونات مصل الدم خالية من وسائل الإعلام، فإن ويشار إلى القارئ إلى مراجع 2-4.
- وقد أجريت على استخدام الفئران كمصدر للخلايا العصبية SCG فقا للمبادئ التوجيهية المعاهد الوطنية للصحة في إطار بروتوكول النشطة التي وافق عليها رعاية الحيوانات المؤسسي واستخدام لجنة (IACUC).
- قبل الشروع في تشريح، وإعداد الكولاجين وlaminin مطلي 96 زراعة الأنسجة أطباق جيدا. باستخدام جهاز pipetting متعدد القنوات، وملء جميع الآبار 96 مع محلول يحتوي على 0.66 ملغ / مل الكولاجين ذيل جرذ. على الفور بإزالة الكولاجين، والتي يمكن استردادها واستخدامها لمدة تصل إلى 8 التشريح. بعد إزالة تيهو الكولاجين، من المهم جدا للسماح للالآبار الجافة تحت غطاء محرك السيارة تدفق رقائقي. مقدار الوقت الذي يستغرقه لتجف يعتمد على عدد من الآبار في الصحن. على سبيل المثال، فإنه عادة ما يستغرق 5-10 دقيقة تقريبا. للآبار في صحن 96 جيد لتجف، ولكن يمكن أن يستغرق فترة تصل الى 30-40 دقيقة إذا تم استخدام أكبر بتنسيق 24 طبق بشكل جيد. فشل لتجف بشكل صحيح نتائج الآبار في المرفق SCG الفقراء. ثم كرر هذا الإجراء باستخدام محلول من 2 ميكروغرام / مل laminin. احتضان الحل laminin من لا يقل عن 2 ساعة على 37 درجة مئوية في حاضنة CO 2 مرطب حتى كنت على استعداد لوحة الخلايا العصبية الخاصة بك (خطوة 1.14).
- يصرح باستخدامها في الحصول عليها تجاريا إناث الفئران الحوامل باستخدام CO 2. بعد رش جيفة مع الايثانول 70٪، يتم إجراء شق على شكل حرف U حول البطن. بعد تقشير البشرة مرة أخرى، يتم في الثانية على شكل حرف U شق من خلال جدار عضلات البطن. الرحم مرئيا على رفع تصل طبقة عضلات البطن. إزالة الرحم ويحدث في 15 الطول طبق. فتح الرحم بعناية باستخدام مقص حادة لتجنب إتلاف الجراء داخل. يجب الإفراج عن كل كيس من الجرو لها الجنينية، وقطعت الحبل السري، والجرو محو النظيفة مع الايثانول 70٪ وKimwipes.
- يعمل في غطاء محرك السيارة تشريح، تضحية الذين لم يولدوا بعد الفئران الوليدة E21 بواسطة قص الرأس عن الجذع. تهدف المقص عند قاعدة العنق، وذلك فوق الكتفين. للكشف عن العقد، دبوس في اسفل الرأس (الرقبة من جانب متابعة) باستخدام الإبر G 23 في ثلاثة مواقع: أ) النخاع الشوكي؛ الثاني) الجلد الأمامي مرفوعتين فوق الأنف ودبس، والثالث) يجب أن تكون معلقة المريء / القصبة الهوائية بعيدا من قاعدة العنق.
- بحث عن * SCG 2 وضعه على جانبي والتشعب الشريان السباتي (2 SCGs في جنين). يقع SCG فقط تحت الفرع. فصل SCG من الشرايين عن طريق سحب والتشعب بعيدا. وضع العقد في 12 مل من وسائل الاعلام-L15 (تستكمل مع 0.4٪ D (+)-الجلوكوز) في أنبوب 15 مل مخروطي الشكل على الجليد.
ق ق = "jove_content"> * وSCG غير شفاف عديم اللون وبالمقارنة مع مبهمة، والأنسجة الدهنية التي تحيط مصفر والتشعب. في محاولة لإزالة أكبر قدر من الأوعية الدموية والأنسجة الدهنية المتبقية، قبل جمع العقد.
- كرر 1.4 و 1.5 حتى يتم حصاد كل SCGs من الأجنة.
- منبذة بلطف العقد لمدة 1 دقيقة بمعدل 600 دورة في الدقيقة، ونضح وسائل الإعلام الزائدة.
- Resuspend على العقد في 1 مل من L15 وسائل الإعلام التي تحتوي على التربسين (0.25٪، من دون EDTA) وكولاجيناز (1 ملغ / مل). احتضان لمدة 30 دقيقة عند 37 درجة مئوية، وتستنهض الهمم كل 10 دقيقة.
- إضافة 10 مل من C-وسائل الاعلام (1X MEM، 0.4٪ D (+)-الجلوكوز، 2 مم L-الجلوتامين، FBS 10٪) لإبطال نشاط التربسين وأجهزة الطرد المركزي لمدة 1 دقيقة بمعدل 600 دورة في الدقيقة.
- إزالة أكبر قدر من وسائل الإعلام التربسين / كولاجيناز كما * ممكن، ويغسل العقد مع 10ML من C-وسائل الاعلام. الطرد المركزي ل1 دقيقة بمعدل 600 دورة في الدقيقة. كرر هذه الخطوة مرة واحدة.
* سوف كولاجيناز المتبقية interfeاعادة مع الركيزة الكولاجين اللازمة لمرفق الخلية على لوحة الثقافة.
- إزالة وسائل الاعلام غسيل وإعادة تعليق العقد في 1 مل من C-وسائل الإعلام ويسحن باستخدام 21 إبرة G تعلق على حقنة 5 مل إلى فصل كتل كبيرة من الخلايا *. الانتهاء من triturating مع إبرة G 23 حتى كتل مرئية فصلها.
* احرص على عدم متمزج المفرط، حيث سيؤدي ذلك إلى تلف الخلايا. إذا كان التربسين والعلاج كولاجيناز كانت ناجحة، بحد أقصى 15 صعودا وهبوطا مع دورات الإبرة G 21؛ وينبغي أن ثلاث دورات مع إبرة G 23 يكون كافيا.
- تصفية الخلايا العصبية من خلال فصل النايلون 70 ميكرون فلتر [دينار بحريني مصفاة خلية العلوم البيولوجية] إلى أنبوب مخروطي 50 مل لتجاهل أي كتل المتبقية.
- سحب قسامة 10 ميكرولتر من تعليق الخلية التي تمت تصفيتها وتخلط مع أزرق التريبان لتحديد عدد من الخلايا الحية. حساب عدد الخلايا التي يكسكل بنشاطأودي الصبغة باستخدام عدادة الكريات.
- إزالة حل laminin من الأطباق 96 جيد انتظار في الحاضنة 37 درجة مئوية (انظر الخطوة 1.2). لا تجف الطبق، ويمكن استخدامها على الفور الحصول على الخلايا تصفيح مرة تتم إزالة laminin. * الاستغناء 5،000-6،000 مجموع الخلايا الحية (50-100 ميكرولتر لكل بئر) في الكولاجين وlaminin قبل المغلفة 96 زراعة الأنسجة طبق بشكل جيد. وتشمل 50 نانوغرام / مل عامل نمو الأعصاب (NGF) في C-وسائل الاعلام.
* ومن المهم للغاية لتوظيف جيد تقنية زراعة الأنسجة عقيمة لأن يتم حذف المضادات الحيوية من نمو وسائل الإعلام. وبالإضافة إلى ذلك، يمكن أن يكون هناك تنوع كبير بين الكولاجين مصدرها من مختلف الموردين. لقد كان لدينا نتائج متسقة عبر دفعات باستخدام الفئران الكولاجين ذيل من ميليبور.
- في DIV (يوم في المختبر) 1، يستعاض عن C-الوسائط المستخدمة في لوحة الخلايا مع 50 NBM ميكروليتر (0.4٪ D (+) - الجلوكوز، 2 مم L-الجلوتامين، B-27 الملحق يحتوي على 50 نانوغرام / مل نيسان الخليج، 5aphidicolin ميكرومتر ميكرومتر و 20 5 فلورويوراسيل [5-الفلورية 2'-deoxyuridine]. احتضان الثقافات لمدة 5 أيام *. عند هذه النقطة، يمكن trypsinizing والعد الخلايا المتبقية في العديد من الآبار تحديد عدد الخلايا العصبية على قيد الحياة لعلاج وكيل المضادة للالإنقسامية. عادة، ما يقرب من 1،000 الخلايا العصبية تظل لكل بئر في لوحة 96 أيضا.
* مشاكل تلوث فطرية أو جرثومية وعادة ما تكون واضحة في أول 24 ساعة من ثقافة. فحص كل بئر بعناية لنمو الجراثيم قبل وسائل الإعلام إلى استبدال الطلاء. إذا تتأثر سوى عدد محدود من الآبار، ويمكن التعامل معها مع حل التبييض المخفف، تشطف وتجفف مع برنامج تلفزيوني من أجل المضي قدما في التجربة. نوصي تكرار أي تجربة فيها حتى لعدد محدود من الآبار وكان التلوث الميكروبي. إذا لوحظ واسعة التلوث الميكروبي في الصحن 96 جيد، لا بد من انتهاء التجربة.
2. عدوى من SCG عبادةالقوام مع HSV-1-EGFP Us11 وإنشاء الإختفاء
عن خلفية مفيدة حول التقنيات الفيروسية، بما في ذلك انتشار فيروس الأساسية، وتحديد عيار الفيروس، وتعدد العدوى (وزارة الداخلية)، وعلى القارئ الرجوع إلى مرجع 5. لمناقشة البيولوجيا هربس، وعلى القارئ الرجوع إلى مرجع 6. أخيرا، وعلى القارئ الرجوع إلى المراجع 7-10 للاطلاع على أمثلة سابقة، والبروتوكولات الأخرى، وخلفية إضافية بشأن ألفا عدوى هربس التحللي من الخلايا العصبية SCG وللمقارنة مع تعديلات بروتوكول لدينا لدراسة وإعادة تنشيط كمون.
- في DIV 6، إضافة الأسيكلوفير (ACV)، نهائي تركيز 100 ميكرون الى وسائل الاعلام الموجودة في كل * جيدا. على سبيل المثال، إذا كان يحتوي على كل من 50 ميكرولتر، إضافة 25 ميكرولتر من مخزون ميكرومتر ACV 300. عادة، يتم إضافة ACV الليلة قبل الإصابة، ولكن يمكن أيضا أن يضاف 6-8 ساعة قبل العدوى.
* ومن السابقمهم للحد من التلاعب ceedingly الجسدية لا لزوم لها من الخلايا العصبية في جميع الأوقات. ويجب أن يتم إزالة ببساطة واستبدال وسائل الإعلام أو إصابة مع مخزونات فيروس بلطف جدا، وببطء. خلاف ذلك، يمكن للضغط الناجم الميكانيكية تؤثر سلبا على سلامة الخلايا العصبية.
- في DIV 7، تصيب الثقافات SCG مع HSV-1-EGFP Us11 (الموصوفة في المرجع 11) في عدد وافر من العدوى (وزارة الداخلية) في الفترة بين 1 -2 (انظر التعليق أدناه على تحديد مهمة وزارة الداخلية الأمثل) *. إضافة الفيروس المخفف مباشرة الى وسائل الاعلام الموجودة في البئر. وتشمل مراقبة وهمية المصابة، والسيطرة على العدوى التحللي ايجابية في وسائل الإعلام التي تفتقر إلى ACV. السماح للعدوى والمضي قدما لمدة 2-3 ساعة عند 37 درجة مئوية.
* يتم احتساب وزارة الداخلية باستخدام عيار فيروس تحدد عن طريق إجراء فحص لوحة في خلايا فيرو (12) وعدد من الخلايا، مطلي الحية المصنف لكل بئر في خطوة 1.14. هذا الحساب مفيد فقط بالمعنى التشغيلية،كما أن عدد الخلايا مجموع المصنف يحتوي على الخلايا العصبية مع الدبقية تلويث، والخلايا الليفية. كما يتم قتل هذه الخلايا تلويث الفاصل عن طريق العلاج بالأدوية المضادة للالإنقسامية وكلاء وزارة الداخلية لفعالية الخلايا العصبية على قيد الحياة هو في الواقع أكبر. من الكمية الأولية ابتداء من 5000 - 6000 الخلايا الحية، ما يقرب من 1،000 الخلايا العصبية تبقى بعد معالجة المضادة للالإنقسامية وكلاء (وفقا لتقييم العد الخلية trypsinizing ومباشرة). يمكن أن أمثل وزارة الداخلية لاستخدامها عند اصابة الخلايا العصبية الثقافات تختلف نوعا ما من أحد فيروس إعداد الأوراق المالية إلى أخرى. مع كل إعداد جديدة من الفيروس، ونحن ننصح باختبار مجموعة محدودة من وزارة الداخلية مختلفة من 1 إلى 2. الهدف هنا هو التعرف على واحد يحتوي على الأقل على بقاء الخلايا العصبية الآثار والنتائج في أكبر عدد من الفعاليات إحياء محرض (المحددة في الفقرة 3). الفيروس Us11-EGFP هي مفيدة بشكل خاص في تحسين الظروف بسرعة ولكن واحدة يمكن استخدامها أيضا قراءات أخرى مثل فحص لوحة أو quantitative PCR. ومما قد يساعد على استخدام فيروس تنقيته من خلال وسادة السكروز لإزالة الشوائب التي تقلل من بقاء الخلية، رغم أن هذا ليس ضروريا وليس إجراء روتيني.
- بعناية تحل محل وسائل الإعلام مع عدوى NBM جديد يحتوي على 50 نانوغرام / مل و 100 NGF * ACV ميكرومتر.
* ومن المهم جدا أن يكون لطيف للغاية عند تغيير وسائل الإعلام عدوى. تهدف غيض من ماصة في جدار البئر وليس في قاع البئر، والسماح لوسائل الإعلام إلى الشريحة بلطف إلى أسفل على الخلايا. ويمكن حتى طرد سريع من وسائل الاعلام من ماصة توليد قوة كافية لفصل محاور عصبية من الركيزة ويسبب الخلايا لتنصل من عادة باعتباره ورقة من الخلايا. إلا إذا كان عدد محدود من الخلايا العصبية فصل (20-30٪)، فإن العواقب تكون أدنى شريطة أن تظهر الخلايا السليمة. الخلايا العصبية المنفصلة من المرجح أن أعد أكثر من مرة، ومع ذلك، لم يعد من محاور عصبية تمدد لطيف 1وسوف د محاور عصبية جديدة تنمو. في حين ليس الأمثل، ويمكن للتجربة والمضي قدما إذا تتأثر سوى عدد محدود من الآبار. إذا كان هناك انفصال واسعة من الخلايا العصبية (70-80٪)، نحن لا نوصي بما في ذلك البئر المتضررة (ق) في التجربة. إذا كان معظم الآبار تحتوي على الخلايا العصبية المنفصلة 70-80٪، ونحن نوصي إنهاء التجربة. في حين أن الخلايا العصبية قد أعد لا يزال، فإنها عادة ما سوف تشكل كتل كبيرة. يعقد هذا التقييم السليم للفرد الخلايا العصبية تنشيط. نوصي تكرار أي تجربة حيث لوحظت الآبار مع الخلايا العصبية منفصلة لضمان عدم تأثر معدلات تنشيط التزام من قبل فرق من الخلايا العصبية للآبار.
وبالإضافة إلى ذلك، من المهم جدا للتعامل مع الثقافات كما دائما بلطف وربما. إجهاد من الحركات، لا لزوم لها مفاجئ (بما في ذلك فتح وإغلاق متكررة من باب غرفة الحاضنة) أو بالقوة وسائل الاعلام ج تطبيقحل وسط ولد في قدرة الثقافات لدعم HSV-1 كمون، وربما أدى إلى ارتفاع معدلات غير مقبولة من تنشيط عفوية في تجربة معينة.
- المحافظة على الثقافات لمدة 6 أيام وخلال هذه الفترة الفيروس ستنشئ كمون. خلال هذه الفترة، واستخدام المجهر الفلورسنت لرصد الخلايا العصبية الصحة والتعبير Us11-EGFP كمؤشر على تكرار التحللي. يجب أن يتم الكشف Us11-EGFP فقط في مراقبة الآبار التي تفتقر ACV العلاج، مشيرا إلى العدوى الأولية الناجحة وتكرارها التحللي الإنتاجية. قد تظهر آثار الاعتلال الخلوي الخلايا العصبية حتى في غياب النمو الفيروسي الإنتاجية. وينبغي للثقافات المصابين عن كثب وبالمقارنة مع وهمية المصابة الخلايا العصبية.
3. تنشيط والتقييم
- في DIV 14، استبدال بعناية وسائل الإعلام التي تحتوي على ACV مع وسائل الإعلام الجديدة التي تفتقر إلى ACV. إذا كان ذلك مناسبا، وتشمل الدوائية (أو البيولوجية) المتغيرات في هذا الوقت. أن تكون الصورةلدى عودتهم إلى اتباع الاحتياطات المنصوص عليها في 2.3.
- على مدى فترة يوم 5-6، ورصد الثقافات الحية باستخدام مجهر نيون للكشف عن الخلايا العصبية التي تمر تنشيط. وبدلا من جمع عينات لأنواع أخرى من التحليلات (البروتين، والأحماض النووية، لوحة فحص الخ).
- حساب تواتر تنشيط عن طريق حساب عدد من الآبار التي تحتوي على EGFP إيجابية الخلايا العصبية والتعبير عن هذا كنسبة من إجمالي عدد الآبار عينة. لاحظ أن التعبير EGFP في الفرد كذلك لا يميز بين هذا الحدث تنشيط الابتدائية وعدوى لاحقة نظرا لانتشار الفيروس. منذ يرد انتشار العدوى إلى ثقافة واحدة أيضا، ويعرف من الناحية التشغيلية واحد أو أكثر EGFP إيجابية في الخلايا العصبية وكذلك حالة تنشيط واحدة تحت هذه الظروف.
* يمكن تنشيط أحداث متعددة تحدث في الثقافة، كما هو موضح في 1. لتمييز حدث تنشيط الأولية من انتشار فيروس الناتجة عن راكوشبالوتاي tivation، يمكن إضافة المانع encapsidation اتجاه و150138. من خلال منع encapsidation، لا تنتج فيروس المعدية وانتشار الناتجة عن تنشيط أمر غير ممكن. وهكذا، فإن إشارة EGFP الكشف في ظل وجود 150138-WAY يعكس عدد من الفعاليات إحياء مستقل ضمن ثقافة أحرق 1،13-15 جيدا. نلاحظ أن اتجاه و150138 فعالة فقط ضد السلالة HSV-1 باتون وغير متوفرة تجاريا. كبديل ل150138 الاتجاه، النظر في استخدام أي من الأمور التالية: أ) ويمكن استخدام فيروس متحولة ضعف في قدرتها على الانتشار إلى الخلايا المجاورة؛ الثاني) فيروس مراسل حيث يتم التعبير عن EGFP من المروج آي إي في وجود مستمر من ACV؛ الثالث) العلاج مع PAA ACV أو لمنع التعبير الجيني في وقت متأخر (والمعدية إنتاج فيروس)، يليه المناعي الأجسام المضادة الموجهة ضد استخدام منتج الجين IE.
4. وسائل بديلة لتقييم إعادة تنشيط باستخدام الفحص
وينبغي الحصول على ontent "> النتائج من تجربة، فرد واحد من إعداد واحدة من SCG. لا يمكن أن يؤديها التجارب النسخ المتماثل مع الاستعدادات SCG مستقل طالما جرى تكرار استخدام كل دفعة SCG واحدة.- تقييم النصوص HSV-1 التحللي. جمع الجيش الملكي النيبالي في الأوقات المطلوبة بعد إزالة ACV في وجود أو عدم وجود محرضات التجريبية المختلفة لتنشيط. عند استخدام 96 لوحات ثقافة جيدة، ونحن نوصي تجميع ما لا يقل عن 20 بئرا معا من أجل كل عينة (حوالي 10 5 خلايا لكل عينة الحمض النووي الريبي). بدلا من ذلك، يمكن مطلي SCGs في جو من الآبار (مثلا لوحة 24 جيد، واستخدام 4-5 X10 4 خلايا / جيد). في حين أنه من المؤكد أن من الممكن الكشف عن الحمض النووي الريبي من أقل من 20 بئرا، وكميات صغيرة نتيجة المشاركة في تقلب عينة إلى عينة لا مبرر له.
- الكشف عن البروتينات HSV-1 التحللي. جمع lysates في الوقت المطلوب بعد تحريض تنشيط. إضافة 7،5 ميكرولتر من العازلة تحلل على كل من 10 ثells في لوحة 96 جيدا وتحليلها بواسطة SDS-PAGE وimmunoblotting. بدلا من ذلك، يمكن الكشف عن البروتينات الفيروسية بواسطة الفحص المجهري التألق المناعي غير المباشر. ويجب أن يتم طلي الأولية على ركيزة ركوب للتصوير مثل ساترة زجاجية معقمة التي كانت قبل المغلفة مع البولي-D-يسين (0.2 ملغ / مل، سيجما) قبل تقديم الطلب من الكولاجين وlaminin (انظر 1.10) .
- الكشف عن جزيئات معدية. جمع طاف على تنشيط الثقافة. إجراء فحص لوحة على monolayers من خلايا فيرو باستخدام التخفيفات التسلسلي للطاف. وبالإضافة إلى ذلك، يمكن إجراء فحوصات لوحة باستخدام lysates الثقافات التجميد لتشمل إذابة الخلايا المرتبطة بها الجسيمات لتحديد عيار.
5. ممثل النتائج
ويوضح الشكل 2A على سبيل المثال حيث 1 trichostatin ميكرومتر A (TSA)، محفز معروف من تنشيط 16-18، يتم تطبيقها على SCG الثقافات إصابة خفية مع H من النوع البريSV1 سلالة مراسل EGFP-Us11. مع إدارة أمن النقل، إعادة تنشيط تصل إلى 50٪ من الحد الأقصى في غضون أيام 2، وبنسبة 5 أيام الهضاب تنشيط حوالي 60٪ من الآبار. خط الأساس ('عفوية') تنشيط ما يقرب من 10٪ في هذه التجربة، ويتراوح عادة من 10-20٪ باستخدام هذا النظام في المختبر. مستويات تنشيط أقصى تختلف تبعا الذي يستخدم محفز تنشيط. ويمكن تطبيق العديد من المحرضات تنشيط لمدة التجربة لأنها لا تتداخل مع تكاثر الفيروس الإنتاجية، ولكن هذا يحتاج إلى أن تحدد تجريبيا. قد محرضات أخرى، بما في ذلك أي كاشف يؤثر على بقاء الخلايا العصبية أو يعوق اكتمال دورة الحياة الإنتاجية الفيروسية، ويتطلب تطبيق نبض عابر لاستفزاز تنشيط.
في حين تراكم EGFP-Us11 في كل بئر من هذه التجربة في تصور الشكل 2A يدل على تنشيط من الكمون، وأنه لا يميز ما إذا كانمشتق Us11-EGFP إشارة في الخلايا العصبية الفردية من حدث تنشيط مستقل، أو انتشار فيروس من خلال تنشيط الثقافة. لتقييم عدد من الخلايا العصبية التي تمر أحداث تنشيط مستقل في كل بئر، والثقافات معالجة مسبقة مع 150138 الاتجاه، وهو مركب يمنع انتشار الفيروس على وجه التحديد من خلال منع encapsidation من الحمض النووي الفيروسي الجينوم 13-15. تم علاج المصابين الثقافات الخلايا العصبية متعاطف مع 150138 الطريق وتنشيط يسببها مع إدارة أمن النقل. فقط تم الكشف عن أعداد كبيرة من الخلايا العصبية EGFP إيجابية في الآبار TSA المعاملة، مقارنة مع الثقافات سيطرة DMSO المعالجة، مما يدل على أن عددا من الفعاليات إحياء المستقلة تحدث في ثقافة الفرد (الشكل 2B).
في مقايسة لدينا، وأعرب عن الصحفي Us11-EGFP من المروج Us11 الذاتية 11. منذ Us11 هو "صحيح في وقت متأخر" أو γ 2 التحللي الجين الفيروسي، ومطلوب الفيروسية تكرار الحمض النووي لexpressi قويفي. ويتضح هذا في الشكل (3)، كما هو اعاقة EGFP-Us11 تراكم من بوليميريز الحمض النووي الفيروسي حامض phosphonoacetic المانع (PAA) في الثقافات التي يسببها لإعادة تنشيط مع LY294002 المانع PI3-كيناز.
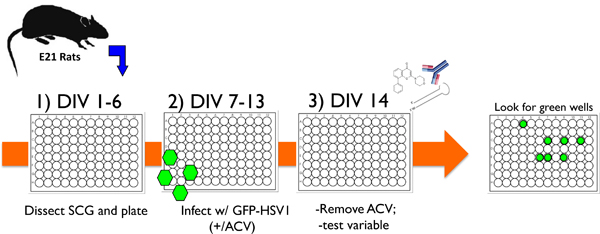
الشكل 1. تخطيطي يوضح بروتوكول نموذجي تجريبي باستخدام الخلايا العصبية مثقف في المختبر لدراسة نظام HSV-1 الكمون وتنشيط. 1) بعد تشريح العقد عنق الرحم متفوقة (SCG) من E21 الفئران، ومطلي الخلايا العصبية فصلها في 96 أطباق جيدا، وتعامل مع الإنقسامية المضادة لل وكلاء لإزالة الخلايا غير العصبية. 2) بعد 6 أيام في المختبر (DIV) مصابون الثقافات مع المؤتلف HSV-1 الذي يحتوي على EGFP تنصهر لهذا الجين Us11 الفيروسات المشفرة في وقت متأخر (EGFP-HSV-1) في حضور الأسيكلوفير (ACV) المخدرات 1، المضادة للفيروسات التي كتل تكرار التحللي. 3) بحلول يوم 14 (DIV 14)، تتم إزالة الأسيكلوفير وEGFP التعبير عنلم يتم الكشف عن. ويمكن الحفاظ على الثقافات ثابت على هذا النحو لمدة 1 شهر أو أكثر، أو يمكن إضافة متغير اختبار لتقييم قدرتها على تنشيط استفزاز من الكمون. يمكن أن يكون المتغير في شكل جزيئات كيميائية صغيرة المانع، وهو جسم مضاد ضد neurotrophin قابل للذوبان أو خلية بروتين السطح، أو التعبير عن الفيروسة البطيئة 1 إما shRNA جينة معينة أو بروتين أعرب ectopically. ويتم رصد ثم تنشيط بتسجيله EGFP إيجابية الآبار في الوقت الحقيقي.
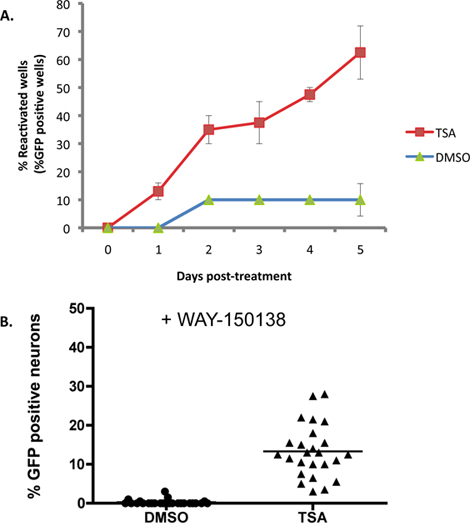
الشكل 2. TSA ينشط HSV-1 في الثقافات SCG. أصيبوا خفية الثقافات SCG كما هو موضح في الشكل رقم 1. في DIV 14، تمت إزالة ACV واستبدالها مع وسائل الإعلام التي تحتوي على 1 ميكرومتر trichostatin A. (TSA) (أ) تم تصور والثقافات وسجل باستخدام المجهر مضان كل يوم بعد العلاج من تعاطي المخدرات لمدة 5 أيام. النسبة المئوية من الآبار التي تمر reactivatويظهر أيون على مدار التجربة مقارنة مع الثقافات مراقبة المعالجة DMSO. تم احتساب النسبة المئوية للتنشيط من قبل عدد من EGFP إيجابية آبار من أصل 20 بئرا من 96 لوحة الثقافة أيضا. أشرطة الخطأ تشير إلى الخطأ المعياري للمتوسط. (ب) تم علاج المصابين الثقافات خفية مع إدارة أمن النقل ومثبط لencapsidation الحمض النووي الفيروسي، وسيلة، 150138 (20 ميكروغرام / مل). وبالمقارنة مع عدد الخلايا العصبية EGFP + 48 ساعة بعد العلاج بالأدوية لسيطرة تعامل مع DMSO وطريقة 150138. كل نقطة بيانات يمثل نسبة الخلايا العصبية + EGFP من أصل 1000 الخلايا العصبية في ثقافة أيضا. شريط يظهر متوسط النسبة المئوية للEGFP + الخلايا العصبية في بئر.
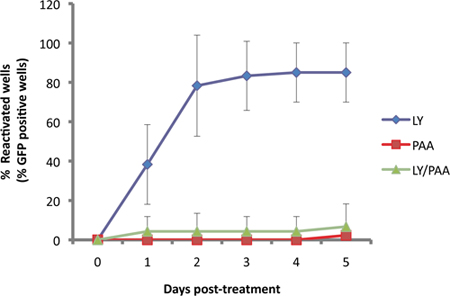
الشكل 3. EGFP detecion يعتمد على تكرار الحمض النووي الفيروسي. الثقافات SCG أصيبوا خفية ثم تعامل مع 10 ميكرون من LY29004، محفز معروف من تنشيط 1. تنشيط الناجمة عن LY (الأزرق) واق مقارنة بتلك تعامل مع الحمض النووي الفيروسي المانع التوليف، حامض phophonoacetic، PAA (300μg/ml، أحمر) والمركبين معا (الخضراء).
Discussion
هذه الثقافة الخلايا العصبية الأولية ونظام عدوى يوفر طريقة بسيطة وفعالة لاستكشاف الآليات الجزيئية الكامنة وراء HSV-1 الكمون وتنشيط. نظام يلخص بأمانة بصمات المقبولة من الكمون المحددة في كل من الإصابات البشرية والحيوانات الحية من النماذج. عندما يكون الفيروس كا...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
نشكر المقيمين على اقتراحاتهم مدروس التي ساعدت على تحسين هذه المخطوطة. وأيد هذا العمل من قبل المنح لMVC (NS21072، HD23315)، ACW (GM61139، S10RR017970) والدردشة (AI073898، GM056927) من المعاهد الوطنية للصحة. وأيد عضو الكنيست في جزء من منحة تدريب المعاهد الوطنية للصحة (5T32 AI007180).
Materials
| Name | Company | Catalog Number | Comments |
| الكاشف | شركة | كتالوج # | تعليقات |
| 70μm النايلون فلتر (مصفاة الخلية) | العلوم البيولوجية دينار بحريني | 352350 | |
| 1X هانك في محلول ملحي متوازن (HBSS - / -) | إينفيتروجن | 14175 | ث / س CaCl 2 و 2 MgCl |
| 1X وسائل الإعلام الأساسية الدنيا (MEM) | إينفيتروجن | 11095-080 | |
| 5-الفلورية 2'-deoxyuridine | سيغما | F0503 | إعداد الأوراق المالية 20 ملم في MEM 1X؛ مخزن في -20 درجة مئوية |
| 96-جيدا لوحات مسطحة القاع TC جيد | كورنينج | 3599 | |
| الأسيكلوفير | Calbiochem | 114798 | إعداد الأوراق المالية 31 ملم في DMSO؛ مخزن في -20 درجة مئوية |
| Aphidicolin | Calbiochem | 178273 | إعداد الأوراق المالية 10 ملم في DMSO؛ مخزن في -20 درجة مئوية |
| B-27 الملحق | إينفيتروجن | 17504-44 | |
| كولاجيناز | سيغما | C2674 | إعداد 10 ملغ / مل الأوراق المالية في HBSS - / -؛ مخزن في -20 درجة مئوية |
| D-(+)، الجلوكوز | سيغما | G6152 | إعداد الأوراق المالية 40٪ في H 2 O، فلتر تعقيم وتخزين عند 4 درجة مئوية |
| L-الجلوتامين | إينفيتروجن | 25030-081 | |
| Laminin | سيغما | L2020 | إعداد 1 ملغ / مل في الأوراق المالية H 2O؛ السريع تجميد 20 ميكرولترaliquats ومخزن في -80 درجة مئوية. المخفف إلى 2 ميكروغرام / مل اضرب العمل. في عقيم O 2 H |
| Leibovit'z L-15 وسائل الاعلام | إينفيتروجن | 11415 | |
| عامل النمو العصبي | هارلان مختبرات | BT.5017 | تجهيز 50 ميكروغرام / مل الأوراق المالية في HBSS - / -؛ مخزن في -80 درجة مئوية |
| Neurobasal المتوسطة | إينفيتروجن | 12348 | |
| Phosphonoacetic حامض (PAA) | سيغما | P6909 | إعداد 75 ملغ / مل الأوراق المالية في H 2 O، متجر في -20 درجة مئوية |
| بولي-D-يسين هيدروبروميد | سيغما | P0899 | إعداد 20 ملغ / مل الأوراق المالية في H 2 O، متجر في -20 درجة مئوية |
| الجرذ الذيل الكولاجين | ميليبور | 08-115 | تركيز يختلف كثيرا مع العرض؛ مخزن في 4 درجات مئوية، وتمييع إلى 0.66 ملغ / مل اضرب العمل. في عقيم O 2 H |
| Trichostatin A | سيغما | T8552 | 1 إعداد الأوراق المالية ملم في DMSO؛ مخزن في -20 درجة مئوية |
| التربسين 2.5٪ | إينفيتروجن | 15090-04 |
References
- Camarena, V., Kobayashi, M., Kim, J. Y., Roehm, P., Perez, R., Gardner, J., Wilson, A. C., Mohr, I., Chao, M. V. Nature and duration of growth factor signaling through receptor tyrosine kinases regulates HSV-1 latency in neurons. Cell Host & Microbe. 8, 320-330 (2010).
- Johnson, M. I., Fedoroff, S., Richardson, A. Primary cultures of sympathetic ganglia. Protocols for Neural Cell Culture. , 71-94 (2001).
- Letourneau, P. C., Fedoroff, S., Richardson, A. Preparation of substrata for in vitro culture of neurons. Protocols for Neural Cell Culture. , 245-254 (2001).
- Price, J. P., Brewer, G. J., Fedoroff, S., Richardson, A. Serum-free media for neural cell cultures. Protocols for Neural Cell Culture. , 255-264 (2001).
- Flint, S. J., Enquist, L. W., Racaniello, V. R., Skalka, A. M. . Principles of virology. , (2008).
- Roizman, B., Pellett, P. E., Knipe, D. M., Howley, P. M. The family Herpesviridae: A brief introduction. Fields Virology. 2, 2381-2397 (2001).
- Price, R. W., Rubenstein, R., Khan, A. Herpes simplex virus infection of isolated autonomic neurons in culture: viral replication and spread in a neuronal network. Arch. Virol. 71, 127-140 (1982).
- Tomishima, M. J., Enquist, L. W. A conserved alpha-herpesvirus protein necessary for axonal localization of viral membrane proteins. J. Cell Biol. 154, 741-752 (2001).
- Ch'ng, T. H., Flood, E. A., Enquist, L. W. Culturing primary and transformed neuronal cells for studying pseudorabies virus infection. Methods Mol. Biol. 292, 299-316 (2005).
- Wang, F., Tang, W., McGraw, H. M., Bennett, J., Enquist, L. W., Friedman, H. M. Herpes simplex virus type 1 glycoprotein E is required for axonal localization of capsid, tegument, and membrane glycoproteins. J. Virol. 79, 13362-13372 (2005).
- Benboudjema, L., Mulvey, M., Gao, Y., Pimplikar, S. W., Mohr, I. Association of the herpes simplex virus type 1 us11 gene product with the cellular kinesin light-chain-related protein PAT1 results in the redistribution of both polypeptides. J. Virol. 77, 9192-9203 (2003).
- Blaho, J., Morton, E. R., Yedowitz, J. C. Herpes simplex virus: propagation, quantification and storage. Curr. Protoc. Microbiol. Chapter 14, Unit 14E.1 (2005).
- Van Zeijl, M., Fairhurst, J., Jones, T. R., Vernon, S. K., Morin, J., LaRocque, J., Feld, B. L., O'Hara, B. L., Bloom, J. D., Johann, S. V. Novel class of thiourea compounds that inhibit herpes simplex virus type 1 DNA cleavage and encapsidation: resistance maps to the UL6 gene. J. Virol. 74, 9054-9061 (2000).
- Newcomb, W. W., Brown, J. C. Inhibition of herpes simplex virus replication by WAY-150138: assembly of capsids depleted of the portal and terminase proteins involved in DNA encapsidation. J. Virol. 76, 10084-10088 (2002).
- Pesola, J. M., Zhu, J., Knipe, D. M., Coen, D. M. Herpes simplex virus 1 immediate-early and early gene expression during reactivation from latency under conditions that prevent infectious virus production. J. Virol. 79, 4516-14525 (2005).
- Arthur, J. L., Scarpini, C. G., Connor, V., Lachmann, R. H., Tolkovsky, A. M., Efstathiou, S. Herpes simplex virus type 1 promoter activity during latency establishment, maintenance and reactivation in primary dorsal root neurons in vitro. J. Virol. 75, 3885-3895 (2001).
- Danaher, R. J., Jacob, R. J., Steiner, M. R., Allen, W. R., Hill, J. M., Miller, C. S. Histone deacetylase inhibitors induce reactivation of herpes simplex virus type 1 in a latency-associated transcript- independent manner in neuronal cells. J. Neurovirol. 11, 306-317 (2005).
- Terry-Allison, T., Smith, C. A., DeLuca, N. A. Relaxed repression of herpes simplex virus type 1 genomes in murine trigenminal neurons. J. Virol. 71, 12394-12405 (2007).
- Harris, R. A., Preston, C. M. Establishment of latency in vitro by the herpes virus type 1 mutant in1918. J. Gen. Virol. 72, 907-913 (1991).
- Wagner, E. K., Bloom, D. C. Experimental investigation of herpes simplex virus latency. Clin. Microbiol. Rev. 10, 419-443 (1997).
- Strelow, L. I., Laycock, K. A., Jun, P. Y., Rader, K. A., Brady, R. H., Miller, J. K., Pepose, J. S., Leib, D. A. A structural and functional comparison of the latency-associated transcript promoters of herpes simplex virus type 1 strains KOS and McKrae. J. Gen Virol. 75, 2475-2480 (1994).
- Stroop, W. G., Banks, M. C. Herpes simplex virus type 1 strain KOS-63 does not cause acute or recurrent ocular disease and does not reactivate ganglionic latency in vivo. Acta Neuropathol. 87, 14-22 (1994).
- Sawtell, N. M., Poon, D. K., Tansky, C. S., Thompson, R. L. The latent herpes simplex virus type 1 genome copy number in individual neurons is virus strain specific and correlates with reactivation. J. Virol. 72, 5343-5350 (1998).
- Thompson, R. L., Cook, M. L., Devi-Rao, G., Wagner, E. K., Stevens, J. G. Functional and molecular analysis of the avirulent wild-type herpes simplex virus type 1 strain KOS. J. Virol. 58, 203-211 (1986).
- Wilcox, C. L., Smith, R. L., Freed, C. R., Johnson, E. M. Nerve growth factor-dependence of herpes simplex virus latency in peripheral sympathetic and sensory neurons in vitro. J. Neurosci. 10, 1268-1275 (1990).
- Roehm, P. C., Camarena, V., Gardner, J. B., Wilson, A. C., Mohr, I., Chao, M. V. Cultured vestibular ganglion neurons demonstrate latent herpes simplex type I reactivation. Laryngoscope. 121, 2268-2275 (2011).
- Kuhn, M. A., Nayak, S., Camarena, V., Gardner, J., Wilson, A., Mohr, I., Chao, M. V., Roehm, P. C. A cell culture model of facial palsy resulting from reactivation of latent herpes simplex virus type 1. Otology & Neurotology. , (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved