È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
A primaria del sistema cultura Neuron per lo Studio della latenza del virus Herpes Simplex e la riattivazione
In questo articolo
Riepilogo
Il protocollo descrive un sistema modello efficiente e riproducibile per studiare herpes simplex virus di tipo 1 (HSV-1) latenza e riattivazione. Il dosaggio utilizza omogenei culture neurone simpatico e consente la dissezione molecolare del virus-neurone interazioni utilizzando una varietà di strumenti interferenza tra RNA e l'espressione di proteine ricombinanti.
Abstract
Herpes simplex virus di tipo 1 (HSV-1) stabilisce una vita lunga infezione latente nei neuroni periferici. Questo serbatoio latente è la fonte di eventi riattivazione ricorrenti che garantiscono la trasmissione e contribuire alla malattia clinica. Antivirali attuali non influenzano il serbatoio latente e non ci sono vaccini. Mentre i dettagli molecolari di replicazione litico sono ben caratterizzati, meccanismi che controllano la latenza nei neuroni rimangono elusivi. La nostra attuale comprensione di latenza è derivato da studi in vivo su modelli animali di piccole dimensioni, che sono stati indispensabili per la definizione dei requisiti dei geni virali e il ruolo delle risposte immunitarie. Tuttavia, è impossibile distinguere effetti specifici sul virus-neurone rapporto da conseguenze più generali di infezione mediati da cellule immunitarie di sostegno o non neuronali in animali vivi. Inoltre, la sperimentazione animale è costosa, richiede tempo, e limitate in termini di opzioni disponibili per la manipolazione di accoglienzaprocessi. Per superare queste limitazioni, un neurone solo sistema è disperatamente necessario che riproduce la vivo nelle caratteristiche di latenza e la riattivazione, ma offre i vantaggi di coltura tissutale in termini di omogeneità e di accessibilità.
Qui vi presentiamo un modello in vitro utilizzando colture di neuroni primari dai gangli simpatici rat cervicale superiore (SCG) (Figura 1) per studiare HSV-1 la latenza e la riattivazione che si adatta maggior parte se non tutti i criteri desiderati. Dopo aver eliminato cellule non neuronali, vicino omogenei TrkA + colture neuronali sono infettati con HSV-1 in presenza di acyclovir (ACV) per sopprimere la replicazione litico. Dopo la rimozione ACV, non produttivi infezioni da HSV-1 che presentano caratteristiche fedelmente accettato di latenza sono stabiliti in modo efficiente. In particolare, mRNA litici, proteine e virus infettivo diventa non rilevabile, anche in assenza di selezione, ma latenza associata trascrizione (LAT) expression persiste in nuclei neuronale. Genomi virali sono mantenuti ad un numero medio di copie 25 per neurone e possono essere indotte a replicare produttivamente interferendo con PI3-chinasi / Akt segnalazione o il ritiro semplice del nerve growth factor 1. A ricombinante HSV-1 EGFP codifica fusa alla proteina virale US11 litico fornisce uno funzionale, in tempo reale marcatore per la replica risultante da riattivazione che è facilmente quantificato. In aggiunta ai trattamenti chimici, metodologie genetiche come la RNA-interferenza o il gene di consegna attraverso vettori lentivirali può essere applicato con successo al sistema di autorizzazione gli studi meccanicistici che sono molto difficili, se non impossibile, negli animali. In sintesi, il SCG-based HSV-1 la latenza / riattivazione sistema fornisce un potente strumento necessario per svelare i meccanismi molecolari che controllano HSV1 latenza e riattivazione nei neuroni, un puzzle di lunga data in virologia, la cui soluzione può offrire nuove intuizioni nello sviluppo di nuove terapie che obiettivo tsi riserva herpesvirus latente.
Protocollo
1. Isolamento e la coltura di neuroni SCG da embrioni di ratto
Per fornire un contesto utile per comprendere questo protocollo, e per una discussione approfondita della letteratura in precedenza che i metodi stabiliti di cultura SCG neurone, compresa la base per la SCG in coltura in vitro, la piastra di rivestimento substrati, ed i componenti del siero senza mezzi di comunicazione, la si rimanda ai riferimenti 2-4.
- L'utilizzo dei ratti come fonte per i neuroni SCG è stata condotta in accordo con le linee guida NIH nel quadro di un protocollo attivo approvato dalla Institutional Animal Care & Use Committee (IACUC).
- Prima di iniziare la dissezione, preparare collagene e laminina rivestito 96 e piastre di coltura dei tessuti. Utilizzando un dispositivo multi-canale di dispensazione, compilare tutti i 96 pozzetti con una soluzione contenente 0,66 mg / ml ratto collagene coda. Immediatamente rimuovere il collagene, che può essere recuperato e utilizzato fino a 8 dissezioni. Dopo la rimozione tegli collagene, è molto importante che i pozzetti asciugare sotto cappa a flusso laminare. La quantità di tempo necessario per asciugare dipende dal numero di pozzi nel piatto. Per esempio, esso prende tipicamente circa 5-10 min. per i pozzi in un piatto ben 96 ad asciugare, ma può richiedere fino a 30 - 40 min, se un formato più grande piatto ben 24 è utilizzato. Il mancato asciugare correttamente i risultati pozzi in allegato SCG poveri. Quindi ripetere la procedura utilizzando una soluzione di 2 ug / ml laminina. Incubare la soluzione laminina di almeno 2 ore a 37 ° C in un incubatore umidificato CO 2 fino a quando si è pronti a piastra vostri neuroni (passo 1.14).
- Commercialmente ottenuti ratti femmine gravide sono sacrificati con CO 2. Dopo la spruzzatura cadavere con etanolo 70%, a forma di U incisione è fatta intorno all'addome. Dopo il peeling indietro la pelle, una seconda a forma di U incisione è fatta attraverso la parete muscolare addominale. L'utero è visibile sul alzando il livello dei muscoli addominali. Togliere l'utero e il luogo in 15centimetri piatto. Aprire con cautela l'utero con una forbice smussato per evitare di danneggiare i cuccioli dentro. Ogni cucciolo deve essere liberata dal suo sacco embrionale, il cordone ombelicale reciso, e il cucciolo pulito con il 70% di etanolo e Kimwipes.
- Lavorare in una cappa di dissezione, il sacrificio non ancora nati cuccioli di ratto E21 dal taglio la testa dal busto. Scopo le forbici alla base del collo, appena sopra le spalle. Per esporre i gangli, definire con precisione la testa (collo-side up), utilizzando aghi da 23 G in tre punti: i) del midollo spinale; ii) la pelle anteriore fin sopra il naso e appuntato, e iii) l'esofago / trachea devono essere riposte lontano dalla base del collo.
- Vuoi per la * due SCG posizionate su entrambi i lati della biforcazione carotidea (due SCGs per embrione). La SCG è situato appena sotto il ramo. Separare il SCG dalle arterie tirando la biforcazione a parte. Posizionare il gangli in 12 ml di L15-media (integrato con 0,4% D (+)-glucosio) in 15 ml tubo conico su ghiaccio.
* Il SCG è trasparente e incolore rispetto alla opaco, giallastro tessuto adiposo che circonda la biforcazione. Provare a rimuovere la maggior quantità di vasi residui del tessuto adiposo e nel sangue, prima di raccogliere i gangli.
- Ripetere 1.4 e 1.5 fino a quando tutti SCGs vengono raccolte dagli embrioni.
- Delicatamente centrifugare i gangli per 1 min a 600 rpm ed aspirare i fogli in eccesso.
- Risospendere il gangli in 1 ml di L15-media contenente tripsina (0,25%, senza EDTA) e collagenasi (1 mg / ml). Incubare per 30 min a 37 ° C, agitare ogni 10 min.
- Aggiungere 10 ml di C-media (1x MEM, 0,4% D (+)-glucosio, 2 mM L-glutammina, 10% FBS) per inattivare la tripsina e centrifugare per 1 min a 600 rpm.
- Rimuovere la maggior quantità di tripsina / collagenasi media come * possibile e lavare i gangli con 10 ml di C-media. Centrifugare per 1 min a 600 rpm. Ripetere questa operazione una sola volta.
Collagenasi * residua interfenuovamente con il substrato collagene necessario per l'adesione delle cellule alla piastra di coltura.
- Rimuovere la carta di lavaggio e risospendere gangli in 1 ml di C-media e triturare con ago da 21 G attaccato ad una siringa da 5 ml di dissociare grandi ciuffi di cellule *. Fine triturando con 23 ago G fino a quando le macchie visibili sono dissociate.
* Fare attenzione a non a un eccesso di triturare, in modo da danneggiare le cellule. Se la tripsina e collagenasi trattamento ha avuto successo, un massimo di quindici su e giù cicli con l'ago 21 G, e tre cicli con l'ago 23 G dovrebbe essere sufficiente.
- Filtrare i neuroni dissociati attraverso un filtro nylon 70 micron [cell filtro BD Biosciences] in una provetta da 50 ml conica per eliminare eventuali grumi rimanenti.
- Aspirare un'aliquota 10 pl di sospensione cellulare filtrato e mescolare con tripan blu per determinare il numero di cellule vive. Contare il numero di cellule che attivamente esclude il colorante con un emocitometro.
- Rimuovere la soluzione laminina dai 96 piatti e in attesa della 37 ° C incubatore (vedi STEP 1.2). Non asciugare il piatto, può essere utilizzato immediatamente per cellule placcatura volta la laminina viene rimosso. Dispensare * I 5.000-6.000 cellule totali dal vivo (50 - 100 ul per pozzetto) nel collagene e laminina pre-verniciato a 96 pozzetti piatto di coltura di tessuti. Include 50 ng / ml fattore di crescita nervoso (NGF) in C-media.
* E 'importante utilizzare una buona tecnica di coltura di tessuto sterile perché gli antibiotici sono stati omessi dai mezzi di comunicazione di crescita. Inoltre, non ci può essere una significativa variabilità tra collagene provenienti da diversi fornitori. Abbiamo avuto risultati costanti tra i lotti con coda di topo collagene da Millipore.
- A DIV (giorno in vitro) 1, sostituire i C-mezzi utilizzati per le cellule piastra con 50 microlitri NBM (0,4% D (+) - glucosio, 2 mM L-glutammina, B-27 integratore contenente 50 ng / ml NGF, 5afidicolina pM e 20 pM di 5-fluorouracile [5-fluoro-2'-desossiuridina]. Incubare le colture per 5 giorni *. A questo punto, trypsinizing e contando le cellule rimanenti in diversi pozzi può determinare il numero di neuroni sopravvissuti anti-mitotico agente di trattamento. Tipicamente, circa 1.000 neuroni rimangono per pozzetto in una piastra a 96 pozzetti.
* Problemi con contaminazioni fungine o batteriche sono di solito evidenti entro le prime 24 ore di cultura. Esaminare con attenzione ogni pozzetto per la crescita microbica prima di sostituire terreni in piastra. Se soltanto un numero limitato di pozzi sono interessate, possono essere trattati con una soluzione diluita di candeggina, lavate con PBS ed essiccato al fine di procedere con l'esperimento. Si consiglia di ripetere qualsiasi esperimento in cui anche un numero limitato di pozzi avevano contaminazione microbica. Se la contaminazione microbica ampio si osserva nel piatto ben 96, l'esperimento deve essere terminato.
2. L'infezione di SCG Cultmisure di protezione contro HSV-1 US11-EGFP e Istituzione di latenza
Per fondo utile sulle tecniche virologici, incluse la propagazione del virus di base, determinando titolo virale, e molteplicità di infezione (MOI), si rimanda il lettore al riferimento 5. Per una discussione di biologia herpesvirus, si rimanda il lettore a fare riferimento 6. Infine, si rimanda ai riferimenti 7-10 per gli esempi precedenti, altri protocolli, e lo sfondo aggiuntive riguardanti la alpha-herpesvirus infezione litica dei neuroni SCG e per il confronto con adattamenti nostro protocollo per studiare la latenza e la riattivazione.
- A DIV 6, aggiungere acyclovir (ACV), concentrazione finale 100 um ai media esistenti in ogni * bene. Ad esempio, se ognuno di essi contiene ben 50 microlitri, aggiungere 25 microlitri di uno stock uM 300 ACV. Tipicamente, ACV si aggiunge la notte prima dell'infezione, ma può anche essere aggiunto 6-8 ore prima dell'infezione.
* Si tratta di exceedingly importante ridurre al minimo necessario manipolazione fisica del neurone in ogni momento. Semplicemente la rimozione e la sostituzione dei media o infettare con le scorte di virus deve essere fatto molto delicatamente e lentamente. In caso contrario, lo stress risultante meccanica può avere un impatto negativo sulla redditività dei neuroni.
- A DIV 7, infettare le colture SCG HSV-1 US11-EGFP (descritto in rif 11) ad una molteplicità di infezione (MOI) tra 1 -2 (vedere di seguito il commento importante determinare MOI ottimale) *. Aggiungere il virus diluito direttamente ai supporti esistenti nel pozzetto. Includere un finto controllo infettato e un controllo delle infezioni litica positivo in media privi di ACV. Consentire l'infezione di procedere per 2-3 ore a 37 ° C.
* MOI è calcolata usando titolo virale determinato mediante saggio di placca su cellule Vero 12 e il numero di cellule vive placcato, seminate per pozzetto in fase 1,14. Questo calcolo è utile solo in senso operativo,come il numero totale di cellule semi contiene neuroni insieme glia contaminanti, e fibroblasti. Poiché queste cellule contaminanti divisione vengono uccisi da un trattamento con agenti anti-mitotici, l'effettiva MOI per i neuroni superstiti è in realtà maggiore. Dalla quantità iniziale di partenza di 5.000 - 6.000 cellule vive, circa 1.000 i neuroni rimangono dopo il trattamento con agenti anti-mitotiche (come valutato dal conteggio delle cellule trypsinizing e diretto). Il MOI ottimale da utilizzare per infettare colture neuronali possono variare leggermente da una preparazione virus magazzino a quella successiva. Con ogni nuovo allestimento del virus, si consiglia di testare una gamma limitata di differenti MOI dal 1 a 2. L'obiettivo qui è quello di individuare quello che ha meno gli effetti sulla vitalità dei neuroni e produce il maggior numero di eventi di riattivazione inducibile (definito nella sezione 3). L'US11-EGFP virus è particolarmente utile in tempi brevi, ottimizzando le condizioni, ma si possono utilizzare anche altre letture, come saggio di placca o di quantisentante PCR. Può essere utile utilizzare virus purificato attraverso un cuscino di saccarosio per rimuovere le impurità che riducono la vitalità cellulare, anche se questo non è essenziale e non eseguita di routine.
- Ricollocare accuratamente i mezzi di infezione con NBM fresco contenente 50 ng / ml NGF e 100 * uM ACV.
* È estremamente importante essere estremamente delicata quando si cambiano i mezzi di infezione. Scopo la punta della pipetta alla parete del pozzo piuttosto che al fondo del pozzo, e permettere ai mezzi di scorrere dolcemente sulle cellule. Anche espulsione rapida supporti dal pipetta può generare una forza sufficiente a staccare i assoni dal substrato e indurre le cellule a distaccherà tipicamente come un foglio di cellule. Se soltanto un numero limitato di neuroni detach (20-30%), le conseguenze sono minime, a condizione che le cellule appaiono sani. I neuroni sono staccate probabile riattaccare nel tempo, tuttavia, gli assoni non sarà più esteso un bend assoni nuovi ricrescere. Mentre non ottimale, l'esperimento può procedere se solo un numero limitato di pozzetti sono interessati. Se vi è il distacco estesa di neuroni (70-80%), si consiglia di non compresi i pozzetti interessati (s) nell'esperimento. Se la maggior parte dei pozzi contengono 70-80% dei neuroni indipendenti, si consiglia di terminare l'esperimento. Mentre i neuroni può ancora rimontare, in genere si formano grumi di grandi dimensioni. Questo complica la corretta valutazione dei singoli neuroni si riattiva. Si consiglia di ripetere qualsiasi esperimento in cui sono stati osservati i pozzi con i neuroni scollegati per garantire che i tassi di riattivazione non sono stati influenzati dal differenziale rispetto dei neuroni ai pozzetti.
Inoltre, è fondamentale per gestire le culture sempre più delicatamente possibile. Sollecitazioni meccaniche da inutili, i movimenti improvvisi (compresi ripetute aperture e chiusura di una porta della camera incubatrice) o forzata Media Application could compromesso la capacità di supportare le culture HSV-1 la latenza, il possibile risultato di tassi eccessivamente elevati di riattivazione spontanea in un dato esperimento.
- Mantenere le culture per 6 giorni durante i quali il virus si stabiliscono latenza. Durante questo periodo, utilizzare un microscopio a fluorescenza per monitorare neurone salute e US11-EGFP espressione come un indicatore di replicazione litico. US11-EGFP deve essere individuata solo nei pozzetti di controllo privi di trattamento ACV, indicando con successo l'infezione primaria e produttivo replica litico. I neuroni possono mostrare effetti citopatici anche in assenza di produttivo crescita virale. Le colture infette devono essere attentamente monitorato e comparato al mock-infetti neuroni.
3. Riattivazione e valutazione
- A DIV 14, accuratamente sostituire le ACV contenenti supporti con mezzi freschi privi ACV. Se del caso, includere farmacologici (o biologico), le variabili in questo momento. Essere sure di seguire le precauzioni indicate in 2.3.
- In un periodo di 5-6 giorni, monitorare i fermenti vivi utilizzando un microscopio a fluorescenza per individuare i neuroni in fase di riattivazione. In alternativa raccogliere campioni per altri tipi di analisi (proteine, acidi nucleici, etc saggio placca).
- Calcolare la frequenza riattivazione contando il numero di pozzetti contenenti EGFP-neuroni positivi e esprimere questa come una percentuale del numero totale dei pozzetti campione. Si noti che l'espressione EGFP in un individuo e non fa distinzione tra un evento di riattivazione primaria e successiva infezione a causa della diffusione virale. Dal momento che la diffusione infettiva è contenuta, per una sola cultura e, uno o più EGFP-positivi neuroni in un pozzo è operativamente definito come un evento di riattivazione in queste condizioni.
Eventi riattivazione * Più può verificarsi in una cultura, come descritto in 1. Per distinguere un evento primario riattivazione dalla diffusione virale derivanti da reazioni tivation, l'inibitore incapsidamento WAY-150.138 possono essere aggiunti. Bloccando incapsidazione, virus infettivo non è prodotto e diffuso derivante dalla riattivazione non è possibile. In questo modo, il segnale EGFP rilevato in presenza di WAY-150138 riflette il numero di eventi di riattivazione indipendenti all'interno di una cultura ben singe 1,13-15. Si noti che WAY-150.138 è efficace solo contro il ceppo-1 e HSV Patton non disponibili in commercio. In alternativa alla WAY-150.138, è possibile utilizzare uno dei seguenti: i) un virus mutante compromessa la capacità di diffusione di cellule vicine possono essere utilizzati; ii) un virus reporter di cui è espressa EGFP da un promotore IE in presenza continua di ACV, iii) il trattamento con PAA o ACV per impedire l'espressione del gene in ritardo (e la produzione di virus infettante), seguita da immunofluorescenza utilizzando anticorpi diretti contro un prodotto del gene IE.
4. Metodi alternativi per la valutazione riattivazione utilizzando il test
ONTENUTO "> I risultati di un individuo, singolo esperimento dovrebbe essere ottenuto da una singola preparazione del SCG. replicati esperimenti possono essere eseguiti con preparazioni SCG indipendenti più a lungo ogni replica è stata condotta utilizzando una singola partita SCG.- La valutazione di HSV-1 trascritti litici. Raccogliere RNA a volte desiderato dopo la rimozione ACV in presenza o assenza di diverse induttori sperimentali di riattivazione. Quando si utilizza 96 piastre di coltura e, si consiglia di mettere in comune almeno 20 pozzi insieme per ogni campione (circa 10 5 cellule per campione di RNA). In alternativa, SCGs possono essere placcati in più pozzetti (ad esempio per una piastra a 24 pozzetti, utilizzare 4-5 x10 4 cellule / pozzetto). Mentre è certamente possibile rilevare RNA da meno di 20 pozzetti, i piccoli volumi coinvolti in risultato indebita da campione a campione variabilità.
- Rilevamento di HSV-1 proteine litiche. Raccogliere lisati all'ora desiderata dopo l'induzione di riattivazione. Aggiungere 7,5 microlitri di tampone di lisi a ciascuna di 10 wells in una piastra a 96 pozzetti e analisi mediante SDS-PAGE e immunoblotting. In alternativa, proteine virali possono essere rilevate da microscopia immunofluorescenza indiretta. La placcatura iniziale deve essere effettuata su un substrato montabile per l'imaging ad esempio un vetrino di vetro sterile che è stata pretrattata con poli-D-lisina (0,2 mg / ml, Sigma) prima dell'applicazione di collagene e laminina (vedi 1.10) .
- Rilevamento di particelle infettive. Raccogliere il supernatante cultura sulla riattivazione. Eseguire un saggio di placca su monostrati di cellule Vero utilizzando diluizioni seriali del supernatante. Inoltre, saggi placca può essere eseguita utilizzando lisati di fermo-scongelati culture per includere cellule associate particelle per determinare il titolo.
5. Risultati rappresentativi
La Figura 2A mostra un esempio dove 1 pM tricostatina A (TSA), un induttore noto di riattivazione 16-18, viene applicato a colture SCG latente infettati con il tipo selvatico HSV1 EGFP-US11 giornalista ceppo. Con la TSA, la riattivazione raggiunge il 50% del massimo entro 2 giorni, e da 5 giorni la riattivazione altopiani intorno al 60% dei pozzi. Linea di base ('spontanea') riattivazione è circa il 10% in questo esperimento e varia tipicamente da 10-20% di utilizzare questo sistema in vitro. Livelli massimi di riattivazione variano a seconda di quale induttore riattivazione viene utilizzato. Induttori riattivazione Molti può essere applicato per la durata dell'esperimento in quanto non interferiscono con produttiva replicazione virale, ma questo deve essere determinato empiricamente. Altri induttori, tra cui un reagente che colpisce la vitalità dei neuroni e impedisce il completamento del ciclo virale vita produttiva, possono richiedere una domanda di impulso transitorio per provocare la riattivazione.
Mentre l'accumulo di EGFP-US11 in ciascun pozzetto dell'esperimento illustrato in Figura 2A è indicativa di riattivazione di latenza, non distingue se l'US11-EGFP segnale in neuroni individuali deriva da un evento riattivazione indipendente, o la diffusione di un virus riattivato attraverso la cultura. Per valutare il numero di neuroni sottoposti eventi riattivazione indipendenti in ciascun pozzetto, le colture sono state pre-trattate con WAY-150.138, un composto che blocca specificamente propagazione virale prevenendo incapsidamento del DNA virale genoma 13-15. Infetti culture dei neuroni simpatici sono stati trattati con WAY-150138 e la riattivazione indotte con TSA. Un numero significativo di EGFP-positivi neuroni sono stati rilevati solo in pozzetti TSA-trattate rispetto a DMSO-trattati con colture di controllo, dimostrando che un certo numero di eventi di riattivazione indipendenti verificano per cultura individuale (Figura 2B).
Nel nostro saggio, il US11-EGFP reporter è espresso dal promotore endogeno US11 11. Dal momento che US11 è un "vero fine" o γ 2 gene virale litico, la replicazione del DNA virale è necessaria per robusto espressivosul. Ciò è illustrato nella figura 3, come EGFP-US11 accumulo è compromessa dalla virale DNA polimerasi di acido fosfonoacetico inibitore (PAA) in colture indotta per riattivare la PI3 chinasi-LY294002 inibitore.
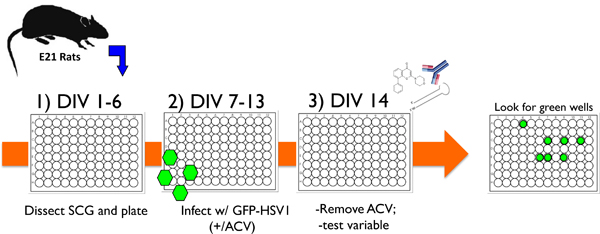
Figura 1. Schema che illustra un tipico protocollo sperimentale con il neurone colta sistema in vitro per studiare HSV-1 la latenza e la riattivazione. 1) Dopo la dissezione superiore gangli cervicali (SCG) da E21 ratti, i neuroni dissociati sono placcati in 96 piatti bene e trattato con anti-mitotico agenti per rimuovere cellule non neuronali. 2) Dopo 6 giorni in vitro (DIV), le colture sono infettati con HSV-1 ricombinante che contiene EGFP fusa al virus codificato US11 gene tardivo (EGFP-HSV-1) in presenza di acyclovir (ACV), un farmaco antivirale che blocchi di replica litico. 3) Di giorno 14 (DIV 14), l'aciclovir viene rimosso e EGFP-espressionenon viene rilevato. Le culture possono essere mantenuta stabilmente in questo modo per 1 mese o più, o una variabile di prova può essere aggiunto per valutare la sua capacità di provocare riattivazione di latenza. La variabile può essere nella forma di un inibitore piccola molecola chimica, un anticorpo contro una neurotrofina solubile o proteina della superficie cellulare, o un lentivirus esprime sia un gene-specifico shRNA o una proteina espressa ectopica. La riattivazione viene poi monitorato segnando EGFP-positivi pozzi in tempo reale.
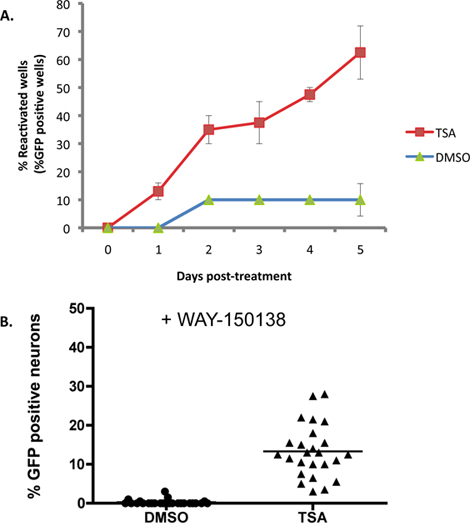
Figura 2. TSA riattiva HSV-1 in colture SCG. Colture SCG sono stati infettati latente come descritto nella Figura 1. A DIV 14, ACV è stato rimosso e sostituito con mezzi contenente 1 pM tricostatina A (TSA). (A) Le colture sono state visualizzate e valutato con microscopia a fluorescenza ogni giorno dopo il trattamento farmaco per un periodo di 5 giorni. La percentuale di pozzi in fase di reactivatione nel corso dell'esperimento è mostrato rispetto al DMSO controllo trattati culture. Percentuale di riattivazione è stato calcolato il numero di EGFP-positivo pozzetti di 20 pozzetti di una piastra 96 coltura bene. Le barre di errore indicano l'errore standard della media. (B) colture latentemente infette sono stati trattati con TSA e un inibitore di incapsidazione DNA virale, WAY-150.138 (20 pg / ml). Il numero di neuroni EGFP + è stato confrontato con 48 ore dopo il trattamento con i farmaci al controllo trattato con DMSO e WAY-150138. Ciascun punto di dati rappresenta il rapporto di eGFP + neuroni fuori 1000 neuroni in una cultura pure. Barra mostra la percentuale media di EGFP + neuroni in un pozzo.
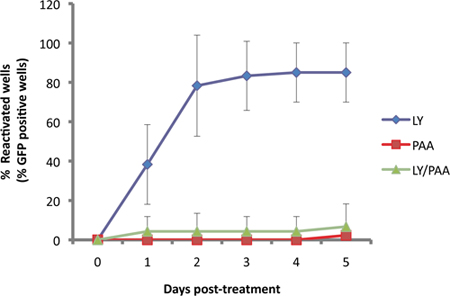
Figura 3. Detecion EGFP dipende dalla replicazione del DNA virale. Culture SCG sono stati latentemente infettate poi trattati con 10 pM di LY29004, un induttore nota di riattivazione 1. La riattivazione indotta da LY (blu) was rispetto a quelli trattati con inibitore della sintesi del DNA virale, acido phophonoacetic, PAA (300μg/ml, rosso) e le due composti insieme (verde).
Discussione
Questa cultura neurone primario e l'infezione del sistema fornisce un metodo semplice ed efficace per esplorare i meccanismi molecolari alla base HSV-1 la latenza e la riattivazione. Il sistema riprende fedelmente le caratteristiche di latenza accettati definiti in entrambe le infezioni umane ed in live-modelli animali. Quando il virus è latente nelle culture SCG, particelle virali infettive e prodotti genici litici non può essere rilevato. L'unico prodotto del gene virale rilevato in neuroni ...
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Ringraziamo i revisori per i loro suggerimenti premurosi che hanno contribuito a migliorare questo manoscritto. Questo lavoro è stato supportato da sovvenzioni a favore di MVC (NS21072, HD23315), ACW (GM61139, S10RR017970) e IM (AI073898, GM056927) dal NIH. MK è stata sostenuta in parte da una formazione sovvenzione del NIH (5T32 AI007180).
Materiali
| Name | Company | Catalog Number | Comments |
| Reagente | Azienda | Catalogo # | Comments |
| 70μm nylon filtro (filtro cella) | BD Biosciences | 352350 | |
| Salt 1x Hank soluzione equilibrata (HBSS - / -) | Invitrogen | 14175 | w / o CaCl 2 e MgCl 2 |
| 1x supporti minimi essenziali (MEM) | Invitrogen | 11095-080 | |
| 5-Fluoro-2'-desossiuridina | Sigma | F0503 | preparare 20 mM in 1x MEM, da conservare a -20 ° C |
| 96 e piastre piane TC ben inferiori | Corning | 3599 | |
| Acyclovir | Calbiochem | 114798 | preparare 31 mM in DMSO; conservare a -20 ° C |
| Afidicolina | Calbiochem | 178273 | preparare stock 10 mM in DMSO; conservare a -20 ° C |
| B-27 Supplement | Invitrogen | 17504-44 | |
| Collagenasi | Sigma | C2674 | preparare i 10 mg / ml in magazzino HBSS - / -; conservare a -20 ° C |
| D-(+)-Glucosio | Sigma | G6152 | preparare 40% stock in H 2 O; filtro sterilizzare e conservare a 4 ° C |
| L-Glutammina | Invitrogen | 25030-081 | |
| Laminina | Sigma | L2020 | preparare 1 mg / ml in magazzino H 2O; rapido congelamento 20 plaliquats e conservare a -80 ° C, diluita a 2 ug / ml di lavoro conc. sterile in H 2 O |
| Leibovit'z L-15 supporti | Invitrogen | 11415 | |
| Nerve Growth Factor | Harlan Laboratories | BT.5017 | preparare i 50 mg / ml in magazzino HBSS - / -, da conservare a -80 ° C |
| Media Neurobasal | Invitrogen | 12348 | |
| Acido fosfonoacetico (PAA) | Sigma | P6909 | preparare i 75 mg / ml in magazzino H 2 O; conservare a -20 ° C |
| Poly-D-lisina bromidrato | Sigma | P0899 | preparare i 20 mg / ml in magazzino H 2 O; conservare a -20 ° C |
| Rat-tail collagene | Millipore | 08-115 | Concentrazione varia con il lotto di fornitura; conservare a 4 ° C e diluire a 0,66 mg / ml conc di lavoro. sterile in H 2 O |
| A tricostatina | Sigma | T8552 | preparare 1 mM in DMSO; conservare a -20 ° C |
| Tripsina 2,5% | Invitrogen | 15090-04 |
Riferimenti
- Camarena, V., Kobayashi, M., Kim, J. Y., Roehm, P., Perez, R., Gardner, J., Wilson, A. C., Mohr, I., Chao, M. V. Nature and duration of growth factor signaling through receptor tyrosine kinases regulates HSV-1 latency in neurons. Cell Host & Microbe. 8, 320-330 (2010).
- Johnson, M. I., Fedoroff, S., Richardson, A. Primary cultures of sympathetic ganglia. Protocols for Neural Cell Culture. , 71-94 (2001).
- Letourneau, P. C., Fedoroff, S., Richardson, A. Preparation of substrata for in vitro culture of neurons. Protocols for Neural Cell Culture. , 245-254 (2001).
- Price, J. P., Brewer, G. J., Fedoroff, S., Richardson, A. Serum-free media for neural cell cultures. Protocols for Neural Cell Culture. , 255-264 (2001).
- Flint, S. J., Enquist, L. W., Racaniello, V. R., Skalka, A. M. . Principles of virology. , (2008).
- Roizman, B., Pellett, P. E., Knipe, D. M., Howley, P. M. The family Herpesviridae: A brief introduction. Fields Virology. 2, 2381-2397 (2001).
- Price, R. W., Rubenstein, R., Khan, A. Herpes simplex virus infection of isolated autonomic neurons in culture: viral replication and spread in a neuronal network. Arch. Virol. 71, 127-140 (1982).
- Tomishima, M. J., Enquist, L. W. A conserved alpha-herpesvirus protein necessary for axonal localization of viral membrane proteins. J. Cell Biol. 154, 741-752 (2001).
- Ch'ng, T. H., Flood, E. A., Enquist, L. W. Culturing primary and transformed neuronal cells for studying pseudorabies virus infection. Methods Mol. Biol. 292, 299-316 (2005).
- Wang, F., Tang, W., McGraw, H. M., Bennett, J., Enquist, L. W., Friedman, H. M. Herpes simplex virus type 1 glycoprotein E is required for axonal localization of capsid, tegument, and membrane glycoproteins. J. Virol. 79, 13362-13372 (2005).
- Benboudjema, L., Mulvey, M., Gao, Y., Pimplikar, S. W., Mohr, I. Association of the herpes simplex virus type 1 us11 gene product with the cellular kinesin light-chain-related protein PAT1 results in the redistribution of both polypeptides. J. Virol. 77, 9192-9203 (2003).
- Blaho, J., Morton, E. R., Yedowitz, J. C. Herpes simplex virus: propagation, quantification and storage. Curr. Protoc. Microbiol. Chapter 14, Unit 14E.1 (2005).
- Van Zeijl, M., Fairhurst, J., Jones, T. R., Vernon, S. K., Morin, J., LaRocque, J., Feld, B. L., O'Hara, B. L., Bloom, J. D., Johann, S. V. Novel class of thiourea compounds that inhibit herpes simplex virus type 1 DNA cleavage and encapsidation: resistance maps to the UL6 gene. J. Virol. 74, 9054-9061 (2000).
- Newcomb, W. W., Brown, J. C. Inhibition of herpes simplex virus replication by WAY-150138: assembly of capsids depleted of the portal and terminase proteins involved in DNA encapsidation. J. Virol. 76, 10084-10088 (2002).
- Pesola, J. M., Zhu, J., Knipe, D. M., Coen, D. M. Herpes simplex virus 1 immediate-early and early gene expression during reactivation from latency under conditions that prevent infectious virus production. J. Virol. 79, 4516-14525 (2005).
- Arthur, J. L., Scarpini, C. G., Connor, V., Lachmann, R. H., Tolkovsky, A. M., Efstathiou, S. Herpes simplex virus type 1 promoter activity during latency establishment, maintenance and reactivation in primary dorsal root neurons in vitro. J. Virol. 75, 3885-3895 (2001).
- Danaher, R. J., Jacob, R. J., Steiner, M. R., Allen, W. R., Hill, J. M., Miller, C. S. Histone deacetylase inhibitors induce reactivation of herpes simplex virus type 1 in a latency-associated transcript- independent manner in neuronal cells. J. Neurovirol. 11, 306-317 (2005).
- Terry-Allison, T., Smith, C. A., DeLuca, N. A. Relaxed repression of herpes simplex virus type 1 genomes in murine trigenminal neurons. J. Virol. 71, 12394-12405 (2007).
- Harris, R. A., Preston, C. M. Establishment of latency in vitro by the herpes virus type 1 mutant in1918. J. Gen. Virol. 72, 907-913 (1991).
- Wagner, E. K., Bloom, D. C. Experimental investigation of herpes simplex virus latency. Clin. Microbiol. Rev. 10, 419-443 (1997).
- Strelow, L. I., Laycock, K. A., Jun, P. Y., Rader, K. A., Brady, R. H., Miller, J. K., Pepose, J. S., Leib, D. A. A structural and functional comparison of the latency-associated transcript promoters of herpes simplex virus type 1 strains KOS and McKrae. J. Gen Virol. 75, 2475-2480 (1994).
- Stroop, W. G., Banks, M. C. Herpes simplex virus type 1 strain KOS-63 does not cause acute or recurrent ocular disease and does not reactivate ganglionic latency in vivo. Acta Neuropathol. 87, 14-22 (1994).
- Sawtell, N. M., Poon, D. K., Tansky, C. S., Thompson, R. L. The latent herpes simplex virus type 1 genome copy number in individual neurons is virus strain specific and correlates with reactivation. J. Virol. 72, 5343-5350 (1998).
- Thompson, R. L., Cook, M. L., Devi-Rao, G., Wagner, E. K., Stevens, J. G. Functional and molecular analysis of the avirulent wild-type herpes simplex virus type 1 strain KOS. J. Virol. 58, 203-211 (1986).
- Wilcox, C. L., Smith, R. L., Freed, C. R., Johnson, E. M. Nerve growth factor-dependence of herpes simplex virus latency in peripheral sympathetic and sensory neurons in vitro. J. Neurosci. 10, 1268-1275 (1990).
- Roehm, P. C., Camarena, V., Gardner, J. B., Wilson, A. C., Mohr, I., Chao, M. V. Cultured vestibular ganglion neurons demonstrate latent herpes simplex type I reactivation. Laryngoscope. 121, 2268-2275 (2011).
- Kuhn, M. A., Nayak, S., Camarena, V., Gardner, J., Wilson, A., Mohr, I., Chao, M. V., Roehm, P. C. A cell culture model of facial palsy resulting from reactivation of latent herpes simplex virus type 1. Otology & Neurotology. , (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon