Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine primäre Neuron Culture System zur Erforschung des Herpes Simplex Virus Latenz und Reaktivierung
In diesem Artikel
Zusammenfassung
Das Protokoll beschreibt eine effiziente und reproduzierbare Modellsystem zur Untersuchung Herpes-simplex-Virus Typ 1 (HSV-1) Latenz und Reaktivierung. Der Test verwendet homogene sympathischen Neuronen Kulturen und ermöglicht die molekulare Analyse der Virus-Neuron-Wechselwirkungen unter Verwendung einer Vielzahl von Anwendungen, wie RNA-Interferenz und Expression von rekombinanten Proteinen.
Zusammenfassung
Herpes simplex Virus Typ-1 (HSV-1) stellt eine lebenslange latente Infektion in peripheren Neuronen. Dieses latente Reservoir ist die Quelle der wiederkehrenden Ereignissen, die Reaktivierung Übertragung zu gewährleisten und dazu beitragen, klinischen Erkrankung. Aktuelle antivirale Medikamente haben kaum Auswirkungen auf das latente Reservoir und es gibt keine Impfstoffe. Während die molekularen Details der Virusvermehrung gut charakterisiert sind, bleiben Mechanismen, die Latenz in den Neuronen schwer fassbar. Unser gegenwärtiges Verständnis von Latenzzeiten von In-vivo-Studien mit kleinen Tiermodellen, die zur Definition der virale Gen Anforderungen und die Rolle der Immunreaktionen wurden unentbehrlich abgeleitet. Jedoch ist es unmöglich, spezifische Wirkungen auf die Virus-Neuron-Verhältnis von mehr allgemeinen Folgen der Infektion durch Immun oder nicht-neuronalen Zellen Unterstützung in lebenden Tieren vermittelt unterscheiden. Darüber hinaus ist Tierversuchen kostspielig, zeitaufwendig und im Hinblick auf die begrenzten verfügbaren Optionen für die Manipulation von HostVerfahren. Um diese Einschränkungen zu überwinden, wird ein Neuron-System nur, dass dringend benötigte reproduziert die in vivo Eigenschaften von Latenz und Reaktivierung, sondern bietet die Vorteile von Gewebekulturen in Bezug auf die Homogenität und Zugänglichkeit.
Hier präsentieren wir ein in vitro Modell unter Verwendung von kultivierten primären sympathischen Neuronen von Ratten überlegen Halsganglien (SCG) (Abbildung 1) zu HSV-1-Latenz und Reaktivierung, die passt zu studieren meisten, wenn nicht alle gewünschten Kriterien. Nach Beseitigung nicht-neuronalen Zellen, sind nahezu homogen TrkA + Neuronenkulturen mit HSV-1 in Anwesenheit von Acyclovir (ACV) die lytische Vermehrung zu unterdrücken infiziert. Nach der Entfernung ACV, nicht-produktive HSV-1-Infektionen, die treu zeigen akzeptiert Markenzeichen der Latenz werden effizient etabliert. Insbesondere werden lytischen mRNAs, Proteine, und das infektiöse Virus nicht nachweisbar, auch in Abwesenheit der Auswahl, aber Latenz-assoziierten Transkript (LAT) exprimierenIonen besteht in neuronalen Kerne. Virale Genome mit einer durchschnittlichen Anzahl von 25 Kopien pro Neuron gehalten und können zur produktiv zu stören PI3-Kinase / Akt Signalisierung oder Rücknahme eines Nerven Wachstumsfaktor 1 zu replizieren. Rekombinantes HSV-1-Codierung EGFP fusioniert mit dem lytischen Proteins US11 eine funktionale Echtzeit-Marker für die Replikation durch die Reaktivierung, die leicht quantifiziert wird. Zusätzlich zu den chemischen Behandlungen können genetische Methoden wie RNA-Interferenz oder Gentransfer über lentiviralen Vektoren erfolgreich auf das System ermöglicht mechanistische Studien, die sehr schwierig, wenn nicht unmöglich, bei Tieren angewendet werden. Zusammenfassend bietet die SCG-basierten HSV-1-Latenz / Reaktivierung System eine leistungsstarke, notwendiges Werkzeug, um die molekularen Mechanismen, die HSV1 Latenz und Reaktivierung in Neuronen, ein langjähriger Rätsel, dessen Lösung in der Virologie können neue Einblicke in die Entwicklung neuer Therapien anbieten zu entwirren, dass Ziel ter latent Herpesvirus Reservoir.
Protokoll
1. Isolierung und Kultivierung von Neuronen aus SCG Rattenembryonen
Um eine sinnvolle Kontext für das Verständnis dieses Protokoll geben, und für eine umfassende Diskussion der älteren Literatur, die etablierten Methoden der SCG Neuron Kultur, einschließlich der Grundlage für die SCG in vitro-Kultur-, Platten-Beschichtung von Substraten und den Komponenten des Serum-freien Medien, die Leser wird auf Referenzen 4.2 bezeichnet.
- Die Verwendung von Ratten als Quelle für die SCG Neuronen wurde in Übereinstimmung mit NIH-Richtlinien im Rahmen einer aktiven Protokoll, das von der Institutional Animal Care & Use Committee (IACUC) zugelassen wurden.
- Vor Beginn der Dissektion, bereiten Kollagen und Laminin beschichteten 96-Well-Zellkulturschalen. Verwendung eines Mehrkanal-Pipettiervorrichtung, geben alle 96 Vertiefungen mit einer Lösung, die 0,66 mg / ml Rattenschwanzkollagen. Ziehen Sie sofort den Collagen, die zurückgewonnen und verwendet werden kann für bis zu 8 Sektionen. Nach dem Entfernen ter Kollagen, ist es sehr wichtig, damit sich die Vertiefungen trocken unter einem Abzug mit laminarer Strömung. Die Menge an Zeit, die zum Trocknen hängt von der Anzahl von Vertiefungen in der Schale. Zum Beispiel ist es typischerweise etwa 5-10 Minuten. für Wells in einer 96-Well-Schale, um zu trocknen, sondern kann bis zu 30 - 40 min, wenn eine größere Format 24 Well-Platte verwendet wird. Eine nicht fachgerechte trocknen die Brunnen führt zu einer schlechten SCG Anhang. Dann wiederholen Sie den Vorgang mit einer Lösung von 2 pg / ml Laminin. Inkubieren Sie die Laminin-Lösung von mindestens 2 Stunden bei 37 ° C in einem befeuchteten CO 2-Inkubator, bis Sie bereit sind, Ihre Platte Neuronen (Schritt 1.14) sind.
- Im Handel erhalten schwangere weibliche Ratten werden eingeschläfert Verwendung von CO 2. Nach dem Besprühen der kadaver mit 70% Ethanol, wird ein U-förmigen Einschnitt um den Bauch gemacht. Nach Abziehen der Haut, wird eine zweite U-förmigen Schnitt durch die Bauchmuskulatur hergestellt. Die Gebärmutter ist sichtbar auf Anheben der Bauchmuskulatur Schicht. Entfernen der Gebärmutter und der Platz in einem 15cm-Spiegel. Öffnen Sie vorsichtig die Gebärmutter mit einem stumpfen Schere nicht zu beschädigen die Welpen innerhalb. Jeder Welpe von seiner embryonalen Sack freigegeben werden muss, durchtrennt die Nabelschnur und der Welpe sauber gewischt mit 70% Ethanol und Kimwipes.
- Arbeiten bei einer Dissektion Kapuze, opfern ungeborenen E21 Rattenjungen durch Scheren des Kopfes vom Rumpf. Richten Sie die Schere an der Basis des Halses, knapp über die Schultern. Um den Ganglien aussetzen, festzunageln den Kopf (Hals-Seite nach oben) unter Verwendung von 23 G Nadeln an drei Standorten: i) Rückenmark; ii) anterioren Haut hochgezogen über der Nase und merken sich, und iii) Speiseröhre / Luftröhre muss weg gesteckt werden von der Basis des Halses.
- Anhand der beiden SCG * auf beiden Seiten der Halsschlagader Bifurkation (zwei Standardkapitalbeihilfen pro Embryo) angeordnet ist. Die SCG ist knapp unterhalb der Filiale entfernt. Trennen Sie die SCG von den Arterien durch Ziehen an der Bifurkation auseinander. Setzen Sie den Ganglien in 12 ml L15-Medium (ergänzt mit 0,4% D (+)-Glucose) in 15 ml konischen Röhrchen auf Eis.
* Die SCG ist durchscheinend und farblos im Vergleich zum opak, gelblich Fettgewebe, das die Gabelung umgibt. Versuchen Sie, so viel der restlichen Fettgewebe und Blutgefäße zu entfernen, vor dem Sammeln der Ganglien.
- Wiederholen 1.4 und 1.5 bis alle Standardkapitalbeihilfen von den Embryonen werden geerntet.
- Vorsichtig zentrifugieren Sie die Ganglien für 1 min bei 600 Umdrehungen pro Minute, und saugen Sie die überschüssige Medien.
- Resuspendieren der Ganglien in 1 ml L15-Medium, das Trypsin (0,25%, ohne EDTA) und Kollagenase (1 mg / ml). Inkubieren für 30 min bei 37 ° C, bewegen alle 10 min.
- 10 ml C-Media (MEM 1x, 0,4% D (+)-Glucose, 2 mM L-Glutamin, 10% FBS), um das Trypsin und Zentrifugation für 1 min bei 600 rpm zu inaktivieren.
- Entfernen Sie so viel von den Trypsin / Collagenase Medien wie möglich * und waschen Sie die Ganglien mit 10 ml C-Medien. Säule für 1 min bei 600 Umdrehungen pro Minute. Wiederholen Sie diesen Schritt einmal.
* Residual Kollagenase werden Störungen nichtwieder mit dem Kollagen Substrat zur Zellanhaftung der Kultur Platte.
- Entfernen Sie die Wasch-und Medien erneut zu suspendieren die Ganglien in 1 ml C-Media und verreiben mit 21 G Nadel an einer 5 ml Spritze zu großen Klumpen von Zellen * distanzieren. Fertig Verreiben mit 23 G Nadel, bis die sichtbare Klumpen dissoziiert sind.
* Achten Sie darauf, über-Verreibung, da dadurch die Zellen zu schädigen. Wenn die Trypsin und Kollagenase-Behandlung erfolgreich war, höchstens fünfzehn nach oben und unten Zyklen mit der Nadel 21 G, und drei Zyklen mit dem 23 G-Nadel sollte ausreichend sein.
- Filtern Sie die dissoziierten Neuronen durch einen 70 um Nylon-Filter [BD Biosciences Zellsieb] In einem 50 ml konischen Röhrchen, um alle verbleibenden Klumpen zu verwerfen.
- Ziehen einer 10 ul Aliquot der Zellsuspension filtriert und gemischt mit Trypanblau, um die Anzahl lebender Zellen zu bestimmen. Zähle die Anzahl der Zellen, die sich aktiv exkl.ude der Farbstoff mit einer Zählkammer.
- Entfernen Sie die Laminin-Lösung aus den 96-Loch-Gerichte warten in der 37 ° C Inkubator (siehe Schritt 1.2). Trocknen Sie die Schale, kann es sofort für die Beschichtung Zellen verwendet werden, sobald die Laminin entfernt wird. Dispense * 5000-6000 insgesamt lebenden Zellen (50 - 100 ul pro Well) in das Kollagen und Laminin pre-beschichteten 96-Well Gewebekulturschale. Einschließen 50 ng / ml Nervenwachstumsfaktor (NGF) im C-Medien.
* Es ist wichtig, um gute sterile Zellkultur-Technik beschäftigen, weil Antibiotika aus dem Wachstumsmedium werden weggelassen. Darüber hinaus kann es signifikante Variabilität unter Collagen von verschiedenen Lieferanten bezogen werden. Wir haben konsistente Ergebnisse über Chargen mit Rattenschwanzkollagen von Millipore hatte.
- Am DIV (day in vitro) 1, ersetzen Sie die C-Platte Medien verwendet werden, um die Zellen mit 50 ul NBM (0,4% D (+) - Glucose, 2 mM L-Glutamin, B-27 Ergänzungsfutter mit 50 ng / ml NGF, 5uM Aphidicolin und 20 uM 5-Fluorouracil [5-Fluor-2'-desoxyuridin]. Inkubieren Sie die Kulturen für 5 Tage *. An diesem Punkt kann trypsinisiert und Zählen der Zellen, die in mehreren Vertiefungen die Anzahl der überlebenden Neuronen der antimitotischen Mittel Behandlung. Typischerweise verbleiben etwa 1.000 Neuronen pro Well in einer 96-Well-Platte.
* Probleme mit Pilz-oder bakterielle Kontamination sind in der Regel innerhalb der ersten 24 Stunden der Kultur deutlich. Untersuchen Sie jede Vertiefung vorsichtig für das mikrobielle Wachstum vor dem Austausch Plattierungsmedien. Wenn nur eine begrenzte Anzahl von Vertiefungen betroffen sind, können sie mit einer verdünnten Bleichlösung, mit PBS gespült und getrocknet, um mit dem Experiment gehen behandelt werden. Wir empfehlen Wiederholung jeglicher Experiment, bei dem auch eine begrenzte Anzahl von Brunnen hatte mikrobiellen Kontamination. Wenn umfangreiche mikrobielle Kontamination in der 96 Well-Platte beobachtet wird, muss der Versuch beendet.
2. Die Infektion von SCG Cultnahmen mit HSV-1 US11-EGFP und Etablierung der Latenz
Für nützliche Hintergrundinformationen über virologische Techniken, einschließlich der grundlegenden Virusvermehrung, die Bestimmung Virustiter und Multiplizität der Infektion (MOI), wird der Leser bezogen auf 5 zu verweisen. Für eine Diskussion der Herpesvirus Biologie wird der Leser bezogen auf 6 verweisen. Schließlich wird der Leser auf Referenzen für 7-10 Beispiele vor, andere Protokolle, und zusätzliche Hintergrundinformationen über die Alpha-Herpesvirus lytische Infektion von SCG Neuronen und zum Vergleich mit unserem Protokoll die Anpassungen an Latenz und Reaktivierung studieren bezeichnet.
- Am DIV 6, fügen Acyclovir (ACV), Endkonzentration 100 uM zu den bestehenden Medien in jedem gut *. Zum Beispiel, wenn jede Vertiefung enthält 50 ul, fügen Sie 25 ul einer 300 uM ACV Lager. Typischerweise wird die ACV Nacht vor der Infektion zugegeben, können aber auch 6-8 Std. vor der Infektion zugegeben werden.
* Es ist ex-ceedingly wichtig, um unnötige physische Manipulation des Neurons jederzeit zu minimieren. Einfach Entfernen und Ersetzen von Medien oder infiziert mit dem Virus Bestände müssen sehr vorsichtig und langsam erfolgen. Andernfalls kann der daraus resultierenden mechanischen Stress negativ auf Neuron Lebensfähigkeit auswirken.
- Am DIV 7, infizieren die SCG Kulturen mit HSV-1 US11-EGFP (beschrieben in Lit. 11) bei einer Multiplizität der Infektion (MOI) zwischen 1 -2 (siehe Kommentar unten auf wichtige Bestimmung der optimalen MOI) *. Fügen Sie den verdünnten Virus direkt zu den bestehenden Medien in den Brunnen. Fügen Sie ein Mock-infizierte Kontrolle und eine lytische Infektion positive Kontrolle in den Medien fehlt ACV. Lassen Sie die Infektion zu 2-3 Stunden bei 37 ° C
* MOI wird unter Verwendung Virustiter durch Ausführen eines Plaque-Assays in Vero-Zellen 12 und die Anzahl der plattierten, lebende Zellen pro Vertiefung ausgesät in Schritt 1,14 bestimmt. Diese Berechnung ist nur in einem operationellen Sinne nützlich,als der Gesamtzahl der Zellen ausgesät enthält Neuronen zusammen mit kontaminierenden Glia und Fibroblasten. Da diese Verunreinigung sich teilenden Zellen durch eine Behandlung mit anti-mitotische Agenten getötet werden, ist die effektive MOI für die überlebenden Nervenzellen tatsächlich größer. Von der ersten Ausgangsmenge von 5.000 - 6.000 lebenden Zellen bleiben etwa 1000 Neuronen nach der Behandlung mit antimitotischen Agenzien (wie durch trypsinisiert und direkte Zellzählung eingeschätzt). Die optimale MOI zu verwenden, wenn infizieren neuronalen Kulturen können etwas variieren von einem Virus Stoffaufbereitung zur nächsten. Mit jeder neuen Präparation des Virus, empfehlen wir die Prüfung einer begrenzten Anzahl von verschiedenen MOI von 1 bis 2. Das Ziel ist hier, um die eine, die die am wenigsten Auswirkungen auf die Lebensfähigkeit Neuron und die Ergebnisse in der größten Anzahl von induzierbaren Reaktivierung Ereignisse (definiert in Abschnitt 3) hat zu identifizieren. Die US11-EGFP-Virus ist besonders hilfreich bei der Optimierung der Bedingungen sehr schnell, aber man kann auch andere Positionsanzeigen wie Plaque-Assay oder quantitative PCR. Es kann hilfreich sein Virus durch ein Saccharose-Kissen gereinigt, um Verunreinigungen zu entfernen, die Lebensfähigkeit der Zellen zu reduzieren, obwohl dies nicht wesentlich ist und nicht routinemäßig durchgeführt verwenden.
- Vorsichtig wieder mit frischen Infektion Medien NBM mit 50 ng / ml NGF und 100 uM ACV *.
* Es ist sehr wichtig zu sein äußerst schonende beim Wechsel der Infektion Medien. Richten Sie die Spitze der Pipette an der Wand des Bohrlochs, anstatt am unteren Rand des Brunnens, und lassen Sie die Medien vorsichtig nach unten rutschen auf die Zellen. Selbst schnelle Ausstoßen von Medien aus der Pipette kann eine ausreichende Kraft zu erzeugen, um die Axone von dem Substrat abzulösen und daß die Zellen abzustreifen typischerweise als ein Bogen von Zellen. Wenn nur eine begrenzte Anzahl von Neuronen trennen (20-30%), sind die Folgen minimalen vorgesehen, dass die Zellen gesund erscheinen. Die freistehenden Neuronen sind wahrscheinlich mit der Zeit wieder anbringen, allerdings sind die Axone nicht mehr schön erweitert werden eind neue Axone wird wieder nachwachsen. Während nicht optimal ist, kann der Versuch fortfahren, wenn nur eine begrenzte Anzahl von Vertiefungen betroffen sind. Wenn es flächigen Ablösung der Neuronen (70-80%), haben wir nicht einschließlich der betroffenen Vertiefung (en) in dem Experiment zu empfehlen. Wenn die Mehrheit der Bohrlöcher 70-80% freistehende Neuronen enthalten, empfehlen wir die Einstellung des Experiments. Während die Neuronen kann noch anfügen, wird sie in der Regel großen Klumpen bilden. Dies erschwert die angemessene Bewertung der einzelnen Neuronen aktiviert. Wir empfehlen Wiederholung jeglicher Experiment, bei dem Brunnen mit freistehenden Neuronen beobachtet, um sicherzustellen, dass die Reaktivierung Preise seien nicht durch Differential Einhaltung von Neuronen in die Vertiefungen geprägt wurden.
Darüber hinaus ist es von entscheidender Bedeutung für eine Übersetzung immer die Kulturen so schonend wie möglich. Mechanische Beanspruchung von unnötigen, plötzlichen Bewegungen (einschließlich wiederholtes Öffnen und Schließen eines Inkubators Kammertür) oder kraftvoll-Media-Anwendung cOuld Kompromiss der Kulturen Fähigkeit, HSV-1-Latenz zu unterstützen, was möglicherweise zu einer inakzeptabel hohen spontanen Reaktivierung in einem gegebenen Experiment.
- Pflegen die Kulturen für 6 Tage, in denen das Virus Latenz zu etablieren wird. Während dieser Zeit, verwenden Sie ein Fluoreszenzmikroskop zu Neuron Gesundheits-und US11-EGFP-Expression als Indikator für die lytische Replikation zu überwachen. US11-EGFP sollte nur in den Kontrollvertiefungen ohne ACV Behandlung nachgewiesen werden, was eine erfolgreiche primäre Infektion und produktiven lytischen Replikation. Neuronen können zytopathischen Effekte sogar in Abwesenheit von produktiver virales Wachstum zeigen. Die infizierten Kulturen sollten genau überwacht werden und im Vergleich zu mock-infizierten Nervenzellen.
3. Reaktivierung und Beurteilung
- Am DIV 14, sorgfältig ersetzen die ACV-haltigen Medien mit frischem Medium ohne ACV. Gegebenenfalls umfassen pharmakologisch (oder biologisch) Variablen zu diesem Zeitpunkt. Sei sure, die Vorsichtsmaßnahmen in 2.3 angegeben zu folgen.
- Über einen 5 bis 6 Tage-Frist, überwachen die lebenden Kulturen mit Hilfe eines Fluoreszenz-Mikroskops zu unterziehen Reaktivierung Neuronen zu erkennen. Alternativ zu sammeln Proben für andere Arten von Analysen (Protein, eine Nukleinsäure, Plaque-Assay usw.).
- Berechnen Sie die Reaktivierung Frequenz durch Zählen der Anzahl der Vertiefungen, die EGFP-positiven Neuronen und bringen das als Teil der gesamten Anzahl von Probenbehältern. Beachten Sie, dass EGFP-Expression im Einzelfall auch nicht zwischen einem primären Reaktivierung Veranstaltung und die anschließende Infektion durch virale Verbreitung zu unterscheiden. Da infektiöse Ausbreitung auf einer einzigen Kultur enthalten ist gut, wird eine oder mehrere EGFP-positive Neurone in einem gut operativ als eine Reaktivierung Veranstaltung unter diesen Bedingungen definiert.
* Mehrere Reaktivierung Ereignisse können in einer Kultur auftreten, wie in 1 beschrieben. Um eine primäre Ereignis Reaktivierung von viralen Ausbreitung, die aus Reaktionen unterscheiden tivation, kann der Inhibitor Enkapsidierung WAY-150138 hinzugefügt werden. Durch die Blockade Enkapsidierung, infektiöse Virus wird nicht erzeugt und verteilt, die sich aus Reaktivierung ist nicht möglich. So spiegelt der EGFP-Signal in Gegenwart von WAY-150138 erfasst die Anzahl der unabhängigen Reaktivierung Ereignisse innerhalb einer Kultur gut singe 1,13-15. Beachten Sie, dass WAY-150.138 nur gegen den HSV-1 Patton-Stammes und nicht im Handel erhältlich ist. Als Alternative zu WAY-150.138, betrachten mit einer der folgenden: i) ein mutiertes Virus in ihrer Fähigkeit, auf benachbarte Zellen ausbreiten beeinträchtigt verwendet werden können, ii) ein Reportergen, Virus, bei der EGFP einem IE-Promotor, in ständiger Anwesenheit exprimiert wird der ACV, iii) Behandlung mit PAA oder ACV späten Genexpression (und das infektiöse Virus Produktion) durch Immunfluoreszenz unter Verwendung von Antikörpern gegen ein Genprodukt gerichtet IE gefolgt verhindern.
4. Alternative Methoden zur Reaktivierung unter Verwendung des Assays Beurteilen
nhalt "> Ergebnisse von einem einzelnen, einzigen Experiment sollte von einer einzigen Präparation von SCG erhalten werden. Wiederholungsversuchen mit unabhängigen SCG Zubereitungen können so lange durchgeführt werden, wie jede Wiederholung wurde unter Verwendung eines einzigen Charge SCG.- Beurteilung von HSV-1-Transkripte lytischen. Sammeln RNA zu gewünschten Zeiten nach ACV Entfernung in Gegenwart oder Abwesenheit von verschiedenen experimentellen Induktoren der Reaktivierung. Bei Verwendung von 96-Well-Kulturplatten, empfehlen wir die Bündelung von mindestens 20 Brunnen zusammen für jede Probe (etwa 10 5 Zellen pro RNA-Probe). Alternativ kann Standardkapitalbeihilfen in größeren Vertiefungen plattiert werden (zB für eine 24-Well-Platte mit 4-5 × 10 4 Zellen / Vertiefung). Zwar ist es sicherlich möglich, die RNA von weniger als 20 Brunnen, kleine Mengen erforderlich sind Ergebnis in ungerechtfertigter Probe zu Probe Variabilität zu erkennen.
- Nachweis von HSV-1 lytische Proteine. Sammle Lysaten zu einem gewünschten Zeitpunkt nach Induktion der Reaktivierung. In 7,5 &mgr; l Lysepuffer zu jeder der 10 WEllen in einer 96-Well-Platte und Analyse durch SDS-PAGE und Immunoblotting. Alternativ können virale Proteine, die durch indirekte Immunfluoreszenz-Mikroskopie nachgewiesen werden. Die erste Beschichtung ist auf einem Substrat montierbar zum Abbilden wie einer sterilen Deckglas, das vorbeschichtet worden ist mit Poly-D-Lysin (0,2 mg / ml, Sigma) vor dem Aufbringen der Kollagen und Laminin durchgeführt werden (siehe 1.10) .
- Nachweis von infektiösen Partikeln. Sammle Kulturüberstand bei Reaktivierung. Führen Sie einen Plaque-Assay auf Einzelschichten von Vero-Zellen mit seriellen Verdünnungen von Überstand. Darüber hinaus können Plaque-Assays unter Verwendung Lysaten von Gefrier-Auftauen Kulturen Zell-assoziierten Teilchen enthalten, um Titer zu bestimmen.
5. Repräsentative Ergebnisse
2A zeigt ein Beispiel, wo 1 uM Trichostatin A (TSA), ein bekannter Induktor der Reaktivierung 16-18, zu SCG latent infizierten Kulturen mit dem Wildtyp-H angelegt wirdSV1 EGFP-US11-Reporter-Stamm. Mit TSA erreicht Reaktivierung 50% der maximal innerhalb von 2 Tagen, und nach 5 Tagen ist die Reaktivierung Plateaus bei etwa 60% der Brunnen. Basislinie ("spontane") Reaktivierung ist etwa 10% in diesem Experiment und typischerweise im Bereich von 10-20% mit Hilfe dieser in-vitro-System. Maximale Reaktivierung Ebenen, die je nach Reaktivierung Induktor verwendet wird. Viele Reaktivierung induzieren kann für die Dauer des Experiments angewandt werden, da sie nicht mit produktiven Virusreplikation nicht stören, aber das muss empirisch ermittelt werden. Andere Induktoren, einschließlich aller Reagenzien, die die Lebensfähigkeit der Nervenzellen beeinträchtigt oder behindert Vollendung des viralen Lebenszyklus produktiv, kann verlangen, ein vorübergehender Impuls Antrag auf Reaktivierung zu provozieren.
Während die Akkumulation von EGFP-US11 in jeder Vertiefung des Experiments in 2A dargestellt ist bezeichnend für die Reaktivierung aus der Latenz, ist es nicht unterscheiden, ob dasUS11-EGFP-Signal in einzelnen Neuronen wird von einer unabhängigen Reaktivierung eines Ereignisses oder der Verbreitung eines Virus reaktiviert durch die Kultur abgeleitet. Um die Anzahl der Neuronen unterzogen unabhängigen Reaktivierung Ereignisse in jeder Vertiefung zu bewerten, wurden die Kulturen mit WAY-150.138, eine Verbindung, die spezifisch blockiert virale Ausbreitung durch die Verhinderung Einkapseln des viralen DNA-Genoms 13-15 vorbehandelt. Infizierte sympathischen Neuron Kulturen wurden mit WAY-150138 und Reaktivierung mit TSA induziert behandelt. Eine erhebliche Anzahl von EGFP-positive Neurone wurden nur im TSA-behandelten Wells festgestellt, im Vergleich zu DMSO-behandelten Kontroll-Kulturen, die belegen, dass eine Reihe von unabhängigen Ereignissen pro Reaktivierung einzelnen Kultur auftreten (Abbildung 2B).
In unserem Test wird der US11-EGFP-Reporter aus dem endogenen Promoter US11 11 zum Ausdruck gebracht. Seit US11 ist ein "true-late" oder γ 2 lytischen Gens wird viralen DNA-Replikation für robuste expressi erforderlichauf. Dies ist in 3 dargestellt, als EGFP-US11 Akkumulation durch die virale DNA-Polymerase-Inhibitor Phosphonoessigsäure (PAA) in Kulturen induziert, mit der PI3-Kinase-Inhibitor LY294002 aktivieren beeinträchtigt wird.
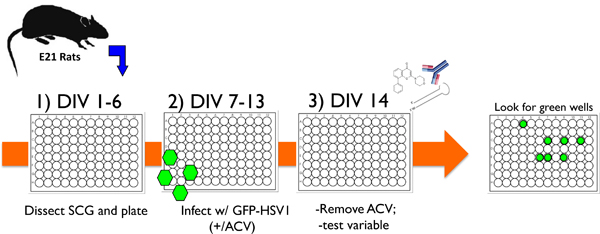
Abbildung 1. Schematische Darstellung eines typischen experimentellen Protokolls mit der kultivierten Neuronen in vitro-System zu HSV-1 Latenz und Reaktivierung zu studieren. 1) Nach Sezieren überlegene Halsganglien (SCG) aus E21-Ratten werden dissoziierter Neuronen in 96-Well-Platten ausplattiert und mit anti-mitotische Mittel zu entfernen, nicht-neuronalen Zellen. 2) Nach 6 Tagen in vitro (DIV) werden die Kulturen mit rekombinantem HSV-1, fusioniert an die EGFP-Virus-codierten US11 späte Gen (EGFP-HSV-1) in Gegenwart Acyclovir (ACV), einem antiviralen Medikament enthält infiziert, Blöcke lytische Replikation. 3) Nach 14 Tagen (DIV 14), die Acyclovir entfernt und EGFP-Expressionwird nicht erkannt. Kulturen stabil auf diese Weise werden für 1 Monat oder länger gehalten werden, oder ein Prüf zugegeben werden, um ihre Fähigkeit zur Reaktivierung aus der Latenz provozieren zu bewerten. Die Variable kann in Form eines kleinen Moleküls chemische Inhibitor, einem Antikörper gegen ein lösliches Neurotrophin oder Zelloberflächen-Protein oder einem Lentivirus, die entweder ein Gen-spezifischen shRNA oder ein ektopisch exprimiert Protein sein. Aktivieren, wird dann durch erziehlt EGFP-positiven Vertiefungen in Echtzeit überwacht.
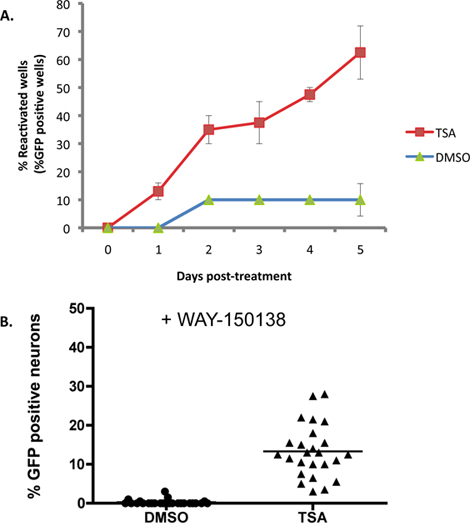
Abbildung 2. TSA reaktiviert HSV-1 in SCG Kulturen. SCG Kulturen latent infiziert waren, wie in Abbildung 1 beschrieben. Bei DIV 14 wurde ACV entfernt und durch Medium, das 1 uM Trichostatin Fassung A (TSA). (A) Die Kulturen wurden visualisiert und ausgewertet Fluoreszenzmikroskopie jeden Tag nach der medikamentösen Behandlung für einen Zeitraum von 5 Tagen. Der Anteil der Vertiefungen unterzogen reactivatIonen innerhalb des Experiments ist im Vergleich zu DMSO-Kontrolle-behandelten Kulturen dargestellt. Prozentsatz der Reaktivierung durch die Anzahl der EGFP-positiven Vertiefungen von 20 Wells einer 96-Well-Kulturplatte berechnet. Fehlerbalken zeigen Standardfehler des Mittelwerts. (B) latent infizierten Kulturen wurden mit TSA und einen Inhibitor der viralen DNA-Einkapselung, WAY-150.138 (20 ug / ml) behandelt. Die Anzahl der EGFP + Neuronen wurde 48 Stunden nach der Behandlung mit den Medikamenten an die Steuerung mit DMSO und WEG-150138 behandelt wurden, verglichen. Jeder Datenpunkt stellt das Verhältnis von EGFP + Neuronen von 1.000 Neuronen in einem Kulturmedium gut. Bar zeigt der durchschnittliche Prozentsatz der EGFP + Neuronen in einem gut.
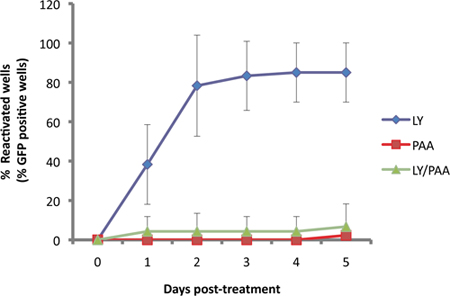
Abbildung 3. EGFP detecion ist abhängig von viralen DNA-Replikation. SCG Kulturen wurden latent infizierte dann mit 10 uM LY29004, ein bekannter Induktor der Reaktivierung 1 behandelt. Die Reaktivierung von LY (blau) induziert was bis die virale DNA-Synthese-Inhibitor, phophonoacetic Säure, PAA (300μg/ml, rot) und den beiden Verbindungen zusammen (grün) behandelt wurden.
Diskussion
Diese primäre Neuron Kultur und Infektion System bietet eine einfache und effektive Methode, um die molekularen Mechanismen HSV-1-Latenz und Reaktivierung zu erkunden. Das System treu rekapituliert die anerkannten Markenzeichen der Latenz in beiden Infektionen beim Menschen und bei Live-Tiermodellen definiert. Wenn das Virus in den SCG Kulturen latent ist, können infektiöse Partikel und lytischen Genprodukte nicht nachgewiesen werden. Die einzige virales Genprodukt in latent infizierten Neuronen, wir...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir danken den Gutachtern für ihre durchdachten Vorschläge, die dieses Manuskript zu verbessern half. Diese Arbeit wurde durch Stipendien an MVC (NS21072, HD23315), ACW (GM61139, S10RR017970) und IM (AI073898, GM056927) von der NIH unterstützt. MK wurde zum Teil durch ein NIH Ausbildungsförderung (5T32 AI007180) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagens | Firma | Katalog # | Kommentare |
| 70μm Nylon-Filter (Zellsieb) | BD Biosciences | 352350 | |
| 1x Hanks Balanced Salt Solution (HBSS - / -) | Invitrogen | 14175 | W / O CaCl 2 und MgCl 2 |
| 1x Minimum Essential Medium (MEM) | Invitrogen | 11095-080 | |
| 5-Fluoro-2'-desoxyuridin | Sigma | F0503 | Vorbereitung 20 mM Lager in 1X MEM; Lagerung bei -20 ° C |
| 96-Loch-flache Boden gut TC Platten | Corning | 3599 | |
| Acyclovir | Calbiochem | 114798 | Vorbereitung 31 mM Stammlösung in DMSO; Lagerung bei -20 ° C |
| Aphidicolin | Calbiochem | 178273 | Vorbereitung 10 mM Stammlösung in DMSO; Lagerung bei -20 ° C |
| B-27 Supplement | Invitrogen | 17504-44 | |
| Collagenase | Sigma | C2674 | Vorbereitung 10 mg / ml in HBSS Lager - / -; Lagerung bei -20 ° C |
| D-(+)-Glucose | Sigma | G6152 | Vorbereitung 40% Lager in H 2 O; Filter sterilisieren und bei 4 ° C lagern |
| L-Glutamin | Invitrogen | 25030-081 | |
| Laminin | Sigma | L2020 | Herstellung von 1 mg / ml Stammlösung in H 2 O; quick-freeze 20 ulaliquats & Speicher bei -80 ° C; verdünnte bis 2 pg / ml konz arbeiten. in sterilem H 2 O |
| Leibovit'z L-15-Medien | Invitrogen | 11415 | |
| Nerve Growth Factor | Harlan Laboratories | BT.5017 | Vorbereitung 50 ug / ml in HBSS Lager - / -; Speicher bei -80 ° C |
| Neurobasalmedium | Invitrogen | 12348 | |
| Phosphonoessigsäure (PAA) | Sigma | P6909 | Vorbereitung 75 mg / ml Stammlösung in H 2 O; Lagerung bei -20 ° C |
| Poly-D-Lysin Hydrobromid | Sigma | P0899 | Es werden 20 mg / ml Stammlösung in H 2 O; Lagerung bei -20 ° C |
| Rattenschwanz Collagen | Millipore | 08-115 | Konzentration variiert mit viel Versorgung; lagern bei 4 ° C und verdünnt auf 0,66 mg / ml konz arbeiten. in sterilem H 2 O |
| Trichostatin A | Sigma | T8552 | Vorbereitung 1 mM Stammlösung in DMSO; Lagerung bei -20 ° C |
| 2,5% Trypsin | Invitrogen | 15090-04 |
Referenzen
- Camarena, V., Kobayashi, M., Kim, J. Y., Roehm, P., Perez, R., Gardner, J., Wilson, A. C., Mohr, I., Chao, M. V. Nature and duration of growth factor signaling through receptor tyrosine kinases regulates HSV-1 latency in neurons. Cell Host & Microbe. 8, 320-330 (2010).
- Johnson, M. I., Fedoroff, S., Richardson, A. Primary cultures of sympathetic ganglia. Protocols for Neural Cell Culture. , 71-94 (2001).
- Letourneau, P. C., Fedoroff, S., Richardson, A. Preparation of substrata for in vitro culture of neurons. Protocols for Neural Cell Culture. , 245-254 (2001).
- Price, J. P., Brewer, G. J., Fedoroff, S., Richardson, A. Serum-free media for neural cell cultures. Protocols for Neural Cell Culture. , 255-264 (2001).
- Flint, S. J., Enquist, L. W., Racaniello, V. R., Skalka, A. M. . Principles of virology. , (2008).
- Roizman, B., Pellett, P. E., Knipe, D. M., Howley, P. M. The family Herpesviridae: A brief introduction. Fields Virology. 2, 2381-2397 (2001).
- Price, R. W., Rubenstein, R., Khan, A. Herpes simplex virus infection of isolated autonomic neurons in culture: viral replication and spread in a neuronal network. Arch. Virol. 71, 127-140 (1982).
- Tomishima, M. J., Enquist, L. W. A conserved alpha-herpesvirus protein necessary for axonal localization of viral membrane proteins. J. Cell Biol. 154, 741-752 (2001).
- Ch'ng, T. H., Flood, E. A., Enquist, L. W. Culturing primary and transformed neuronal cells for studying pseudorabies virus infection. Methods Mol. Biol. 292, 299-316 (2005).
- Wang, F., Tang, W., McGraw, H. M., Bennett, J., Enquist, L. W., Friedman, H. M. Herpes simplex virus type 1 glycoprotein E is required for axonal localization of capsid, tegument, and membrane glycoproteins. J. Virol. 79, 13362-13372 (2005).
- Benboudjema, L., Mulvey, M., Gao, Y., Pimplikar, S. W., Mohr, I. Association of the herpes simplex virus type 1 us11 gene product with the cellular kinesin light-chain-related protein PAT1 results in the redistribution of both polypeptides. J. Virol. 77, 9192-9203 (2003).
- Blaho, J., Morton, E. R., Yedowitz, J. C. Herpes simplex virus: propagation, quantification and storage. Curr. Protoc. Microbiol. Chapter 14, Unit 14E.1 (2005).
- Van Zeijl, M., Fairhurst, J., Jones, T. R., Vernon, S. K., Morin, J., LaRocque, J., Feld, B. L., O'Hara, B. L., Bloom, J. D., Johann, S. V. Novel class of thiourea compounds that inhibit herpes simplex virus type 1 DNA cleavage and encapsidation: resistance maps to the UL6 gene. J. Virol. 74, 9054-9061 (2000).
- Newcomb, W. W., Brown, J. C. Inhibition of herpes simplex virus replication by WAY-150138: assembly of capsids depleted of the portal and terminase proteins involved in DNA encapsidation. J. Virol. 76, 10084-10088 (2002).
- Pesola, J. M., Zhu, J., Knipe, D. M., Coen, D. M. Herpes simplex virus 1 immediate-early and early gene expression during reactivation from latency under conditions that prevent infectious virus production. J. Virol. 79, 4516-14525 (2005).
- Arthur, J. L., Scarpini, C. G., Connor, V., Lachmann, R. H., Tolkovsky, A. M., Efstathiou, S. Herpes simplex virus type 1 promoter activity during latency establishment, maintenance and reactivation in primary dorsal root neurons in vitro. J. Virol. 75, 3885-3895 (2001).
- Danaher, R. J., Jacob, R. J., Steiner, M. R., Allen, W. R., Hill, J. M., Miller, C. S. Histone deacetylase inhibitors induce reactivation of herpes simplex virus type 1 in a latency-associated transcript- independent manner in neuronal cells. J. Neurovirol. 11, 306-317 (2005).
- Terry-Allison, T., Smith, C. A., DeLuca, N. A. Relaxed repression of herpes simplex virus type 1 genomes in murine trigenminal neurons. J. Virol. 71, 12394-12405 (2007).
- Harris, R. A., Preston, C. M. Establishment of latency in vitro by the herpes virus type 1 mutant in1918. J. Gen. Virol. 72, 907-913 (1991).
- Wagner, E. K., Bloom, D. C. Experimental investigation of herpes simplex virus latency. Clin. Microbiol. Rev. 10, 419-443 (1997).
- Strelow, L. I., Laycock, K. A., Jun, P. Y., Rader, K. A., Brady, R. H., Miller, J. K., Pepose, J. S., Leib, D. A. A structural and functional comparison of the latency-associated transcript promoters of herpes simplex virus type 1 strains KOS and McKrae. J. Gen Virol. 75, 2475-2480 (1994).
- Stroop, W. G., Banks, M. C. Herpes simplex virus type 1 strain KOS-63 does not cause acute or recurrent ocular disease and does not reactivate ganglionic latency in vivo. Acta Neuropathol. 87, 14-22 (1994).
- Sawtell, N. M., Poon, D. K., Tansky, C. S., Thompson, R. L. The latent herpes simplex virus type 1 genome copy number in individual neurons is virus strain specific and correlates with reactivation. J. Virol. 72, 5343-5350 (1998).
- Thompson, R. L., Cook, M. L., Devi-Rao, G., Wagner, E. K., Stevens, J. G. Functional and molecular analysis of the avirulent wild-type herpes simplex virus type 1 strain KOS. J. Virol. 58, 203-211 (1986).
- Wilcox, C. L., Smith, R. L., Freed, C. R., Johnson, E. M. Nerve growth factor-dependence of herpes simplex virus latency in peripheral sympathetic and sensory neurons in vitro. J. Neurosci. 10, 1268-1275 (1990).
- Roehm, P. C., Camarena, V., Gardner, J. B., Wilson, A. C., Mohr, I., Chao, M. V. Cultured vestibular ganglion neurons demonstrate latent herpes simplex type I reactivation. Laryngoscope. 121, 2268-2275 (2011).
- Kuhn, M. A., Nayak, S., Camarena, V., Gardner, J., Wilson, A., Mohr, I., Chao, M. V., Roehm, P. C. A cell culture model of facial palsy resulting from reactivation of latent herpes simplex virus type 1. Otology & Neurotology. , (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten