É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um sistema de cultura primária Neuron para o Estudo da Herpes Simplex Virus latência e reativação
Neste Artigo
Resumo
O protocolo descreve um sistema de modelo eficiente e reprodutível para estudar vírus herpes simplex tipo 1 (HSV-1) a latência e reactivação. O ensaio emprega homogéneos culturas de neurónios simpáticos e permite a dissecção molecular do vírus de neurónios-interacções usando uma variedade de ferramentas, incluindo a interferência de RNA e de expressão de proteínas recombinantes.
Resumo
Herpes simplex virus tipo-1 (HSV-1) estabelece uma infecção latente ao longo da vida em neurónios periféricos. Este reservatório latente é a fonte de eventos de reactivação recorrentes que assegurar a transmissão e contribuir para doença clínica. Antivirais atuais não impactar o reservatório latente e não existem vacinas. Embora os detalhes moleculares de replicação lítica são bem caracterizados, mecanismos de controle de latência nos neurônios permanecem ainda desconhecidos. A nossa compreensão actual de latência é derivado a partir de estudos in vivo utilizando modelos animais pequenos, que têm sido indispensáveis para definir os requisitos de genes virais e do papel de respostas imunes. No entanto, é impossível distinguir efeitos específicos sobre a relação vírus neurónio-a partir de consequências mais gerais de infecção mediada por células de suporte imunes ou não-neuronais em animais vivos. Além disso, a experimentação animal é dispendiosa, morosa, e limitado em termos de opções disponíveis para a manipulação de acolhimentoprocessos. Para superar essas limitações, um sistema de neurônios-só é desesperadamente necessário que reproduz a características in vivo de latência e reativação, mas oferece os benefícios da cultura de tecidos em termos de homogeneidade e de acessibilidade.
Apresentamos aqui mais um modelo in vitro utilizando culturas de neurónios simpáticos primárias a partir de gânglios rato cervical superior (SCG) (Figura 1) para estudar o HSV-1 latência e reactivação que se encaixa se não de todos os critérios desejados. Depois de eliminar células não-neuronais, perto homogéneos TrkA culturas + de neurónios são infectadas com HSV-1 na presença de aciclovir (ACV) para suprimir a replicação lítica. Remoção ACV seguinte, não produtivos HSV-1 infecções que exibem características fielmente aceites de latência são eficientemente estabelecida. Notavelmente, os mRNAs líticas, proteínas, e vírus infeccioso tornar-se indetectável, mesmo na ausência de selecção, mas a latência associada transcrição (LAT) expressaion persiste em núcleos neuronal. Genomas virais são mantidas a um número de cópias médio de 25 por neurónio e podem ser induzidas a produtivamente replicar por interferir com PI3-quinase / sinalização Akt ou a retirada simples do factor de crescimento do nervo 1. Um recombinante HSV-1 EGFP codificação fundido com a proteína viral lítica US11 fornece um funcional, marcador de tempo real para a replicação resultante da reactivação que é facilmente quantificado. Além disso a tratamentos químicos, as metodologias genéticas tais como a entrega de RNA-interferência ou gene através lentivirais pode ser aplicado com sucesso para o sistema que permite estudos mecanísticos que são muito difíceis, se não impossível, em animais. Em resumo, a SCG baseado HSV-1 sistema de latência / reativação fornece uma poderosa ferramenta necessária para desvendar os mecanismos moleculares que controlam HSV1 latência e reativação de neurônios, um enigma de longa data em virologia cuja solução pode oferecer novas perspectivas no desenvolvimento de novas terapias que alvo tele latente reservatório herpesvírus.
Protocolo
1. Isolamento e cultura de neurônios Scg de embriões de ratos
Para proporcionar um contexto útil para a compreensão deste protocolo, e para uma discussão exaustiva da literatura anteriormente que métodos estabelecidos de SCG cultura neurónio, incluindo a base para SCG cultura in vitro, a placa de revestimento de substrato, e os componentes de meios isentos de soro, o leitor é remetido para referências de 2-4.
- O uso de ratos como uma fonte para os neurônios Scg foi conduzido de acordo com as diretrizes do NIH no âmbito de um protocolo ativo aprovada pelo Institutional Animal Care & Use Committee (IACUC).
- Antes de iniciar a dissecção, preparar colágeno e laminina revestido 96 pratos de cultura de tecidos. Utilizando um dispositivo de pipetagem multi-canal, preencher todos os 96 poços com uma solução contendo 0,66 mg / ml de colagénio da cauda de rato. Imediatamente remover o colagénio, a qual pode ser recuperado e utilizado para até 8 dissecações. Após a remoção tele colagénio, que é muito importante para permitir que os poços seco sob um fluxo laminar. A quantidade de tempo que leva para secar depende do número de poços no prato. Por exemplo, que normalmente demora cerca de 5-10 min. para poços em um prato de 96 cavidades para secar, mas pode demorar até 30-40 min se um formato maior 24 prato bem é usado. Deixar de secar os poços resultados em anexo SCG pobres. Em seguida, repetir o procedimento utilizando uma solução de 2 ug / ml de laminina. Incubar a solução laminina de pelo menos 2 horas a 37 ° C numa atmosfera húmida incubadora de CO 2 até estar pronto para a chapa seus neurónios (passo 1,14).
- Comercialmente obtidos ratas grávidas são sacrificados usando CO 2. Após a pulverização do cadáver com etanol a 70%, de uma incisão em forma de U é feita em torno do abdómen. Depois de descascar a pele, uma incisão em forma de U segundo é feita através da parede do músculo abdominal. O útero é visível quando se levantando a camada muscular abdominal. Remover o útero e coloque em um 15prato cm. Abra cuidadosamente o útero usando uma tesoura sem corte, para evitar danificar os filhotes dentro. Cada filhote deve ser liberado a partir do seu saco embrionário, o cordão umbilical cortado, e que o filhote limpo com etanol 70% e Kimwipes.
- Trabalhar em uma capa de dissecação, sacrificar nascer filhotes de ratos E21 por corte a cabeça do tronco. Objectivo da tesoura na base do pescoço, um pouco acima dos ombros. Para expor os gânglios, fixar para baixo a cabeça (pescoço virado para cima), utilizando agulhas 23 G em três locais: i cabo) espinhal; ii) da pele anterior puxado para cima o nariz e preso, e iii) esôfago / traquéia deve ser fixado fora a partir da base do pescoço.
- Olhar para o * SCG dois posicionados em ambos os lados da bifurcação da artéria carótida (dois por embrião SCGs). A SCG está localizado logo abaixo do ramo. Separa-se a SCG das artérias, puxando a bifurcação separados. Colocar os gânglios em 12 ml de L15-média (suplementado com 0,4% de D (+)-glucose) em 15 ml tubo cónico em gelo.
* O SCG é translúcida e incolor em comparação com o tecido adiposo opaco, amarelado que rodeia a bifurcação. Tente remover o máximo dos vasos adiposo residuais dos tecidos e do sangue, antes de recolher os gânglios.
- Repita 1,4 e 1,5 até que todos os SCGs são colhidas a partir dos embriões.
- Suavemente centrifugar o gânglio durante 1 min a 600 rpm e aspirar os meios de comunicação em excesso.
- Ressuspender o gânglios em 1 ml de L15-media contendo tripsina (0,25%, sem EDTA) e colagenase (1 mg / ml). Incubar durante 30 min a 37 ° C, agitar a cada 10 min.
- Adicionar 10 ml de C-media (1x MEM, 0,4% de D (+)-glucose, 2 mM de L-glutamina, FBS 10%) para inactivar a tripsina e centrifuga-se durante 1 min a 600 rpm.
- Remover o máximo dos meios de comunicação de tripsina / colagenase como possível * e lave os gânglios com 10ml de C-media. Centrifugar durante 1 min a 600 rpm. Repita este passo uma vez.
* Colagenase residual interferindore com o substrato de colagénio necessária para ligação de células na placa de cultura.
- Remover os meios de lavagem e re-suspender o gânglios em 1 ml de C-media e tritura-se utilizando 21 agulha G ligada a uma seringa de 5 ml para dissociar grandes aglomerações de células *. Concluir trituração com 23 agulha G até que os grumos visíveis são dissociados.
* Tenha cuidado para não sobre-triturado, pois isso irá danificar as células. Se a tripsina e colagenase tratamento foi bem sucedida, um máximo de 15 ciclos de cima e para baixo com a agulha 21 G, e três ciclos com a agulha 23 G deve ser suficiente.
- Filtre os neurônios dissociados através de um filtro de nylon 70 mM [BD Biosciences célula filtro] em um tubo de 50 ml para descartar qualquer aglomerados restantes.
- Retirar uma alíquota de 10 uL da suspensão de células filtrada e misturar com azul de tripano para determinar o número de células vivas. Contar o número de células que activamente exclude o corante utilizando um hemocitómetro.
- Remover a solução laminina a partir dos 96 pratos bem em espera na incubadora a 37 ° C (ver PASSO 1.2). Não secar o prato, ele pode ser usado imediatamente para as células de revestimento, uma vez a laminina é removido. Pipetar * Os 5.000-6.000 total de células vivas (50 - 100 uL por poço) para o colagénio ea laminina pré-revestidas 96 prato de cultura de tecidos. Incluir 50 ng / ml factor de crescimento do nervo (NGF) no C-media.
* É fundamental empregar técnica de cultura de tecido bom estéril porque os antibióticos são omitidos os meios de crescimento. Além disso, pode haver variação significativa entre o colagénio proveniente de diferentes fornecedores. Temos tido resultados consistentes em lotes usando colágeno da cauda de rato da Millipore.
- No DIV (dias in vitro) 1, substituir os C-meios usados para as células da placa com 50 NBM uL (0,4% de D (+) - glucose, 2 mM de L-glutamina, B-27 suplemento contendo 50 ng / mL de NGF, 5afidicolina iM e 20 uM de 5-fluorouracilo [5-fluoro-2'-desoxiuridina]. Incubar as culturas durante 5 dias *. Neste ponto, trypsinizing e contando as células restantes em vários poços pode determinar o número de neurónios sobreviventes após o tratamento com o agente anti-mitótico. Tipicamente, cerca de 1.000 neurónios permanecem por poço numa placa de 96 poços.
* Os problemas de contaminação por fungos ou bactérias são geralmente evidente dentro das primeiras 24 horas de cultura. Examine cuidadosamente cada poço para o crescimento microbiano antes de substitui placas. Se apenas um número limitado de poços são afectados, eles podem ser tratados com uma solução de lixívia diluída, enxaguadas com PBS e secou-se, a fim de prosseguir com a experiência. Recomendamos repetir qualquer experimento onde até mesmo um número limitado de poços tiveram a contaminação microbiana. Se a contaminação microbiana extensa é observado no prato de 96 cavidades, o teste deve ser terminada.
2. Infecção da SCG CultUres com HSV-1 US11-EGFP e Estabelecimento de Latência
Para o fundo útil em técnicas de virológicos, incluindo a propagação de vírus de base, título de vírus, que determina, e multiplicidade de infecção (MOI), o leitor é remetido para fazer referência a 5. Para uma discussão da biologia herpesvírus, o leitor é remetido para fazer referência 6. Finalmente, o leitor é remetido para referências 7-10 de exemplos anteriores, outros protocolos, e fundo adicional sobre alfa-herpesvírus infecção lítica de neurônios SCG e para comparação com as adaptações nosso protocolo para estudar a latência e reativação.
- No DIV 6, adicione o aciclovir (ACV), concentração final de 100 mM para os meios de comunicação existentes em cada * bem. Por exemplo, se cada poço contém 50 ul, adicionar 25 ul de um estoque de 300 mM ACV. Tipicamente, é adicionado ACV a noite antes da infecção, mas também pode ser adicionado 6-8 horas antes da infecção.
* É exceedingly importante para minimizar a manipulação física desnecessária do neurónio em todos os momentos. Basta remover e substituir mídia ou infectar com stocks de vírus deve ser feito com muito cuidado e lentamente. Caso contrário, o estresse resultante mecânica pode ter um impacto negativo sobre a viabilidade dos neurônios.
- No DIV 7, infectar as culturas Scg com HSV-1 US11-EGFP (descrito na ref 11) a uma multiplicidade de infecção (MOI) entre 1 -2 (ver abaixo observação importante na determinação MOI óptima) *. Adicionar o vírus diluído directamente para os meios já existentes no poço. Incluir um controlo de mock-infectados e um controle de infecção lítica positiva na mídia falta ACV. Permitir que a infecção para prosseguir durante 2-3 horas a 37 ° C.
* MOI é calculado utilizando título de vírus determinada através da realização de um ensaio de placa em células Vero 12 eo número de células vivas chapeado, semeadas por poço no passo 1,14. Este cálculo é útil somente no sentido operacional,como o número total de células seeded contém neurónios em conjunto com a glia contaminante, e fibroblastos. Como estas células contaminantes divisórias são mortas por tratamento com anti-mitóticas agentes, a MOI eficaz para os neurónios sobreviventes é realmente maior. A partir da quantidade inicial de partida de 5000 - 6000 células vivas, a cerca de 1.000 neurónios permanecem após o tratamento com agentes anti-mitóticos (como avaliado por contagem de células trypsinizing e directa). O ideal MOI para usar quando infectar culturas neuronais pode variar um pouco de uma preparação de estoque de vírus para o próximo. Com cada nova preparação de vírus, sugerimos que teste uma gama limitada de diferente MOI de 1-2. O objetivo aqui é identificar o que tem menos efeitos sobre a viabilidade dos neurônios e os resultados no maior número de eventos induzíveis reativação (definido na seção 3). O vírus US11-EGFP é particularmente útil para rapidamente otimizando as condições, mas pode-se usar outras leituras, como ensaio de placa ou quantitativo PCR. Ela pode ajudar a utilizar vírus purificado através de uma almofada de sacarose para remover as impurezas que reduzem a viabilidade das células, apesar de isto não é essencial e não realizada rotineiramente.
- Cuidadosamente substituir o meio de infecção com NBM fresco contendo 50 ng / mL de NGF e 100 * ACV uM.
* É extremamente importante a ser extremamente suave ao mudar os meios de comunicação de infecção. Objectivo da ponta da pipeta na parede do poço, em vez de na parte inferior do poço, e permitir que os meios de comunicação para deslize suavemente para baixo sobre as células. Mesmo ejecção rápida dos meios de comunicação a partir da pipeta pode gerar uma força suficiente para separar os axónios a partir do substrato e fazer com que as células para desprender e tipicamente como uma folha de células. Se apenas um número limitado de neurónios detach (20-30%), as consequências são mínimas, desde que as células parecem saudável. Os neurónios destacadas são susceptíveis de recolocar ao longo do tempo, no entanto, os axónios não será mais bem estendida umaaxônios d novos irá regredir. Embora não seja ideal, a experiência pode prosseguir se apenas um número limitado de poços são afetados. Se houver descolamento extensa de neurónios (70-80%), não é recomendável incluindo o bem afectado (s) na experiência. Se a maioria dos poços contêm 70-80% de neurônios destacados, recomendamos que encerra o experimento. Enquanto os neurônios ainda pode recolocar, que normalmente vai formar grumos grandes. Isso dificulta a avaliação adequada de cada um dos neurônios reativados. Sugerimos repetir qualquer experiência onde poços com neurónios destacadas foram observadas para garantir que as taxas de reactivação não foram influenciados pela adesão diferencial de neurónios aos poços.
Além disso, é fundamental para lidar com as culturas sempre tão delicadamente quanto possível. O estresse mecânico de desnecessários, movimentos bruscos (incluindo a abertura e fechamento repetido de uma porta da câmara incubadora) ou forte mídia aplicação ccompromisso ould a capacidade culturas para apoiar HSV-1 latência, possivelmente resultando em taxas inaceitavelmente altos de reativação espontânea em um determinado experimento.
- Manter as culturas durante 6 dias durante os quais o vírus vai estabelecer latência. Durante este período, usar um microscópio fluorescente para monitorar neurónio saúde e US11-EGFP expressão como um indicador da replicação lítica. US11-EGFP deve ser detectada apenas na poços de controlo falta de tratamento ACV, indicando infecção primária de sucesso e replicação lítica produtivo. Neurónios podem mostrar efeitos citopáticos, mesmo na ausência de crescimento virai produtiva. As culturas infectadas devem ser cuidadosamente monitorizados e comparados com mock-infectados neurônios.
3. Reativação e Avaliação
- No DIV 14, substitua cuidadosamente a mídia contendo ACV por meio fresco falta ACV. Se for caso disso, incluir farmacológicos (ou biológico) variáveis neste momento. Ser sure seguir as precauções indicadas em 2.3.
- Ao longo de um período de dias 5 a 6, monitorar as culturas vivas utilizando um microscópio de fluorescência para detectar neurónios submetidos a reactivação. Alternativamente recolher amostras para outros tipos de análises (proteína, ácido nucleico, etc ensaio de placa).
- Calcula-se a frequência de reactivação por contagem do número de poços que contêm EGFP-positivas neurónios e expressar esta como uma proporção do número total de poços de amostra. Observe que a expressão EGFP em um indivíduo bem, não faz distinção entre um evento de reativação primária e subseqüente infecção devido a propagação viral. Uma vez que propagação infecciosa está contido a uma cultura único poço, um ou mais EGFP-positivas neurónios em um poço é operacionalmente definida como um evento de reactivação sob estas condições.
* Eventos reactivação múltiplos podem ocorrer em uma cultura, como descrito em 1. Para distinguir um evento de reactivação primária a partir de propagação virai resultante da reacção vação, o inibidor de encapsidação WAY-150.138 podem ser adicionados. Ao bloquear encapsidação, vírus infeccioso não é produzido e espalhar resultante da reactivação não é possível. Assim, o sinal de EGFP detectada na presença de WAY-150.138 reflecte o número de eventos independentes de reactivação dentro de uma cultura singe bem 1,13-15. Note-se que WAY-150.138 é apenas eficaz contra o HSV-1 estirpe Patton e não está disponível comercialmente. Como uma alternativa para WAY-150.138, considerar a utilização de qualquer dos seguintes: i) um vírus mutante deficiente na sua capacidade de se espalhar para as células vizinhas pode ser utilizado; ii) um vírus repórter onde EGFP é expressa a partir de um promotor IE na presença contínua de ACV; iii) tratamento com PAA ou ACV para prevenir a expressão do gene tardio (e produção de vírus infecciosos) seguido por imunofluorescência utilizando anticorpos dirigidos contra um produto de gene IE.
4. Métodos Alternativos para avaliar reativação utilizando o ensaio de
ONTEÚDO "> Os resultados de uma experiência, único indivíduo deve ser obtido a partir de uma única preparação de SCG. experiências duplicadas pode ser realizada com preparações SCG independentes, enquanto cada repetição foi conduzido utilizando um lote SCG único.- Avaliação de HSV-1 transcripts líticas. Recolher o RNA às vezes desejado após remoção ACV na presença ou ausência de diferentes indutores experimentais de reactivação. Quando se utiliza 96 placas de cultura assim, é recomendável pooling pelo menos 20 poços em conjunto para cada amostra (cerca de 10 5 células por amostra de RNA). Alternativamente, pode ser SCGs plaqueadas em poços de maiores (por exemplo, para uma placa de 24 poços, utilizar 4-5 x10 4 células / poço). Embora seja certamente possível detectar RNA de menos de 20 poços, os pequenos volumes de resultado envolvidos na variabilidade da amostra para amostra injustificada.
- Detecção de HSV-1 proteínas líticas. Collect lisados em um tempo desejado após a indução da reactivação. Adicionar 7,5 ul de tampão de lise a cada um de 10 wells em uma placa de 96 poços e analisar por SDS-PAGE e imunotransferência. Alternativamente, as proteínas virais podem ser detectados por microscopia de imunofluorescência indirecta. O revestimento inicial deve ser feito sobre um substrato montável para imagiologia, tais como uma lamela de vidro estéril que tenha sido pré-revestido com poli-D-lisina (0,2 mg / ml, Sigma), antes da aplicação do colagénio e laminina (ver 1,10) .
- Detecção de partículas infecciosas. Recolher o sobrenadante da cultura sobre a reativação. Executar um ensaio de placa em monocamadas de células Vero, utilizando diluições em série do sobrenadante. Além disso, ensaios de placa pode ser realizada utilizando lisados de congelamento-descongelamento culturas para incluir associados a células partículas para determinar título.
5. Os resultados representativos
A Figura 2A ilustra um exemplo em que 1 uM tricostatina A (TSA), um indutor conhecido de reactivação 16-18, é aplicado a SCG culturas infectadas de forma latente com a H do tipo selvagemSV1 estirpe repórter EGFP-US11. Com TSA, a reactivação atinge 50% do máximo dentro de 2 dias, e por 5 dias a planaltos reactivação em cerca de 60% dos poços. Linha de base de reactivação ('espontânea') é de aproximadamente 10% nesta experiência e varia tipicamente de 10-20% usando este sistema in vitro. Níveis máximos de reactivação variar dependendo de qual indutor reactivação é utilizada. Os indutores de reactivação pode ser aplicado para a duração da experiência em que não interferem com a replicação virai produtiva, mas isto tem de ser determinada empiricamente. Outros indutores, incluindo qualquer reagente que afecte a viabilidade dos neurónios ou dificulta a conclusão do ciclo de vida virai produtiva, pode necessitar de uma aplicação pulso transiente para provocar a reactivação.
Embora a acumulação de EGFP-US11 em cada poço da experiência representada na Figura 2A é indicativo de reactivação de latência, não distingue se oUS11-EGFP sinal em neurónios individuais é derivado de um evento de reactivação independente, ou a propagação de um vírus reactivada através da cultura. Para avaliar o número de neurónios submetidos a eventos independentes de reactivação em cada poço, as culturas foram pré-tratados com WAY-150.138, um composto que bloqueia especificamente propagação virai através da prevenção de encapsidação do DNA viral genoma 13-15. Infectados culturas de neurônios simpáticos foram tratados com WAY 150138 e reativação induzida com TSA. Um número significativo de EGFP-positivas neurónios foram detectadas apenas em poços de TSA-tratados, em comparação com culturas de controlo tratados com DMSO, demonstrando que um número de eventos independentes de reactivação ocorrer por cultura individual (Figura 2B).
No nosso ensaio, o repórter US11-EGFP é expresso a partir do promotor endógeno US11 11. Desde US11 é um "verdadeiro-tarde" ou γ 2 gene viral lítica, a replicação do DNA viral é necessária para a expressividade robustapor diante. Isto é ilustrado na Figura 3, como EGFP-US11 acumulação é prejudicada pela DNA polimerase virai inibidor de ácido fosfonoacético (PAA) em culturas induzidas para reactivar com o inibidor de LY294002 PI3-quinase.
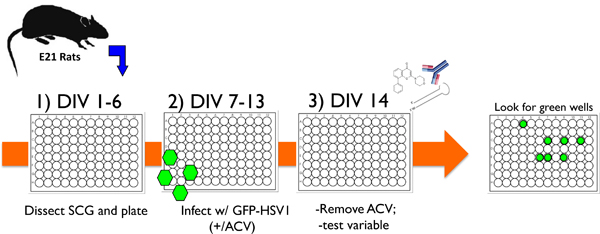
Figura 1. Esquemático que ilustra um protocolo experimental típico usando o neurónio cultivadas sistema in vitro para estudar o HSV-1 e latência de reactivação. 1) Após dissecação dos gânglios cervicais superiores (SCG) de ratos E21, os neurónios dissociadas são plaqueadas em 96 pratos de poços e tratadas com anti-mitótico agentes para remover células não neuronais. 2) Após 6 dias in vitro (DIV), as culturas são infectadas com HSV-1 recombinante que contém EGFP fundido com o vírus-encoded US11 gene tardio (EGFP-HSV-1) na presença aciclovir (ACV), uma droga antiviral que blocos de replicação lítica. 3) Por dia 14 (DIV 14), o aciclovir é removido e EGFP-expressãonão é detectado. Culturas pode ser mantida de forma estável dessa maneira por um mês ou mais, ou uma variável de teste podem ser adicionados para avaliar a sua capacidade para provocar a reactivação da latência. A variável pode estar na forma de um inibidor de pequena molécula química, um anticorpo contra uma neurotrofina solúvel ou proteína da superfície celular, ou um lentivírus expressando quer shRNA um gene específico ou uma proteína ectopicamente expressa. A reativação é então monitorada marcando EGFP positivos poços em tempo real.
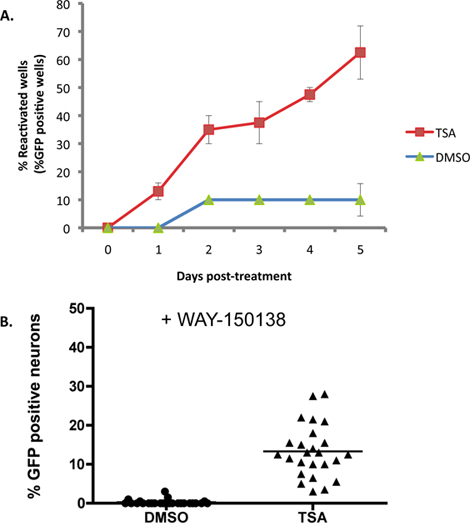
Figura 2. TSA reactiva HSV-1 em culturas de GCS. Culturas Scg foram infectadas de forma latente, tal como descrito na Figura 1. No DIV 14, ACV foi removido e substituído com meio contendo 1 mM tricostatina A. (TSA) (A) As culturas foram visualizados e registados com microscopia de fluorescência de cada dia após o tratamento de droga durante um período de 5 dias. A percentagem de poços submetidos reactivatião ao longo da experiência é apresentado em relação ao controlo DMSO-tratados culturas. Percentagem de reactivação foi calculado pelo número de EGFP-positivo poços de 20 poços de uma placa de cultura de 96 poços. As barras de erro indicam o erro padrão da média. (B) As culturas infectadas de forma latente foram tratados com TSA e um inibidor de encapsidação do DNA virai, WAY-150.138 (20 ug / ml). O número de EGFP + neurónios foi comparado 48 horas após o tratamento com os medicamentos para o controlo tratado com DMSO e WAY-150.138. Cada ponto de dados representa a proporção de EGFP + de neurónios em 1.000 neurónios em cultura bem. Bar mostra o percentual médio da EGFP + de neurônios em um poço.
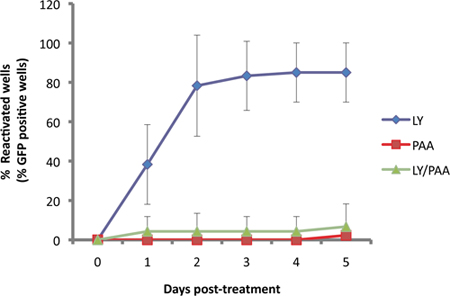
Figura 3. Detecion EGFP é dependente de replicação do DNA virai. Culturas Scg foram infectadas de forma latente, em seguida, tratados com 10 mM de LY29004, um indutor conhecido de reactivação 1. Reativação induzida por LY (azul) was em comparação com os tratados com inibidor da síntese de ADN virai, ácido phophonoacetic, PAA (300μg/ml, vermelho) e os dois compostos em conjunto (verde).
Discussão
Esta cultura neurônio primário e sistema de infecção fornece um método simples e eficaz para explorar os mecanismos moleculares subjacentes HSV-1 latência e reativação. O sistema fielmente recapitula as características aceitas de latência definidos em ambas as infecções humanas e em modelos de animais vivos. Quando o vírus é latente nas culturas SCG, partículas virais infecciosas e produtos de genes líticas não pode ser detectado. O produto do gene virai detectado apenas em neurónios l...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Agradecemos aos revisores por suas sugestões inteligentes que ajudaram a melhorar este manuscrito. Este trabalho foi suportado por concessões para MVC (NS21072, HD23315), ACW (GM61139, S10RR017970) e IM (AI073898, GM056927) do NIH. MK foi apoiado em parte por um treinamento NIH subvenção (5T32 AI007180).
Materiais
| Name | Company | Catalog Number | Comments |
| Reagente | Companhia | Catalogo | Comentários |
| 70μm nylon filtro (coador de celular) | BD Biosciences | 352350 | |
| Solução 1x Salina Equilibrada de Hank (HBSS - / -) | Invitrogen | 14175 | w / o CaCl 2 e MgCl 2 |
| 1x mínimos Mídia Essenciais (MEM) | Invitrogen | 11095-080 | |
| 5-Fluoro-2'-desoxiuridina | Sigma | F0503 | preparar 20 mM em 1x MEM; armazenar a -20 ° C |
| 96-bem planas bem fundo placas TC | Corning | 3599 | |
| Aciclovir | Calbiochem | 114798 | preparar 31 mM em DMSO; armazenar a -20 ° C |
| Afidicolina | Calbiochem | 178273 | preparar 10 mM em DMSO; armazenar a -20 ° C |
| B-27 Suplemento | Invitrogen | 17504-44 | |
| Colagenase | Sigma | C2674 | preparar 10 mg / ml em HBSS estoque - / -; armazenar a -20 ° C |
| D-(+)-Glucose | Sigma | G6152 | preparar estoque 40% em H 2 O; filtro de esterilizar e armazenar a 4 ° C |
| L-Glutamina | Invitrogen | 25030-081 | |
| A laminina | Sigma | L2020 | preparar 1 mg / ml em estoque H 2O; rápido a congelar 20 laliquats e armazenar a -80 ° C; diluído para 2 mg / ml conc de trabalho. em estéril de H2O |
| Leibovit'z meio L-15 | Invitrogen | 11415 | |
| Fator de Crescimento do Nervo | Harlan Laboratories | BT.5017 | preparar 50 ug / ml em HBSS estoque - / -; armazenam a -80 ° C |
| Médio Neurobasal | Invitrogen | 12348 | |
| Fosfonoacético ácido (PAA) | Sigma | P6909 | preparar 75 mg / ml estoque em H2O; armazenar a -20 ° C |
| Poli-D-lisina bromidrato | Sigma | P0899 | preparar 20 mg / ml estoque em H2O; armazenar a -20 ° C |
| Rat-tail de colágeno | Millipore | 08-115 | Concentração varia com o lote de abastecimento; Armazenar a 4 ° C e diluída para 0,66 mg / ml conc de trabalho. em estéril de H2O |
| Tricostatina A | Sigma | T8552 | preparar 1 mM em DMSO; armazenar a -20 ° C |
| Tripsina 2,5% | Invitrogen | 15090-04 |
Referências
- Camarena, V., Kobayashi, M., Kim, J. Y., Roehm, P., Perez, R., Gardner, J., Wilson, A. C., Mohr, I., Chao, M. V. Nature and duration of growth factor signaling through receptor tyrosine kinases regulates HSV-1 latency in neurons. Cell Host & Microbe. 8, 320-330 (2010).
- Johnson, M. I., Fedoroff, S., Richardson, A. Primary cultures of sympathetic ganglia. Protocols for Neural Cell Culture. , 71-94 (2001).
- Letourneau, P. C., Fedoroff, S., Richardson, A. Preparation of substrata for in vitro culture of neurons. Protocols for Neural Cell Culture. , 245-254 (2001).
- Price, J. P., Brewer, G. J., Fedoroff, S., Richardson, A. Serum-free media for neural cell cultures. Protocols for Neural Cell Culture. , 255-264 (2001).
- Flint, S. J., Enquist, L. W., Racaniello, V. R., Skalka, A. M. . Principles of virology. , (2008).
- Roizman, B., Pellett, P. E., Knipe, D. M., Howley, P. M. The family Herpesviridae: A brief introduction. Fields Virology. 2, 2381-2397 (2001).
- Price, R. W., Rubenstein, R., Khan, A. Herpes simplex virus infection of isolated autonomic neurons in culture: viral replication and spread in a neuronal network. Arch. Virol. 71, 127-140 (1982).
- Tomishima, M. J., Enquist, L. W. A conserved alpha-herpesvirus protein necessary for axonal localization of viral membrane proteins. J. Cell Biol. 154, 741-752 (2001).
- Ch'ng, T. H., Flood, E. A., Enquist, L. W. Culturing primary and transformed neuronal cells for studying pseudorabies virus infection. Methods Mol. Biol. 292, 299-316 (2005).
- Wang, F., Tang, W., McGraw, H. M., Bennett, J., Enquist, L. W., Friedman, H. M. Herpes simplex virus type 1 glycoprotein E is required for axonal localization of capsid, tegument, and membrane glycoproteins. J. Virol. 79, 13362-13372 (2005).
- Benboudjema, L., Mulvey, M., Gao, Y., Pimplikar, S. W., Mohr, I. Association of the herpes simplex virus type 1 us11 gene product with the cellular kinesin light-chain-related protein PAT1 results in the redistribution of both polypeptides. J. Virol. 77, 9192-9203 (2003).
- Blaho, J., Morton, E. R., Yedowitz, J. C. Herpes simplex virus: propagation, quantification and storage. Curr. Protoc. Microbiol. Chapter 14, Unit 14E.1 (2005).
- Van Zeijl, M., Fairhurst, J., Jones, T. R., Vernon, S. K., Morin, J., LaRocque, J., Feld, B. L., O'Hara, B. L., Bloom, J. D., Johann, S. V. Novel class of thiourea compounds that inhibit herpes simplex virus type 1 DNA cleavage and encapsidation: resistance maps to the UL6 gene. J. Virol. 74, 9054-9061 (2000).
- Newcomb, W. W., Brown, J. C. Inhibition of herpes simplex virus replication by WAY-150138: assembly of capsids depleted of the portal and terminase proteins involved in DNA encapsidation. J. Virol. 76, 10084-10088 (2002).
- Pesola, J. M., Zhu, J., Knipe, D. M., Coen, D. M. Herpes simplex virus 1 immediate-early and early gene expression during reactivation from latency under conditions that prevent infectious virus production. J. Virol. 79, 4516-14525 (2005).
- Arthur, J. L., Scarpini, C. G., Connor, V., Lachmann, R. H., Tolkovsky, A. M., Efstathiou, S. Herpes simplex virus type 1 promoter activity during latency establishment, maintenance and reactivation in primary dorsal root neurons in vitro. J. Virol. 75, 3885-3895 (2001).
- Danaher, R. J., Jacob, R. J., Steiner, M. R., Allen, W. R., Hill, J. M., Miller, C. S. Histone deacetylase inhibitors induce reactivation of herpes simplex virus type 1 in a latency-associated transcript- independent manner in neuronal cells. J. Neurovirol. 11, 306-317 (2005).
- Terry-Allison, T., Smith, C. A., DeLuca, N. A. Relaxed repression of herpes simplex virus type 1 genomes in murine trigenminal neurons. J. Virol. 71, 12394-12405 (2007).
- Harris, R. A., Preston, C. M. Establishment of latency in vitro by the herpes virus type 1 mutant in1918. J. Gen. Virol. 72, 907-913 (1991).
- Wagner, E. K., Bloom, D. C. Experimental investigation of herpes simplex virus latency. Clin. Microbiol. Rev. 10, 419-443 (1997).
- Strelow, L. I., Laycock, K. A., Jun, P. Y., Rader, K. A., Brady, R. H., Miller, J. K., Pepose, J. S., Leib, D. A. A structural and functional comparison of the latency-associated transcript promoters of herpes simplex virus type 1 strains KOS and McKrae. J. Gen Virol. 75, 2475-2480 (1994).
- Stroop, W. G., Banks, M. C. Herpes simplex virus type 1 strain KOS-63 does not cause acute or recurrent ocular disease and does not reactivate ganglionic latency in vivo. Acta Neuropathol. 87, 14-22 (1994).
- Sawtell, N. M., Poon, D. K., Tansky, C. S., Thompson, R. L. The latent herpes simplex virus type 1 genome copy number in individual neurons is virus strain specific and correlates with reactivation. J. Virol. 72, 5343-5350 (1998).
- Thompson, R. L., Cook, M. L., Devi-Rao, G., Wagner, E. K., Stevens, J. G. Functional and molecular analysis of the avirulent wild-type herpes simplex virus type 1 strain KOS. J. Virol. 58, 203-211 (1986).
- Wilcox, C. L., Smith, R. L., Freed, C. R., Johnson, E. M. Nerve growth factor-dependence of herpes simplex virus latency in peripheral sympathetic and sensory neurons in vitro. J. Neurosci. 10, 1268-1275 (1990).
- Roehm, P. C., Camarena, V., Gardner, J. B., Wilson, A. C., Mohr, I., Chao, M. V. Cultured vestibular ganglion neurons demonstrate latent herpes simplex type I reactivation. Laryngoscope. 121, 2268-2275 (2011).
- Kuhn, M. A., Nayak, S., Camarena, V., Gardner, J., Wilson, A., Mohr, I., Chao, M. V., Roehm, P. C. A cell culture model of facial palsy resulting from reactivation of latent herpes simplex virus type 1. Otology & Neurotology. , (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados