Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Первичная система культуры нейронов по изучению простого герпеса латентности вирусов и реактивации
В этой статье
Резюме
В протоколе описываются эффективные и воспроизводимые модели системы для изучения вируса простого герпеса типа 1 (HSV-1) задержки и реактивации. Анализ использует однородную симпатических нейронов культуры и позволяет молекулярной вскрытия вируса нейронных взаимодействий, используя различные инструменты, включая РНК-интерференции и экспрессии рекомбинантных белков.
Аннотация
Herpes simplex virus type-1 (HSV-1) establishes a life-long latent infection in peripheral neurons. This latent reservoir is the source of recurrent reactivation events that ensure transmission and contribute to clinical disease. Current antivirals do not impact the latent reservoir and there are no vaccines. While the molecular details of lytic replication are well-characterized, mechanisms controlling latency in neurons remain elusive. Our present understanding of latency is derived from in vivo studies using small animal models, which have been indispensable for defining viral gene requirements and the role of immune responses. However, it is impossible to distinguish specific effects on the virus-neuron relationship from more general consequences of infection mediated by immune or non-neuronal support cells in live animals. In addition, animal experimentation is costly, time-consuming, and limited in terms of available options for manipulating host processes. To overcome these limitations, a neuron-only system is desperately needed that reproduces the in vivo characteristics of latency and reactivation but offers the benefits of tissue culture in terms of homogeneity and accessibility.
Here we present an in vitro model utilizing cultured primary sympathetic neurons from rat superior cervical ganglia (SCG) (Figure 1) to study HSV-1 latency and reactivation that fits most if not all of the desired criteria. After eliminating non-neuronal cells, near-homogeneous TrkA+ neuron cultures are infected with HSV-1 in the presence of acyclovir (ACV) to suppress lytic replication. Following ACV removal, non-productive HSV-1 infections that faithfully exhibit accepted hallmarks of latency are efficiently established. Notably, lytic mRNAs, proteins, and infectious virus become undetectable, even in the absence of selection, but latency-associated transcript (LAT) expression persists in neuronal nuclei. Viral genomes are maintained at an average copy number of 25 per neuron and can be induced to productively replicate by interfering with PI3-Kinase / Akt signaling or the simple withdrawal of nerve growth factor1. A recombinant HSV-1 encoding EGFP fused to the viral lytic protein Us11 provides a functional, real-time marker for replication resulting from reactivation that is readily quantified. In addition to chemical treatments, genetic methodologies such as RNA-interference or gene delivery via lentiviral vectors can be successfully applied to the system permitting mechanistic studies that are very difficult, if not impossible, in animals. In summary, the SCG-based HSV-1 latency / reactivation system provides a powerful, necessary tool to unravel the molecular mechanisms controlling HSV1 latency and reactivation in neurons, a long standing puzzle in virology whose solution may offer fresh insights into developing new therapies that target the latent herpesvirus reservoir.
протокол
1. Выделение и культуры СКГ нейроны из эмбрионов крыс
Чтобы обеспечить полезный контекст для понимания этого протокола, а также для всестороннего обсуждения ранее литературы, установленных методов культуры SCG нейронов, в том числе на основе СКГ в пробирке культуру, плиты покрытия подложки, а также компоненты сыворотки свободных средств массовой информации, Мы отсылаем читателя к ссылкам 2-4.
- Использование крыс в качестве источника для СКГ нейроны был проведен в соответствии с руководящими принципами NIH под активным протоколом утвержденным Уходу за животными и использованию комитета (IACUC).
- Перед началом вскрытия, подготовки коллаген и ламинин покрытием 96 блюд культуре ткани. С помощью многоканальной пипеткой устройства, заполнить все 96 лунок с раствором, содержащим 0,66 мг / мл крысы хвост коллагена. Немедленно снять коллагена, который может быть восстановлена и используется до 8 вскрытия. После удаления тОн коллагена, очень важно, чтобы скважин сухой под капотом ламинарного потока. Количество времени, необходимое для сухой зависит от количества скважин на блюдо. Например, как правило, занимает около 5-10 минут. для скважин в 96 блюдо, чтобы высохнуть, но может занять до 30 - 40 мин при более широком формате 24 и блюда используются. Неспособность правильно высушить скважин приводит к плохому вложений ГКО. Затем повторите процедуру, используя раствор 2 мкг / мл ламинин. Инкубируйте ламинин решение, по крайней мере 2 часа при 37 ° C в увлажненной CO 2 инкубатор пока вы не готовы к пластине ваших нейронов (шаг 1.14).
- Коммерчески получить беременных самок крыс были подвергнуты эвтаназии использованием CO 2. После распыления труп с 70% этанола, П-образный надрез по всему животу. После пилинга кожа спины, второй П-образный разрез через брюшную стенку мышцы. Матка видна на подняв брюшной мышечный слой. Удаление матки и место в 15см блюдо. Аккуратно откройте матки при помощи тупого ножницами, чтобы не повредить щенка в. Каждый щенок должен быть освобожден от своего эмбрионального мешка, разорвала пуповину, и щенок протирать 70% этанола и Kimwipes.
- Работа на вскрытие капота, жертвовать нерожденных E21 крысят от стрижки головы от туловища. Направьте ножницы у основания шеи, чуть выше плеч. Чтобы разоблачить ганглиев, придавить голову (шею вверх), используя 23 игл G в трех местах: а) спинного мозга; II) кожи передней подъехал на носу и возлагали и III) пищевода / трахеи должны быть закреплены от от основания шеи.
- Посмотрите на двух SCG * расположены по обе стороны от сонной артерии бифуркации (два SCGs в зародыше). SCG находится прямо под отделение. Отделите SCG из артерий, потянув за бифуркации друг от друга. Поместите ганглиев в 12 мл L15-медиа (дополнено 0,4% D (+)-глюкозы) в 15 мл коническую трубку на льду.
* SCG является прозрачным и бесцветным по сравнению с непрозрачным, желтоватого жировой ткани, которая окружает бифуркации. Попробуйте удалить как можно больше остаточной жировой ткани и кровеносные сосуды, перед сбором ганглиях.
- Повторите 1.4 и 1.5, пока все SCGs собирают из эмбрионов.
- Осторожно центрифуги ганглиев в течение 1 мин при 600 оборотах в минуту и аспирации избыточного СМИ.
- Ресуспендируют ганглиев в 1 мл L15-средах, содержащих трипсина (0,25%, без ЭДТА) и коллагеназы (1 мг / мл). Инкубировать 30 мин при 37 ° C, агитировать каждые 10 мин.
- Добавить 10 мл C-Media (MEM 1x, 0,4% D (+)-глюкозы, 2 мМ L-глутамина, 10% FBS) для инактивации трипсина и центрифуги в течение 1 мин при 600 оборотах в минуту.
- Удалить столько трипсин / коллагеназа СМИ как возможный * и мыть ганглиев с 10 мл C-Media. Центрифуга в течение 1 мин при 600 оборотах в минуту. Повторите этот шаг сразу.
* Остаточные коллагеназы будет интерферометрыповторно с коллагеновой подложке, необходимых для крепления на клетки культуры пластины.
- Удалить мыть средствами массовой информации и повторно приостанавливать ганглиев в 1 мл C-Media и растереть использованием 21 G игла прилагается к 5 мл шприц, чтобы отделить большие скопления клеток *. Готово истирание с 23 до игла G видимого скопления разобщены.
* Будьте осторожны, не более, измельченного в порошок, так как это может привести к повреждению клеток. Если трипсина и коллагеназы лечение было успешным, максимум пятнадцать вверх и вниз циклов с 21-игла G, и три цикла с 23-игла G должно быть достаточно.
- Фильтр диссоциированных нейронов через 70 мкм нейлоновый фильтр [BD Biosciences ячейки фильтра] в 50 мл коническую трубку, чтобы отменить оставшиеся сгустки.
- Вывод 10 мкл отфильтрованного клеточной суспензии и смешать с трипанового синего, чтобы определить количество живых клеток. Подсчитать количество клеток, которые активно плюсудэ красителя помощью гемоцитометра.
- Удалить ламинин решение от 96 блюд ждет в 37 ° C инкубатор (см. шаг 1.2). Не сушите блюдо, его можно использовать сразу для гальванических ячеек, как только ламинина удаляется. Внесите * 5000-6000 общего живых клеток (50 - 100 мкл на лунку) в коллаген и ламинин предварительно покрытых 96 блюдо культуры тканей. Включает 50 нг / мл фактора роста нервов (ФРН) в C-Media.
* Очень важно использовать хороший стерильных тканевых культур, потому что антибиотики исключены из питательной среды. Кроме того, могут быть значительными вариабельность коллагена источников от разных поставщиков. У нас стабильные результаты по партии использованием коллагена хвост крысы из Millipore.
- На DIV (день в пробирке) 1 заменить C-носители, используемые для пластин клеток с 50 мкл НБМ (0,4% D (+) - глюкоза, 2 мМ L-глутамина, B-27 добавка, содержащая 50 нг / мл NGF, 5aphidicolin мкМ и 20 мкМ 5-фторурацил [5-фтор-2'-дезоксиуридина]. Инкубируйте культур в течение 5 дней *. На данный момент, trypsinizing и подсчета клеток, оставшихся в нескольких скважинах можно определить число нейронов, сохранившихся анти-митотический агент лечения. Как правило, около 1000 нейронов остаются на лунку в 96-луночный планшет.
* Проблемы с грибковой или бактериальной загрязненности, как правило, очевидны в течение первых 24 часов культуры. Проверьте каждую лунку тщательно для развития микроорганизмов до замене покрытия СМИ. Если бы только ограниченное число скважин пострадавших, их можно рассматривать с разбавленным раствором хлорной извести, промывают PBS и сушат для того, чтобы приступить к эксперименту. Мы рекомендуем повторять эксперимент, в котором любой, даже ограниченное число скважин было микробного загрязнения. При обширном микробное загрязнение наблюдается в 96 блюдо, эксперимент должен быть прекращен.
2. Заражение СКГ КультUres с HSV-1 Us11-EGFP и создания задержки
Полезные фон на вирусологические методы, в том числе основных распространения вируса, определение титра вируса, и множественность заражения (МВД), читатель может ссылаться на 5. Для обсуждения биологии вируса герпеса, мы отсылаем читателя к работе 6. Наконец, мы отсылаем читателя к 7-10 ссылки на предыдущие примеры, другие протоколы, и дополнительный фон в отношении альфа-герпесвирусов литической инфекции в СКГ нейронов и для сравнения с нашей адаптации протокола изучить ожидания и реактивации.
- На DIV 6 добавить ацикловир (ACV), конечной концентрации 100 мкМ существующих средств массовой информации в каждую лунку *. Например, если каждый и содержит 50 мл, добавляют 25 мкл 300 мкМ акции ACV. Как правило, ACV добавлен в ночь перед инфекцией, а также могут быть добавлены 6-8 часа до инфекции.
* Это бывшиевычайно важно свести к минимуму ненужные физические манипуляции с нейрона на все времена. Простое удаление и замену средств массовой информации или заражения вирусом акций должно быть сделано очень аккуратно и медленно. В противном случае, в результате механического напряжения могут отрицательно повлиять на жизнеспособность нейронов.
- На DIV 7 заразить СКГ культур с HSV-1 Us11-EGFP (описанный в работе 11) при множественности заражения (МВД) в период с 1-2 (см. комментарий ниже важной по определению оптимального МВД) *. Добавить разбавленный вирус непосредственно в существующие средства массовой информации в скважине. Включите макет-инфицированных контроля и литической инфекции положительного контроля в средствах массовой информации не хватает ACV. Позвольте перейти к инфекции в течение 2-3 часов при температуре 37 ° C.
* МВД рассчитывается титра вируса определяется путем проведения анализа доска в клетках Веро 12 и число покрытием, живые клетки посеяны в хорошо шагом 1.14. Этот расчет имеет смысл только в оперативном смысле,как общее количество клеток семенами содержит нейроны вместе с загрязняющие глии и фибробластов. Поскольку эти загрязняющие делящиеся клетки погибают от лечения с анти-митотического агенты, эффективные МВД для выживания нейронов на самом деле больше. Из начального количества, начиная от 5000 - 6000 живых клеток, около 1000 нейронов остаются после лечения анти-митотического агентов (по оценке trypsinizing и прямого подсчета клеток). Оптимальный МВД использовать при заражении культуры нейронов может несколько отличаться от подготовки массы вируса к другому. С каждым новым подготовке вирус, мы рекомендуем проверить ограниченный круг различных МВД России от 1 до 2. Цель здесь заключается в определении той, которая имеет наименьшее воздействие на жизнеспособность нейронов и приводит к наибольшим числом индуцибельной реактивации событий (определенных в разделе 3). Us11-EGFP вирус особенно полезно в условиях быстро оптимизировать условия, но можно использовать и другие показания, такие как анализ налета или количественныхtative ПЦР. Это может помочь использовать вирус очищают сахарозы подушки для удаления примесей, которые снижают жизнеспособность клеток, хотя это не является существенным и обычно не выполняются.
- Тщательно заменить инфекции СМИ со свежими НБМ, содержащий 50 нг / мл NGF и 100 мкМ * ACV.
* Очень важно быть предельно внимательны при изменении инфекции СМИ. Цель кончиком пипетки на стене хорошо, а не на дно колодца, и позволить средствам массовой информации, чтобы мягко скользить вниз на клетки. Даже быстрый выброс носителей из пипетки может генерировать достаточную силу, чтобы отделить аксоны от подложки и нанести клеткам сбрасывать как правило, в листе клеток. Если только ограниченное количество нейронов отсоединения (20-30%), последствия будут минимальными при условии, что клетки выглядят здоровыми. Отдельные нейроны могут прикрепить с течением времени, однако, аксоны больше не будет хорошо продленг новых аксонов будет восстанавливать. Хотя это и не оптимальный, эксперимент можно продолжить, если только ограниченное число скважин пострадали. Если есть обширный отряд нейронов (70-80%), мы не рекомендуем в том числе пострадавших также (ы) в эксперименте. Если большинство скважин содержат 70-80% отдельных нейронов, мы рекомендуем прекращении эксперимента. В то время как нейроны могут еще прикрепить, они обычно образуют большие скопления. Это затрудняет правильную оценку отдельных нейронов активируется. Мы рекомендуем повторять любой эксперимент, в котором отдельные скважины с нейроны были обнаружены, чтобы реактивация ставки не зависит от дифференциальных соблюдение нейронов скважин.
Кроме того, очень важно всегда обращаться культур как нежно, как возможно. Механическое напряжение от лишних, резких движений (в том числе повторное открытие и закрытие двери камеры инкубатора) или силового медиа-приложения сульд компромисс культур способность поддерживать ВПГ-1 задержкой, что может привести к недопустимо высоким уровнем спонтанной реактивации в данном эксперименте.
- Поддерживать культуру в течение 6 дней, во время которого вирус будет установить задержку. В этот период использовать флуоресцентный микроскоп для контроля здоровья и нейрон-Us11 EGFP выражение как индикатор литической репликации. Us11-EGFP должны быть обнаружены только в контрольных скважинах отсутствует ACV лечения, что указывает на успешное первичное инфицирование и продуктивной литической репликации. Нейроны могут показать цитопатического эффекта даже при отсутствии производительных вирусного роста. Инфицированных культур следует тщательно контролировать и по сравнению с макетом инфицированных нейронов.
3. Возобновление и оценки
- На DIV 14, тщательно заменить ACV-содержащих средств массовой информации со свежими средах без ACV. В случае необходимости, включают фармакологические (или биологическое) переменные в это время. Будьте сЮр, чтобы соблюдать меры предосторожности, указанные в 2.3.
- За 5-6-дневный период, следить за живыми культурами помощью флуоресцентного микроскопа обнаружить нейроны, подвергающихся повторной активации. Кроме сбора образцов для других видов анализов (белки, нуклеиновые кислоты и т.д. доска анализ).
- Рассчитать частоту реактивации путем подсчета количества скважин, содержащих EGFP-позитивных нейронов и выразить это в процентах от общего количества образцов скважин. Обратите внимание, что EGFP выражение в индивидуальном и не делает различия между первичным событием возобновление и последующее заражение из-за вирусного распространения. С распространением инфекционных содержится в одной культуры и одного или нескольких EGFP-позитивных нейронов в скважину оперативно определяется как возобновление событий в этих условиях.
* Несколько событий реактивация может произойти в культуре, как описано в разделе 1. Чтобы отличить первичный случай реактивация вирусного распространения в результате реакции тивации, encapsidation ингибитор WAY-150138 может быть добавлен. Блокируя encapsidation, инфекционный вирус не производятся и распространяются в результате реактивации не представляется возможным. Таким образом, EGFP сигнал обнаружен в присутствии WAY-150138 отражает количество независимых событий в реактивации ожог культуры и 1,13-15. Обратите внимание, что WAY-150138 действует только в отношении ВПГ-1 штамм Паттон, а не на коммерческой основе. В качестве альтернативы WAY-150138, рассмотрите возможность использования любого из следующих: а) мутантный вирус нарушения в его способности распространяться на соседние клетки могут быть использованы, II), где репортер вирус EGFP выражается в IE промоутер в постоянном присутствии от ACV, III) лечение с ПАА или ACV, чтобы предотвратить конце экспрессии генов (и инфекционных производство вирус), а затем иммунофлюоресценции с использованием антител, направленных против продуктов генной IE.
4. Альтернативные методы оценки Возобновление использования Пробирной
Отправить по почте "> Результаты человека, одного эксперимента должны быть получены из одного подготовки СКГ. Replicate эксперименты могут быть выполнены с независимой подготовкой SCG тех пор, пока каждый репликации был проведен с использованием одного пакета ГКО.- Оценка ВПГ-1 литических стенограммы. Соберите РНК в нужное время после удаления ACV в присутствии или отсутствии различных экспериментальных индукторы реактивации. При использовании 96 пластин культуры, мы рекомендуем объединения по крайней мере 20 скважин вместе для каждого образца (примерно 10 5 клеток в образце РНК). Кроме того, SCGs могут быть покрыты в больших ямах (например, для 24-луночного планшета, используйте 4-5 х10 4 клеток / лунку). Хотя это, конечно, можно обнаружить РНК с менее чем 20 скважин, в небольших объемах участвуют в результате необоснованного образца к образцу изменчивости.
- Выявление ВПГ-1 литических белков. Соберите лизатов в заданное время после индукции реактивации. Добавить 7,5 мкл лизис буфера для каждого из 10 Втлоктя в 96 ячейках и анализировать на SDS-PAGE и иммуноблоттинга. Кроме того, вирусные белки могут быть обнаружены путем непрямой иммунофлюоресценции микроскопии. Первоначально покрытие должно быть сделано на монтаж подложки для работы с изображениями, таких как стерильные покровного стекла, которые были предварительно покрытой поли-D-лизин (0,2 мг / мл, Sigma) до применения коллагена и ламинина (см. 1.10) .
- Выявление инфекционных частиц. Соберите супернатанта культуры на реактивации. Выполнить анализ налета на монослоя клеток Веро использованием серийных разведений супернатант. Кроме того, налет анализов могут быть выполнены с использованием лизатов замораживания талых культур включают клетки связанных частиц, чтобы определить титр.
5. Представитель Результаты
Рисунок 2А показывает пример, когда 1 мкМ трихостатин (TSA), известный индуктор реактивации 16-18, применяется к СКГ культуры латентно инфицированных дикого типа HSV1 EGFP-Us11 репортер напряжения. С TSA, реактивация достигает 50% от максимальной в течение 2 дней, а на 5 дней возобновление плато около 60% скважин. Базовая линия («спонтанное») реактивации примерно на 10% в этом эксперименте, и обычно составляет от 10-20% при использовании этой системы в лабораторных условиях. Максимальные уровни реактивации варьироваться в зависимости от реактивации индуктора используется. Многие индукторы реактивации могут применяться в течение всего срока проведения эксперимента, поскольку они не мешают продуктивной репликации вируса, но это должно быть определено опытным путем. Другие индукторы, в том числе любой реагент, который влияет на жизнеспособность нейронов или препятствует завершению вирусной производственного цикла жизни, может потребоваться применение переходного импульса, чтобы спровоцировать возобновление.
В то время как накопление EGFP-Us11 в каждую лунку эксперимента изображена на рисунке 2А свидетельствует о возобновлении с задержкой, он не различает лиUs11-EGFP сигнала в отдельных нейронов, полученных из независимых случай возобновления или распространения вируса возобновлена через культуру. Для оценки числа нейронов проходят независимые события реактивации в каждую лунку, культуры были предварительно обработаны с WAY-150138, соединения, запрещающего распространение вирусных, предотвращая encapsidation из вирусной ДНК генома 13-15. Зараженные симпатических нейронов культуры лечили WAY-150138 и реактивации индуцированные АСП. Значительное число EGFP-положительных нейронов был обнаружен лишь в TSA-обработанных скважин, по сравнению с ДМСО обработанных культуры управления, демонстрируя, что число независимых событий реактивация происходит в отдельных культуры (рис. 2В).
В нашем анализе, Us11-EGFP репортер выражается с эндогенными Us11 промоутер 11. С Us11 является "истинно поздно" или γ 2 вирусных литического генов, репликации ДНК, необходимых для надежной expressiо. Это показано на рисунке 3, а EGFP-Us11 накопления нарушена вирусной ДНК-полимеразы ингибитора phosphonoacetic кислоты (ПАК) в культурах вынуждены возобновить с PI3 ингибитор LY294002.
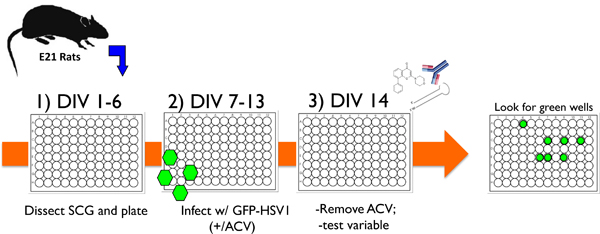
Рисунок 1. Схема иллюстрирует типичный экспериментальный протокол, используя культурные нейрона в системе лабораторных для изучения ВПГ-1 и задержкой реактивации. 1) После вскрытия верхних шейных ганглиев (ГКО) от E21 крыс, диссоциированных нейронов высевают в 96 посуда и лечение анти-митотического средства для удаления не-нервных клеток. 2) После 6 дней в пробирке (DIV) культур, инфицированных рекомбинантным ВПГ-1, который содержит EGFP слит с вирусом в кодировке Us11 конце гена (EGFP-HSV-1) в присутствии ацикловир (ACV), противовирусный препарат, который литических блоков репликации. 3) К 14-й день (DIV 14), ацикловир удаляется и EGFP выраженияне обнаружено. Культуры могут стабильно поддерживаться таким образом, в течение 1 месяца или более, или испытание переменным могут быть добавлены для оценки его способности вызывать реактивацию с задержкой. Переменная может быть в виде небольшого ингибитор химических молекул, антител к растворимым нейротрофина или белков клеточной поверхности, или лентивирусов выражения или генов конкретного ShRNA или эктопически выразил белка. Возобновление затем контроль, забив EGFP-положительных скважин в режиме реального времени.
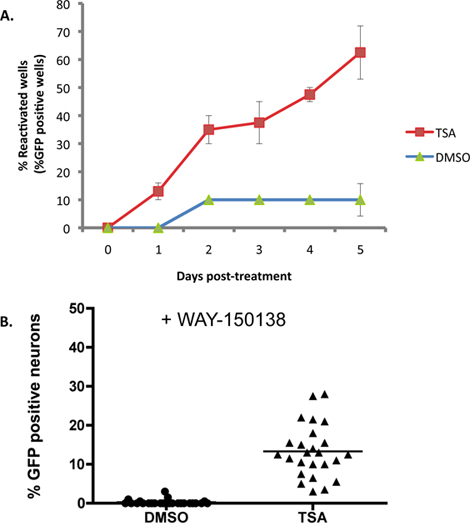
Рисунок 2. TSA активизирует ВПГ-1 в СКГ культур. СКГ культур латентно инфицированных как показано на рис 1. На DIV 14, ACV был удален и заменен на среде, содержащей 1 мкМ трихостатин (TSA). (A) культуры были визуализированы и забил с помощью флуоресцентной микроскопии каждый день после того, как препарат для лечения в течение 5 дней. Доля скважин проходит reactivatион в течение эксперимента показали по сравнению с ДМСО контроль обработанных культур. Процент реактивации была рассчитана на количество EGFP-положительных скважин из 20 скважин, из 96 пластин культуры. Ошибка указывает барах стандартная ошибка среднего. (B) латентно инфицированных культур лечили TSA и ингибитор вирусной ДНК encapsidation, WAY-150138 (20 мкг / мл). Количество EGFP + нейронов по сравнению 48 часов после обработки препаратов для контроля лечения с ДМСО и WAY-150138. Каждая точка данных представляет собой отношение EGFP + нейроны из 1000 нейронов в культуре хорошо. Бар показывает средний процент EGFP + нейронов в колодец.
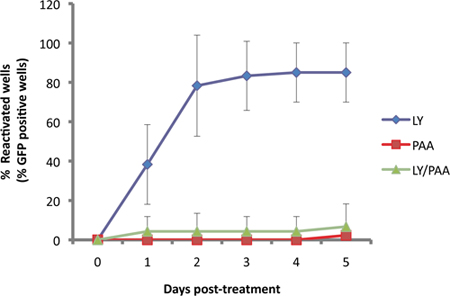
Рисунок 3. EGFP detecion зависит от вирусной репликации ДНК. СКГ культур латентно инфицированных затем обрабатывают 10 мкМ LY29004, известный индуктор реактивации 1. Возобновление индуцированных LY (синий) вапо сравнению с тем, получавших ингибитор синтеза вирусной ДНК, phophonoacetic кислоты, ПАК (300μg/ml, красный) и два соединения вместе (зеленый).
Обсуждение
Это первичной культуре нейронов и инфекции система обеспечивает простой и эффективный метод для изучения молекулярных механизмов, лежащих в основе HSV-1 и задержкой реактивации. Система точно повторяет принятое признаки задержки определен в обоих инфекций человека и...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы благодарим рецензентов за их вдумчивые предложения, которые помогли улучшить эту рукопись. Эта работа была поддержана грантами на MVC (NS21072, HD23315), ACW (GM61139, S10RR017970) и IM (AI073898, GM056927) из NIH. MK была частично поддержана грантом NIH обучение (5T32 AI007180).
Материалы
| Name | Company | Catalog Number | Comments |
| Реагент | Компания | Каталог # | Комментарии |
| 70μm нейлоновый фильтр (ячейка фильтр) | BD Biosciences | 352350 | |
| Сбалансированные соли 1x Хэнка Решение (HBSS - / -) | Invitrogen | 14175 | без CaCl 2 и MgCl 2 |
| 1x минимально необходимой информации (MEM) | Invitrogen | 11095-080 | |
| 5-фтор-2'-дезоксиуридина | Сигма | F0503 | подготовить 20 мМ акций 1x MEM, хранить при -20 ° C |
| 96-а также плоские днища ТС | Гранулирование | 3599 | |
| Ацикловир | Calbiochem | 114798 | подготовить запас 31 мм в ДМСО, хранить при -20 ° C |
| Aphidicolin | Calbiochem | 178273 | подготовить 10 мМ акции в ДМСО, хранить при -20 ° C |
| B-27 Дополнение | Invitrogen | 17504-44 | |
| Коллагеназы | Сигма | C2674 | подготовить 10 мг / мл в HBSS акции - / -, хранить при -20 ° C |
| D-(+)-глюкозы | Сигма | G6152 | подготовить 40% акций H 2 O; фильтр стерилизуют и хранят при температуре 4 ° C |
| L-Глютамин | Invitrogen | 25030-081 | |
| Ламинин | Сигма | L2020 | подготовить 1 мг / мл акции H 2O; быстрого замораживания 20 мклaliquats и хранят при -80 ° С, разбавленный до 2 мкг / мл рабочего конц. в стерильной H 2 O |
| Leibovit'z L-15 средств массовой информации | Invitrogen | 11415 | |
| Фактор роста нервов | Харлан лаборатории | BT.5017 | подготовить 50 мкг / мл акции HBSS - / -, магазин при -80 ° C |
| Neurobasal среднего | Invitrogen | 12348 | |
| Phosphonoacetic кислоты (ПАК) | Сигма | P6909 | подготовить 75 мг / мл акции H 2 O, хранить при -20 ° C |
| Поли-D-лизин гидробромида | Сигма | P0899 | подготовить 20 мг / мл акции H 2 O, хранить при -20 ° C |
| Крыса хвостом коллагена | Millipore | 08-115 | Концентрация зависит от питания много, хранить при 4 ° С, разбавленный до 0,66 мг / мл рабочего конц. в стерильной H 2 O |
| Трихостатин | Сигма | T8552 | подготовить 1 мМ акции в ДМСО, хранить при -20 ° C |
| Трипсина 2,5% | Invitrogen | 15090-04 |
Ссылки
- Camarena, V., Kobayashi, M., Kim, J. Y., Roehm, P., Perez, R., Gardner, J., Wilson, A. C., Mohr, I., Chao, M. V. Nature and duration of growth factor signaling through receptor tyrosine kinases regulates HSV-1 latency in neurons. Cell Host & Microbe. 8, 320-330 (2010).
- Johnson, M. I., Fedoroff, S., Richardson, A. Primary cultures of sympathetic ganglia. Protocols for Neural Cell Culture. , 71-94 (2001).
- Letourneau, P. C., Fedoroff, S., Richardson, A. Preparation of substrata for in vitro culture of neurons. Protocols for Neural Cell Culture. , 245-254 (2001).
- Price, J. P., Brewer, G. J., Fedoroff, S., Richardson, A. Serum-free media for neural cell cultures. Protocols for Neural Cell Culture. , 255-264 (2001).
- Flint, S. J., Enquist, L. W., Racaniello, V. R., Skalka, A. M. . Principles of virology. , (2008).
- Roizman, B., Pellett, P. E., Knipe, D. M., Howley, P. M. The family Herpesviridae: A brief introduction. Fields Virology. 2, 2381-2397 (2001).
- Price, R. W., Rubenstein, R., Khan, A. Herpes simplex virus infection of isolated autonomic neurons in culture: viral replication and spread in a neuronal network. Arch. Virol. 71, 127-140 (1982).
- Tomishima, M. J., Enquist, L. W. A conserved alpha-herpesvirus protein necessary for axonal localization of viral membrane proteins. J. Cell Biol. 154, 741-752 (2001).
- Ch'ng, T. H., Flood, E. A., Enquist, L. W. Culturing primary and transformed neuronal cells for studying pseudorabies virus infection. Methods Mol. Biol. 292, 299-316 (2005).
- Wang, F., Tang, W., McGraw, H. M., Bennett, J., Enquist, L. W., Friedman, H. M. Herpes simplex virus type 1 glycoprotein E is required for axonal localization of capsid, tegument, and membrane glycoproteins. J. Virol. 79, 13362-13372 (2005).
- Benboudjema, L., Mulvey, M., Gao, Y., Pimplikar, S. W., Mohr, I. Association of the herpes simplex virus type 1 us11 gene product with the cellular kinesin light-chain-related protein PAT1 results in the redistribution of both polypeptides. J. Virol. 77, 9192-9203 (2003).
- Blaho, J., Morton, E. R., Yedowitz, J. C. Herpes simplex virus: propagation, quantification and storage. Curr. Protoc. Microbiol. Chapter 14, Unit 14E.1 (2005).
- Van Zeijl, M., Fairhurst, J., Jones, T. R., Vernon, S. K., Morin, J., LaRocque, J., Feld, B. L., O'Hara, B. L., Bloom, J. D., Johann, S. V. Novel class of thiourea compounds that inhibit herpes simplex virus type 1 DNA cleavage and encapsidation: resistance maps to the UL6 gene. J. Virol. 74, 9054-9061 (2000).
- Newcomb, W. W., Brown, J. C. Inhibition of herpes simplex virus replication by WAY-150138: assembly of capsids depleted of the portal and terminase proteins involved in DNA encapsidation. J. Virol. 76, 10084-10088 (2002).
- Pesola, J. M., Zhu, J., Knipe, D. M., Coen, D. M. Herpes simplex virus 1 immediate-early and early gene expression during reactivation from latency under conditions that prevent infectious virus production. J. Virol. 79, 4516-14525 (2005).
- Arthur, J. L., Scarpini, C. G., Connor, V., Lachmann, R. H., Tolkovsky, A. M., Efstathiou, S. Herpes simplex virus type 1 promoter activity during latency establishment, maintenance and reactivation in primary dorsal root neurons in vitro. J. Virol. 75, 3885-3895 (2001).
- Danaher, R. J., Jacob, R. J., Steiner, M. R., Allen, W. R., Hill, J. M., Miller, C. S. Histone deacetylase inhibitors induce reactivation of herpes simplex virus type 1 in a latency-associated transcript- independent manner in neuronal cells. J. Neurovirol. 11, 306-317 (2005).
- Terry-Allison, T., Smith, C. A., DeLuca, N. A. Relaxed repression of herpes simplex virus type 1 genomes in murine trigenminal neurons. J. Virol. 71, 12394-12405 (2007).
- Harris, R. A., Preston, C. M. Establishment of latency in vitro by the herpes virus type 1 mutant in1918. J. Gen. Virol. 72, 907-913 (1991).
- Wagner, E. K., Bloom, D. C. Experimental investigation of herpes simplex virus latency. Clin. Microbiol. Rev. 10, 419-443 (1997).
- Strelow, L. I., Laycock, K. A., Jun, P. Y., Rader, K. A., Brady, R. H., Miller, J. K., Pepose, J. S., Leib, D. A. A structural and functional comparison of the latency-associated transcript promoters of herpes simplex virus type 1 strains KOS and McKrae. J. Gen Virol. 75, 2475-2480 (1994).
- Stroop, W. G., Banks, M. C. Herpes simplex virus type 1 strain KOS-63 does not cause acute or recurrent ocular disease and does not reactivate ganglionic latency in vivo. Acta Neuropathol. 87, 14-22 (1994).
- Sawtell, N. M., Poon, D. K., Tansky, C. S., Thompson, R. L. The latent herpes simplex virus type 1 genome copy number in individual neurons is virus strain specific and correlates with reactivation. J. Virol. 72, 5343-5350 (1998).
- Thompson, R. L., Cook, M. L., Devi-Rao, G., Wagner, E. K., Stevens, J. G. Functional and molecular analysis of the avirulent wild-type herpes simplex virus type 1 strain KOS. J. Virol. 58, 203-211 (1986).
- Wilcox, C. L., Smith, R. L., Freed, C. R., Johnson, E. M. Nerve growth factor-dependence of herpes simplex virus latency in peripheral sympathetic and sensory neurons in vitro. J. Neurosci. 10, 1268-1275 (1990).
- Roehm, P. C., Camarena, V., Gardner, J. B., Wilson, A. C., Mohr, I., Chao, M. V. Cultured vestibular ganglion neurons demonstrate latent herpes simplex type I reactivation. Laryngoscope. 121, 2268-2275 (2011).
- Kuhn, M. A., Nayak, S., Camarena, V., Gardner, J., Wilson, A., Mohr, I., Chao, M. V., Roehm, P. C. A cell culture model of facial palsy resulting from reactivation of latent herpes simplex virus type 1. Otology & Neurotology. , (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены