A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تنقية والتصور من Lipopolysaccharide من البكتريا سالبة الجرام بواسطة استخراج مائي، الفينول الساخن
In This Article
Summary
نحن تصف تعديل حار طريقة استخراج مائي، الفينول لتنقية lipopolysaccharide (بي إس) من الجراثيم سلبية الغرام. انتزعت مرة، يمكن تحليلها في وقت لاحق من قبل LPS SDS-PAGE وتصور من قبل تلطيخ مباشرة أو طخة مناعية الغربية.
Abstract
Lipopolysaccharide (LPS) عنصرا رئيسيا من الأغشية سلبية الغرام الخارجي الجرثومي. هذا هو جزيء الدهون الثلاثية التي تتكون من ألف والذي يتجسد في الغشاء الخارجي، وهو جوهر oligosaccharide وتكرار O-مستضد الوحدات التي تمتد إلى الخارج من سطح الخلية 1 و 2. LPS هو جزيء سائد مناعيا أن المهم بالنسبة للخبث والتسبب في العديد من الأنواع البكتيرية، بما في ذلك الزائفة الزنجارية، والأنواع السالمونيلا، والإشريكية القولونية 3-5، والاختلاف في شكل LPS تكوين O-مستضد أساس التنميط المصلي من السلالات. وتشارك LPS في المرفق لاستضافة خلايا في بدء الإصابة، ويوفر حماية من تكملة بوساطة القتل؛ السلالات التي تفتقر LPS يمكن أن تكون مخففة عن خبث 6-8. لهذه الأسباب، من المهم أن تصور LPS، وخاصة من السلالات الإكلينيكية. تصور LPS النطاقات أنماط واعتراف محدد 1ويمكن أن تكون أدوات مفيدة ntibodies لتحديد الأنساب وسلالة لتوصيف مختلف المسوخ.
في هذا التقرير، وصفنا ساخنة مائي، الفينول طريقة لعزل وتنقية LPS من سلبية الغرام الخلايا البكتيرية. هذا البروتوكول يسمح لاستخراج LPS بعيدا عن الأحماض النووية والبروتينات التي يمكن أن تتداخل مع تصور من LPS التي تحدث مع أقصر، وطرق استخلاص أقل كثافة 9. أعد LPS يمكن فصلها بهذه الطريقة من قبل كبريتات الصوديوم دوديسيل (SDS)-بولكرلميد الكهربائي للهلام (صفحة) والملون مباشرة باستخدام الكربوهيدرات / بروتين سكري البقع أو معيار أساليب تلطيخ الفضة. العديد من الأمصال المضادة لللLPS تحتوي على الأجسام المضادة التي مع بروتينات الغشاء الخارجي أو الأهداف المستضدية الأخرى التي يمكن أن تعوق عبور رد فعل، لوحظ التفاعل بعد طخة مناعية الغربية من SDS-PAGE-فصل lysates خلية النفط الخام. علاج البروتيني من lysates خلية النفط الخام وحدها ليست دائما وسيلة فعالة لإزالة هذهالخلفية باستخدام هذا التصور أو أساليب أخرى. كذلك، يمكن معالجة الأنزيم البروتيني واسعة في محاولة لإزالة هذه الخلفية تؤدي إلى LPS جودة الفقيرة التي لم يتم حلها بشكل جيد من قبل أي من الطرق المذكورة أعلاه. لهذه الأسباب، فإننا نعتقد أن البروتوكول التالي، المقتبس من Westpahl وجن 10، يعتبر مثاليا لاستخلاص LPS.
Protocol
1. إعداد البكتيريا لاستخراج LPS
- بدء ثقافة بين عشية وضحاها في 5 مل من مرق لوريا (LB)، على أن تستكمل مع المضادات الحيوية إذا لزم الأمر. تنمو ثقافة بين عشية وضحاها (12-18 ساعة) في هز حاضنة عند 37 درجة مئوية في الدقيقة 200 و.
- تمييع 1:10 ثقافة مع LB واتخاذ 600 OD القراءة في معمل. واستنادا إلى القراءة 600 التطوير التنظيمي، وجعل التعليق 1.5 مل من البكتيريا الخاصة بك إلى OD 600 من 0.5.
- بيليه البكتيريا في microcentrifuge في ز س 10600 لمدة 10 دقائق. إزالة والتخلص من طاف. ويمكن تخزين بيليه في -20 درجة مئوية، إذا LPS لن يكون استخراجه مباشرة.
2. استخراج LPS
- أولا، إعداد 2X SDS العازلة. جعل حل 50 مل من 4٪ β-المركابتويثانول SDS، (BME) 4٪ و 20٪ الجلسرين في 0.1 م تريس، حمض الهيدروكلوريك، ودرجة الحموضة 6.8. إضافة قليل من اللون الأزرق برموفينول لصبغ الحل. جعل SDS-العازلة 1X الأوراق المالية عن طريق تمييع 2X قتوك 1:1 في معقم المقطرة O. 2 H ويمكن تخزين هذا في درجة حرارة الغرفة.
- جعل ثلاث عمليات منفصلة 10 ملغ / مل حلول من أنا الدناز، ريبونوكلياز، وK بروتين في معقم المقطرة O. 2 H
- Resuspend البكتيريا مكعبات من الخطوة 1.3 في 200 ميكروليتر من 1X SDS-العازلة. ضمان معلق تماما بيليه بواسطة pipetting الحل صعودا ونزولا ببطء. لا دوامة.
- غلي البكتيريا العالقة في حمام مائي لمدة 15 دقيقة. السماح للحل لتبريد في درجة حرارة الغرفة لمدة 15 دقيقة.
- إضافة 5 ميكرولتر من أنا الدناز على حد سواء والحلول ريبونوكلياز أعدت في 2.2. احتضان هذه العينات على 37 درجة مئوية لمدة 30 دقيقة. * هذه الخطوة اختيارية، وليس هناك فارق ضئيل في نوعية LPS بين عينات nuclease المعاملة وغير المعاملة.
- إضافة 10 ميكرولتر من محلول K بروتيناز أعدت في 2.2. احتضان هذه العينات على 59 درجة مئوية لمدة 3 ساعات. لا يمكن أن يؤديها هذه الخطوة بين عشية وضحاها، إذا كان هناك ضيق الوقت.
- إلى كل إعلان، عينةد 200 ميكرولتر من (ويمكن استخدام المياه المشبعة الفينول كبديل إذا تريس المشبعة الفينول غير متوفر) المثلج تريس المشبعة الفينول. ضمان سقف لتغلق الأنابيب بإحكام، ودوامة كل عينة لنحو 5 إلى 10 ثوان.
- احتضان هذه العينات على 65 درجة مئوية لمدة 15 دقيقة، vortexing في بعض الأحيان. بعد احتضان بارد إلى درجة حرارة الغرفة، ثم يضاف 1 مل من درجة حرارة الغرفة ايثر على كل عينة ودوامة لمدة 5 إلى 10 ثوان. مما لا شك فيه لأداء الأثير في مقبض غطاء الدخان، كما هو الحال المضطربة.
- منبذة العينات في ز س 20600 لمدة 10 دقائق. إزالة بعناية عينات من أجهزة الطرد المركزي واستخراج الطبقة السفلية الزرقاء. مما لا شك فيه لتجنب العلوي، وطبقة واضحة. تاركين وراءهم كمية صغيرة من طبقة الأزرق هو الأفضل للتلوث مع الطبقة العليا.
- إعادة استخراج عينات بتكرار الخطوات 2،7-2،9. اثنان الاستخراج تكفي عادة. إذا كانت عينات يبدو غائما، قد يكون أكثر الاستخراج performeد. إضافة 200 ميكرولتر من العازلة، SDS 2X إلى كل من العينات المستخرجة قبل فصل بواسطة SDS-PAGE. يمكن تشغيل العينات في 8٪ الهلام SDS-بولكرلميد -15٪. خمسة إلى 15 ميكرولتر من LPS أعد استخدام هذا الأسلوب هو ما يكفي لتصور عادة.
3. ممثل النتائج
يمكن أن عينات LPS أعدت على النحو الوارد أعلاه يمكن تصور من قبل تلطيخ مباشرة بعد الانفصال عن SDS-PAGE باستخدام معيار الفضة تلطيخ بروتوكول أو تلطيخ LPS عدة متاحة تجاريا. بدلا من ذلك، يمكن أن تنتقل LPS فصلها عن مادة هلامية بولكرلميد إلى غشاء النيتروسليلوز وتعرض لغربي immunoblotting باستخدام LPS محددة لمكافحة الأمصال. لهذا البروتوكول، وكنا الموالية للس الزمرد جل Lipopolysaccharide 300 كيت اللطخة (المسابر الجزيئية)، واتباع إرشادات الشركة المصنعة.
هو مبين في الشكل 1 هو الموالية للس الزمرد 300 ملون 12٪ SDS-بولكرلميد هلام. كل حارة يحتوي على 15 ميكرولتر من LPS أعدت من DIFعزل سلالات من ferent مؤلم بيركولديريا من عينات البلغم من مرضى التليف الكيسي. LPS مختلف أنماط النطاقات وسلم، وتعكس أرقام مختلفة O-مستضد تكرار وحدات ملحقة oligosaccharide الأساسية، واضحة باستخدام هذا الأسلوب، على سبيل المثال، والعينات في حارة 1 و 6 لديها أنماط مماثلة ربط بعضها ببعض (محاصر في الحمراء).
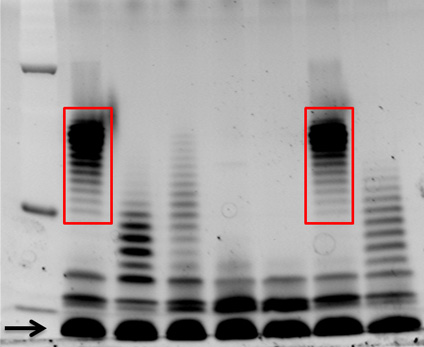
الشكل 1. الموالية للس الزمرد 300 LPS الملون من العزلات مؤلم بيركولديريا السريرية. LPS من سبع B. تم عزل سلالات مؤلم من تفشي هذا المرض في مرضى التليف الكيسي على النحو المبين في هذا البروتوكول. تم فصل خمسة عشر ميكرولتر على هلام SDS-بولكرلميد 12٪، والملون مع الموالية للالزمرد س 300، وفقا لتعليمات الشركة المصنعة. يشار LPS الأساسية سهم، وLPS تظهر أنماط مماثلة من النطاقات O-مستضد يكرر هي محاصر في أحمر. M = علامة الوزن الجزيئي.
Discussion
وقد وصفت لنا وسيلة لتنقية LPS بعيدا عن مكونات الخلية الأخرى، بما فيها الأحماض النووية والبروتينات. هذه الطريقة توفر جودة عالية LPS التي يمكن استخدامها في عدد من الطرق تصور مختلف، بما في ذلك الكربوهيدرات من تلطيخ SDS-PAGE المواد الهلامية، كما هو مبين في الشكل رقم 1. ويمكن است...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وأيد هذا العمل من المنح المقدمة من المعاهد الوطنية للصحة ومؤسسة التليف الكيسي.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | |
| الدناز أنا المؤتلف، ريبونوكلياز خالية | روش | 04716728001 | |
| ريبونوكلياز A | روش | 10109169001 | |
| بروتين K | الصياد | BP1700 | |
| تريس المشبعة الفينول | الصياد | BP1750-100 | |
| إثيل الأثير | توماس العلمية | C313K31 | |
| الموالية للس الزمرد جل Lipopolysaccharide 300 كيت اللطخة | المسابر الجزيئية | P20495 |
References
- Raetz, C. R., Whitfield, C. Lipopolysaccharide endotoxins. Annu. Rev. Biochem. 71, 635-700 (2002).
- Valvano, M. A. Export of O-specific lipopolysaccharide. Front. Biosci. 8, 452-471 (2003).
- Pier, G. B. Pseudomonas aeruginosa lipopolysaccharide: a major virulence factor, initiator of inflammation and target for effective immunity. Int. J. Med. Microbiol. 297, 277-295 (2007).
- Freudenberg, M. A. Role of lipopolysaccharide susceptibility in the innate immune response to Salmonella typhimurium infection: LPS, a primary target for recognition of Gram-negative bacteria. Microbes Infect. 3, 1213-1222 (2001).
- Jann, K., Jann, B. Polysaccharide antigens of Escherichia coli. Rev. Infect. Dis. 9, S517-S526 (1987).
- McCallum, K. L., Schoenhals, G., Laakso, D., Clarke, B., Whitfield, C. A high-molecular-weight fraction of smooth lipopolysaccharide in Klebsiella serotype O1:K20 contains a unique O-antigen epitope and determines resistance to nonspecific serum killing. Infect. Immun. 57, 3816-3822 (1989).
- Hancock, R. E. Pseudomonas aeruginosa isolates from patients with cystic fibrosis: a class of serum-sensitive, nontypable strains deficient in lipopolysaccharide O side chains. Infect. Immun. 42, 170-177 (1983).
- Gupta, S. K., Masinick, S., Garrett, M., Hazlett, L. D. Pseudomonas aeruginosa lipopolysaccharide binds galectin-3 and other human corneal epithelial proteins. Infect. Immun. 65, 2747-2753 (1997).
- Hitchcock, P. J., Brown, T. M. Morphological heterogeneity among Salmonella lipopolysaccharide chemotypes in silver-stained polyacrylamide gels. J. Bacteriol. 154, 269-277 (1983).
- Westphal, O., Jann, K. Bacterial lipopolysaccharides. Methods Carbohyr. Chem. 5, 83 (1965).
- Lieberman, T. D. Parallel bacterial evolution within multiple patients ties novel genes to pathogenesis. Nat Genet. , (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved