Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Purification et visualisation de lipopolysaccharide de bactéries à Gram négatif par Hot-phénol aqueux d'extraction
Dans cet article
Résumé
Nous décrivons une méthode modifiée de chaud extraction aqueuse de phénol pour purifier le lipopolysaccharide (LPS) de bactéries Gram-négatives. Une fois extraite, les LPS peuvent ensuite être analysées par SDS-PAGE et visualisés par coloration directe ou immunoblot de l'Ouest.
Résumé
Lipopolysaccharide (LPS) est une composante majeure de bactéries Gram-négatives membranes externes bactériennes. Il est une molécule tripartite composé de lipide A, qui est incorporé dans la membrane externe, un noyau oligosaccharides et répéter O-antigène unités qui s'étendent vers l'extérieur depuis la surface de la cellule 1, 2. LPS est une molécule immunodominant qui est important pour la virulence et la pathogenèse de nombreuses espèces bactériennes, y compris Pseudomonas aeruginosa, Salmonella et Escherichia coli 3-5, et les différences dans la forme LPS composition de l'antigène O la base pour le sérotypage des souches. LPS est impliqué dans l'attachement à des cellules hôtes lors de l'initiation de l'infection et offre une protection contre médiée par le complément meurtre; souches qui n'ont pas LPS peuvent être atténuées pour la virulence 6-8. Pour ces raisons, il est important de visualiser LPS, en particulier à partir d'isolats cliniques. LPS Visualisation profils de bandes et de la reconnaissance spécifique d'un parntibodies peuvent être des outils utiles pour identifier les lignées de contrainte et de caractériser différents mutants.
Dans ce rapport, nous décrivons une chaude aqueuse-phénol méthode pour l'isolement et la purification de LPS de bactéries Gram-négatives des cellules bactériennes. Ce protocole permet l'extraction de LPS l'écart des acides nucléiques et des protéines qui peuvent interférer avec la visualisation de LPS qui se produit avec plus courts, des méthodes d'extraction moins intensives 9. LPS préparés de cette façon peuvent être séparés par le dodécylsulfate de sodium (SDS)-électrophorèse sur gel de polyacrylamide (PAGE) et directement teinté à l'aide de glucides / glycoprotéine taches ou les méthodes standard de coloration à l'argent. Beaucoup anti-sérums contiennent des anticorps au LPS que des réactions croisées avec les protéines de membrane externe ou des cibles antigéniques d'autres qui peuvent nuire à la réactivité observés à la suite de l'Ouest de la immunoblot SDS-PAGE-séparés lysats cellulaires bruts. Le traitement aux protéases de lysats cellulaires bruts seuls n'est pas toujours un moyen efficace d'éliminer cettede fond en utilisant tel ou autres méthodes de visualisation. En outre, le traitement protéase vaste dans une tentative de supprimer ce fond peut conduire à LPS de mauvaise qualité qui n'est pas bien résolus par l'une des méthodes ci-dessus. Pour ces raisons, nous croyons que le protocole suivant, adapté de Westpahl et Jann 10, est idéal pour l'extraction de LPS.
Protocole
1. Préparation de bactéries pour l'extraction LPS
- Démarrer une culture de nuit dans 5 ml de milieu Luria Broth (LB), complété avec des antibiotiques si nécessaire. Cultiver la culture pendant la nuit (12-18 heures) dans un incubateur agitateur à 37 ° C et 200 rpm.
- Diluer la culture avec 1:10 LB et de prendre une DO 600 de lecture dans un spectrophotomètre. Sur la base de la DO 600 lecture, faire une suspension de 1,5 mL de vos bactéries à une DO 600 de 0,5.
- Pellet les bactéries dans une microcentrifugeuse à 10.600 x g pendant 10 minutes. Retirer et jeter le surnageant. Le culot peut être conservé à -20 ° C, si LPS ne va pas être extrait immédiatement.
2. Extraction de LPS
- Tout d'abord, préparer 2x tampon SDS. Faire une solution à 50 ml de 4% β-mercaptoéthanol (BME), 4% de SDS et 20% de glycérol dans 0,1 M de Tris-HCl, pH 6,8. Ajouter une pincée de bleu de bromophénol pour teindre la solution. Faire un 1x SDS-stock tampon en diluant 2X stac 1:1 dans distillée stérile H 2 O. Cela peut être conservé à température ambiante.
- Faites trois jumeaux 10 mg / ml des solutions de DNase I, RNase, et la protéinase K dans distillée stérile H 2 O.
- Remettre en suspension les bactéries enrobées de l'étape 1.3 dans 200 ul de SDS-1x tampon. Veiller à ce que le culot est complètement remis en suspension par pipetage la solution de haut en bas lentement. Ne pas vortex.
- Faire bouillir les bactéries en suspension dans un bain d'eau pendant 15 minutes. Laisser la solution refroidir à température ambiante pendant 15 minutes.
- Ajouter 5 pi de deux DNase I et des solutions RNase préparé en 2.2. Incuber les échantillons à 37 ° C pendant 30 minutes. * Cette étape est facultative, il ya une différence minime de la qualité de LPS entre les échantillons nucléase traités et non traités.
- Ajouter 10 ul de la solution K protéinase préparé en 2.2. Incuber les échantillons à 59 ° C pendant 3 heures. Cette étape peut être réalisée du jour au lendemain, si il ya des contraintes de temps.
- Pour chaque échantillon, annonced 200 pl de glacée Tris-phénol saturé (eau-phénol saturé peut être utilisée comme substitut si Tris-phénol saturé n'est pas disponible). S'assurer que les bouchons sur les tubes sont fermés hermétiquement et vortex chaque échantillon pendant environ 5 à 10 secondes.
- Incuber les échantillons à 65 ° C pendant 15 minutes, vortex occasionnellement. Après une incubation refroidir à température ambiante, puis ajouter 1 mL de la température ambiante diéthyléther à chaque échantillon et vortex pendant 5 à 10 secondes. Veillez à effectuer l'éther poignée dans une hotte, car il est volatil.
- Centrifuger les échantillons à 20600 x g pendant 10 minutes. Retirez délicatement les échantillons provenant de la centrifugeuse et extraire la couche fond bleu. Soyez sûr d'éviter la couche supérieure claire. Laissant une petite quantité de la couche bleue est préférable à la contamination de la couche supérieure.
- Ré-extraire les échantillons en répétant les étapes 2.7 à 2.9. Deux extractions sont généralement suffisantes. Si les échantillons apparaissent nuageux, plusieurs extractions peuvent être performed. Ajouter 200 ul de 2x SDS-tampon pour chacun des échantillons prélevés avant de se séparer par SDS-PAGE. Les échantillons peuvent être exécutés sur 8% -15% de SDS-polyacrylamide gels. Cinq à quinze ul de LPS préparés en utilisant cette méthode est généralement suffisante pour la visualisation.
3. Les résultats représentatifs
Échantillons LPS préparés comme ci-dessus peuvent être visualisées par coloration directe après la séparation par SDS-PAGE en utilisant un étalon-argent-coloration protocole ou d'un kit de coloration disponibles dans le commerce LPS. Alternativement, LPS séparés sur un gel de polyacrylamide peut être transféré à une membrane de nitrocellulose et soumis à un Western immunoblot en utilisant le LPS spécifique anti-sérums. Pour ce protocole, nous avons utilisé le Pro-Q Emerald 300 Kit Gel Teinté Lipopolysaccharide (Molecular Probes), et suivi les instructions du fabricant.
Illustré à la figure 1 est une Pro-Q Emerald 300 teinté 12% SDS-gel de polyacrylamide. Chaque voie contient 15 pl de LPS préparés à partir de difsouches différentes de Burkholderia dolosa isolé à partir d'échantillons de crachats de patients atteints de mucoviscidose. LPS Différents profils de bandes réfléchissantes échelle, des nombres différents de l'antigène O répéter les unités rattachées au noyau oligosaccharide, sont manifestes en utilisant cette méthode, par exemple, des échantillons de la piste 1 et 6 ont les mêmes profils de bandes à l'autre (encadré en rouge).
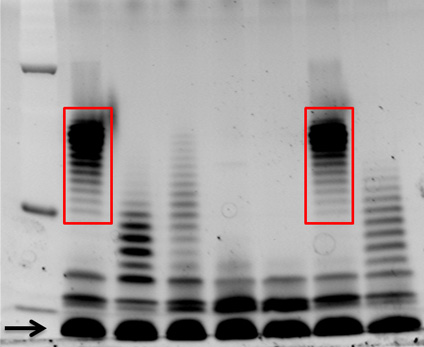
Figure 1. Pro-Q Emerald 300 LPS colorées à partir d'isolats cliniques. Dolosa Burkholderia LPS de sept B. souches dolosa d'une éclosion chez les patients atteints de fibrose kystique ont été isolés comme décrit dans le présent protocole. Quinze ul ont été séparés sur un 12% SDS-gel de polyacrylamide, et colorées avec Pro-Q Emerald 300, selon les instructions du fabricant. LPS noyau est indiquée d'une flèche, et le LPS montrant des profils de bandes similaires de O-antigène répète sont encadrés en rouge. M = marqueur de poids moléculaire.
Discussion
Nous avons décrit un procédé de purification LPS l'écart des autres composants cellulaires, y compris les acides nucléiques et des protéines. Cette méthode offre une haute qualité LPS qui peuvent être utilisés dans un certain nombre de méthodes de visualisation différentes, y compris la coloration des glucides gels SDS-PAGE, comme le montre la figure 1. Cette méthode peut être utilisée au sérotype LPS à partir d'une variété de souches, à l'aide spécifique anti-sérums, ou pour montrer la...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Ce travail a été soutenu par des subventions du National Institutes of Health et la Fondation de la fibrose kystique.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | |
| DNase I recombinante, sans RNase | Roche | 04716728001 | |
| RNase A | Roche | 10109169001 | |
| Protéinase K | Pêcheur | BP1700 | |
| Tris-phénol saturé | Pêcheur | BP1750-100 | |
| Ether diéthylique | Thomas scientifique | C313K31 | |
| Pro-Q Emerald 300 Kit Gel Teinté Lipopolysaccharide | Molecular Probes | P20495 |
Références
- Raetz, C. R., Whitfield, C. Lipopolysaccharide endotoxins. Annu. Rev. Biochem. 71, 635-700 (2002).
- Valvano, M. A. Export of O-specific lipopolysaccharide. Front. Biosci. 8, 452-471 (2003).
- Pier, G. B. Pseudomonas aeruginosa lipopolysaccharide: a major virulence factor, initiator of inflammation and target for effective immunity. Int. J. Med. Microbiol. 297, 277-295 (2007).
- Freudenberg, M. A. Role of lipopolysaccharide susceptibility in the innate immune response to Salmonella typhimurium infection: LPS, a primary target for recognition of Gram-negative bacteria. Microbes Infect. 3, 1213-1222 (2001).
- Jann, K., Jann, B. Polysaccharide antigens of Escherichia coli. Rev. Infect. Dis. 9, S517-S526 (1987).
- McCallum, K. L., Schoenhals, G., Laakso, D., Clarke, B., Whitfield, C. A high-molecular-weight fraction of smooth lipopolysaccharide in Klebsiella serotype O1:K20 contains a unique O-antigen epitope and determines resistance to nonspecific serum killing. Infect. Immun. 57, 3816-3822 (1989).
- Hancock, R. E. Pseudomonas aeruginosa isolates from patients with cystic fibrosis: a class of serum-sensitive, nontypable strains deficient in lipopolysaccharide O side chains. Infect. Immun. 42, 170-177 (1983).
- Gupta, S. K., Masinick, S., Garrett, M., Hazlett, L. D. Pseudomonas aeruginosa lipopolysaccharide binds galectin-3 and other human corneal epithelial proteins. Infect. Immun. 65, 2747-2753 (1997).
- Hitchcock, P. J., Brown, T. M. Morphological heterogeneity among Salmonella lipopolysaccharide chemotypes in silver-stained polyacrylamide gels. J. Bacteriol. 154, 269-277 (1983).
- Westphal, O., Jann, K. Bacterial lipopolysaccharides. Methods Carbohyr. Chem. 5, 83 (1965).
- Lieberman, T. D. Parallel bacterial evolution within multiple patients ties novel genes to pathogenesis. Nat Genet. , (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon