A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
טיהור ויזואליזציה של Lipopolysaccharide של חיידקים גראם שליליים, על ידי הפקת מימית, פנול חם
In This Article
Summary
אנו מתארים שיטה שונה חמה מימית, פנול החילוץ לטיהור lipopolysaccharide (LPS) של חיידקים גראם שליליים. חילוץ פעם, LPS ניתן לנתח לאחר מכן על ידי SDS-PAGE ו דמיינו ידי צביעה ישירה או immunoblot המערבי.
Abstract
Lipopolysaccharide (LPS) מהווה מרכיב מרכזי של גראם שליליים הקרומים החיצוניים חיידקים. זוהי מולקולה משולשת המורכבת השומנים, אשר מוטבע קרום חיצוני, ליבה oligosaccharide וחזרה O-אנטיגן יחידות להאריך החוצה מפני השטח של התא 1, 2. LPS הוא מולקולה immunodominant כי חשוב ארסיות ו בפתוגנזה של מיני חיידקים רבים, כולל Pseudomonas aeruginosa, מיני סלמונלה, אשריכיה קולי ו 3-5, וההבדלים בצורת O-אנטיגן הרכב LPS בסיס serotyping של זנים. LPS הוא מעורב מצורף לארח תאים על תחילתו של זיהום ומספק הגנה מפני הרג השלמה בתיווך, זנים חסרי LPS יכול להיות נחלש עבור ארסיות 6-8. מסיבות אלו, חשוב לדמיין LPS, בעיקר קליני מבודד. LPS חזותי שהתקבצו דפוסי הכרה על ידי ספציפיתntibodies יכול להיות כלי שימושי לזיהוי השושלות להתאמץ כדי לאפיין מוטנטים שונים.
בדו"ח זה, אנו מתארים שיטה חמה מימית, פנול עבור בידוד וטיהור של LPS של גראם שליליים תאים חיידקיים. פרוטוקול זה מאפשר מיצוי של LPS הרחק חומצות גרעין וחלבונים שיכול להפריע ויזואליזציה של LPS המתרחשת עם, שיטות קצרות יותר החילוץ פחות אינטנסיבית 9. LPS מוכן בדרך זו יכול להיות מופרדים על ידי נתרן גופרתי dodecyl (SDS), ג'ל אלקטרופורזה polyacrylamide (עמוד) ומוכתמת ישירות באמצעות פחמימות / גליקופרוטאין כתמים או צביעה רגילה ושיטות כסף. רבים נגד סרה כדי LPS מכיל נוגדנים צולבות להגיב עם חלבונים בממברנה החיצונית או מטרות אנטיגני אחרות שיכולות להפריע תגובתיות שנצפו בעקבות immunoblot המערבי של SDS-PAGE מופרד lysates סלולריים הגולמי. טיפול פרוטאז של lysates תא גולמי בלבד לא תמיד הדרך היעילה של הסרת זורקע שימוש או שיטות הדמיה אחרות. יתר על כן, הטיפול פרוטאז נרחב בניסיון להסיר את הרקע יכול להוביל LPS באיכות ירודה אשר לא נפתרה היטב בכל אחת מהשיטות הנ"ל. מסיבות אלו, אנו מאמינים כי הפרוטוקול הבא, עיבוד Westpahl ו ג'אן 10, הוא אידיאלי להפקת LPS.
Protocol
1. הכנת חיידקים להפקת LPS
- התחל התרבות לילה 5 מ"ל של מרק לוריא (LB), השלימו עם אנטיביוטיקה במידת הצורך. לגדול בתרבות לילה (12-18 שעות) בעוד כמה רועדות החממה ב 37 מעלות צלזיוס ו -200 סל"ד.
- לדלל את 1:10 עם התרבות LB ולקחת קריאה 600 OD ב ספקטרופוטומטר. בהתבסס על קריאה OD 600, להפוך את ההשעיה 1.5 מ"ל של חיידקים שלך OD של 600 0.5.
- גלולה החיידקים microcentrifuge על 10,600 X גרם במשך 10 דקות. הסר וזורקים supernatant. גלולה ניתן לאחסן ב -20 מעלות צלזיוס, אם LPS לא הולך להיות מופק באופן מיידי.
2. הפקת LPS
- ראשית, להכין מאגר 2x SDS. הפוך את הפתרון 50 מ"ל של 4% β-mercaptoethanol (BME), SDS 4% ו גליצרול 20% ב 0.1 M Tris-HCl, pH 6.8. הוספת קמצוץ כחול bromophenol לצבוע את הפתרון. הפוך את המניות SDS-חיץ 1x ידי דילול של 2Xטוק 01:01 ב סטרילית מזוקקים H 2 O. זה יכול להיות מאוחסן בטמפרטורת החדר.
- תן שלוש נפרדות 10 מ"ג / מ"ל פתרונות של DNase אני, RNase, ו proteinase K ב סטרילית מזוקקים H 2 O.
- Resuspend החיידקים pelleted משלב 1.3 ב 200 μl של 1x-SDS המאגר. ודא גלולה הוא resuspended לחלוטין pipetting הפתרון מעלה ומטה באיטיות. אל המערבולת.
- מרתיחים את החיידקים מושעה באמבט מים במשך 15 דקות. אפשר פתרון להתקרר בטמפרטורת החדר במשך 15 דקות.
- הוסף 5 μl של שניהם אני DNase פתרונות RNase ערוכים 2.2. דגירה דגימות ב 37 מעלות צלזיוס במשך 30 דקות. * שלב זה הוא אופציונלי, יש הבדל מזערי באיכות LPS בין דגימות nuclease שטופלו ולא טיפול.
- הוסף 10 μl של הפתרון K proteinase ערוכים 2.2. דגירה דגימות ב 59 מעלות צלזיוס במשך 3 שעות. שלב זה יכול להתבצע בין לילה, אם יש אילוצי זמן.
- כל מודעה המדגם,ד 200 μl של קר כקרח טריס רווי פנול (מים רווי פנול ניתן להשתמש כתחליף אם טריס רווי פנול אינו זמין). להבטיח את המכסים על צינורות סגורים בחוזקה, מערבולת כל דגימה של כ 5 עד 10 שניות.
- דגירה דגימות ב 65 מעלות צלזיוס במשך 15 דקות, vortexing מדי פעם. לאחר דוגרים מצננים לטמפרטורת החדר, ולאחר מכן להוסיף 1 מ"ל של האתר בטמפרטורת החדר diethyl למדגם כל המערבולת במשך 5 עד 10 שניות. הקפידו לבצע אתר ידית במנדף, כפי שהוא הפכפך.
- צנטריפוגות מדגמים על 20,600 X גרם במשך 10 דקות. מוציאים בזהירות את דגימות צנטריפוגות ולחלץ את השכבה התחתונה כחולה. יש להקפיד למנוע את השכבה העליונה, ברור. משאירים מאחוריהם כמות קטנה של שכבת כחול עדיף על זיהום בשכבה העליונה.
- לחלץ מחדש את הדגימות על ידי חזרה על שלבים 2.7-2.9. שתי עקירות מספיקים בדרך כלל. אם הדגימות מופיעות מעונן, עקירות יותר עשוי להיות performeד. הוסף 200 μl של חיץ-SDS 2x לכל אחד דגימות שנלקחו לפני הפרדה על ידי-SDS. דוגמאות ניתן להפעיל על 8% -15% SDS-polyacrylamide ג'ל. חמש עד 15 μl של LPS שהוכנו בשיטה זו הוא בדרך כלל מספיק להדמיה.
3. נציג תוצאות
דגימות תקליטים שהוכנו לעיל ניתן דמיינו ידי צביעה ישירה לאחר ההפרדה על עמוד SDS באמצעות פרוטוקול סטנדרטי כסף מכתים או LPS זמינים מסחרית ערכת צביעה. לחלופין, LPS המופרדים על ג'ל polyacrylamide ניתן להעביר קרום nitrocellulose ו נתון המערבי immunoblotting באמצעות LPS ספציפי נגד סרה. עבור פרוטוקול זה, השתמשנו Pro-Q אמרלד 300 ג'ל Lipopolysaccharide ערכת הכתם (בדיקות מולקולריות), ועקב אחר הוראות היצרן.
שמוצג באיור 1 הוא Pro-Q אמרלד 300 12% צבעונית SDS-polyacrylamide ג'ל. הנתיב מכיל 15 μl של LPS שהוכנו difזנים ולבניית של Burkholderia dolosa מבודד דגימות כיח של חולי סיסטיק פיברוזיס. LPS שונות שהתקבצו דפוסי הסולם, שיקוף של מספרים שונים O-אנטיגן חוזר יחידות המחוברות הליבה oligosaccharide, ניכרים בשיטה זו, לדוגמה, דגימות במסלול 1 ו 6 יש דפוסי שהתקבצו דומים זה לזה (מסגרת אדומה).
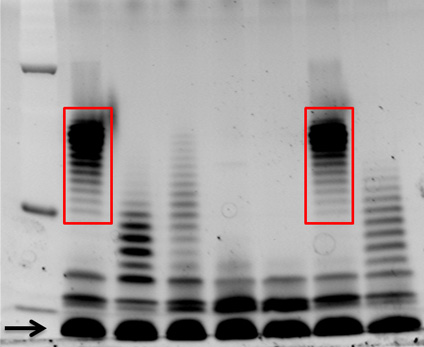
באיור 1. Pro-Q אמרלד 300 LPS מוכתם מבודד Burkholderia dolosa קליניים. LPS של 7 ב ' זנים dolosa מ פרוץ בחולי סיסטיק פיברוזיס בודדו כמתואר בפרוטוקול זה. חמש עשרה μl הופרדו על ג'ל SDS-polyacrylamide 12%, ומוכתמים Pro-Q אמרלד 300, לפי הוראות היצרן. LPS הליבה מצוין החץ ולאחר LPS מראה דפוסי שהתקבצו דומים של O-אנטיגן חוזר הם מסגרת אדומה. M = משקל מולקולרי הסמן.
Discussion
תיארנו שיטה לטיהור LPS הרחק מרכיבים תאיים אחרים, כולל חומצות גרעין וחלבונים. שיטה זו מספקת באיכות גבוהה LPS כי ניתן להשתמש במספר שיטות הדמיה שונות, כולל צביעה של פחמימות SDS-עמוד ג'לים, כפי שמוצג באיור 1. שיטה זו יכולה לשמש סרוטיפ LPS ממגוון רחב של זנים, תוך שימוש ספציפי נגד...
Disclosures
אין ניגוד עניינים הצהיר.
Acknowledgements
עבודה זו נתמכה על ידי מענקים מהמוסד הלאומי לבריאות וקרן סיסטיק פיברוזיס.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | |
| DNase אני רקומביננטי, RNase ללא | רוש | 04716728001 | |
| RNase | רוש | 10109169001 | |
| Proteinase K | דיג | BP1700 | |
| טריס רווי פנול | דיג | BP1750-100 | |
| Diethyl Ether | תומאס מדעי | C313K31 | |
| Pro-Q אמרלד 300 ג'ל Lipopolysaccharide הכתם Kit | בדיקות מולקולריות | P20495 |
References
- Raetz, C. R., Whitfield, C. Lipopolysaccharide endotoxins. Annu. Rev. Biochem. 71, 635-700 (2002).
- Valvano, M. A. Export of O-specific lipopolysaccharide. Front. Biosci. 8, 452-471 (2003).
- Pier, G. B. Pseudomonas aeruginosa lipopolysaccharide: a major virulence factor, initiator of inflammation and target for effective immunity. Int. J. Med. Microbiol. 297, 277-295 (2007).
- Freudenberg, M. A. Role of lipopolysaccharide susceptibility in the innate immune response to Salmonella typhimurium infection: LPS, a primary target for recognition of Gram-negative bacteria. Microbes Infect. 3, 1213-1222 (2001).
- Jann, K., Jann, B. Polysaccharide antigens of Escherichia coli. Rev. Infect. Dis. 9, S517-S526 (1987).
- McCallum, K. L., Schoenhals, G., Laakso, D., Clarke, B., Whitfield, C. A high-molecular-weight fraction of smooth lipopolysaccharide in Klebsiella serotype O1:K20 contains a unique O-antigen epitope and determines resistance to nonspecific serum killing. Infect. Immun. 57, 3816-3822 (1989).
- Hancock, R. E. Pseudomonas aeruginosa isolates from patients with cystic fibrosis: a class of serum-sensitive, nontypable strains deficient in lipopolysaccharide O side chains. Infect. Immun. 42, 170-177 (1983).
- Gupta, S. K., Masinick, S., Garrett, M., Hazlett, L. D. Pseudomonas aeruginosa lipopolysaccharide binds galectin-3 and other human corneal epithelial proteins. Infect. Immun. 65, 2747-2753 (1997).
- Hitchcock, P. J., Brown, T. M. Morphological heterogeneity among Salmonella lipopolysaccharide chemotypes in silver-stained polyacrylamide gels. J. Bacteriol. 154, 269-277 (1983).
- Westphal, O., Jann, K. Bacterial lipopolysaccharides. Methods Carbohyr. Chem. 5, 83 (1965).
- Lieberman, T. D. Parallel bacterial evolution within multiple patients ties novel genes to pathogenesis. Nat Genet. , (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved