A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مسعور الملح تعديل Nafion لإنزيم الشلل وتحقيق الاستقرار
In This Article
Summary
هذه المادة سوف تصف الإجراء لتوليف انزيم Nafion تعديل hydrophobically غشاء الشلل وكيفية شل البروتينات و / أو الأنزيمات في الغشاء واختبار النشاط الخاصة.
Abstract
على مدى العقد الماضي، كان هناك مجموعة كبيرة من الإنزيمات يجمد طلب واستقرت بما في ذلك التحفيز الأحيائي، أجهزة الاستشعار، وخلايا الوقود الحيوي. 1-3 في معظم تطبيقات bioelectrochemical، وثبتوا على الانزيمات أو العضيات سطح القطب مع استخدام نوع من البوليمر المصفوفة. وهذا ينبغي أن سقالة البوليمر الحفاظ على الانزيمات مستقرة وتسمح لنشر السهل من الجزيئات والأيونات داخل وخارج المصفوفة. وتستند معظم البوليمرات المستخدمة لهذا النوع من الشلل على الأمينات أو polyalcohols - البوليمرات التي تحاكي البيئة الطبيعية للأنزيمات أنهم تغليف واستقرار الانزيم من خلال الهيدروجين أو الرابطة الأيونية. طريقة أخرى لتحقيق الاستقرار في الانزيمات ينطوي على استخدام المذيلات، والتي تحتوي على المناطق التي يمكن أن تغلف مسعور والاستقرار الانزيمات. 4،5 وعلى وجه الخصوص، وضعت مجموعة Minteer بوليمر micellar يعتمد على Nafion متاحة تجاريا. 6،7 Nafionنفسه هو بوليمر micellar التي تسمح لنشر القناة بمساعدة من البروتونات والكاتيونات الصغيرة الأخرى، ولكن المذيلات وقنوات صغيرة للغاية والبوليمر هو حمضية جدا نظرا لسلاسل حمض السلفونيك الجانب، والتي هي غير مواتية لتجميد الانزيم. ومع ذلك، عندما يتم خلط Nafion مع وجود فائض من أملاح الأمونيوم مسعور مثل بروميد ألكيل tetrabutylammonium (TBAB)، والكاتيونات الأمونيوم الرباعية استبدال البروتونات وتصبح أيونات مكافحة للجماعات سلفونات على سلاسل البوليمر الجانب (الشكل 1). هذه النتائج في جو من المذيلات وقنوات داخل البوليمر التي تسمح لنشر ركائز الكبيرة والأيونات والتي هي ضرورية لوظيفة الأنزيمية مثل ثنائي النوكليوتيد نيكوتيناميد أدينين (NAD). وقد استخدم هذا البوليمر تعديل Nafion إلى شل العديد من أنواع مختلفة من الانزيمات الميتوكوندريا وكذلك لاستخدامها في أجهزة الاستشعار والخلايا الوقود الحيوي. 8-12 تصف هذه الورقة إجراء رواية لجعل هذا MICellar تجميد انزيم غشاء البوليمر التي يمكن تحقيق الاستقرار في الانزيمات. وترد تفاصيل تركيب الغشاء انزيم الشلل micellar، وإجراءات شل حركة الانزيمات داخل الغشاء، والمقايسات لدراسة النشاط الأنزيمي محددة للانزيم يجمد أدناه.
Protocol
1. تعديل Nafion مع أملاح الأمونيوم الرباعية
- يهز زجاجة من 5٪ التعليق Nafion ث / V بقوة لتقريبا. تم تعليق 30 ثانية لضمان أن Nafion بشكل موحد في الحل.
- ماصة من 2 مل من Nafion الآن إعادة علقت في قارورة زجاج (حجم القارورة يمكن أن تحتوي من 2.5 مل إلى 10 مل).
- قياس الزائدة 3-أضعاف المولي (نسبة إلى مجموعات حامض السلفونيك على البوليمر Nafion) من بروميد ألكيل ملح الأمونيوم (وترد الجماهير المناسب في الجدول 1) وإضافة إلى هذه القارورة التي تحتوي على مل 2 من Nafion.
- دوامة القارورة في 1500 دورة في الدقيقة لمدة 10-15 دقيقة.
- صب الحل لزج في علبة من البلاستيك وزنها الذي يقيس تقريبا. 3 × 3 بوصة، واستخدام ماصة لنقل أي حل المتبقية من القارورة إلى علبة وزنها.
- السماح لللتتبخر المذيبات من القارب تزن، وترك أصفر / بني، فيلم شفافة على الجزء السفلي من الدرج وزنها (FIجوري 2). يجب أن معدل تبخر المذيبات يكون من النوع الذي يحتاج إلى أكثر من 6 ساعات لجميع المذيبات لتتبخر. إذا كان يتبخر المذيب سريع جدا، وسوف بيضاء، تشكل المواد يابس بدلا من فيلم شفافة تشير إلى أنه تم تدمير الهيكل micellar من البوليمر، ويجب إعادة بدء الإجراء. إذا تبخر المذيبات بطيئة جدا، قد دو المرطب يكون ضروريا، لأن بطيئة جدا من التبخر يؤدي عادة إلى هلام، مبتذل البرتقال ويجب إعادة بدء الإجراء. تتراوح درجة الحرارة النموذجية لتبخر المذيبات هي 20 حتي 37 ° C. الظروف الفعلية لتجفيف هي وظيفة من الرطوبة النسبية ودرجة الحرارة في الغرفة، ولكن من المهم أن يجري تجفيف بطيئة للحفاظ على هيكل مذيلة، ولكن ليس بطيئا جدا للسماح لتشكيل هلام.
- ملء مع الماء تزن قارب 18M غير المتأينة Ωcm (10-20 مل من الماء)، وغطاء، والسماح لينقع لمدة 12-24 ساعة لإزالة الزائدة بروميد الأمونيوم ألكيل الأملاح وHBR. صب (أو ماصة) من الماء وشطف مع الماء 3 مرات DI ما يكفي لملء علبة في كل مرة. يجب الحرص على عدم فقدان أي من فيلم البوليمر خلال هذه الخطوة.
- تسمح علبة وزنها حتى على الجلوس كشف البوليمر جافة تماما في هذه النقطة، يجب أن يكون البوليمر الفيلم واضحة وهشة إلى حد ما بلاستيكية. مرة أخرى، إذا كان الهواء رطبا جدا، قد تكون دي المرطب اللازمة لاستكمال التبخر في الوقت المناسب.
- باستخدام ملعقة، وإزالة بعناية الفيلم المجففة من علبة وزنها وتحويلها إلى قارورة زجاجية نظيفة.
- إضافة 2 مل من الايثانول و 3 حبات السيراميك خلط، ودوامة لمدة 4 ساعات أو حتى يتم تماما الفيلم البوليمر إعادة علقت.
2. تجميد الانزيمات في TBAB معدلة وNafion لفحوصات نشاط
- لانزيم الجافة، تزن من 1-10 مغ للانزيم في أنبوب microcentrifuge 1.5 مل، وإضافة 1 مل من 100 ملي العازلة الفوسفات درجة الحموضة 7 إلى إنشاء 1-10 مغ / مل حل الانزيم. FOص وهو الانزيم الذي هو في الحل، استخدام حمض bicinchoninic (BCA) مقايسة 13 إلى تحديد كمية البروتين، وإضافة مبلغ مناسب من 100 ملي العازلة الفوسفات لجعل تركيز البروتين إلى 1-10 ملغ / مل. 1-10 مل ملغ / ليتوافق عادة 1-50 nanomoles / مل.
- إلى 120 ميكرولتر من 1 ملغ / مل حل الانزيم، إضافة 60 ميكرولتر من الحل ألكيل Nafion الأمونيوم معدلة و، ودوامة لمدة 10 ثانية. (يمكن زيادتها حتى هذا الخليط لأعداد كبيرة من مكررات. حافظ على نسبة الانزيم حل البوليمر إلى في 2:1.)
- ماصة 60 ميكرولتر من الحل انزيم / البوليمر في الجزء السفلي من 3 cuvettes الفردية 1 2 سم، والسماح ليجف بين عشية وضحاها.
3. فحص انزيم مشلول من إنزيم NAD التي تعتمد على
- إلى كوفيت، إضافة 1.3 مل من الصوديوم 50 ملي بيروفوسفات (الرقم الهيدروجيني 8.8)، 1.5 مل من NAD ملي 15 (الطازجة)، و 0.1 مل من الماء.
- وضع كوفيت في معمل الأشعة فوق البنفسجية / فيس (أي Evolut ThermoScientificايون 260 السيرة الذاتية والحرارية Spectronic جينيسيس 20) لتعيين الطول الموجي من 340 نانومتر.
- مطياف الصفر، ثم قم بإضافة 0،1 مل ايثانول. مزج الكواشف من قبل pipetting بلطف صعودا وهبوطا الحل 5 مرات. لفارغة، استخدم 0.1 مل من المياه الإضافية بدلا من مل 0.1 من الايثانول.
- تسجيل الامتصاصية في 340 نانومتر في 5 دقائق بعد تم إضافة الكواشف إلى كوفيت و 20 دقيقة بعد. رسم نقاط البيانات اثنين للحصول منحدر التي يمكن استخدامها لإجراء العمليات الحسابية النشاط.
4. مقايسة من Dehydrogenases PQQ التي تعتمد على مشلول
- إلى كوفيت، إضافة 1.5 مل من فوسفات الصوديوم (الرقم الهيدروجيني 7.3) و 200 ميكرولتر من 600 ميكرومتر PMS.
- وضع كوفيت في معمل الأشعة فوق البنفسجية / فيس لتعيين الطول الموجي من 600 نانومتر ومن ثم الصفر طيف.
- إضافة 100 ميكرولتر من 700 ميكرولتر DCIP و 200 ميكرولتر من الركيزة التي تهم (الإيثانول، الأسيتالديهيد، الجلسرين، والجلوكوز، أو غليسيرألدهيد)، ومزج الكواشف من قبل pipetting بلطف solutأيون صعودا وهبوطا 5 مرات. لفارغة، يستخدم الانسان 200 ميكرولتر من الماء بدلا من الركيزة في المصالح.
- تسجيل الامتصاصية في 600 نانومتر في 5 دقائق بعد تم إضافة الكواشف إلى كوفيت و 20 دقيقة بعد.
5. مقايسة من أوكسيديز الجلوكوز مشلول
- إلى كوفيت، إضافة 2.0 مل من محلول يحتوي على 0.2 م حمض الهيدروكسي ف، 0.02٪ (W / V) أزيد الصوديوم، 128 U البيروكسيديز، 0.3 مم 4-aminoantipyrine، 1 M الفوسفات والبوتاسيوم، و 50 مللى جلوكوز. مزيج الحل من قبل pipetting صعودا وهبوطا 5 مرات.
- وضع كوفيت في مجموعة الطيف UV / فيس لطول موجة من 510 نانومتر.
- تسجيل الامتصاصية بنحو 510 نيوتن متر عند 5 دقائق بعد تم إضافة الكواشف إلى كوفيت ومرة أخرى في 20 دقيقة بعد.
6. ممثل النتائج
يمكن أن تتعطل هيكل micellar من البوليمر Nafion تعديلها من قبل تجفيف الملح الأصلي / البوليمر المشترك محمل الفيلم فاس جدار. ويبين الشكل 2 خليط الملح / البوليمر التي تم تجفيفها بشكل صحيح مما أدى بطريقة شفافة وفيلم البني الفاتح. الفيلم الذي يجف بسرعة كبيرة يمكن أن تؤدي إلى رقائق، بيضاء غير شفافة من البوليمر يرجع ذلك إلى حقيقة أن عملية التجفيف يمكن أن تدمر هيكل micellar.
مرة واحدة وقد تم خلط Nafion تعديل البوليمر وانزيم وشارك في الإدلاء على الجزء السفلي من كوفيت، يمكن استخدام المقايسات النشاط الأنزيمي لتقييم استقرار الانزيم في فيلم البوليمر. الجداول 2-4 نتائج الفحص تظهر من الإنزيمات نازعة 2 ويجمد أوكسيديز الجلوكوز في مختلف الأفلام Nafion تعديل، على التوالي. لاحظ أعلى نشاط الانزيمات التي ثبتوا أمام الإنزيمات في حل العازلة، تبين أن البوليمرات Nafion تعديل يستطيعون في الحقيقة تعزيز نشاط بعض الأنزيمات (وتسمى فرط النشاط). الانزيمات غيرها من القيود التي تقلل نشاط النقل الخاصة بهم عندما شل في البوليمر (cellulases أي وamylases، التي هي ركائز الجزيئات كبيرة جدا).
40،89 ملغ / مل| أملاح الأمونيوم الرباعية المستخدمة | 3 أضعاف الزائدة |
| T3A (بروميد tetrapropylammonium) | 32،37 ملغ / مل |
| TBAB (بروميد tetrabutylammonium) | 39،19 ملغ / مل |
| TPAB (بروميد tetrapentylammonium) | 46،01 ملغ / مل |
| TEHA (بروميد triethylhexylammonium) | 32،37 ملغ / مل |
| تمحا (بروميد trimethylhexylammonium) | 27،25 ملغ / مل |
| TMOA (بروميد trimethyloctylammonium) | 30،66 ملغ / مل |
| TMDA (بروميد trimethyldecylammonium) | 34،07 ملغ / مل |
| TMDDA (بروميد trimethyldodecylammonium) | 37،48 ملغ / مل |
| TMTDA (بروميد trimethyltetradecylammonium) | |
| TMHDA (بروميد trimethylhexadecylammonium) | 44،31 ملغ / مل |
| TMODA (بروميد trimethyloctadecylammonium) | 47،71 ملغ / مل |
الجدول 1. المبالغ من أملاح الأمونيوم رباعي ألكيل لاستخدامها لNafion البوليمر التعديل.
| نوع من Nafion | نشاط انزيم (U / G) |
| العازلة (لا البوليمر) | 16،63 ± 8،11 |
| Nafion (un-mod.) | 9،25 ± 2،21 |
| TMTDA | 3،23 ± 2،92 |
| TBAB | 3،93 ± 3،33 |
| TMDDA | 4،19 ± 1،04 |
| TMOA | 3،51 ± 1،11 |
| TMDA | 8،00 ± 4،53 |
| تمحا | 1،68 ± 1،39 |
| TMHDA | 4،83 ± 0،99 |
| TMODA | 10،45 ± 3،20 |
الجدول 2 NAD التي تعتمد على نشاط إنزيم الجلوكوز يجمد في مجموعة مختارة من البوليمرات Nafion تعديل (ملاحظة: النشاط يجمد هي وظيفة من نشاط محدد الأولية للانزيم).
| نوع من Nafion | نشاط انزيم (MU / ز) |
| العازلة (لا البوليمر) | 7،18 ± 0،51 |
| Nafion (un-mod.) | 70،1 ± 0.5 |
| TMTDA | 133 ± 6 |
| TBAB | 244 ± 4 |
| TMDDA | 221 ± 6 |
| TMOA | 1،78 ± 0،63 |
| TMDA | 206 ±5 |
| TEHA | 40،1 ± 50،6 |
| TMHDA | 0 |
| TMODA | 1.45 ± 0.06 |
الجدول 3 PQQ التي تعتمد على نشاط إنزيم الجلوكوز يجمد في مجموعة مختارة من البوليمرات Nafion تعديل (ملاحظة: النشاط يجمد هي وظيفة من نشاط محدد الأولية للانزيم).
| نوع من Nafion | نشاط انزيم (U / G) |
| العازلة (لا البوليمر) | 103.61 ± 3.15 |
| Nafion (un-mod.) | 19،93 10،10 ± |
| TMTDA | 247.25 ± 12.49 |
| TBAB | 152.27 ± 5.29 |
| TMDDA | 262.05 ± 6.26 |
| TMOA | 129.18 ± 2.31 |
| TMDA | 141.23 ± 1.97 |
| تمحا | 131.75 ± 2.89 |
| TMHDA | 132.50 ± 1.18 |
| TMODA | 136.50 ± 0.96 |
الجدول 4 أوكسيديز الجلوكوز النشاط الممثل محددة يجمد في مجموعة مختارة من البوليمرات Nafion تعديل (ملاحظة: النشاط يجمد هي وظيفة من نشاط محدد الأولية للانزيم).
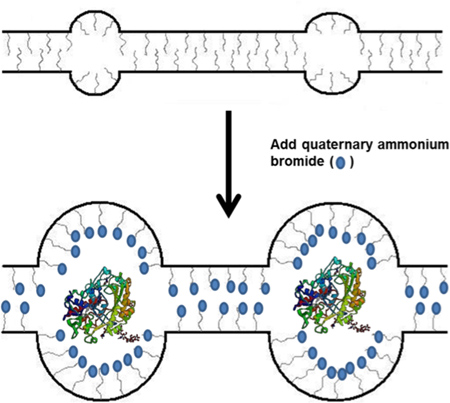
الشكل 1. التخطيطي التأسيس TBAB في البوليمر Nafion واستخدامها فيما بعد في شل حركة الانزيم.

الشكل 2. الصورة البصرية من الأفلام المشاركة في الزهر الأولي من Nafion وTBAB. بطء تجفيف المحاصيل و، الضوء الشفاف الذي يغطي الفيلم البني بوttom من علبة وزنها.
Discussion
في الإجراء وصفها، وتستخدم أملاح الأمونيوم رباعي ألكيل لتعديل Nafion التجارية لخلق البوليمرات micellar التي يمكن استخدامها في شل والاستقرار الانزيمات. وصف المقايسات في المعرض الداخلي والتي يمكن استخدامها في شل البوليمر مجموعة واسعة من الانزيمات مع الاحتفاظ عالية من النشا...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
الكتاب نعترف مكتب البحوث البحرية، الولايات المتحدة المجلس فول الصويا، والمؤسسة الوطنية للعلوم للتمويل.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | كتالوج رقم | |
| Nafion | سيغما الدريخ | 70160 | |
| أملاح رباعي بروميد alkylammonium | سيغما الدريخ | N / A | |
| نازعة هيدروجين الكحول | سيغما الدريخ | A3263 | |
| الأدينين ثنائي النوكليوتيد نيكوتيناميد (NAD) | Simga الدريخ | N7004 | |
| الصوديوم بيروفوسفات | سيغما الدريخ | P8010 | |
| Phenazine ميثوسلوفيت (PMS) | سيغما الدريخ | P9625 | |
| 2،6-Dichloroindophenol (DCIP) | سيجأماه الدريخ | D1878 | |
| الجلوكوز أوكسيديز | سيغما الدريخ | G7141 | |
| 4-الهيدروكسي حمض | سيغما الدريخ | 240141 | |
| أزيد الصوديوم | سيغما الدريخ | S8032 | |
| البيروكسيديز | سيغما الدريخ | P8375 | |
| 4-aminoantipyrine | سيغما الدريخ | 06800 | |
| UV / VIS الطيفي | الحرارية | تطور السيرة الذاتية أو Spectronic 260 جينيسيس 20 | |
| دوامة الجني | |||
| ميزان تحليلي |
References
- Calabrese-Barton, S., Gallaway, J., Atanassov, P. Enzymatic biofuel cells for implantable and microscale devices Chem. Rev. 104, 4867-4886 (2004).
- Cracknell, J. A., Vincent, K. A., Armstrong, F. A. Enzymes as Working or Inspirational Electrocatalysts for Fuel Cells and Electrolysis. Chem. Rev. 108, 2439-2461 (2008).
- Minteer, S. D., Liaw, B. Y., Cooney, M. J. Enzyme-Based Biofuel Cells. Curr. Opin. Biotechnol. 18, 228-234 (2007).
- Callahan, J. W., Kosicki, G. W. The Effect of Lipid Micelles on Mitochondrial Malate Dehydrogenase. Canadian Journal of Biochemistry. 45, 839-851 (1967).
- Martinek, K. Modeling of the Membrane Environment of Enzymes: Superactivity of Laccase Entrapped into Surfactant Reversed Micelles in Organic Solvents. Biokhimiya. 53, 1013-1016 (1988).
- Moore, C. M., Akers, N. L., Hill, A. D., Johnson, Z. C., Minteer, S. D. Improving the Environment for Immobilized Dehydrogenase Enzymes by Modifying Nafion with Tetraalkylammonium Bromides. Biomacromolecules. 5, 1241-1247 (2004).
- Schrenk, M. J., Villigram, R. E., Torrence, N. J., Brancato, S. J., Minteer, S. D. Effects of Mixture Casting Nafion with Quaternary Ammonium Bromide Salts on the Ion-Exchange Capacity and Mass Transport in the Membranes. J. Membr. Sci. 205, 3-10 (2002).
- Akers, N. L., Moore, C. M., Minteer, S. D. Development of Alcohol/O2 Biofuel Cells Using Salt-Extracted Tetrabutylammonium Bromide/Nafion Membranes to Immobilize Dehydrogenase Enzymes. Electrochim. Acta. 50, 2521-2525 (2005).
- Sokic-Lazic, D., Minteer, S. D. Citric Acid Cycle Biomimic on a Carbon Electrode. Biosens. Bioelectron. 24, 939-944 (2008).
- Arechederra, R. L., Minteer, S. D. Complete Oxidation of Glycerol in an Enzymatic Biofuel Cell. Fuel Cells. 9, 63-69 (2009).
- Germain, M., Arechederra, R. L., Minteer, S. D. Nitroaromatic Actuation of Mitochondrial Bioelectrocatalysis for Self-Powered Explosive Sensors. J. Am. Chem. Soc. 130, 15272-15273 (2008).
- Addo, P. K., Arechederra, R. L., Minteer, S. D. Evaluating Enzyme Cascades for Methanol/Air Biofuel Cells Based On NAD+-Dependent Enzymes. Electroanalysis. 22, 807-812 (2010).
- Smith, P. K., Krohn, R. I., Hermanson, G. T., Mallia, A. K., Gartner, F. H., Provenzano, M. D., Fujimoto, E. K., Goeke, N. M., Olson, B. J., Klenk, D. C. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150, 76-85 (1985).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved