Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Hydrophobe Salz-modifizierte Nafion zur Enzymimmobilisierung und Stabilisierung
In diesem Artikel
Zusammenfassung
In diesem Artikel wird das Verfahren zur Synthese eines hydrophob modifizierten Nafion Membran und Enzymimmobilisierung, wie Proteine und / oder Enzyme in der Membran zu immobilisieren und Testen ihrer spezifischen Aktivität beschreiben.
Zusammenfassung
Im letzten Jahrzehnt gab es eine Fülle von Anwendungen für Enzyme immobilisiert und stabilisiert einschließlich Biokatalyse, Biosensoren und Biobrennstoffzellen. 03.01 In den meisten bioelektrochemische Anwendungen werden Enzyme oder Organellen auf einer Elektrodenoberfläche mit dem Einsatz von irgendeiner Art von immobilisierten Polymermatrix. Diese Polymer-Gerüst, sollten sich die Enzyme stabil und ermöglichen die einfache Diffusion von Molekülen und Ionen in die und aus der Matrix. Die meisten Polymere für diese Art der Immobilisierung verwendet werden auf der Grundlage Polyamine oder Polyalkohole - Polymere, die die Natur der Enzyme, dass sie und kapseln Stabilisierung des Enzyms durch Wasserstoff oder ionische Bindung zu imitieren. Ein weiteres Verfahren zur Stabilisierung von Enzymen ist die Verwendung von Micellen, die hydrophoben Regionen, die einzukapseln und stabilisieren Enzyme enthalten kann. 4,5 Insbesondere hat die Minteer Gruppe eine mizellare Polymer auf im Handel erhältlich Nafion entwickelt. 6,7 Nafionselbst ist ein Polymer, das micellare für den Kanal-unterstützte Diffusion von Protonen und anderen kleinen Kationen ermöglicht, aber die Micellen und Kanäle sind extrem klein ist und das Polymer sehr sauer durch Sulfonsäure Seitenketten, was ungünstig für Enzymimmobilisierung ist. Wenn jedoch Nafion mit einem Überschuß an hydrophoben Alkyl Ammoniumsalze, wie Tetrabutylammoniumbromid (TBAB) gemischt wird, ersetzen die quaternäre Ammoniumkationen die Protonen und werden die Gegenionen zu den Sulfonatgruppen an der Polymerseitenketten (1). Dies führt zu größeren Micellen und Kanälen innerhalb des Polymers, das für die Diffusion von großen Substraten und Ionen, die notwendig für die enzymatische Funktion wie Nikotinamid-Adenin-Dinukleotid (NAD) sind zu ermöglichen. Diese modifizierte Polymer Nafion wurde verwendet, um viele verschiedene Arten von Enzymen sowie Mitochondrien für den Einsatz in Biosensoren und Biobrennstoffzellen immobilisieren. 12.08 Dieser Beitrag beschreibt ein neuartiges Verfahren für die Herstellung dieser micEllar Polymer Enzymimmobilisierung Membran, die Enzyme stabilisieren können. Die Synthese des mizellenförmigen Enzymimmobilisierung Membran, dem Verfahren zur Immobilisierung von Enzymen in der Membran und den Assays zur Untersuchung enzymatische spezifische Aktivität des immobilisierten Enzyms sind unten aufgeführt.
Protokoll
1. Modifizierung von Nafion mit quartären Ammoniumsalzen
- Schütteln eine Flasche von 5% w / v Nafion Suspension kräftig für ca.. 30 Sekunden bis die Nafion gewährleistet ist, gleichmäßig in der Lösung suspendiert.
- Pipette aus 2 ml der nun erneut suspendiert Nafion in einen Glaskolben (Fläschchen Volumen konnte von 2,5 ml bis 10 ml enthalten).
- Messen einer 3-fachen molaren Überschuss (bezogen auf die Sulfonsäuregruppen der Nafion-Polymer) des Alkylammonium Bromidsalz (gegebenenfalls Massen sind in Tabelle 1 gezeigt) und addieren, um das Fläschchen mit dem 2 ml Nafion.
- Vortex das Fläschchen bei 1500 rpm für 10-15 Minuten.
- Gießen Sie die viskose Lösung in einen Kunststoff Waagschale, die ca. misst. 3 x 3 cm, und verwenden Sie eine Pipette, um das restliche Lösung aus der Durchstechflasche zu übertragen auf die Waagschale.
- Lassen Sie die Lösungsmittel zu verdampfen aus dem Gewicht Boot, wobei ein gelb / braun, transparenten Films auf dem Boden der Waagschale (FiBild 2). Die Geschwindigkeit der Verdampfung des Lösungsmittels sollte so sein, dass es mehr als 6 Stunden für alle Lösungsmittel verdampfen erfolgt. Wenn das Lösungsmittel verdunstet zu schnell, wird ein weißes, knusprigem Material anstelle Form eines transparenten Films anzeigt, dass der mizellaren Struktur des Polymers zerstört worden ist, und Sie müssen neu starten Sie den Vorgang. Wenn Lösungsmittelverdampfung zu langsam ist, kann eine de-Luftbefeuchter erforderlich sein, weil zu langsam, der Verdunstung führt typischerweise zu einer klebrigen, orange Gel und Sie müssen neu starten Sie den Vorgang. Typische Temperaturbereiche für Lösungsmittelverdampfung sind 20 bis 37 ° C. Die tatsächlichen Bedingungen für das Trocknen eine Funktion der relativen Feuchte und Temperatur in dem Raum, aber es ist wichtig, dass das Trocknen wobei langsam Mizellenstruktur beizubehalten, aber nicht zu langsam, um die Gelbildung zu ermöglichen.
- Füllen Sie das Boot wiegt mit 18m Qcm de-ionisiertem Wasser (10-20 ml Wasser), Abdeckung, und lassen Sie sie für 12-24 Stunden einweichen, um überschüssige Alkylammonium Bromidsalze und HBr zu entfernen.
- Gießen (oder Pipette) aus dem Wasser und spülen Sie 3-mal mit genug DI-Wasser zu füllen Sie das Fach jeder Zeit. Schreiben darauf, keine der Polymerfolie während dieses Schritts zu verlieren.
- Lassen Sie die Waagschale auf die unbedeckten sitzen, bis das Polymer vollständig trocken ist An dieser Stelle sollte das Polymer eine klare und etwas spröde Kunststoff-Folie sein. Auch wenn die Luft sehr feucht ist, kann eine de-Luftbefeuchter erforderlich sein, die Verdunstung in einer fristgerechten Weise zu vervollständigen.
- Mit einem Spatel vorsichtig die getrocknete Film aus der Waagschale und übertragen sie in ein sauberes Glasgefäß.
- Geben Sie 2 ml Ethanol und 3 Keramik-Misch-Perlen und Wirbel für 4 Stunden oder bis der Polymerfilm vollständig resuspendiert.
2. Immobilisierung von Enzymen in TBAB-Modified Nafion für Aktivitätstests
- Für einen trockenen Enzym, abwiegen 1-10 mg des Enzyms in ein 1,5 ml Mikrozentrifugenröhrchen, und fügen Sie 1 ml 100 mM Phosphatpuffer pH 7, eine 1-10 mg / ml Enzymlösung zu schaffen. For ein Enzym, das in Lösung ist, mit einem Bicinchoninsäure (BCA)-Probe 13, um die Menge des Proteins zu bestimmen, und geben eine entsprechende Menge von 100 mM Phosphatpuffer, um die Proteinkonzentration auf 1-10 mg / ml zu bringen. 1-10 mg / ml entspricht typischerweise bis 1-50 Nanomol / ml.
- Um 120 ul der 1 mg / ml Enzymlösung mit 60 uL des Alkylammonium-modifizierte Nafion-Lösung, und Vortex für 10 Sekunden. (Dieses Gemisch kann für eine große Anzahl von Wiederholungen skaliert werden. Halten des Enzym-zu-Polymer-Lösung Verhältnis von 2:1.)
- Pipette 60 pl des Enzyms / Polymer-Lösung in den Boden 3 separate 1 cm 2 Küvetten, und über Nacht trocknen lassen.
3. Assay von immobilisierter NAD-abhängigen Dehydrogenase-Enzym
- Um die Küvette, fügen 1,3 ml von 50 mM Natriumpyrophosphat (pH 8,8), 1,5 ml 15 mM NAD (frisch hergestellt) und 0,1 ml Wasser.
- Legen Sie die Küvette in einem UV / VIS Spektralphotometer (dh ThermoScientific EvolutIon 260 Bio-und Thermo Spectronic Genesys 20) zu einer Wellenlänge von 340 nm eingestellt.
- Null des Spektrometers, und dann 0,1 ml Ethanol. Mischen Sie die Reagenzien vorsichtig Pipettieren der Lösung auf und ab 5 mal. Für ein Leerzeichen mit 0,1 ml von zusätzlichem Wasser anstelle der 0,1 ml Ethanol.
- Optische Dichte bei 340 nm nach 5 Minuten, nachdem die Reagenzien in die Küvette und 20 Minuten nach zugegeben. Zeichnen Sie die zwei Datenpunkte, um eine Steigung, die für die Tätigkeit Berechnungen verwendet werden können bekommen.
4. Assay von PQQ-abhängige Dehydrogenasen
- Um die Küvette, fügen Sie 1,5 ml Natriumphosphat (pH 7,3) und 200 ul von 600 um PMS.
- Legen Sie die Küvette in einem UV / VIS Spektralphotometer, einstellbar auf eine Wellenlänge von 600 nm und dann auf Null das Spektrometer.
- Fügen Sie 100 ul 700 ul und 200 ul DCIP des Substrats von Interesse (Ethanol, Acetaldehyd, Glycerin, Glucose, oder Glycerinaldehyd), und mischen Sie die Reagenzien durch vorsichtiges Pipettieren der solutIonen auf und ab 5 mal. Für einen leeren, verwenden Sie 200 ul Wasser anstelle des Substrats von Interesse.
- Optische Dichte bei 600 nm nach 5 Minuten, nachdem die Reagenzien in die Küvette und 20 Minuten nach zugegeben.
5. Assay von immobilisierten Glucose-Oxidase
- Um die Küvette, 2,0 mL einer Lösung, die 0,2 M p-Hydroxybenzoesäure, 0,02% (w / v) Natriumazid, 128 U Peroxidase, 0,3 mM 4-Aminoantipyrin, 1 M Kaliumphosphat, und 50 mM Glucose. Mischen Sie die Lösung durch Auf-und Abpipettieren 5 mal.
- Legen Sie die Küvette in einem UV / VIS Spektralphotometer einstellbar auf eine Wellenlänge von 510 nm auf.
- Optische Dichte bei 510 nm nach 5 Minuten, nachdem die Reagenzien in die Küvette und wieder 20 Minuten nach zugegeben.
6. Repräsentative Ergebnisse
Die micellare Struktur des modifizierten Nafion Polymer kann durch Trocknen des ursprünglichen Salz / Polymer-Co-gegossenen Film zu fas gestörtt. 2 zeigt ein Salz / Polymer-Mischung, die getrocknet worden ist vollständig um einen transparenten, hellbraun Film. Ein Film, der zu schnell trocknet in opaken weißen Flocken von Polymeren aufgrund der Tatsache, dass die Trocknung der micellaren Struktur zu zerstören führen.
Sobald das modifizierte Nafion Polymer und Enzym gemischt worden und auf dem Boden einer Küvette zusammen gegossen, können enzymatische Aktivitäts-Assays verwendet, um die Stabilität des Enzyms in der Polymerfolie zu beurteilen. Tabellen 2-4 zeigen Testergebnisse von zwei Dehydrogenaseenzyme und Glucose-Oxidase in verschiedenen modifizierten Nafion Filme immobilisiert sind. Man beachte die höhere Aktivität der Enzyme, die gegen die Enzyme in Pufferlösung immobilisiert sind, die zeigen, dass modifizierte Polymere Nafion kann tatsächlich erhöhen die Aktivität bestimmter Enzyme (so genannte Überaktivität). Andere Enzyme haben Transport Beschränkungen auf, die spezifische Aktivität zu verringern, wenn sie bewegungsunfähig im Polymer (dh Cellulasen und Amylasen, deren Substrate sind recht groß Makromolekülen).
| Quaternäres Ammoniumsalz verwendet | 3-fachen Überschuss |
| T3A (Tetrapropylammoniumbromid) | 32,37 mg / ml |
| TBAB (Tetrabutylammoniumbromid) | 39,19 mg / ml |
| TPAB (Tetrapentylammoniumbromid) | 46,01 mg / ml |
| TEHA (triethylhexylammonium Bromid) | 32,37 mg / ml |
| TMHA (trimethylhexylammonium Bromid) | 27,25 mg / ml |
| TMOA (trimethyloctylammonium Bromid) | 30,66 mg / ml |
| TMDA (trimethyldecylammonium Bromid) | 34,07 mg / ml |
| TMDDA (Trimethyldodecylammonium Bromid) | 37,48 mg / ml |
| TMTDA (Trimethyltetradecylammoniumsalze Bromid) | 40,89 mg / ml |
| TMHDA (trimethylhexadecylammonium Bromid) | 44,31 mg / ml |
| TMODA (trimethyloctadecylammonium Bromid) | 47,71 mg / ml |
Tabelle 1. Mengen von Tetraalkylammonium-Salze, die zum Nafion Polymer benutzt werden können.
| Art der Nafion | Enzymaktivität (U / g) |
| Buffer (kein Polymer) | 16,63 ± 8,11 |
| Nafion (un-mod.) | 9,25 ± 2,21 |
| TMTDA | 3,23 ± 2,92 |
| TBAB | 3,93 ± 3,33 |
| TMDDA | 4,19 ± 1,04 |
| TMOA | 3,51 ± 1,11 |
| TMDA | 8,00 ± 4,53 |
| TMHA | 1,68 ± 1,39 |
| TMHDA | 4,83 ± 0,99 |
| TMODA | 10,45 ± 3,20 |
Tabelle 2 NAD-abhängige Glucose-Dehydrogenase-Aktivität in ausgewählten modifizierten Polymeren Nafion (Anmerkung: immobilisierte Aktivität ist eine Funktion der anfänglichen spezifischen Aktivität des Enzyms) immobilisiert..
| Art der Nafion | Die Enzymaktivität (mU / g) |
| Buffer (kein Polymer) | 7,18 ± 0,51 |
| Nafion (un-mod.) | 70,1 ± 0,5 |
| TMTDA | 133 ± 6 |
| TBAB | 244 ± 4 |
| TMDDA | 221 ± 6 |
| TMOA | 1,78 ± 0,63 |
| TMDA | 206 ±5 |
| TEHA | 40,1 ± 50,6 |
| TMHDA | 0 |
| TMODA | 1,45 ± 0,06 |
Tabelle 3 PQQ-abhängige Glucose-Dehydrogenase-Aktivität in ausgewählten modifizierten Polymeren Nafion (Anmerkung: immobilisierte Aktivität ist eine Funktion der anfänglichen spezifischen Aktivität des Enzyms) immobilisiert..
| Art der Nafion | Enzymaktivität (U / g) |
| Buffer (kein Polymer) | 103,61 ± 3,15 |
| Nafion (un-mod.) | 19,93 ± 10,10 |
| TMTDA | 247,25 ± 12,49 |
| TBAB | 152,27 ± 5,29 |
| TMDDA | 262,05 ± 6,26 |
| TMOA | 129,18 ± 2,31 |
| TMDA | 141,23 ± 1,97 |
| TMHA | 131,75 ± 2,89 |
| TMHDA | 132,50 ± 1,18 |
| TMODA | 136,50 ± 0,96 |
. Tabelle 4 Repräsentative Glucoseoxidase spezifische Aktivität in ausgewählten modifizierten Polymeren Nafion (: immobilisierte Aktivität ist eine Funktion der anfänglichen spezifischen Aktivität des Enzyms beachten) immobilisiert.
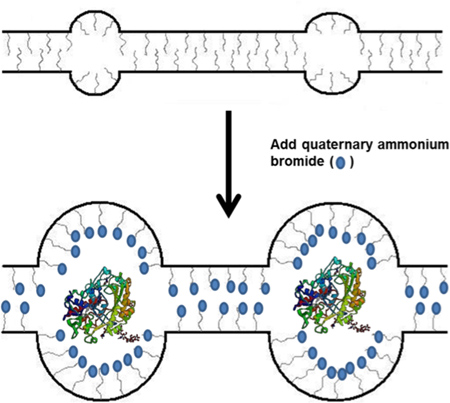
Abbildung 1. Schematische Darstellung der TBAB Einbau in Nafion-Polymer und die anschließende Verwendung in Enzymimmobilisierung.

Abbildung 2. Optische Foto von anfänglichen Co-Gießfolien von Nafion und TBAB. Langsam trocknend liefert eine transparente, hellbraune Fettfilm über das bottom der Waagschale.
Diskussion
In der beschriebenen Verfahren werden Tetraalkylammonium-Salze eingesetzt, um kommerzielle Nafion zu modifizieren, um micellaren Polymere, die verwendet zu immobilisieren und stabilisieren Enzyme können zu schaffen. Die beschriebenen Tests in dem Verfahren zeigen, dass das Polymer verwendet werden, um eine Vielzahl von Enzymen mit einem hohen Beibehaltung der Aktivität zu immobilisieren. Wenn das interessierende Enzym hat eine sehr geringe Aktivität oder unrein ist, kann eine höhere Konzentration erforderlich sein u...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Autoren danken dem Office of Naval Research, United Soybean Board und der National Science Foundation für finanzielle Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
| Nafion | Sigma-Aldrich | 70160 | |
| Tetra Alkylammonium Bromidsalze | Sigma-Aldrich | n / a | |
| Alkohol-Dehydrogenase | Sigma-Aldrich | A3263 | |
| Nicotinamid-Adenin-Dinukleotid (NAD) | Simga-Aldrich | N7004 | |
| Natriumpyrophosphat | Sigma-Aldrich | P8010 | |
| Phenazinmethosulfat (PMS) | Sigma-Aldrich | P9625 | |
| 2,6-Dichlorindophenol (DCIP) | Sigma-Aldrich | D1878 | |
| Glucose-Oxidase | Sigma-Aldrich | G7141 | |
| 4-Hydroxybenzoesäure | Sigma-Aldrich | 240141 | |
| Natriumazid | Sigma-Aldrich | S8032 | |
| Peroxidase | Sigma-Aldrich | P8375 | |
| 4-Aminoantipyrin | Sigma-Aldrich | 06800 | |
| UV / VIS Spektralphotometer | Thermo | Evolution 260 Bio oder Spectronic Genesys 20 | |
| Vortex Genie | |||
| Analysenwaage |
Referenzen
- Calabrese-Barton, S., Gallaway, J., Atanassov, P. Enzymatic biofuel cells for implantable and microscale devices Chem. Rev. 104, 4867-4886 (2004).
- Cracknell, J. A., Vincent, K. A., Armstrong, F. A. Enzymes as Working or Inspirational Electrocatalysts for Fuel Cells and Electrolysis. Chem. Rev. 108, 2439-2461 (2008).
- Minteer, S. D., Liaw, B. Y., Cooney, M. J. Enzyme-Based Biofuel Cells. Curr. Opin. Biotechnol. 18, 228-234 (2007).
- Callahan, J. W., Kosicki, G. W. The Effect of Lipid Micelles on Mitochondrial Malate Dehydrogenase. Canadian Journal of Biochemistry. 45, 839-851 (1967).
- Martinek, K. Modeling of the Membrane Environment of Enzymes: Superactivity of Laccase Entrapped into Surfactant Reversed Micelles in Organic Solvents. Biokhimiya. 53, 1013-1016 (1988).
- Moore, C. M., Akers, N. L., Hill, A. D., Johnson, Z. C., Minteer, S. D. Improving the Environment for Immobilized Dehydrogenase Enzymes by Modifying Nafion with Tetraalkylammonium Bromides. Biomacromolecules. 5, 1241-1247 (2004).
- Schrenk, M. J., Villigram, R. E., Torrence, N. J., Brancato, S. J., Minteer, S. D. Effects of Mixture Casting Nafion with Quaternary Ammonium Bromide Salts on the Ion-Exchange Capacity and Mass Transport in the Membranes. J. Membr. Sci. 205, 3-10 (2002).
- Akers, N. L., Moore, C. M., Minteer, S. D. Development of Alcohol/O2 Biofuel Cells Using Salt-Extracted Tetrabutylammonium Bromide/Nafion Membranes to Immobilize Dehydrogenase Enzymes. Electrochim. Acta. 50, 2521-2525 (2005).
- Sokic-Lazic, D., Minteer, S. D. Citric Acid Cycle Biomimic on a Carbon Electrode. Biosens. Bioelectron. 24, 939-944 (2008).
- Arechederra, R. L., Minteer, S. D. Complete Oxidation of Glycerol in an Enzymatic Biofuel Cell. Fuel Cells. 9, 63-69 (2009).
- Germain, M., Arechederra, R. L., Minteer, S. D. Nitroaromatic Actuation of Mitochondrial Bioelectrocatalysis for Self-Powered Explosive Sensors. J. Am. Chem. Soc. 130, 15272-15273 (2008).
- Addo, P. K., Arechederra, R. L., Minteer, S. D. Evaluating Enzyme Cascades for Methanol/Air Biofuel Cells Based On NAD+-Dependent Enzymes. Electroanalysis. 22, 807-812 (2010).
- Smith, P. K., Krohn, R. I., Hermanson, G. T., Mallia, A. K., Gartner, F. H., Provenzano, M. D., Fujimoto, E. K., Goeke, N. M., Olson, B. J., Klenk, D. C. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150, 76-85 (1985).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten