È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Idrofobo Salt-modificato Nafion per l'immobilizzazione degli enzimi e la stabilizzazione
In questo articolo
Riepilogo
Questo articolo descrive la procedura di sintesi di un enzima modificato in modo idrofobo membrana Nafion immobilizzazione e come immobilizzare proteine e / o enzimi all'interno della membrana e verificare la loro attività specifica.
Abstract
Negli ultimi dieci anni, c'è stata una ricchezza di domanda di enzimi immobilizzati e stabilizzati tra biocatalisi, biosensori, e le cellule di biocarburanti. 1-3 In maggior parte delle applicazioni bioelectrochemical, enzimi o organuli sono immobilizzati su una superficie dell'elettrodo con l'utilizzo di un certo tipo di matrice polimerica. Questa impalcatura polimero dovrebbe tenere gli enzimi stabile e consentire la facile diffusione delle molecole e ioni in e fuori dalla matrice. La maggior parte dei polimeri utilizzati per questo tipo di immobilizzazione sono basati su poliammine o polialcoli - polimeri che imitano l'ambiente naturale degli enzimi che incapsulano e stabilizzare l'enzima mediante idrogeno o legame ionico. Un altro metodo per stabilizzare gli enzimi comporta l'uso di micelle, che contengono regioni idrofobiche che può incapsulare e stabilizzare gli enzimi. 4,5 In particolare, il gruppo Minteer ha sviluppato un polimero basato su micellare Nafion commercialmente disponibili. 6,7 Nafionsi è un polimero che permette micellare del canale assistita diffusione di protoni e altri cationi piccoli, ma le micelle e canali sono estremamente piccoli e il polimero è molto acido solfonico dovuto catene laterali acide, il che è sfavorevole per l'immobilizzazione degli enzimi. Tuttavia, quando Nafion viene miscelato con un eccesso di idrofobi sali di alchilammonio quali tetrabutilammonio bromuro (TBAB), i cationi di ammonio quaternario sostituire i protoni e gli ioni diventano contatore ai gruppi solfonato sulle catene laterali polimeriche (Figura 1). Questo crea delle micelle e canali all'interno del polimero che consentono la diffusione di grandi substrati e ioni che sono necessari per la funzione enzimatica come nicotinammide adenin dinucleotide (NAD). Questo polimero Nafion modificato è stato usato per immobilizzare vari tipi di enzimi e mitocondri per l'uso in biosensori e cellule biocarburanti. 8-12 Questo documento descrive una nuova procedura per effettuare questo microfonoellar membrana polimerica immobilizzazione degli enzimi in grado di stabilizzare gli enzimi. La sintesi della membrana micellare immobilizzazione dell'enzima, la procedura per immobilizzare gli enzimi all'interno della membrana, e saggi per studiare le attività enzimatica specifica dell'enzima immobilizzato sono riportate di seguito.
Protocollo
1. Modifica del Nafion con sali di ammonio quaternario
- Agitare una bottiglia del 5% w / v sospensione Nafion vigorosamente per ca. 30 secondi per assicurare che Nafion viene sospeso in soluzione uniforme.
- Pipettare in 2 mL di Nafion ora risospeso in una fiala di vetro (volume fiala può contenere da 2,5 ml a 10 ml).
- Misura di 3 volte in eccesso molare (rispetto a gruppi di acido solfonico nel polimero Nafion) del sale di alchil ammonio bromuro (masse appropriate sono mostrati in Tabella 1) ed aggiungere al flaconcino contenente il 2 mL di Nafion.
- Vortex il flacone a 1500 rpm per 10-15 minuti.
- Versare la soluzione viscosa in un vassoio di plastica di peso che misura ca. 3 x 3 pollici, e utilizzare una pipetta per trasferire i residui della soluzione dal flaconcino al vassoio di pesatura.
- Lasciare evaporare i solventi dal peso barca, lasciando un giallo / marrone, pellicola trasparente sul fondo del vassoio di pesatura (Figura 2). Il tasso di evaporazione del solvente deve essere tale che ci vuole più di 6 ore per evaporare tutto il solvente. Se il solvente evapora troppo velocemente, un bianco, croccante materiale formerà, invece di una pellicola trasparente che indica che la struttura micellare del polimero è stata distrutta, ed è necessario riavviare la procedura. Se evaporazione del solvente è troppo lento, un de-umidificatore può essere necessario, perché troppo lenta evaporazione porta normalmente a uno cattivo gusto, gel arancione ed è necessario riavviare la procedura. Intervalli di temperatura tipici per evaporazione del solvente sono 20 - 37 ° C. Le condizioni effettive di essiccazione sono funzione della temperatura e dell'umidità relativa nella camera, ma è importante che l'essiccazione essendo lento per mantenere struttura micellare, ma non troppo lento per permettere la formazione di gel.
- Riempire il peso barca con 18M Qcm acqua deionizzata (10-20 ml di acqua), coprire e lasciare in immersione per 12-24 ore per rimuovere i sali in eccesso alchil ammonio bromuro e HBr.
- Versare (o pipetta) l'acqua e lavare 3 volte con acqua deionizzata a sufficienza per riempire il cassetto ogni volta. Fare attenzione a non perdere uno dei film polimerico in questa fase.
- Lasciare il vassoio di pesatura per sedersi scoperto fino a che il polimero è completamente asciutta A questo punto, il polimero dovrebbe essere una pellicola trasparente e piuttosto fragili plastica. Anche in questo caso, se l'aria è molto umida, uno de-umidificatore può essere necessario per completare l'evaporazione in modo tempestivo.
- Utilizzando una spatola, rimuovere con cura la pellicola essiccata dal vassoio di pesatura e trasferirlo in una fiala di vetro pulito.
- Aggiungere 2 mL di etanolo e 3 perle di ceramica di miscelazione e miscelare per 4 ore o fino a quando il film polimerico viene completamente ri-sospeso.
2. Immobilizzazione di enzimi in TBAB Nafion-Modified per saggi di attività
- Per un enzima secco, pesare 1-10 mg dell'enzima in una provetta da 1,5 ml, e aggiungere 1 ml di 100 mM tampone fosfato pH 7 per creare un 1-10 mg / ml di soluzione enzimatica. For un enzima che è in soluzione, utilizzare un acido bicinconinico (BCA) dosaggio 13 per determinare la quantità di proteine, e aggiungere una quantità appropriata di 100 mM tampone fosfato per portare la concentrazione di proteina di 1-10 mg / mL. 1-10 mg mL / in genere corrisponde a 1-50 nanomoli / mL.
- Per 120 microlitri della 1 mg / mL di soluzione enzimatica, aggiungere 60 ul di alchil ammonio-modificato soluzione di Nafion, e vortex per 10 secondi. (Questa miscela può essere scalato per un gran numero di repliche. Mantenere l'enzima-to-polimero rapporto di soluzione 2:1.)
- Pipettare 60 pl di dell'enzima / polimero soluzione nel fondo 3 distinti 1 cm 2 cuvette, e lasciare asciugare durante la notte.
3. Saggio di immobilizzata NAD-Dependent Enzyme deidrogenasi
- Per la cuvetta, aggiungere 1,3 ml di 50 mM pirofosfato di sodio (pH 8,8), 1,5 ml di 15 mM NAD (preparati al momento), e 0,1 ml di acqua.
- Posizionare la cuvetta in uno spettrofotometro UV / Vis (cioè Evolut ThermoScientificion 260 Bio e Thermo Spectronic Genesys 20) impostato su una lunghezza d'onda di 340 nm.
- Azzerare lo spettrometro, e quindi aggiungere 0,1 mL di etanolo. Mescolare i reagenti pipettando gentilmente la soluzione su e giù per 5 volte. Per un vuoto, usare 0,1 mL di acqua addizionale, invece del 0,1 mL di etanolo.
- Registrare l'assorbanza a 340 nm a 5 minuti dopo i reagenti sono stati aggiunti alla cuvetta e 20 minuti dopo. Tracciare i due punti di dati per ottenere una pendenza che può essere utilizzato per i calcoli di attività.
4. Saggio di immobilizzati PQQ-dipendenti deidrogenasi
- Per la cuvetta, aggiungere 1,5 ml di fosfato di sodio (pH 7,3) e 200 pl di 600 uM PMS.
- Posizionare la cuvetta in uno spettrofotometro UV / Vis impostato a una lunghezza d'onda di 600 nm e quindi azzerare il spettrometro.
- Aggiungere 100 pl di 700 microlitri DCIP e 200 pl del substrato di interesse (etanolo, acetaldeide, glicerolo, glucosio, o gliceraldeide), e miscelare i reagenti pipettando gentilmente la soluzion su e giù per 5 volte. Per un vuoto, usare 200 pl di acqua invece del substrato di interesse.
- Registrare l'assorbanza a 600 nm a 5 minuti dopo i reagenti sono stati aggiunti alla cuvetta e 20 minuti dopo.
5. Saggio di glucosio ossidasi immobilizzato
- Per la cuvetta, aggiungere 2,0 ml di una soluzione contenente 0,2 M p-idrossibenzoico, sodio azide 0,02% (w / v), 128 U perossidasi, 0,3 mM di 4-amminoantipirina, 1 M di fosfato di potassio, e 50 mM di glucosio. Miscelare la soluzione pipettando su e giù 5 volte.
- Posizionare la cuvetta in uno UV / Vis set spettrofotometro ad una lunghezza d'onda di 510 nm.
- Registrare l'assorbanza a 510 nm a 5 minuti dopo i reagenti sono stati aggiunti alla cuvetta e di nuovo a 20 minuti dopo.
6. Risultati rappresentativi
La struttura micellare del polimero Nafion modificata può essere interrotto con l'essiccazione del sale originale / co-polimero fuso film troppo fast. Figura 2 mostra un sale / polimero miscela che è stata essiccata correttamente conseguente pellicola trasparente, marrone chiaro. Un film che asciuga troppo velocemente può provocare opachi, bianchi fiocchi di polimero a causa del fatto che il processo di asciugatura può distruggere la struttura micellare.
Una volta che il polimero modificato Nafion e enzima sono stati miscelati e co-espressi sul fondo di una cuvetta, saggi di attività enzimatica può essere utilizzato per valutare la stabilità dell'enzima all'interno del film polimerico. Tabelle 2-4 mostrano i risultati del dosaggio dei due enzimi deidrogenasi e glucosio ossidasi immobilizzata in vari film Nafion modificati, rispettivamente. Nota la maggiore attività degli enzimi che sono immobilizzati contro gli enzimi in soluzione tampone, mostrando che i polimeri modificati Nafion può migliorare l'attività di certi enzimi (chiamati superactivity). Altri enzimi hanno limitazioni di trasporto che riducono la loro attività specifica quando li immobilizzare il polimero (amilasi e cellulasi ad esempio, i cui substrati sono macromolecole piuttosto grandi).
| Sale di ammonio quaternario utilizzata | 3 volte più elevato |
| T3A (bromuro di tetrapropilammonio) | 32,37 mg / ml |
| TBAB (bromuro di tetrabutilammonio) | 39,19 mg / ml |
| TPAB (bromuro tetrapentilammonio) | 46,01 mg / ml |
| TEHA (bromuro triethylhexylammonium) | 32,37 mg / ml |
| TMHA (bromuro trimethylhexylammonium) | 27,25 mg / ml |
| TMOA (bromuro trimethyloctylammonium) | 30,66 mg / ml |
| TMDA (bromuro trimethyldecylammonium) | 34,07 mg / ml |
| TMDDA (bromuro trimethyldodecylammonium) | 37,48 mg / ml |
| TMTDA (bromuro trimethyltetradecylammonium) | 40,89 mg / ml |
| TMHDA (bromuro trimetilesadecilammonio) | 44,31 mg / ml |
| TMODA (bromuro trimetilesadecilammonio) | 47,71 mg / ml |
Tabella 1. Importi di tetra-alchil sali di ammonio da utilizzare per Nafion polimero modifica.
| Tipo di Nafion | L'attività enzimatica (U / g) |
| Buffer (no polimero) | 16,63 ± 8,11 |
| Nafion (un-mod.) | 9,25 ± 2,21 |
| TMTDA | 3,23 ± 2,92 |
| TBAB | 3,93 ± 3,33 |
| TMDDA | 4,19 ± 1,04 |
| TMOA | 3,51 ± 1,11 |
| TMDA | 8,00 ± 4,53 |
| TMHA | 1,68 ± 1,39 |
| TMHDA | 4,83 ± 0,99 |
| TMODA | 10,45 ± 3,20 |
Tabella 2 NAD-dipendente attività glucosio deidrogenasi immobilizzato in Nafion selezionati polimeri modificati (nota: attività immobilizzata è una funzione iniziale di attività specifica dell'enzima)..
| Tipo di Nafion | L'attività enzimatica (mU / g) |
| Buffer (no polimero) | 7,18 ± 0,51 |
| Nafion (un-mod.) | 70,1 ± 0,5 |
| TMTDA | 133 ± 6 |
| TBAB | 244 ± 4 |
| TMDDA | 221 ± 6 |
| TMOA | 1,78 ± 0,63 |
| TMDA | 206 ±5 |
| TEHA | 40,1 ± 50,6 |
| TMHDA | 0 |
| TMODA | 1,45 ± 0,06 |
Tabella 3 PQQ dipendente dalla attività glucosio deidrogenasi immobilizzato in Nafion selezionati polimeri modificati (nota: attività immobilizzata è una funzione iniziale di attività specifica dell'enzima)..
| Tipo di Nafion | L'attività enzimatica (U / g) |
| Buffer (no polimero) | 103,61 ± 3,15 |
| Nafion (un-mod.) | 19,93 ± 10,10 |
| TMTDA | 247,25 ± 12,49 |
| TBAB | 152,27 ± 5,29 |
| TMDDA | 262,05 ± 6,26 |
| TMOA | 129,18 ± 2,31 |
| TMDA | 141,23 ± 1,97 |
| TMHA | 131,75 ± 2,89 |
| TMHDA | 132,50 ± 1,18 |
| TMODA | 136,50 ± 0,96 |
. Rappresentativa Tabella 4 attività specifica glucosio ossidasi immobilizzata in Nafion selezionati polimeri modificati (nota: attività immobilizzata è una funzione iniziale di attività specifica dell'enzima).
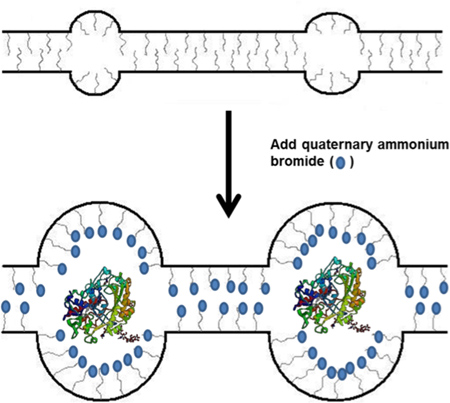
Figura 1. Schema di incorporazione TBAB Nafion in polimero e il successivo utilizzo in immobilizzazione degli enzimi.

Figura 2. Fotografia ottica di un primo atto co-cast film di Nafion e TBAB. Lenta asciugatura produce un pellicola trasparente, marrone chiaro copre la bottom del vassoio di pesatura.
Discussione
Nel procedimento descritto, tetra-alchil ammonio vengono utilizzati per modificare Nafion commerciale per creare micellari polimeri che possono essere utilizzati per immobilizzare e stabilizzare gli enzimi. I saggi descritti nella procedura mostrano che il polimero può essere utilizzato per immobilizzare un'ampia varietà di enzimi con un'elevata ritenzione di attività. Se l'enzima di interesse ha una attività molto bassa o è impuro, una più alta concentrazione può essere richiesta e non devono inficia...
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Gli autori riconoscono l'Office of Naval Research, consiglio di soia Uniti, e la National Science Foundation per il finanziamento.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | |
| Nafion | Sigma-Aldrich | 70160 | |
| Tetra alchilammonio bromuro di sali | Sigma-Aldrich | n / a | |
| Alcool deidrogenasi | Sigma-Aldrich | A3263 | |
| Nicotinammide adenin dinucleotide (NAD) | SIGMA-Aldrich | N7004 | |
| Pirofosfato di sodio | Sigma-Aldrich | P8010 | |
| Fenazina metosolfato (PMS) | Sigma-Aldrich | P9625 | |
| 2,6-Dichloroindophenol (DCIP) | SigMA-Aldrich | D1878 | |
| Glucosio ossidasi | Sigma-Aldrich | G7141 | |
| 4-idrossibenzoico | Sigma-Aldrich | 240141 | |
| Sodio azide | Sigma-Aldrich | S8032 | |
| Perossidasi | Sigma-Aldrich | P8375 | |
| 4-aminoantipirina | Sigma-Aldrich | 06800 | |
| UV / Vis Spettrofotometro | Thermo | Evolution 260 Bio o Spectronic Genesys 20 | |
| Vortex Genie | |||
| Bilancia analitica |
Riferimenti
- Calabrese-Barton, S., Gallaway, J., Atanassov, P. Enzymatic biofuel cells for implantable and microscale devices Chem. Rev. 104, 4867-4886 (2004).
- Cracknell, J. A., Vincent, K. A., Armstrong, F. A. Enzymes as Working or Inspirational Electrocatalysts for Fuel Cells and Electrolysis. Chem. Rev. 108, 2439-2461 (2008).
- Minteer, S. D., Liaw, B. Y., Cooney, M. J. Enzyme-Based Biofuel Cells. Curr. Opin. Biotechnol. 18, 228-234 (2007).
- Callahan, J. W., Kosicki, G. W. The Effect of Lipid Micelles on Mitochondrial Malate Dehydrogenase. Canadian Journal of Biochemistry. 45, 839-851 (1967).
- Martinek, K. Modeling of the Membrane Environment of Enzymes: Superactivity of Laccase Entrapped into Surfactant Reversed Micelles in Organic Solvents. Biokhimiya. 53, 1013-1016 (1988).
- Moore, C. M., Akers, N. L., Hill, A. D., Johnson, Z. C., Minteer, S. D. Improving the Environment for Immobilized Dehydrogenase Enzymes by Modifying Nafion with Tetraalkylammonium Bromides. Biomacromolecules. 5, 1241-1247 (2004).
- Schrenk, M. J., Villigram, R. E., Torrence, N. J., Brancato, S. J., Minteer, S. D. Effects of Mixture Casting Nafion with Quaternary Ammonium Bromide Salts on the Ion-Exchange Capacity and Mass Transport in the Membranes. J. Membr. Sci. 205, 3-10 (2002).
- Akers, N. L., Moore, C. M., Minteer, S. D. Development of Alcohol/O2 Biofuel Cells Using Salt-Extracted Tetrabutylammonium Bromide/Nafion Membranes to Immobilize Dehydrogenase Enzymes. Electrochim. Acta. 50, 2521-2525 (2005).
- Sokic-Lazic, D., Minteer, S. D. Citric Acid Cycle Biomimic on a Carbon Electrode. Biosens. Bioelectron. 24, 939-944 (2008).
- Arechederra, R. L., Minteer, S. D. Complete Oxidation of Glycerol in an Enzymatic Biofuel Cell. Fuel Cells. 9, 63-69 (2009).
- Germain, M., Arechederra, R. L., Minteer, S. D. Nitroaromatic Actuation of Mitochondrial Bioelectrocatalysis for Self-Powered Explosive Sensors. J. Am. Chem. Soc. 130, 15272-15273 (2008).
- Addo, P. K., Arechederra, R. L., Minteer, S. D. Evaluating Enzyme Cascades for Methanol/Air Biofuel Cells Based On NAD+-Dependent Enzymes. Electroanalysis. 22, 807-812 (2010).
- Smith, P. K., Krohn, R. I., Hermanson, G. T., Mallia, A. K., Gartner, F. H., Provenzano, M. D., Fujimoto, E. K., Goeke, N. M., Olson, B. J., Klenk, D. C. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150, 76-85 (1985).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon