A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
في الوقت الحقيقي التصوير الرقمي من خلايا الدم البيضاء البطاني التفاعل في الإسكيمية-ضخه من الإصابات (IRI) في الجرذان العضلة المشمرة
In This Article
Summary
الرقمية intravital المجهري epifluorescence من الوريدات شعيرة وريدية في دوران الأوعية الدقيقة مشمري هو وسيلة مريحة للحصول على نظرة ثاقبة الكريات البيض البطاني تفاعل في الجسم الحي في الإسكيمية-ضخه الاصابة (IRI) من الأنسجة العضلية المخططة. ونحن نقدم هنا بروتوكولا مفصلة لتنفيذ بأمان تقنية ومناقشة تطبيقاتها والقيود.
Abstract
وقد تورط الإسكيمية-ضخه الاصابة (IRI) في مجموعة كبيرة من الحالات المرضية مثل السكتة الدماغية الدماغ، احتشاء عضلة القلب، نقص تروية الأمعاء، وكذلك بعد عملية زرع القلب والأوعية الدموية، وجراحة إعادة إشباع الخلايا 1. من الأنسجة الدماغية في السابق، في حين أساسي للوقاية من لا رجعة فيه إصابة الأنسجة، يتسبب التهاب الزائدة من الأنسجة المتضررة. المتاخمة لإنتاج أنواع الاكسجين التفاعلية، تفعيل نظام مكمل وزيادة نفاذية الاوعية الدموية الدقيقة، وتنشيط الكريات البيض من هو واحد من الأطراف الفاعلة المبدأ في سلسلة من تلف الأنسجة المرضية للالتهابات خلال ضخه. 2، 3 تنشيط خلايا الدم البيضاء هي عملية متعددة الخطوات التي تتكون من المتداول، التصاق وطيد والتهجير وبوساطة تفاعل معقد بين جزيئات الالتصاق ردا على chemoattractants مثل عوامل مكملة، كيموكينات، أو عامل الصفيحات تفعيل-4 <ف الطبقة = "jove_content"> وفي الوقت الذي توسط في الغالب المتداول الكريات البيض في الأوردة شعيرة وريدية بواسطة تفاعل selectins 5 مع يغاندس وما يماثلها، التصاق الكريات البيض من شركة إلى البطانة غير selectin التي تسيطر عليها عن طريق ملزمة لجزيئات الالتصاق بين الخلايا (ICAM) والخليوي وعائي جزيئات الالتصاق (VCAM). 6، 7
معيار الذهب للمراقبة في الجسم الحي من الكريات البيض البطاني التفاعل تقنية المجهر intravital، لأول مرة في عام 1968. 8
على الرغم من وصفت نماذج مختلفة من المعهد الجمهوري الدولي (نقص التروية، ضخه الاصابة) لمختلف الأجهزة، 9-12 قليلة فقط هي مناسبة لرؤية مباشرة من تجنيد الكريات البيض في قاع الاوعية الدموية الدقيقة على مستوى عال من جودة الصورة. 8
نحن هنا لتعزيز رقمي المجهري epifluorescence intravital من الوريد شعيرة وريدية في دوران الأوعية الدقيقة مشمريمن الفئران 13 كوسيلة من وسائل مريحة لنوعيا وكميا تحليل تجنيد الكريات البيض عن المعهد الجمهوري الدولي للبحوث في الأنسجة العضلية المخططة وتوفير دليل مفصل لإنجاز تقنية. نحن لتوضيح مزيد من المخاطر المشتركة وتقديم النصائح المفيدة التي ينبغي أن تمكن القارئ أن نقدر حقا، وآمن طريقة أداء.
في خطوة من قبل بروتوكول خطوة نقوم تصور كيف تبدأ مع تخدير تنفس تسيطر عليها تحت مراقبة كافية للحفاظ على الحيوانات تخدير بحزم لفترات أطول من الوقت. وصفنا ثم إعداد ورقة مشمري كما شقة رقيقة لقرار الضوئية المعلقة وتوفير بروتوكول للتصوير الكريات البيض في المعهد الجمهوري الدولي الذي تم راسخة في مختبراتنا.
Protocol
1. التخدير والمراقبة
- وينبغي أن الملائمة الأخلاقيات الوطنية والمؤسسية أن تكون في مكان قبل إجراء التجارب على الحيوانات. بعد الحصول على موافقة من لجنة الأخلاقيات تخدير الفئران الذكور سبراغ داولي مع وزن الجسم 120-180 غ. تسليم 2-3 المجلد٪ isoflurane إلى مربع زجاجي عبر المرذاذ isoflurane ووضع داخل الفئران.
- حالما يتم تحقيق المستوى المناسب من التخدير (عدم وجود رد فعل حتى أخمص القدمين أو قرصة الذيل) ويحدد وزن الفأر، وحلق في منطقة عنق الرحم بطني.
- وضع فأر في الاستلقاء على ظهري وسادة التدفئة للحفاظ على درجة حرارة الجسم عند 37 درجة مئوية وتطبيق isoflurane في المجلد 2٪ باستخدام قناع السيليكون.
وأفضل إنجاز الخطوات التالية إعداد باستخدام الميكروسكوب الجراحي.
- لإعداد القصبة الهوائية، والشريان السباتي وحبل الوريد، تنفيذ (أ) 2 سم شق الجلد الأفقية في منطقة سو الشق فوق القص وتعبئة الغدد اللعابية أفقيا.
- كنت تواجه الآن عضلات الرقبة بطني. بعناية فرقوا بينهم في خط الوسط، والعثور على القصبة الهوائية. فضح 1-2 سم من القصبة الهوائية ووضع ملقط الصغيرة تحتها وذلك لرفع الامر.
- الشق الآن في منتصف الطريق نحو من خلال الجانب البطني من القصبة الهوائية. يجب الحرص على عدم قطع الطريق على جميع من خلال، اذا كنت تفعل، ونهاية قطع من القصبة الهوائية وسوف تنزلق إلى صدره وسيكون من الصعب جدا على التعامل معها.
- إدراج أنبوب Abbocath (14G) استخدام أنبوب القصبة الهوائية في الجزء السفلي من القصبة الهوائية، والتي قد سبق متصلة التنفس الصناعي للحيوانات. نصيحة: تثبيت الشركة في المشابك مغناطيس فضلا عن خياطة من القصبة الهوائية حول أنبوب أمر ضروري للحفاظ على أنبوب القصبة الهوائية في مكان. عموما نحن نستخدم تيريليني 5/0 خياطة، ويمكن استخدام مماثل لكن مواد خياطة الجروح.
- يمكن أن يكون التنفس ثم حجم للرقابة (تردد، 35-45 الأنفاس / دقيقة، حجم المد والجزر، 4،5-5 مل، 2 قوة المراقبة الدولية 14 انخماص من خلال المحافظة على إيجابية نهاية الزفير ضغط من 5 الى 10 ملم من H 2 O. 15 - Isoflurane 1.5؛ - يو بي>، 0.35 0.50.
- لcanulation السباتي، يتم فصل العضلات حق قصي لامي من قبل تشريح حادة لتحديد موقع الشريان السباتي.
- فصل العصب المبهم بعناية من الشريان السباتي وجبل الشريان في ملقط 1 الدقيقة الزاوية لوقف تدفق الدم من القلب.
- تمر قطعتين من طول متساو من خاط تحت الشريان السباتي. في إشارة إلى القلب، ويرتبط خاط أكثر البعيدة بإحكام إلى انسداد تدفق الدم من منطقة الرأس في حين يرتبط خياطة القريبة فضفاضة حول الشريان السباتي.
- باستخدام مقص الجزئي يتم إجراء قطع صغير في الشريان السباتي بين الحروف المركبة 2.
- اضافة الى وجود القسطرة البولي ايثيلين (0.28 مم القطر الداخلي) مملوءة بمحلول ملحي عادي متصلة محول الضغط.
- REMاوفه الملقط الصغير والصفحات القسطرة الى مزيد من الشريان. تشديد ثم ضمد الداني حول الشرايين والقسطرة. تلميح: طلب من خاط 1 2 القريبة يمنع النزيف بعد إزالة الملقط الصغير.
- ربط ربطة البعيدة حول الشريان السباتي والقسطرة للمرسى إضافي.
- مراقبة مستمرة من قبل التخدير معدل ضربات القلب والرصد والضغط الشرياني. أداء متقطع غاز الدم الشرياني التحليلات باستخدام محلل غازات الدم. 16 ألف معدل ضربات القلب أقل من 300 نبضة في الدقيقة أو تزيد عن 360 نبضة في الدقيقة، فضلا عن الضغط الشرياني يعني أقل من 80 مم زئبق إسقاط لفترة أطول من 5 دقائق هي معايير الاستبعاد. 17، 18 الحفاظ على الدم درجة الحموضة في حدود فسيولوجية (7،35-7،45). في حال التجربة لابد من إنهاء بسبب معدلات الرصد غير طبيعية، ويخدش الحيوان بواسطة خلع الرقبة أو exanguation.
للتطبيق في الوريد من الأصباغ الفلورية أو غيرها من المخدرات ساهتمام و، القيام بما يلي:
- التركيز على منطقة من الوريد الوداجي الايسر مع الميكروسكوب الجراحي.
- بالملقط في كل يد، المسيل للدموع لفافة رقيقة للكشف عن حبل الوريد. تركيب وريد في الدقيقة ملقط 1 الزاوية. وتدفق الدم ثم توقف.
- باستخدام ملقط، يتم تمرير قطعتين من طول المتساوية للخياطة تحت حبل الوريد متطابقة إلى canulation السباتي. ربط الخيط بإحكام القاصي والداني خياطة فضفاضة حول حبل الوريد.
- إجراء قطع صغير في حبل الوريد وتضاف قسطرة البولي ايثيلين (0.28 مم القطر الداخلي) أنه قد تم مسح مع المياه المالحة. بمناسبة أن شق وcanulation يمكن أن تكون أكثر تطلبا، وتستغرق وقتا طويلا من ذلك من الشريان السباتي.
- الخيط القسطرة نحو القلب وإحكام رباط الأقرب إلى قلب حول الوريد والقسطرة.
- بعد سالكية المطابقة، ربط ربطة البعيدة حول القسطرة. نصيحة: تثبيت إضافية من بوقد القسطرة عشر مع الشريط منع dislodgment.
- شطف القسطرة في كثير من الأحيان لمنع تخثر الدم داخل اللمعة.
2. إعداد العضلات المشمرة
- نحن نستخدم مرحلة الألومنيوم من 1،5-2 سم سماكة للتصوير مشمري. المرحلة تعتمد بشكل سريع في درجة الحرارة المرغوبة للسادة التدفئة وبالتالي التخفيف من حدة التحكم الحراري من نسيج العضلة المشمرة. هذا أمر بالغ الأهمية للدراسات التهاب. وكبديل يمكن استخدام منصة زجاجي على الرغم من تنظيم درجة الحرارة مشمري هو أكثر صعوبة. وضع كيس الصفن في وسط المسرح.
- يتم إجراء شق الأولي في الجلد واللفافة المنوية الخارجية فوق الصفن في النهاية البعيدة جدا يليه توسع حذرة من المساحة تحت الجلد باستخدام مقص غرامة. تجنب لمس الأنسجة الكامنة مع الصكوك.
- بأسرع ما يتعرض النسيج هو مبلل مع ما قبل الساخنة (37 درجة مئوية) مخزنة فوسفات المالحة واي حلالكالسيوم والمغنيسيوم عشر. تطبيق حل بانتظام إلى أي نوع من الأنسجة المكشوفة.
- تتم إزالة بعناية النسيج الضام بين لفافة من المنوي الخارجية والعضلات المشمرة لتحرير العضلات المشمرة من الأنسجة المحيطة.
- السطح الخارجي للعضلة المشمرة ومن ثم مسح بحذر من النسيج الضام. superfusion المستمر خلال هيدرات تشريح النسيج الضام، وتسهيل الرؤية وإزالتها.
- خياطة نهاية البعيدة للكيس المشمرة على الاستمرار وتوسيع نطاق قليلا في نهاية كيس.
- شق نهاية البعيدة للكيس على الجانب البطني واستطال الشق قريب باستخدام مقص الصغرى. كوى بعناية نزيف السفن على طول خطوط شق الاستفادة من الكي الحراري. تجنب الكي لا لزوم لها للحد من مثيرات الالتهابية إضافية. تلميح: يتم تغيير ديناميكية تدفق الدم بالقرب من المحيط الخارجي للإعداد من قبل هذا تلف الأنسجة 19 لذلك، للحد منحد ذاته يؤثر على جمع البيانات، ينبغي استخدام الأوعية الدموية بالقرب من مركز للتحضير للتصوير.
- والمشمرة مفتوحة شقة تقع على قاعدة التمثال على الرغم من الألومنيوم لا تزال متصلة من جانب الرباط رقيقة إلى البربخ تحت الخصية. الأمر الذي يعكس الخصية إلى جانب واحد يعرض هذا الرباط بما في ذلك الشريان الصغيرة والوريد التي تتصل البربخ. استخدام مكواة لختم السفن وتوظيف مقص الجزئي لقطع الرباط الضام بين الخصية والأنسجة مشمري.
- دفع بلطف ظهر الخصية معزولة في القناة الأربية. مؤلفين آخرين يقطع الخصية بعد ربط الداني (orchiectomy) جنبا إلى جنب مع لوحة بدعة الأربية المرتبطة بها (20). وفي نموذج حساسة مثل تنشيط الكريات البيض التي يسببها المعهد الجمهوري الدولي ونحن نحاول تجنب كل المنبهات إضافية الجراحية، وبالتالي فإننا الامتناع عن الإستئصال الخصية، والتي هي عادة ليست من الضروري الحصول على ما يكفي من التعرض للعضلة المشمرة.
- بالإضافة إلى أولخياطة تثبيت 4 حواف النسيج (اثنان في كل جانب)، ونعلق على مواضيع الأشرطة لنشر بحذر النسيج مشمري شعاعيا على المسرح الألومنيوم. مما يترك فجوة بين مرحلة الألومنيوم والمدخل الخارجي للقناة الإربية يبسط اللاحقة لقطة المشمرة عن نقص التروية.
- مكان طرفي القسطرة البولي ايثيلين (0.28 مم القطر الداخلي) على مقربة من نسيج العضلة المشمرة لإعداد superfusion. تأكد من أن التجويف خال من الهواء لتجنب فقاعات الهواء في غرفة السوائل في نهاية المطاف.
- رسم خط من الفازلين (الفازلين) حول العضلة المشمرة باستخدام حقنة. يجب على خط توسيع حجم انزلاق الغطاء الذي يستخدم لتغطية.
- لإنشاء غرفة السوائل، ووضع غطاء زلة مربع (32 × 32 ملم) على نسيج العضلة المشمرة ونعلق بحزم حواف إلى خط الفازلين.
- في حال لم يتم superfused النسيج مشمري مع دواء معين، واستبدال المستمر للانفلونزا المحيطةمعرف هو غير الأساسية. ويجوز للتطبيق واحد من الفوسفات مخزنة محلول ملحي مع الكالسيوم والمغنيسيوم في غرفة سيتم إنشاؤها ثم كاف. التحفيز المحلية مع المخدرات وينبغي مع ذلك أن يؤديها بشكل مستمر عن طريق مضخة صغيرة نضح بمعدل 3 مل لكل ساعة.
- النسيج مشمري جاهز الآن للتصوير المجهري.
3. Intravital الإعداد
قد يكون الإعداد الأساسي intravital تختلف. وينبغي للتصوير epifluorescence يتم تنفيذ التجارب في غرفة مظلمة.
- يتم نقل الحيوانات إلى مرحلة مجهر 1 epifluorescence intravital مجهزة نانومتر 470 الصمام مصدر مضيئة للبرنامج الموسع للتمنيع، الإضاءة. استخدم هدفا الغمر بالماء (20 × / 1.0) لتحقيق التكبير من حوالي 800 ×. سجل ملاحظات عن طريق كاميرا رقمية عالية القرار والسجلات مخزن على جهاز كمبيوتر شخصي للتقييم حاليا.
- لوضع العلامات الكريات البيض، حقن رودامين6G عن طريق الوريد عن طريق القسطرة الوداجي بتركيزات قدرها 0.4 وزن الجسم ملغم / كغم.
- اختيار الوريد شعيرة وريدية للمراقبة. وينبغي أن حجم السفينة وينبغي أن تتراوح ما بين 20-60 ميكرومتر وتدفق الدم تكون كافية. للتقليل من تأثير التنشيط المسبق للنسيج، قد تكون استخدمت السفن الوحيدة التي المتداول الكريات البيض هو <20 cells/30 ثانية، وعدد الخلايا الملتصقة <10 cells/200μm من البطانة وريدي لمزيد من التحليل.
- إذا كان ذلك ممكنا، ويمكن استخدام ما يصل الى ثلاثة الوريدات شعيرة وريدية للمراقبة، ولكن يجب أن يكون موجودا أنها في الفرع المقابل من النسيج مشمري لتجنب الخلط بين السفن في نقاط زمنية مختلفة.
4. الإسكيمية-ضخه من الإصابات (آي آي آر)
- اسمحوا الأنسجة الاستقرار لمدة 30 دقيقة.
- إجراء تسجيل من 30 ثانية لتأسيس القيم القاعدية للالمتداول الكريات البيض والالتزام. من الناحية المثالية، وتولد في التسجيلات 3 مجموع القاعدية للتحقق من الخليةأرقام والحصول على الانحرافات المعيارية.
- وضع بلطف مقطع السفينة Biemer حوالي نهاية القريبة جدا من النسيج مشمري يتعرض باستخدام ملقط التطبيق. وينبغي أن يحدث ركود على الفور، ويمكن تصور بواسطة المجهر epifluorescence في القسم السفينة المرصودة.
- ويمكن استخدام مجموعة متنوعة من الدورات الوقت اعتمادا على مستوى الضرر المطلوب. نحن نطبق 30 دقيقة من الوقت الإسكيمية كما هو موضح من قبل مؤلفين آخرين. 21-23 إزالة المشبك السفينة بعد ذلك. تسمح مجرى الدم لتحقيق الاستقرار لمدة 15 دقيقة.
- ويمكن إجراء تسجيلات لاحقة لمدة 30 ثانية خلال فترة ضخه (على سبيل المثال 30 ثانية كل 15 دقيقة). حفظ التسجيلات رقميا لتحليلها حاليا.
- لإنهاء هذه التجربة، والموت الرحيم والفئران من قبل التفكك عنق الرحم تحت التخدير كافية عن طريق الضغط على أداة حادة مثل حافة ممل من شفرة المقص في قاعدة الجمجمة. مع الآخريد، يتم سحبها بسرعة من قاعدة الذيل، مما تسبب في فصل من الفقرة العنقية من الجمجمة.
5. حاليا تحليل تشغيل الفيديو
- لتحليل تشغيل الفيديو حاليا فإنه من المفيد لاستخدام البرمجيات التي تسمح للاختيار من الصور المميزة ومراقبة تسلسل الفيديو في حركة بطيئة. ضبط التباين والسطوع بشكل مناسب. نستخدم البرامج المقدمة من قبل الشركة المصنعة للمجهر الذي يسمح قياسات الطول والتكبير الرقمي.
- لتقدير حجم المتداول الكريات البيض، وتحديد خط الظاهري الذي يتقاطع عموديا السفينة التي تنسجم في كافة السجلات. حساب عدد الكريات البيض المتداول أن تجتاز خط في غضون 30 ثانية يدويا.
- لتقدير حجم الكريات البيض تمسكا، وتحديد وعاء 200 ميكرون المقطع الذي يتسق في جميع السجلات 23 حساب عدد الكريات البيض واضحة للعيان أن تبقى ثابتة خلال 30 ثانية - وبالتالي definإد تمسكا كما (24).
6. ممثل النتائج
المعهد الجمهوري الدولي من العضلات المشمرة له أي تأثير على الضغط الشرياني المتوسط (MAP)، معدل ضربات القلب ودرجة الحموضة في الدم
باستخدام الإعداد المذكورة آنفا (الشكل 1)، نحن نحقق في دوران الأوعية الدقيقة في المعهد الجمهوري الدولي عبر بروتوكول ساعتين، ومع ذلك وقتا أطول بكثير مراقبة ما يصل الى 6 ساعات ممكن. كما هو مبين في الشكل 2، المعهد الجمهوري الدولي من العضلات المشمرة ليس له آثار كبيرة على التداول macrohemodynamic الفئران كما يعني الضغط الشرياني ومعدل نبضات القلب مستقرة طوال فترة التحقيق. وعلاوة على ذلك نحن مراقبة التوازن بواسطة القياسات المتكررة لشرياني درجة الحموضة في الدم التي تراوحت في حدود الفسيولوجية وأظهرت أنه ليس كبيرا بين مجموعة الاختلافات.
المعهد الجمهوري الدولي يدفع المتداول الكريات البيض في تداول مشمري
تفاعل الكريات البيض البطانية هو مفتاححدث في التهاب حاد. عن طريق الفحص المجهري intravital جدنا الزيادة المعتمدة على الزمن في عدد الكريات البيض المتداول في المعهد الجمهوري الدولي من العضلات المشمرة (الشكل 3A) متطابقة إلى البيانات السابقة 21 و 25. المتداول التي شنت على مدى الوقت اثنين من مراقبة ساعات كحد أقصى 137،63 ± 22،55٪ من قيمة خط الأساس بعد 120 دقيقة من وقت ضخه وصلت بعد ذلك دلالة إحصائية مقارنة مع الحيوانات الشام التي تعمل (137.63 ± 22.55 مقابل 99.43 ± 14.04٪ من قيمة خط الأساس).
المعهد الجمهوري الدولي يدفع التصاق الكريات البيض في تداول مشمري
لمزيد من التقييم من الكريات البيض البطاني تفاعل حللنا التصاق الكريات البيض في قسم ميكرومتر السفينة 200. حث المعهد الجمهوري الدولي زيادة في عدد الكريات البيض من ملتصقة التي تجاوزت بشكل كبير قيم صورية تعمل الحيوانات بعد 60 دقيقة (118.33 ± 6.83 مقابل 96.27 ± 5.78٪ من قيمة خط الأساس)، وكذلك ASCEnded من 120 دقيقة من ضخه (الشكل 3B).
في الملخص الذي وصفها في نموذج الجسم الحي تمد له ما يبرره بيانات متسقة من تنشيط الكريات البيض الحاد في البقاء على قيد الحياة، بينما الحيوان IRI والاستقرار تداول.
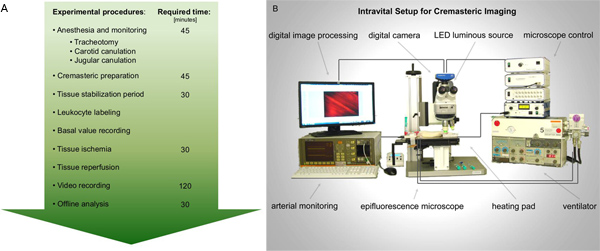
الشكل 1. أ. الرسم البياني لأداء intravital المجهري epifluorescence في الإسكيمية-ضخه إصابة الفئران العضلات المشمرة وبعد التحضيرات اللازمة للتخدير والرصد، ويتعرض العضلات المشمرة الفئران للتصوير. تؤخذ السجلات تفعيل الكريات البيض قبل وبعد الإسكيمية الأنسجة. يتم إجراء تحليل أفضل لاحقة الفيديو حاليا. B. الشكل التخطيطي في الإعداد intravital المقترحة. انقر هنا لعرض أكبر شخصية .
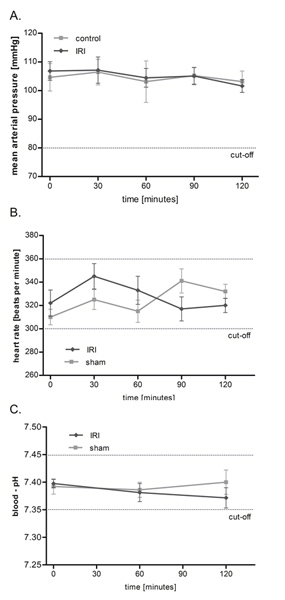
الشكل 2. المعهد الجمهوري الدولي من العضلات المشمرة له أي تأثير على الضغط الشرياني المتوسط (MAP)، معدل ضربات القلب ودرجة الحموضة في الدم. متوسط الضغط الشرياني (A) ومعدل ضربات القلب (B) تم رصد كل 30 دقيقة في كافة مراحل التجربة عن طريق تحويل طاقة الضغط بعد canulation للحق الشريان السباتي. تم إجراء قياس درجة الحموضة في الدم الشرياني (C) بعد 60، 0، و 120 دقيقة. القيم يعني ± SEM من 6 الفئران مختلفة وعلى مستويات تراوحت الفسيولوجية دون كبير الخلافات بين الجماعات. انقر هنا لعرض أكبر شخصية .
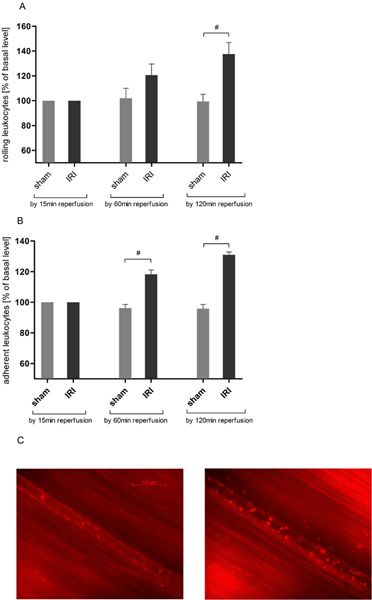
الشكل 3. المعهد الجمهوري الدولي يزيد من الكريات البيضالبطاني التفاعل في تداول المشمرة، وبعد وصفها من الكريات البيض مع 6G رودامين (0.4 وزن الجسم ملغ / كلغ) كان يستخدم المجهر epifluorescence intravital لتحديد الكريات البيض البطاني التفاعل في الاصابة ضخه عبر بروتوكول 120 دقيقة بعد 30 دقيقة من نقص تروية الأنسجة. واتخذت السجلات في التكبير من حوالي × 800 ألف. المعهد الجمهوري الدولي زيادة كبيرة في عدد الكريات البيض المتداول في الأوردة شعيرة وريدية من العضلة المشمرة من 120 دقيقة من ضخه في حين المتداول الكريات البيض لا تزال مستقرة في كافة مراحل التجربة في نسيج العضلة المشمرة التي لم تكن تخضع لنقص التروية. القيم يعني ± SEM من 6 جرذان المرصودة. # P <0.05 باستخدام اختبار T مزاوج. B. يتم زيادة كبيرة في عدد الكريات البيض ملتصقة في اختيارها عشوائيا 200μm قسم سفينة شعيرة وريدية بعد 30 دقيقة من نقص تروية العضلة المشمرة واللاحقة 60 دقيقة من ضخه الأنسجة. الحصول على النتائج حتى مواعادة ضوحا بعد فترة سنتين ضخه ساعات. القيم يعني ± SEM من 6 جرذان المرصودة. # P <0.05 باستخدام اختبار T مزاوج. صور الممثل جيم من الوريد شعيرة وريدية قبل الإسكيمية (يسار) وبعد 120 دقيقة المعهد الجمهوري الدولي (يمين). انقر هنا لعرض أكبر شخصية .
Discussion
الكريات البيض البطاني تفاعل وإنتاج أنواع الاكسجين التفاعلية وتفعيل نظام المتممة هي الملامح الرئيسية لضعف الأنسجة IRI التي يسببها. يعتبر دوران الأوعية الدقيقة (26) من الأنسجة المتضررة، في موقع لا يتجزأ عن ظهور التهابات. وبصرف النظر عن التجارب المجراة سابقا م...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وأيد هذا العمل من خلال منحة من "جمعية الألمانية للبحوث" لأيزينهارت SU (EI 866/1-1).
Materials
| Name | Company | Catalog Number | Comments |
| اسم المعدات: | شركة: | كتالوج رقم: | تعليق: |
| Forene 100٪ (V / V) | رئيس الدير | B506 | API isoflurane |
| تيريليني خياطة | سراج Weissner | OC108000 | |
| التجويف Portex الجميلة البوليثين الأنابيب | الحدادون الطبية | 800/100/100 | 0.28 القطر الداخلي مم |
| محلول ملحي 0،9٪ | Fresinus كابي | 808771 | |
| تغيير واحد في قمة مجموعة فاخرة مكواة | Bovie الطبية | DEL1 | |
| Abbocath-T 14G | Venisystems | G713- A01 | استخدام أنبوب عدسة |
| 900C مضاعفات جهاز التهوية | ماكيه | تستخدم ventialtor الحيوان | |
| منطقي الضغط محول | الحدادون الطبية | MX1960 | |
| Sirecust 404 مراقب | شركة سيمنز | ||
| ABL 700 الفوق محلل | الاشعاع | لقياس غازات الدم | |
| التدفئة وسادة | Effenberger | 8319 | |
| الألومنيوم مرحلة | Alfun | AW7022 | |
| مجهر جراحي OPMI 6 SDFC | كارل زايس | ||
| المجهرية صكوك مختبر قوآخرون | S & T | 767 | |
| Biemer سفينة كليب | دينر | 64،562 | |
| تطبيق ملقط | دينر | 64،568 | مقطع لسفينة Biemer |
| رودامين 6G | سيغما الدريخ | R4127 | |
| فازلين أبيض DAB | ونثروب | 2726853 | |
| تغطية نظارات | 32x32 ملم | ||
| Intravital الإعداد | |||
| زايس محوري نطاق A-1 MAT | كارل زايس | 490036 | epifluorescence المجهر |
| الصمام 470 نانومتر | كارل زايس | 423052 | مصدر ضوء مضان |
| COLIBRI 2 نظام | كارل زايس | 423052 | |
| W-خطة لامزيغ 20X / 1،0 مدينة دبي للإنترنت | كارل زايس | 421452 | مياه الغمر هدف |
| AxioCam MRM التنقيح 3، فاير واير | كارل زايس | 426509 | كاميرا رقمية عالية القرار |
| محوري رؤية جنيه البرمجيات | كارل زايس | 410130 | استخدامها لتحليل حاليا |
References
- Cetin, C. Protective effect of fucoidin (a neutrophil rolling inhibitor) on ischemia reperfusion injury: experimental study in rat epigastric island flaps. Ann. Plast. Surg. 47, 540-546 (2001).
- Granger, D. N. Role of xanthine oxidase and granulocytes in ischemia-reperfusion injury. Am. J. Physiol. 255, H1269-H1275 (1988).
- Lazarus, B. The role of mast cells in ischaemia-reperfusion injury in murine skeletal muscle. J Pathol. 191, 443-448 (2000).
- van den Heuvel, M. G. Review: Ischaemia-reperfusion injury in flap surgery. J. Plast. Reconstr. Aesthet. Surg. 62, 721-726 (2009).
- Rosen, S. D. Cell surface lectins in the immune system. Semin. Immunol. 5, 237-247 (1993).
- van der Flier, A., Sonnenberg, A. Function and interactions of integrins. Cell Tissue Res. 305, 285-298 (2001).
- Panes, J., Perry, M., Granger, D. N. Leukocyte-endothelial cell adhesion: avenues for therapeutic intervention. Br. J. Pharmacol. 126, 537-550 (1999).
- Gavins, F. N., Chatterjee, B. E. Intravital microscopy for the study of mouse microcirculation in anti-inflammatory drug research: focus on the mesentery and cremaster preparations. J. Pharmacol. Toxicol. Methods. 49, 1-14 (2004).
- Sutton, T. A. Injury of the renal microvascular endothelium alters barrier function after ischemia. Am. J. Physiol. Renal. Physiol. 285, 191-198 (2003).
- Serracino-Inglott, F. Differential nitric oxide synthase expression during hepatic ischemia-reperfusion. Am. J. Surg. 185, 589-595 (2003).
- Eppinger, M. J. Mediators of ischemia-reperfusion injury of rat lung. Am J Pathol. 150, 1773-1784 (1997).
- Dumont, E. A. Real-time imaging of apoptotic cell-membrane changes at the single-cell level in the beating murine heart. Nat Med. 7, 1352-1355 (2001).
- Baez, S. An open cremaster muscle preparation for the study of blood vessels by in vivo microscopy. Microvasc Res. 5, 384-394 (1973).
- Woeste, G. Octreotide attenuates impaired microcirculation in postischemic pancreatitis when administered before induction of ischemia. Transplantation. 86, 961-967 (2008).
- Schultz, J. E., Hsu, A. K., Gross, G. J. Morphine mimics the cardioprotective effect of ischemic preconditioning via a glibenclamide-sensitive mechanism in the rat heart. Circ. Res. 78, 1100-1104 (1996).
- Dobschuetz, E. v. o. n. Dynamic intravital fluorescence microscopy--a novel method for the assessment of microvascular permeability in acute pancreatitis. Microvasc Res. 67, 55-63 (2004).
- Vutskits, L. Adverse effects of methylene blue on the central nervous system. Anesthesiology. 108, 684-692 (2008).
- Takasu, A. Improved survival time with combined early blood transfusion and fluid administration in uncontrolled hemorrhagic shock in rats. J. Trauma. 8, 312-316 (2010).
- Proctor, K. G., Busija, D. W. Relationships among arteriolar, regional, and whole organ blood flow in cremaster muscle. Am. J. Physiol. 249, 34-41 (1985).
- Bagher, P., Segal, S. S. The Mouse Cremaster Muscle Preparation for Intravital Imaging of the Microcirculation. J. Vis. Exp. (52), e2874 (2011).
- Kanwar, S., Hickey, M. J., Kubes, P. Postischemic inflammation: a role for mast cells in intestine but not in skeletal muscle. Am. J. Physiol. 275, 212-218 (1998).
- Leoni, G. Inflamed phenotype of the mesenteric microcirculation of melanocortin type 3 receptor-null mice after ischemia-reperfusion. FASEB J. 22, 4228-4238 (2008).
- Simoncini, T. Interaction of oestrogen receptor with the regulatory subunit of phosphatidylinositol-3-OH kinase. Nature. 407, 538-541 (2000).
- Woollard, K. J. Pathophysiological levels of soluble P-selectin mediate adhesion of leukocytes to the endothelium through Mac-1 activation. Circ. Res. 103, 1128-1138 (2008).
- Mori, N. Ischemia-reperfusion induced microvascular responses in LDL-receptor -/- mice. Am. J. Physiol. 276, H1647-H1654 (1999).
- Eisenhardt, S. U. Monitoring Molecular Changes Induced by Ischemia/Reperfusion in Human Free Muscle Flap Tissue Samples. Ann. Plast. Surg. , (2011).
- Eisenhardt, S. U. Generation of activation-specific human anti-{alpha}M{beta}2 single-chain antibodies as potential diagnostic tools and therapeutic agents. Blood. 109, 3521-3528 (2007).
- Eisenhardt, S. U. Dissociation of pentameric to monomeric C-reactive protein on activated platelets localizes inflammation to atherosclerotic plaques. Circ Res. 105, 128-137 (2009).
- Eisenhardt, S. U. C-reactive protein: how conformational changes influence inflammatory properties. Cell Cycle. 8, 3885-3892 (2009).
- Granger, D. N. . Physiology and pathophysiology of leukocyte adhesion. , 520 (1995).
- Baatz, H. Kinetics of white blood cell staining by intravascular administration of rhodamine 6G. Int. J. Microcirc. Clin. Exp. 15, 85-91 (1995).
- Mempel, T. R. In vivo imaging of leukocyte trafficking in blood vessels and tissues. Curr. Opin. Immunol. 16, 406-417 (2004).
- Abbitt, K. B., Rainger, G. E., Nash, G. B. Effects of fluorescent dyes on selectin and integrin-mediated stages of adhesion and migration of flowing leukocytes. J. Immunol. Methods. 239, 109-119 (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved