Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Sıçan Cremaster'ın kas iskemi-reperfüzyon Hasarı içinde Lökosit-endotelyal Etkileşim Gerçek zamanlı Dijital Görüntüleme (IRI)
Bu Makalede
Özet
Kremasterik mikrosirkülasyonda postkapiller venüllerde Dijital intravital Epifloresans mikroskopi lökosit-endotel etkileşimi içgörü kazanmak için uygun bir yöntemdir In vivo Çizgili kas dokusunda iskemi-reperfüzyon (IRI) içinde. Biz burada güvenle tekniği gerçekleştirmek ve uygulamaları ve sınırlamaları tartışmak için ayrıntılı bir protokol sağlar.
Özet
Tersinmez önlenmesi için gerekli süre işemi-reperfüzyon yaralanması (IRI), serebral inme, miyokard enfarktüsü, bağırsak iskemi yanı sıra, daha önce iskemik doku transplantasyonu ve kardiyovasküler cerrahi. 1 Reperfüzyon aşağıdaki gibi patolojik durumların büyük bir dizi rolü de ortaya konmuştur doku hasarı, etkilenen doku aşırı enflamasyon ortaya çıkarır. Reaktif oksijen türlerinin, tamamlayıcı sisteminin aktivasyonu üretimine ve mikrovasküler geçirgenliğin artış bitişik, lökositlerin aktivasyonu reperfüzyon esnasında inflamatuar doku hasarının patolojik basamağında prensibi oyuncular biridir. 2, 3 Leukocyte aktivasyonu kapsayan çok aşamalı bir işlemdir , haddeleme firma adezyon ve göçü ve bu tür tamamlayıcı faktörleri, kemokinleri veya trombosit aktive edici faktör olarak chemoattractants yanıt olarak adezyon molekülleri arasındaki karmaşık bir etkileşim aracılık eder. 4 <p class = "jove_content"> postkapiller venlerde lökosit yuvarlanmasını ağırlıklı olarak kendi sayacı ligandlar, endotele lökositlerin sıkı adezyon adezyon molekülleri (ICAM) ve vasküler hücresel bağlama yoluyla selektin-kontrollü ile selektinler 5 etkileşimi aracılık ederken yapışma molekülleri (VCAM). 6, 7
Lökosit-endotel etkileşimi in vivo gözlem için altın standart olarak ilk kez 1968 yılında tanımlanan intravital mikroskopi tekniğidir. 8
IRI (iskemi-reperfüzyon) çeşitli modelleri çeşitli organları için tarif edilmiş olsa da, 9-12 sadece birkaç görüntü kalitesi yüksek bir seviyede mikrovasküler yatakta lökosit göçünün doğrudan görüntülenmesi için uygundur. 8
Biz burada kremasterik mikrosirkülasyonda postkapiller venül sayısal intravital Epifloresans mikroskopi teşvikkalitatif ve kantitatif olarak çizgili kas dokusunda IRI-araştırma için lökosit göçünün analiz ve tekniği gerçekleştirmek için ayrıntılı bir el kitabı sunmak için uygun bir yöntem olarak sıçan 13. Biz daha fazla ortak tuzaklar göstermek ve okuyucu gerçekten takdir sağlamak ve güvenli bir yöntem yapmalıdır yararlı ipuçları sunmaktadır.
Adım protokol tarafından bir adımda biz daha uzun süre için hayvan sıkıca anestezi altında tutmak için yeterli gözetim altında solunum kontrollü anestezi ile başlamak nasıl betimliyor. Daha sonra üstün optik çözünürlük için bir ince düz bir levha olarak kremasterik hazırlık tanımlamak ve iyi laboratuarımızda kurulmuştur IRI lökosit görüntüleme için bir protokol sağlar.
Protokol
1. Anestezi ve İzleme
- Hayvan deneylerinde gerçekleştirmeden önce uygun ulusal ve kurumsal etik yerde olmalıdır. 180 gr - 120 bir vücut ağırlığı ile etik komite uyutmak erkek Sprague Dawley sıçan onayını takiben. Izofluran vaporizer üzeri pleksiglas kutu 3 vol% izofluran ve sıçan içine yerleştirin - 2 sunun.
- En kısa sürede anestezi uygun düzeyde sağlanır sağlanmaz (parmak veya kuyruk tutam tepki eksikliği) sıçan ağırlıklandırılmış ve ventral servikal alanda traş edilir.
- 37 vücut ısısını korumak için bir ısıtma pedi üzerinde dorsal sıçan yerleştirin ° C ve silikon bir maske kullanarak 2 vol% az izofluran geçerlidir.
Aşağıdaki hazırlık adımları iyi bir cerrahi mikroskop kullanılarak gerçekleştirilir.
- Trakeanın hazırlanması için, karotis arter ve juguler ven, bölgede o 2 cm'lik bir yatay cilt kesisi gerçekleştirmekf suprasternal ve yanal tükürük bezleri harekete.
- Artık ventral boyun kasları karşı karşıya. Orta hatta onları dikkatle ayırmak ve trakea bulabilirsiniz. Trakeanın 2 cm ve yukarı yükseltmek böylece onu da altında bir mikro forseps yerlefltirmek - 1 Açığa.
- Şimdi trakeanın ventral tarafı ile yaklaşık yarım kesmedim. , Tüm yol boyunca kesmek için bunu yaparsanız, trakeanın kesik ucuna göğüs geri kayacak ve çalışmak çok zor olabilir dikkatli olun.
- Daha önce, bir hayvan vantilatör bağlı olmuştur trakea, alt kısmı içine tüp olarak kullanılan bir Abbocath tüp (14G) takın. İpucu: Firma mengenelerle sabitlenmekten yanı sıra tüp etrafında trakea dikilmesi yerine trakeal tüp tutmak esastır. Genellikle terylen 5/0 sütür kullanabilirsiniz, ancak benzer bir dikiş materyali kullanılabilir.
- Tidal hacim, 4,5-5 ml;; FiO2 45 soluk / dk - Solunum sonra (frekans, 35 hacim kontrollü olabilir , 0.35 - 0.50;. İsofluranın 1.5 - 2 vol%) 14 Atelektazi H 2 10 mm 5 ekspirasyon sonu basınç pozitif bir muhafaza ile önlenebilir O. 15
- Karotis kanülasyonu için, sağ sternohyoid kas karotis arter bulmak için künt diseksiyon ile ayrılır.
- Karotis arter dikkatlice vagus siniri ayırın ve kan kalpten akan durdurmak için açılı bir mikro forseps üzerinde arter monte edin.
- Karotis arter altında sütür eşit uzunlukta iki adet geçirin. Kalp referans olarak, daha distal sütür proksimal dikiş karotis arter etrafında gevşek bağlıdır ise baş bölgesinde akan kan tıkamak sıkıca bağlıdır.
- Mikro makas kullanarak küçük bir kesim, iki bitişik harfler arasında karotis arter haline getirilir.
- Bir basınç transdüktörüne bağlı normal tuzlu su çözeltisi ile doldurulmuş bir polietilen kateter (0,28 mm iç çapı) takın.
- Remartere kateter daha mikro forseps ve iplik ove. Sonra arter ve kateter etrafından proksimal ligatür sıkın. İpucu: ikinci bir proksimal sütür uygulaması mikro forseps çıkardıktan sonra kanama engeller.
- Karotis etrafında distal ligasyonu ve ek ankraj için kateter bağlayın.
- Izleme kalp hızı ve kan basıncı tarafından sürekli anestezi izleyin. Kan gazı analizörü kullanılarak aralıklı arteriyel kan gazı analizi yapın. 16 A kalp hızı 300 bpm veya aşan 360 bpm daha düşük hem de uzun 5 dakika süreyle 80 mmHg altına düşmesi, ortalama arter basıncı dışlama kriterleri vardır. 17, 18 kan koruyun fizyolojik sınırlar içinde pH (7,35-7,45). Deney nedeniyle anormal izleme oranlarına feshedilmiş olan durumda, boyun çıkığı ya exanguation tarafından hayvan derisini soymak.
Flüoresan boyalar ya da başka ilaçlar o intravenöz uygulama içinf faiz, aşağıdakileri gerçekleştirin:
- Cerrahi mikroskop ile juguler ven alanında odaklanın.
- Her el forseps ile juguler ven ortaya çıkarmak için ince fasya gözyaşı. Açılı bir mikro forseps üzerine ven monte edin. Kan akışı sonra duracaktır.
- Forseps kullanarak dikiş eşit uzunlukta iki adet karotis kanülasyonu için uyumlu juguler ven altında geçirilir. Sıkı distal sütür ve juguler ven çevresinde gevşek proksimal sütür bağlayın.
- Juguler ven içine küçük bir kesim yapın ve tuzlu su ile yıkanmalıdır edilmiş bir polietilen kateter (0.28 mm iç çap) yerleştirin. Insizyon ve kanülasyon karotis göre daha zahmetli ve zaman alıcı olabilir işaretleyin.
- Kalp doğru kateter geçirin ve ven ve kateter etrafından kalbe yakın bağ sıkın.
- Uygun açıklığı sonra, kateter etrafında distal bağ bağla. İpucu: bo Ek fiksasyonubant ile inci kateterler dislodgment önleyebilir.
- Intraluminal pıhtılaşmayı önlemek için sık sık kateterler durulayın.
2. Cremaster'ın Muscle hazırlanması
- Kremasterik görüntüleme için 2 cm kalınlığında - Biz 1.5 bir alüminyum sahne kullanın. Aşamasında hızla böylece kremasterik doku termal kontrol hafifletilmesi ısıtma pedi istenen sıcaklık benimser. Bu inflamasyon çalışmaları için çok önemlidir. Kremasterik sıcaklığında düzenlenmesi daha güç olsa da alternatif olarak bir Pleksiglas platformu kullanılabilir. Aşamasının merkezinde skrotumda yerleştirin.
- Başlangıç kesi ince makasla subdermal alanı ihtiyatlı genişlemesi takiben çok uzak ucu içinde skrotumun yukarıda cilt ve dış spermatik pano içinde yapılır. Aletleri ile temel doku dokunmaktan kaçının.
- En kısa sürede doku maruz olarak önceden ısıtılmış ile nemlendirilir (37 ° C) fosfat salin wi tamponluth kalsiyum ve magnezyum. Açıkta doku düzenli çözümü uygulayın.
- Dış spermatik fasya ve Cremaster'ın kas arasındaki bağ dokusu özenle çevreleyen dokudan Cremaster'ın kas boşaltmak için kaldırılır.
- Cremaster'ın kas dış yüzeyi daha sonra temkinli bir bağ dokusu silinmiş olabilir. Sürekli superfusion diseksiyonu hidratlar sırasında bağ dokusu, görünürlük ve çıkarmasını kolaylaştıracak.
- Basılı tutun Cremaster'ın çuval distal ucu dikerek ve biraz çuval sonuna uzatmak.
- Ventral yüzüne çuval distal ucu kesilirken ve mikro makas kullanırken proksimalde kesi uzatıyoruz. Dikkatli bir termal koter kullanılarak kesi hatları boyunca kanayan damarların dağlamak. Ek inflamatuar uyaranlara sınırlamak için gereksiz koterizasyon kaçının. İpucu:. Hazırlık çevresine yakın Kan akış dinamikleri Bu doku hasarı değişmiş Bu nedenle 19, en aza indirmek içinse veri toplama etkiler, hazırlık merkezine yakın kan damarlarının görüntülenmesi için kullanılmalıdır.
- Açık Cremaster'ın gerçi hala testisin altında epididim ince bir bağ ile bağlanmış alüminyum kaide üzerinde düz yatıyor. Bir tarafa testisi yansıtan epididim bağlanmak küçük bir arter ve ven gibi bu bağın ortaya koyar. Gemiler mühür ve testis ve kremasterik doku arasındaki bağ bağ kesmek için mikro makas istihdam koter kullanın.
- Yavaşça kasık kanalı içine izole testis geri itin. Diğer yazarlar ilişkili inguinal fad ped ile birlikte proksimal ligasyonu (orşiektomi) sonra testis rezeke. Hepimiz ek cerrahi uyaranlara kaçınıyorum IRI bağlı lökosit aktivasyonu gibi hassas bir modelde 20, bu yüzden genellikle değildir testis, rezeksiyon imtina Cremaster'ın kasının yeterli maruz almak gerekir.
- İlk ek olarakfiksasyon sütür dört doku kenarları (her tarafta iki adet) ve dikkatli bir alüminyum sahnede radyal kremasterik doku yaymak için kurdeleler konuları ekleyin. Alüminyum sahne ve inguinal kanalın dış girişinde arasında bir boşluk bırakarak iskemi için sonraki kremasterik kırpma kolaylaştırır.
- Yeri polietilen kateter iki ucu (0.28 mm iç çap) superfusion kurulumu için kremasterik doku yakın. Lümen nihai sıvı odasında hava kabarcıklarını önlemek için serbest bir hava olduğundan emin olun.
- Bir şırınga kullanılarak Cremaster'ın adele çevresinde vazelin (vazelin) bir çizgi çizin. Hattı kapsama için kullanılır kapak kayma genişletilmesi gerekir.
- Bir sıvı odası oluşturmak için, kremasterik doku üzerinde kare bir kapak kayma (32 × 32 mm) yerleştirin ve sıkıca Vazelin hattına kenarları takın.
- Durumda kremasterik doku belirli bir ilaç, çevredeki grip sürekli değiştirilmesi ile superfused değildirid gereksiz olduğunu. Fosfat tek bir uygulama, kalsiyum ve magnezyum hazırlandı bölmeye sahip tamponlu tuz çözeltisi ardından yeterli olabilir. Ilaçlar ile uyarılması Ancak lokal saat başına 3 ml 'lik bir oranda mikro-perfüzyon pompa vasıtasıyla sürekli yapılmalıdır.
- Kremasterik doku şimdi mikroskopik görüntüleme için hazırdır.
3. Intravital Kurulum
Temel intravital kurulum değişebilir. Epifloresans görüntüleme için deneyler karanlık bir odada yürütülmelidir.
- Hayvan epi-aydınlatma için ışık kaynağı LED 470 nm ile donatılmış bir intravital Epifloresans mikroskop aşamasında aktarılır. Yaklaşık 800 × büyütme elde etmek için suya daldırma objektif (20 × / 1.0) kullanın. Yüksek çözünürlüklü bir dijital kamera ve çevrimdışı değerlendirme için bir kişisel bilgisayarda saklama kayıtlarının yardımıyla Kayıt gözlemler.
- Lökosit etiketleme için, rodamin enjekteIntravenöz olarak 0.4 mg / kg vücut ağırlığı arasında konsantrasyonlarda jugular kateter ile 6G.
- Gözlem için bir postkapiller venül seçin. Damar çapı 20-60 mikron ve kan akımı arasında olmalıdır yeterli olmalıdır. Doku pre-aktive etkisini en aza indirmek için, lökosit haddeleme <20 cells/30 saniye ve yapışık hücrelerin sayısı
- Mümkünse kadar ila üç postkapiller venlerde gözlenmesi için kullanılabilir, ancak bunlar farklı zaman noktalarında damarlarının kafa önlemek için kremasterik doku karşılık gelen bir bölümünde yer almalıdır.
4. İskemi-reperfüzyon Hasarı (IIR)
- Doku 30 dakika için stabilize edelim.
- Lökosit yuvarlanmasını ve uyulması için bazal değerleri kurmak için 30 saniyelik bir kayıt yapın. İdeal olarak, hücre doğrulamak için toplam üç bazal kayıtlarında oluşturmaknumaraları ve standart sapma elde etmek için.
- Yavaşça uygulama forseps kullanılarak açığa kremasterik doku çok proksimal ucu etrafında bir Biemer damar klibin yerleştirin. Durağanlık hemen gerçekleşmesi gereken ve gözlenen damar bölümünde Epifloresans mikroskopi ile görülebilmesi.
- Zaman içerisinde çeşitli hasarı gerekli seviyede bağlı olarak kullanılabilir. Diğer yazarlar tarafından detaylı olarak açıklanmış olan iskemi süresinin 30 dakika uygulayın. 21-23 sonrasında damar kıskacı çıkarın. Kan akışı bir 15 dakika stabilize olmasını bekleyin.
- 30 saniye süresi daha sonraki kayıt reperfüzyon (örneğin 30 saniye her 15 dakika) boyunca yapılabilir. Çevrimdışı analiz için dijital olarak saklayın.
- Deney sona ermesi için, sıçan gibi kafatası tabanında bir makas bıçak donuk kenarı gibi künt bir enstrüman basarak yeterli anestezi altında servikal dislokasyon ile ötenazi edilir. Diğer ileÖte yandan, kuyruk tabanı hızlı kafatası servikal omur ayrılmasına neden çekilir.
5.. Çevrimdışı Video Oynatma Analizi
- Isimli video oynatma analiz için ayrı resim ve yavaş hareket video sırasının gözlem seçimi sağlayan yazılım kullanmak yararlıdır. Uygun kontrast ve parlaklığını ayarlayın. Biz uzunluk ölçümleri ve dijital büyütme sağlayan mikroskop üreticisi tarafından sağlanan yazılımı kullanın.
- Lökosit yuvarlanmasını miktarının tayini için, tüm kayıtları tutarlı olduğundan dikey gemi kesişen bir sanal hattı tanımlayabilirsiniz. Elle 30 saniye içinde sınırını geçmesi haddeleme lökosit sayısını.
- Yapışık lökositlerin ölçülmesi için, tüm kayıtları tutarlı bir 200 mikron geminin tanımlayın 23 30 saniye boyunca sabit kalmasını açıkça görünür lökosit say -. Böylece defined olarak yapışık. 24
6. Temsilcisi Sonuçlar
Cremaster'ın kas IRI ortalama arter basıncı (OAB), kalp hızı ve kan pH üzerinde etkisi yoktur
Söz konusu kurulum (Şekil 1) kullanarak, bir iki saat protokolü üzerinden IRI yılında mikrosirkülasyonu araştırıldı, ancak 6 saate kadar çok daha uzun bir gözlem zaman mümkündür. Şekil 2 de gösterildiği gibi ortalama kan basıncı ve kalp atım hızı soruşturma süresi boyunca stabil olarak, Cremaster'ın kas IRI sıçan sirkülasyon üzerinde anlamlı bir etkisi vardır macrohemodynamic. Ayrıca biz fizyolojik sınırlar içinde idi o kan pH arteriyel sık ölçümleri ile homeostaz izlenmekte ve anlamlı gruplar arası farklılıklar gösterdi.
IRI kremasterik dolaşımdaki lökosit yuvarlanmasını indükler
Lökosit endotel etkileşimi bir anahtardırakut inflamasyon olay. Intravital mikroskopi sayesinde biz Cremaster'ın kas IRI (Şekil 3A) önceki verileri 21, 25 ile uyumlu olarak haddeleme lökosit sayısında bir zaman bağımlı bir artış bulundu. Rolling 137,63 maksimum ± reperfüzyon süresi 120 dakika sonra bazal değerin% 22.55 ile iki saat gözlem zaman içinde monte edilmiş ve daha sonra (137,63 ± 22,55 vs 99,43 ± bazal değerin% 14,04) sham operasyonu hayvanlara kıyasla istatistiksel anlamlılığa ulaşmıştır.
IRI kremasterik dolaşımdaki lökosit adezyon indükler
Lökosit-endotel etkileşimi daha fazla değerlendirme için biz bir 200 mikron gemi bölümünde lökosit adezyon analiz. IRI 60 dakika sonra hayvanlar ameliyat anlamlı sahte değerleri aşıldığında yapışık lökosit sayısında bir artışa neden olduğunu (118,33 ± 6,83 vs 96,27 ± bazal değerin% 5.78) ve daha ASCEreperfüzyon 120 dakika (Şekil 3B) tarafından nded.
Özetle vivo modelde açıklanan IRI ederken hayvanın hayatta kalma ve dolaşım istikrar akut lökosit aktivasyonu tutarlı veri garantilidir sağlar.
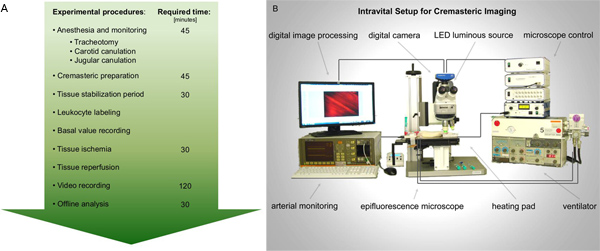
Şekil 1.. Sıçan Cremaster'ın kas iskemi-reperfüzyon hasarında intravital Epifloresans mikroskopi performans için A. akış çizelgesi. Anestezi ve izlenmesi için gerekli hazırlıklar tamamlandıktan sonra, sıçan Cremaster'ın kas görüntüleme için maruz kalmaktadır. Lökosit aktivasyonunun kayıtların doku iskemisi öncesi ve sonrası alınmıştır. Daha sonraki video analizi en iyi offline yapılır. B. Önerilen intravital kurulum şematik figür. büyük rakamı görmek için buraya tıklayın .
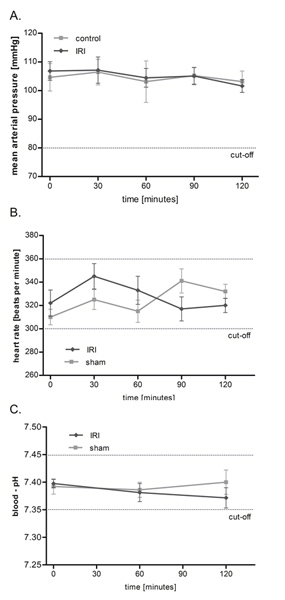
Şekil 2. Cremaster'ın kas IRI ortalama arter basıncı (OAB), kalp hızı ve kan pH üzerinde etkisi yoktur. Arter basıncı (A) ve kalp atım hızı (B) ortalama sağ kanülasyon sonra basınç dönüştürücü ile deney boyunca her 30 dakika takip edildi karotis arter. Kan-Ph (C) ölçülmesi 0, 60 sonra gerçekleştirilir ve 120 dakika oldu. Değerler ortalama ± 6 farklı sıçanların SEM ve gruplar arası anlamlı bir fark olmayan fizyolojik düzeyde idi. büyük rakam görmek için buraya tıklayın .
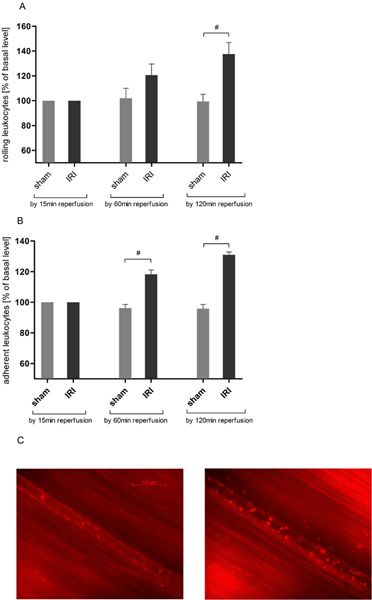
Şekil 3. IRI lökosit artarKremasterik dolaşımda-endotel etkileşimi. Intravital Epifloresans mikroskopi doku iskemisi 30 dakika sonra 120 dakika protokolü üzerinden reperfüzyonda lökosit-endotel etkileşimi belirlemek için kullanılmıştır rodamin 6G (0.4 mg / kg vücut ağırlığı) ile lökositlerin etiketleme sonra. Kayıtları yaklaşık büyütme × 800 alınmıştır. Lökosit yuvarlanmasını iskemi uğramadı kremasterik dokuda deney boyunca sabit kalır, oysa A. IRI önemli reperfüzyon 120 dakika Cremaster'ın kas postkapiller venlerde haddeleme lökosit sayısını artırır. Değerler ortalama ± standart 6 gözlenen sıçan SEM. # P <0.05 eşleştirilmemiş t testi kullanılarak. B. yapışık lökosit sayısında önemli ölçüde kremasterik iskemi 30 dakika ve doku reperfüzyon sonraki 60 dakika sonra rasgele seçilen 200μm postkapiller damar bölümünde artar. Sonuçlar hatta mo olsunBir iki saat reperfüzyon döneminden sonra telaffuz ediyorsun. Değerler ortalama ± standart 6 gözlenen sıçan SEM. # P <0.05 postkapiller venül C. Temsilcisi resimleri önceden iskemi (sol). Eşleştirilmemiş t testi kullanılarak ve IRI (sağda) sonra 120 dakika. büyük rakam görmek için buraya tıklayın .
Tartışmalar
Lökosit-endotel etkileşimi, reaktif oksijen türlerinin üretimi ve kompleman sisteminin aktivasyonu IRI bağlı doku disfonksiyonunun temel özellikleridir. Etkilenen doku 26 mikrosirkülasyon inflamatuar başlangıcı için ayrılmaz yeri olarak kabul edilir. Dışında bu akış odası deneyleri 27, 28, ex vivo deneyler daha da in vivo alaka içinde değerlendirmek intravital görüntüleme köklü modelleri sağlamak zorunludur. IRI çeşitli organ sistemlerine suç...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu çalışma SU Eisenhardt için "Deutsche Forschungsgemeinschaft" (EI 866/1-1) bir hibe ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Ekipman Adı: | Şirket: | Katalog No: | Yorumlar: |
| Forene% 100 (V / V) | Başrahip | B506 | API izofluran |
| Terylen Sütür | Serag Weissner | OC108000 | |
| Portex Güzel Polietilen Boru Bore | Tıp Smiths | 800/100/100 | 0.28 mm iç çapı |
| % 0,9 tuz çözeltisi | Fresinus Kabi | 808771 | |
| Değişim-A-ucu deluxe koter kiti | Bovie Tıp | DEL1 | |
| Abbocath-T 14G | Venisystems | G713- A01 | objektif tüpü olarak kullanılan |
| Servo Vantilatör 900C | Maquet | hayvan ventialtor olarak kullanılan | |
| Mantıksal basınç dönüştürücü | Tıp Smiths | MX1960 | |
| Sirecust 404 Monitör | Siemens | ||
| ABL 700 Masaüstü Analyzer | Radyometre | kan gazı ölçümü için | |
| Isıtma pedi | Effenberger | 8319 | |
| Alüminyum sahne | Alfun | AW7022 | |
| Cerrahi mikroskop OPMI 6-SDFC | Carl Zeiss | ||
| Mikro cerrahi aletlerin laboratuvar set | S & T | 767 | |
| Biemer damar klip | Diener | 64.562 | |
| Forseps uygulanması | Diener | 64.568 | Biemer damar klip için |
| Rodamin 6G | Sigma-Aldrich | R4127 | |
| Vazelin beyaz DAB | Winthrop | 2726853 | |
| Gözlük Kapak | 32x32 mm | ||
| Intravital kurulum | |||
| Zeiss Axio Kapsam A-1 MAT | Carl Zeiss | 490036 | Epifloresans mikroskop |
| 470 nm LED | Carl Zeiss | 423052 | floresan ışık kaynağı |
| Colibri 2 Sistem | Carl Zeiss | 423052 | |
| B Planı-Apochromat 20x / 1,0 DIC | Carl Zeiss | 421452 | suya daldırma hedefi |
| AxioCam MRM Rev 3 FireWire | Carl Zeiss | 426509 | yüksek çözünürlüklü dijital kamera |
| Axio vizyon LE yazılımı | Carl Zeiss | 410130 | çevrimdışı analiz için kullanmak |
Referanslar
- Cetin, C. Protective effect of fucoidin (a neutrophil rolling inhibitor) on ischemia reperfusion injury: experimental study in rat epigastric island flaps. Ann. Plast. Surg. 47, 540-546 (2001).
- Granger, D. N. Role of xanthine oxidase and granulocytes in ischemia-reperfusion injury. Am. J. Physiol. 255, H1269-H1275 (1988).
- Lazarus, B. The role of mast cells in ischaemia-reperfusion injury in murine skeletal muscle. J Pathol. 191, 443-448 (2000).
- van den Heuvel, M. G. Review: Ischaemia-reperfusion injury in flap surgery. J. Plast. Reconstr. Aesthet. Surg. 62, 721-726 (2009).
- Rosen, S. D. Cell surface lectins in the immune system. Semin. Immunol. 5, 237-247 (1993).
- van der Flier, A., Sonnenberg, A. Function and interactions of integrins. Cell Tissue Res. 305, 285-298 (2001).
- Panes, J., Perry, M., Granger, D. N. Leukocyte-endothelial cell adhesion: avenues for therapeutic intervention. Br. J. Pharmacol. 126, 537-550 (1999).
- Gavins, F. N., Chatterjee, B. E. Intravital microscopy for the study of mouse microcirculation in anti-inflammatory drug research: focus on the mesentery and cremaster preparations. J. Pharmacol. Toxicol. Methods. 49, 1-14 (2004).
- Sutton, T. A. Injury of the renal microvascular endothelium alters barrier function after ischemia. Am. J. Physiol. Renal. Physiol. 285, 191-198 (2003).
- Serracino-Inglott, F. Differential nitric oxide synthase expression during hepatic ischemia-reperfusion. Am. J. Surg. 185, 589-595 (2003).
- Eppinger, M. J. Mediators of ischemia-reperfusion injury of rat lung. Am J Pathol. 150, 1773-1784 (1997).
- Dumont, E. A. Real-time imaging of apoptotic cell-membrane changes at the single-cell level in the beating murine heart. Nat Med. 7, 1352-1355 (2001).
- Baez, S. An open cremaster muscle preparation for the study of blood vessels by in vivo microscopy. Microvasc Res. 5, 384-394 (1973).
- Woeste, G. Octreotide attenuates impaired microcirculation in postischemic pancreatitis when administered before induction of ischemia. Transplantation. 86, 961-967 (2008).
- Schultz, J. E., Hsu, A. K., Gross, G. J. Morphine mimics the cardioprotective effect of ischemic preconditioning via a glibenclamide-sensitive mechanism in the rat heart. Circ. Res. 78, 1100-1104 (1996).
- Dobschuetz, E. v. o. n. Dynamic intravital fluorescence microscopy--a novel method for the assessment of microvascular permeability in acute pancreatitis. Microvasc Res. 67, 55-63 (2004).
- Vutskits, L. Adverse effects of methylene blue on the central nervous system. Anesthesiology. 108, 684-692 (2008).
- Takasu, A. Improved survival time with combined early blood transfusion and fluid administration in uncontrolled hemorrhagic shock in rats. J. Trauma. 8, 312-316 (2010).
- Proctor, K. G., Busija, D. W. Relationships among arteriolar, regional, and whole organ blood flow in cremaster muscle. Am. J. Physiol. 249, 34-41 (1985).
- Bagher, P., Segal, S. S. The Mouse Cremaster Muscle Preparation for Intravital Imaging of the Microcirculation. J. Vis. Exp. (52), e2874 (2011).
- Kanwar, S., Hickey, M. J., Kubes, P. Postischemic inflammation: a role for mast cells in intestine but not in skeletal muscle. Am. J. Physiol. 275, 212-218 (1998).
- Leoni, G. Inflamed phenotype of the mesenteric microcirculation of melanocortin type 3 receptor-null mice after ischemia-reperfusion. FASEB J. 22, 4228-4238 (2008).
- Simoncini, T. Interaction of oestrogen receptor with the regulatory subunit of phosphatidylinositol-3-OH kinase. Nature. 407, 538-541 (2000).
- Woollard, K. J. Pathophysiological levels of soluble P-selectin mediate adhesion of leukocytes to the endothelium through Mac-1 activation. Circ. Res. 103, 1128-1138 (2008).
- Mori, N. Ischemia-reperfusion induced microvascular responses in LDL-receptor -/- mice. Am. J. Physiol. 276, H1647-H1654 (1999).
- Eisenhardt, S. U. Monitoring Molecular Changes Induced by Ischemia/Reperfusion in Human Free Muscle Flap Tissue Samples. Ann. Plast. Surg. , (2011).
- Eisenhardt, S. U. Generation of activation-specific human anti-{alpha}M{beta}2 single-chain antibodies as potential diagnostic tools and therapeutic agents. Blood. 109, 3521-3528 (2007).
- Eisenhardt, S. U. Dissociation of pentameric to monomeric C-reactive protein on activated platelets localizes inflammation to atherosclerotic plaques. Circ Res. 105, 128-137 (2009).
- Eisenhardt, S. U. C-reactive protein: how conformational changes influence inflammatory properties. Cell Cycle. 8, 3885-3892 (2009).
- Granger, D. N. . Physiology and pathophysiology of leukocyte adhesion. , 520 (1995).
- Baatz, H. Kinetics of white blood cell staining by intravascular administration of rhodamine 6G. Int. J. Microcirc. Clin. Exp. 15, 85-91 (1995).
- Mempel, T. R. In vivo imaging of leukocyte trafficking in blood vessels and tissues. Curr. Opin. Immunol. 16, 406-417 (2004).
- Abbitt, K. B., Rainger, G. E., Nash, G. B. Effects of fluorescent dyes on selectin and integrin-mediated stages of adhesion and migration of flowing leukocytes. J. Immunol. Methods. 239, 109-119 (2000).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır