A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בזמן אמת הדמיה דיגיטלית של אינטראקציה ליקוציט-אנדותל של פגיעה איסכמיה reperfusion (IRI) של השריר Cremaster עכברוש
In This Article
Summary
מיקרוסקופ דיגיטלי intravital epifluorescence של venules postcapillary ב microcirculation cremasteric היא שיטה נוחה להבנה טובה של אינטראקציה ליקוציט-אנדותל In vivo לפציעה איסכמיה reperfusion (IRI) של רקמת שריר מפוספס. אנחנו כאן לספק פרוטוקול מפורט בצורה בטוחה לבצע את טכניקת ולדון היישומים שלה והמגבלות.
Abstract
איסכמיה reperfusion פציעה (IRI) היה מעורב במגוון גדול של מצבים פתולוגיים כגון שבץ מוחי, אוטם שריר הלב, איסכמיה במעי, כמו גם בעקבות reperfusion השתלת ניתוח לב וכלי דם 1. של רקמה איסכמית בעבר, בעוד חיוני למניעת בלתי הפיך רקמת פציעה, מעורר דלקת מופרזת של רקמת המושפעת. סמוך הייצור של מינים החמצן מגיב, הפעלה של מערכת המשלים והגדילה את חדירות כלי הדם, את ההפעלה של leukocytes הוא אחד השחקנים עיקרון מפל פתולוגית של נזק לרקמה הדלקתית במהלך reperfusion. 2, 3 הפעלת ליקוציט הוא תהליך רב שלבי הכולל של גלגול, הדבקה איתן גלגול, והוא מתווך על ידי פעילות גומלין בין מולקולות הדבקה בתגובה chemoattractants כגון גורמים משלימים, כמוקינים, או טסיות דם, הפעלת גורם. 4 <p class = "jove_content"> בעוד מתגלגל ליקוציט ב venules postcapillary מתווכת בעיקר עם ligands מרשם שלהם, הדבקה של חברת leukocytes כדי האנדותל הוא selectin מבוקר באמצעות כבילת מולקולות הדבקה אינטר (ICAM) וכלי דם הסלולר על ידי האינטראקציה של selectins 5 מולקולות הדבקה (VCAM). 6, 7
תקן הזהב עבור בהתבוננות vivo של אינטראקציה ליקוציט-האנדותל היא טכניקה של מיקרוסקופיה intravital, תוארה לראשונה בשנת 1968. 8
אף על פי מודלים שונים של IRI (איסכמיה reperfusion פציעה) תוארו של איברים שונים, 9-12 רק מעטים מתאימים להדמיה ישירה של גיוס ליקוציט במיטה כלי הדם ברמה גבוהה של איכות התמונה. 8
אנחנו כאן לקדם את מיקרוסקופיה דיגיטלית epifluorescence intravital של ורדיד postcapillary ב microcirculation cremastericשל חולדה 13 כשיטה נוחה איכותית וכמותית לנתח גיוס ליקוציט לחקר-IRI ברקמת השריר מפוספס ולספק מדריך מפורט עבור להשיג את הטכניקה. בנוסף, אנו מדגימים ממכשולים נפוצים ולספק עצות שימושיות אשר צריך לאפשר לקורא להעריך באמת, ובטוח לבצע את השיטה.
בשלב ידי פרוטוקול צעד שאנו מתארים כיצד להתחיל עם הרדמה הנשימה מבוקרת תחת פיקוח מספיק כדי לשמור על בעל החיים מורדם היטב במשך תקופות זמן ארוכות יותר. לאחר מכן, אנו מתארים את הכנת cremasteric כסיד שטוח דק של רזולוציה אופטית יוצאת מן הכלל ולספק פרוטוקול הדמיה ליקוציט ב IRI כי כבר נקבעה גם במעבדות שלנו.
Protocol
1. הרדמה וניטור
- אתיקה לאומיים ומוסדיים מתאימים צריך להיות במקום לפני ביצוע ניסויים בבעלי חיים. בעקבות אישור ועדת האתיקה להרדים חולדות ממין זכר ספרג Dawley עם משקל גוף 120-180 גרם. לספק 2-3% בנפח isoflurane לתיבת פרספקס דרך מאדה isoflurane ומניחים בתוך עכברוש.
- ברגע רמה מתאימה של ההרדמה מושגת (חוסר תגובה הבוהן או קמצוץ הזנב) חולדה משוקלל והתגלח על אזור צוואר הרחם הגחון.
- מניחים את עכבר שכיבה הגב על משטח חימום כדי לשמור על טמפרטורת הגוף על 37 מעלות צלזיוס וליישם isoflurane ב כרך 2% באמצעות מסיכת סיליקון.
הצעדים הבאים הם הכנה הטובה ביותר להשיג באמצעות מיקרוסקופ כירורגי.
- להכנת קנה הנשימה, העורק הראשי ואת וריד הצוואר, מבצעים חתך אופקי 2 ס"מ העור באזור OF חריץ suprasternal ולגייס את בלוטות הרוק רוחבית.
- כעת להתמודד עם שרירי הצוואר הגחון. בזהירות להפריד אותם קו האמצע ולמצוא את קנה הנשימה. לחשוף 1 - 2 ס"מ של קנה הנשימה ומקום מלקחיים מיקרו מתחתיה על מנת להעלות את זה.
- עכשיו לחתוך בערך באמצע בצד הגחון של קנה הנשימה. שימו לב לא לחתוך עד הסוף, אם כן, את הקצוות של קנה הנשימה יגלוש לתוך החזה להיות מאוד קשה לעבוד איתו.
- הכנס צינור Abbocath (14 גר) משמש צינור קנה הנשימה לתוך החלק התחתון של קנה הנשימה, אשר בעבר היה מחובר למכונת הנשמה חיה. טיפ: קיבעון המשרד על מהדק מגנט וכן תפירת של קנה הנשימה סביב הצינור הוא חיוני כדי לשמור על צינור קנה הנשימה במקום. בדרך כלל אנו משתמשים הטרילין 5/0 תפר, תפר חומר דומה אך ניתן להשתמש בו.
- הנשימה יכול להיות מבוקר נפח (תדירות, 35 - 45 נשימות לדקה, נפח גאות, 4.5-5 מ"ל; FiO 2 , 0.35-0.50;. Isoflurane 1.5-2% בנפח) 14 Atelectasis ניתן למנוע על ידי שמירה על חיובי סוף הנשיפה הלחץ של 5 עד 10 מ"מ של H 2 א '15
- עבור canulation הראש, השרירים sternohyoid הזכות מופרד על ידי דיסקציה קהה כדי לאתר את העורק הראשי.
- להפריד את העצב התועה בקפידה מתוך עורק הצוואר ו הר העורק על כ מלקחיים מיקרו בזווית לעצור זרימת הדם מהלב.
- עוברים שתי חתיכות באורך שווה של תפר מתחת בעורק הראש. בהתייחסו לב, תפר דיסטלי יותר קשור בחוזקה לחסום זרימת הדם מאזור הראש בעוד תפר הפרוקסימלי קשורה ברפיון סביב עורק הצוואר.
- באמצעות מספריים מיקרו חתך קטן נעשה לתוך עורק הצוואר בין שתי ליגטורות.
- הכנס קטטר פוליאתילן (0.28 מ"מ קוטר פנימי) מלא תמיסת מלח רגיל המחובר מתמר הלחץ.
- ראםאובה את מלקחיים מיקרו נושא קטטר יותר לתוך העורק. ואז להדק את הקשירה סביב הפרוקסימלי בעורק ו קטטר. טיפ: יישום תפר הפרוקסימלי 2 מונע דימום לאחר הסרת מלקחיים מיקרו.
- לקשור את המיתר דיסטלי סביב הראש ואת קטטר לעגינת נוסף.
- מעקב אחר הרדמה ברציפות בשיעור ניטור הלב לחץ הדם. בצע לסירוגין העורקים גז דם ניתוחים באמצעות גז Analyzer דם. 16 קצב הלב נמוך יותר מאשר 300 BPM או עולה על 360 פעימות לדקה, כמו גם לחץ הדם הממוצע יורד מתחת 80 מ"מ כספית עבור יותר מ 5 דקות הם הקריטריונים הדרה. 17, 18 שמור על הדם pH בגבולות פיזיולוגיים (7.35-7.45). במקרה ניסוי צריך להסתיים בשל שיעורי ניטור תקינות, לשרוט את בעל החיים על ידי נקע בצוואר או exanguation.
עבור היישום תוך ורידי של צבעי ניאון או סמים אחרים הועניין f, לבצע את הפעולות הבאות:
- להתמקד באזור של וריד הצוואר השמאלי באמצעות מיקרוסקופ כירורגי.
- עם מלקחיים בכל יד, לקרוע את fascia דקה כדי לחשוף את וריד הצוואר. הר וריד על כ מלקחיים מיקרו בזווית. זרימת הדם לאחר מכן להפסיק.
- באמצעות מלקחיים, שתי חתיכות באורך שווה של תפר מועברים תחת וריד הצוואר תואמים את canulation הראש. לקשור את תפר דיסטלי בחוזקה תפר הפרוקסימלי באופן רופף סביב וריד הצוואר.
- לעשות חתך קטן לווריד הצוואר ולהכניס קטטר פוליאתילן (0.28 מ"מ קוטר פנימי) כי כבר סמוקות עם מי מלח. סמן את החתך ואת canulation יכול להיות תובעני יותר זמן רב יותר מזה של הראש.
- חוט קטטר אל הלב להדק את המיתר הכי קרוב ללב סביב הוריד את הקטטר.
- לאחר patency conforming, לקשור ליגטורה דיסטלי סביב הקטטר. טיפ: קיבוע נוסף של בוצנתרים ה עם סרט עשוי למנוע dislodgment.
- יש לשטוף צנתרים לעתים קרובות כדי למנוע קרישת intraluminal.
2. הכנת שריר Cremaster
- אנו משתמשים בשלב אלומיניום של 1.5-2 ס"מ עובי הדמיה cremasteric. בשלב במהירות מאמצת את הטמפרטורה הרצויה של כרית חימום ובכך להקל על בקרת החום של רקמת cremasteric. זה חיוני ללימודים דלקת. לחלופין פלטפורמת פרספקס ניתן להשתמש על פי תקנה של הטמפרטורה cremasteric קשה יותר. מכניסים את שק האשכים במרכז הבמה.
- החתך הראשוני נעשה העור fascia הזרע חיצוני מעל שק האשכים בסופו של דבר דיסטלי מאוד ואחריו הרחבה זהירה של שטח subdermal באמצעות מספריים עדינים. אל תיגע הרקמה הבסיסית עם המכשירים.
- ברגע רקמה חשופה היא טבולה מראש מחוממת (37 ° C) פוספט שנאגרו פתרון Wi מלוחיםה סידן ומגנזיום. החל פתרון קבוע לרקמת כל חשוף.
- רקמת החיבור בין fascia הזרע חיצוני שריר cremaster מוסרת בזהירות כדי לשחרר את השרירים cremaster מן הרקמה הסובבת.
- המשטח החיצוני של השריר cremaster מכן הוא פונה בזהירות של רקמת חיבור. Superfusion רציף במהלך הנתיחה הידרטים רקמת החיבור, להקל על ניראות ההסרה.
- לתפור את הקצה הדיסטלי של שק cremaster להחזיק ומעט להרחיב את סוף השקית.
- לחתוך את הקצה הדיסטלי של שק על ההיבט הגחון וכן להאריך את החתך proximally באמצעות מספריים מיקרו. בזהירות לצרוב כלי דם בנוסח חתך ניצול כויה תרמית. למנוע צריבה מיותרת להגביל גירויים דלקתיות נוספות. טיפ:. זרימת הדם דינמיקה ליד בפריפריה ההכנה משתנים לפי הנזק לרקמות 19 לכן, כדי למזער אתSE משפיע על איסוף נתונים, כלי דם ליד מרכז הכנה אמור לשמש עבור דימות.
- Cremaster פתוח שוכב על כן אלומיניום אבל עדיין מחובר באמצעות רצועה דקה יותרת האשך מתחת האשך. המשקף את האשך לצד אחד חושפת את הרצועה כולל עורק וריד קטן אשר מתחבר יותרת האשך. השתמש כויה לאטום את כלי ולהעסיק את המספריים מיקרו לקצץ את הרצועה המחברת בין האשך ורקמות cremasteric.
- דחף בעדינות בחזרה אשך בודד לתוך תעלת מפשעתי. מחברים אחרים לכרות האשך לאחר ליגטורה פרוקסימלי (orchiectomy) יחד עם פנקס אופנה הקשורים מפשעתי. 20 במודל רגיש ההפעלה הנגרמת IRI ליקוציט אנחנו מנסים למנוע את כל הגירויים כירורגיות נוספות, ולכן אנו נמנעים resecting testis, שהיא בדרך כלל לא צריך לקבל חשיפה מספקת של השריר cremaster.
- בנוסף 1תפר קיבעון ארבע קצוות של רקמה (2 בכל צד) ולצרף את החוטים כדי הקלטות בזהירות להפיץ את רקמת cremasteric רדיאלית על הבמה אלומיניום. השארת הפער בין הבמה אלומיניום הכניסה החיצוני של תעלת מפשעתי מפשט חיתוך cremasteric לאחר מכן על איסכמיה.
- מקום שני הקצוות של קטטר פוליאתילן (0.28 מ"מ קוטר פנימי) קרוב רקמות cremasteric להתקנה superfusion. ודא לומן ללא אוויר, כדי למנוע בועות אוויר בתא נוזל בסופו של דבר.
- למתוח קו של וזלין (וזלין) סביב השריר cremaster באמצעות מזרק. הקו צריך להאריך את גודל פיסת כיסוי המשמש כיסוי.
- כדי ליצור תא נוזל, במקום להחליק מכסה מרובע (32 × 32 מ"מ) על רקמות cremasteric ובתקיפות לחבר את הקצוות לקו וזלין.
- במקרה רקמות cremasteric לא superfused בתרופה מסוימת, החלפת מתמשך של השפעת הסביבהid היא חיונית. בקשה אחת של פוספט שנאגרו תמיסת מלח עם סידן ומגנזיום לתוך תא שנוצר עשוי אז להיות מספיק. גירוי מקומי עם תרופות עם זאת יש לבצע ברציפות בשיעור של 3 מ"ל לשעה באמצעות משאבת מיקרו זלוף.
- רקמת cremasteric מוכן כעת הדמיה מיקרוסקופית.
3. Intravital ההתקנה
ההגדרה הבסיסית intravital עשוי להשתנות. הדמיה epifluorescence הניסויים צריך להתבצע בחדר חשוך.
- בעלי חיים מועבר בשלב של המיקרוסקופ epifluorescence intravital מצויד 470 ננומטר הוביל מקור האור הזוהר של EPI-תאורה. השתמש טבילה במים אובייקטיבי (20 × / 1.0) כדי להשיג הגדלה של כ × 800. שיא תצפיות באמצעות מצלמה ברזולוציה גבוהה דיגיטלית רשומות חנות במחשב אישי להערכת מחובר.
- תיוג ליקוציט, להזריק rhodamine6G באמצעות קטטר לווריד הצוואר בריכוזים של משקל מ"ג / ק"ג 0.4 הגוף.
- בחר ורדיד postcapillary לצורך השגחה. גודל כלי השיט צריך לנוע בין 20-60 מיקרומטר וזרימת הדם אמור להיות מספיק. כדי למזער את ההשפעה של הפעלה מראש של רקמה, כלי בלבד, שבו הוא מתגלגל ליקוציט <20 cells/30 שניות את מספר התאים חסיד <10 cells/200μm של האנדותל venular עשוי להיות מנוצל לניתוח נוסף.
- במידת האפשר, עד 3 venules postcapillary ניתן להשתמש לצורך השגחה, אך הם צריכים להיות ממוקם בחלק המקביל רקמות cremasteric כדי למנוע בלבול כלי בנקודות זמן שונות.
4. איסכמיה reperfusion פגיעה (IIR)
- בואו רקמות לייצב במשך 30 דקות.
- לבצע הקלטה של 30 שניות לקבוע ערכי הבסיס של גלגול דבקות ליקוציט ו. באופן אידיאלי, ליצור בשלושה הקלטות בסך הכל הבסיס לאמת את התאמספרים ולקבל סטיות תקן.
- בעדינות למקם קליפ כלי Biemer בסביבות סוף בקרבה גדולה של רקמת cremasteric נחשף באמצעות מלקחיים יישומים. קיפאון צריך להתרחש מיד ניתן דמיינו ידי מיקרוסקופ epifluorescence בסעיף כלי הנצפה.
- מגוון רחב של קורסים הזמן יכול להיות מנוצל בהתאם לרמת הנזק הנדרש. אנחנו מיישמים את 30 דקות של זמן איסכמיה כפי שתואר על ידי מחברים אחרים. 21-23 הסר מהדק כלי לאחר מכן. אפשר להזרים דם כדי לייצב עוד 15 דקות.
- ההקלטות הבאות של משך 30 שניות יכול להתבצע לאורך כל התקופה reperfusion (למשל 30 שניות כל 15 דקות). להציל את ההקלטות באופן דיגיטלי לצורך ניתוח לא מקוון.
- על סיום הניסוי, עכברוש הוא מורדמים על ידי פריקה צוואר הרחם בהרדמה מספיק על ידי לחיצה על מכשיר קהה, כמו קצה של להב קהה מספריים בבסיס הגולגולת. עם זאתיד, בבסיס הזנב נמשך במהירות, גורם הפרדת חוליות צוואר הרחם מהגולגולת.
5. וידאו מנותק פלייבק ניתוח
- לניתוח וידאו מחובר השמעה כדאי להשתמש בתוכנה המאפשרת מבחר של תמונות שונות ותצפית של רצף וידאו בהילוך איטי. התאם את הניגודיות והבהירות באופן הולם. אנו משתמשים בתוכנה המסופקת על ידי היצרן של מיקרוסקופ המאפשר מדידות אורך הגדלה דיגיטלית.
- כימות של גלגול ליקוציט, הגדרת קו וירטואלי שחוצה כלי אנכית העולה בקנה אחד בכל הרישומים. ספירת כדוריות דם לבנות מתגלגל שעוברים את הקו תוך 30 שניות ידני.
- כימות של leukocytes חסיד, הגדר 200 כלי מיקרומטר סעיף העולה בקנה אחד ברשומות כל 23 ספירת לויקוציטים הנראים בבירור להישאר סטטית במהלך 30 שניות -. ובכך definאד חסיד בשם. 24
6. נציג תוצאות
IRI של שריר cremaster אין כל השפעה על לחץ הדם הממוצע (MAP), קצב הלב ואת רמת החומציות בדם
באמצעות התקנה הנ"ל (איור 1), חקרנו microcirculation ב IRI על פרוטוקול 2 שעות, אולם זמן תצפית הרבה יותר זמן עד 6 שעות אפשרי. כפי שניתן לראות בתרשים 2, IRI של שריר cremaster אין השפעה משמעותית על מחזור הדם macrohemodynamic עכברוש כמו לחץ הדם וקצב הלב אומר להישאר יציב לאורך כל תקופת החקירה. יתר על כן אנו במעקב הומאוסטזיס על ידי מדידות תכופות של עורקי הדם pH זה נע בגבולות פיזיולוגיים משמעותיים לא הראו הבדלים בין קבוצות.
IRI גורם מתגלגל ליקוציט במחזור cremasteric
האינטראקציה האנדותל ליקוציט הוא מפתחאירוע דלקת חריפה. באמצעות מיקרוסקופ intravital מצאנו עלייה של הזמן תלוי במספר leukocytes מתגלגלים IRI של שריר cremaster (איור 3 א) תואמים לנתונים קודמים 21, 25. רולינג רכוב לאורך זמן 2 שעות תצפית מרבי של 137.63 ± 22.55% מערך הבסיס לאחר 120 דקות של זמן reperfusion והגיע אז מובהקות סטטיסטית בהשוואה לחיות הדמה החדשות המופעלים (137.63 ± 22.55 לעומת 99.43 ± 14.04% מערך הבסיס).
IRI גורם הידבקות ליקוציט במחזור cremasteric
לצורך הערכה נוספת של אינטראקציה ליקוציט-האנדותל ניתחנו הידבקות ליקוציט ב סעיף 200 כלי מיקרומטר. IRI גרמו לעלייה במספר כדוריות דם לבנות חסיד באופן משמעותי חריגה ערכי דמה פעלו בעלי חיים לאחר 60 דקות (118.33 ± 6.83 לעומת 96.27 ± 5.78% מערך הבסיס) ו ASCE נוסףnded ידי 120 דקות של reperfusion (איור 3 ב).
לסיכום שתואר במודל vivo מספקת נתונים עקביים של הפעלת ליקוציט חריפה בהישרדות תוך חיים IRI ויציבות מחזור הדם היא מוצדקת.
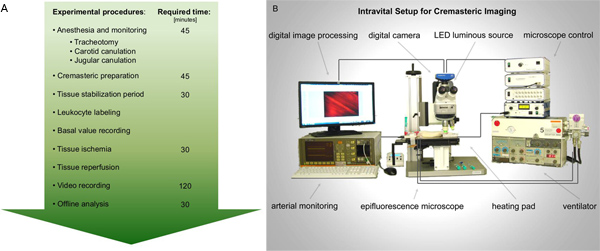
באיור 1. תרשים זרימה א 'לביצוע intravital מיקרוסקופיה epifluorescence לפגיעה reperfusion איסכמיה של שריר cremaster עכברוש. בעקבות ההכנות הדרושות הרדמה וניטור, שרירים cremaster חולדה נחשפת הדמיה. רשומות של הפעלת ליקוציט נלקחים לפני ואחרי איסכמיה רקמות. ניתוח וידאו לאחר מבוצע הטוב ביותר מקוון. ב ' דמות סכמטית על ההתקנה intravital המוצע. לחץ כאן כדי להציג דמות גדולה .
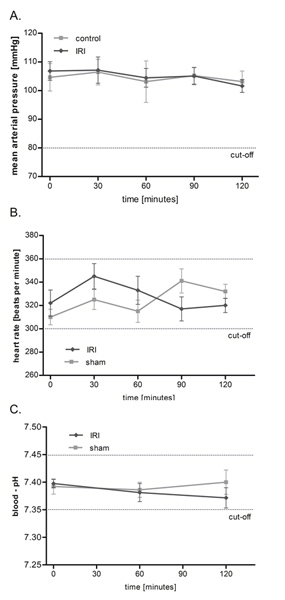
איור 2. IRI של שריר cremaster אין כל השפעה על לחץ הדם הממוצע (MAP), קצב הלב ואת רמת החומציות בדם. ממוצע לחץ הדם () וקצב לב (ב) היו במעקב כל 30 דקות במהלך הניסוי באמצעות מתמר הלחץ לאחר canulation של זכות עורק התרדמה. מדידת ה-pH בדם העורקי (ג) בוצעה לאחר 0, 60, 120 דקות. הערכים הם ממוצע ± SEM של 6 חולדות שונות נע על רמות פיזיולוגיות ללא הבדלים משמעותיים בין קבוצות. לחץ כאן כדי להציג דמות גדולה .
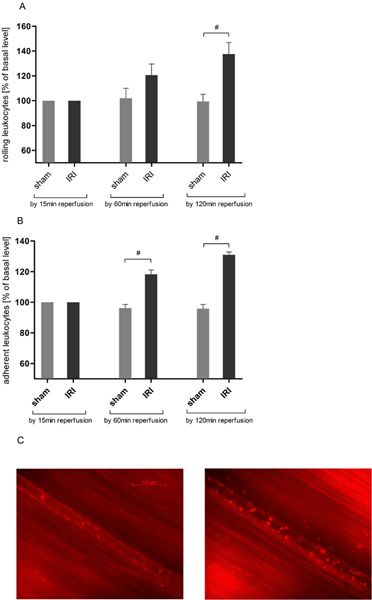
איור 3. IRI עולה ליקוציטאנדותל, אינטראקציה במחזור cremasteric. אחרי תיוג של leukocytes עם rhodamine 6G (0.4 מ"ג / ק"ג משקל גוף) מיקרוסקופיה epifluorescence intravital שימש כדי לקבוע ליקוציט-האנדותל אינטראקציה לפגיעה reperfusion על פרוטוקול 120 דקות אחרי 30 דקות של איסכמיה רקמות. רשומות צולמו בהגדלה של כ × 800. א IRI מגביר באופן משמעותי את מספר כדוריות דם לבנות מתגלגלים venules postcapillary של שריר cremaster ידי 120 דקות של reperfusion בעוד מתגלגל ליקוציט נשאר יציב לאורך כל הניסוי ברקמות cremasteric כי לא עבר איסכמיה. ערכים ממוצע ± SEM של 6 חולדות ציין. # P <0.05 באמצעות מבחן t מזווג. ב 'מספר leukocytes חסיד הוא גדל באופן משמעותי בסעיף כלי 200μm שנבחרו באקראי postcapillary לאחר 30 דקות של איסכמיה cremasteric ואחרי 60 דקות של reperfusion רקמות. תוצאות לקבל גם מומחדש בולטת לאחר תקופה שעות 2 reperfusion. ערכים ממוצע ± SEM של 6 חולדות ציין. # P <0.05 באמצעות מבחן t מזווג. תמונות ג נציג של ורדיד postcapillary לפני איסכמיה (משמאל) ו -120 דקות לאחר IRI (מימין). לחץ כאן כדי להציג דמות גדולה .
Discussion
ליקוציט-האנדותל אינטראקציה, הייצור של מינים החמצן מגיב והפעלה של מערכת המשלים הם התכונות העיקריות של תפקוד לקוי של IRI הנגרמת לרקמה. 26 microcirculation הרקמה הפגועה נחשב כאתר נפרד עבור הופעת דלקת. מלבד הניסויים ב vivo לשעבר כגון קאמרית מבחני הזרימה 27, 28 זה חובה ל...
Disclosures
אין ניגוד עניינים הצהיר.
Acknowledgements
עבודה זו נתמכה על ידי מענק של "דויטשה Forschungsgemeinschaft" כדי SU Eisenhardt (EI 866/1-1).
Materials
| Name | Company | Catalog Number | Comments |
| שם של ציוד: | חברה: | קטלוג מספר: | הערות: |
| Forene 100% (V / V) | ראש מנזר | B506 | API isoflurane |
| הטרילין קשירת | Serag Weissner | OC108000 | |
| Portex פיין לשעמם Tubing ניילון | רפואה Smiths | 800/100/100 | 0.28 מ"מ קוטר פנימי |
| תמיסת מלח 0,9% | Fresinus Kabi | 808771 | |
| שנה-A-עצה דלוקס ערכת כויה | Bovie רפואי | DEL1 | |
| Abbocath-T 14 גר | Venisystems | G713- A01 | משמש צינור עדשה |
| למאוורר סרוו 900C | Maquet | משמש ventialtor בעלי חיים | |
| לחץ לוגי מתמר | רפואה Smiths | MX1960 | |
| Sirecust 404 Monitor | סימנס | ||
| ABL 700 benchtop Analyzer | רדיומטר | למדידת גזים בדם | |
| כרית חימום | Effenberger | 8319 | |
| אלומיניום הבמה | Alfun | AW7022 | |
| מיקרוסקופ כירורגי OPMI 6-SDFC | Carl Zeiss | ||
| Microsurgical המכשירים במעבדה שלet | S & T | 767 | |
| Biemer קליפ כלי | דינר | 64.562 | |
| יישום מלקחיים | דינר | 64.568 | עבור קליפ כלי Biemer |
| Rhodamine 6G | Sigma-Aldrich | R4127 | |
| וזלין לבן DAB | וינתרופ | 2726853 | |
| כיסוי משקפיים | 32x32 מ"מ | ||
| Intravital ההתקנה | |||
| Zeis Axio היקף MAT-1 | קרל Zeis | 490036 | epifluorescence מיקרוסקופ |
| 470 ננומטר נורית | קרל Zeis | 423052 | מקור אור פלואורסצנטי |
| קוליברי 2 מערכת | קרל Zeis | 423052 | |
| תכנית W-Apochromat 20x / 1,0 DIC | קרל Zeis | 421452 | טבילה במים המטרה |
| AxioCam MRM הכומר 3 FireWire | קרל Zeis | 426509 | מצלמה דיגיטלית ברזולוציה גבוהה |
| החזון Axio LE תוכנה | קרל Zeis | 410130 | משתמשים לניתוח מחובר |
References
- Cetin, C. Protective effect of fucoidin (a neutrophil rolling inhibitor) on ischemia reperfusion injury: experimental study in rat epigastric island flaps. Ann. Plast. Surg. 47, 540-546 (2001).
- Granger, D. N. Role of xanthine oxidase and granulocytes in ischemia-reperfusion injury. Am. J. Physiol. 255, H1269-H1275 (1988).
- Lazarus, B. The role of mast cells in ischaemia-reperfusion injury in murine skeletal muscle. J Pathol. 191, 443-448 (2000).
- van den Heuvel, M. G. Review: Ischaemia-reperfusion injury in flap surgery. J. Plast. Reconstr. Aesthet. Surg. 62, 721-726 (2009).
- Rosen, S. D. Cell surface lectins in the immune system. Semin. Immunol. 5, 237-247 (1993).
- van der Flier, A., Sonnenberg, A. Function and interactions of integrins. Cell Tissue Res. 305, 285-298 (2001).
- Panes, J., Perry, M., Granger, D. N. Leukocyte-endothelial cell adhesion: avenues for therapeutic intervention. Br. J. Pharmacol. 126, 537-550 (1999).
- Gavins, F. N., Chatterjee, B. E. Intravital microscopy for the study of mouse microcirculation in anti-inflammatory drug research: focus on the mesentery and cremaster preparations. J. Pharmacol. Toxicol. Methods. 49, 1-14 (2004).
- Sutton, T. A. Injury of the renal microvascular endothelium alters barrier function after ischemia. Am. J. Physiol. Renal. Physiol. 285, 191-198 (2003).
- Serracino-Inglott, F. Differential nitric oxide synthase expression during hepatic ischemia-reperfusion. Am. J. Surg. 185, 589-595 (2003).
- Eppinger, M. J. Mediators of ischemia-reperfusion injury of rat lung. Am J Pathol. 150, 1773-1784 (1997).
- Dumont, E. A. Real-time imaging of apoptotic cell-membrane changes at the single-cell level in the beating murine heart. Nat Med. 7, 1352-1355 (2001).
- Baez, S. An open cremaster muscle preparation for the study of blood vessels by in vivo microscopy. Microvasc Res. 5, 384-394 (1973).
- Woeste, G. Octreotide attenuates impaired microcirculation in postischemic pancreatitis when administered before induction of ischemia. Transplantation. 86, 961-967 (2008).
- Schultz, J. E., Hsu, A. K., Gross, G. J. Morphine mimics the cardioprotective effect of ischemic preconditioning via a glibenclamide-sensitive mechanism in the rat heart. Circ. Res. 78, 1100-1104 (1996).
- Dobschuetz, E. v. o. n. Dynamic intravital fluorescence microscopy--a novel method for the assessment of microvascular permeability in acute pancreatitis. Microvasc Res. 67, 55-63 (2004).
- Vutskits, L. Adverse effects of methylene blue on the central nervous system. Anesthesiology. 108, 684-692 (2008).
- Takasu, A. Improved survival time with combined early blood transfusion and fluid administration in uncontrolled hemorrhagic shock in rats. J. Trauma. 8, 312-316 (2010).
- Proctor, K. G., Busija, D. W. Relationships among arteriolar, regional, and whole organ blood flow in cremaster muscle. Am. J. Physiol. 249, 34-41 (1985).
- Bagher, P., Segal, S. S. The Mouse Cremaster Muscle Preparation for Intravital Imaging of the Microcirculation. J. Vis. Exp. (52), e2874 (2011).
- Kanwar, S., Hickey, M. J., Kubes, P. Postischemic inflammation: a role for mast cells in intestine but not in skeletal muscle. Am. J. Physiol. 275, 212-218 (1998).
- Leoni, G. Inflamed phenotype of the mesenteric microcirculation of melanocortin type 3 receptor-null mice after ischemia-reperfusion. FASEB J. 22, 4228-4238 (2008).
- Simoncini, T. Interaction of oestrogen receptor with the regulatory subunit of phosphatidylinositol-3-OH kinase. Nature. 407, 538-541 (2000).
- Woollard, K. J. Pathophysiological levels of soluble P-selectin mediate adhesion of leukocytes to the endothelium through Mac-1 activation. Circ. Res. 103, 1128-1138 (2008).
- Mori, N. Ischemia-reperfusion induced microvascular responses in LDL-receptor -/- mice. Am. J. Physiol. 276, H1647-H1654 (1999).
- Eisenhardt, S. U. Monitoring Molecular Changes Induced by Ischemia/Reperfusion in Human Free Muscle Flap Tissue Samples. Ann. Plast. Surg. , (2011).
- Eisenhardt, S. U. Generation of activation-specific human anti-{alpha}M{beta}2 single-chain antibodies as potential diagnostic tools and therapeutic agents. Blood. 109, 3521-3528 (2007).
- Eisenhardt, S. U. Dissociation of pentameric to monomeric C-reactive protein on activated platelets localizes inflammation to atherosclerotic plaques. Circ Res. 105, 128-137 (2009).
- Eisenhardt, S. U. C-reactive protein: how conformational changes influence inflammatory properties. Cell Cycle. 8, 3885-3892 (2009).
- Granger, D. N. . Physiology and pathophysiology of leukocyte adhesion. , 520 (1995).
- Baatz, H. Kinetics of white blood cell staining by intravascular administration of rhodamine 6G. Int. J. Microcirc. Clin. Exp. 15, 85-91 (1995).
- Mempel, T. R. In vivo imaging of leukocyte trafficking in blood vessels and tissues. Curr. Opin. Immunol. 16, 406-417 (2004).
- Abbitt, K. B., Rainger, G. E., Nash, G. B. Effects of fluorescent dyes on selectin and integrin-mediated stages of adhesion and migration of flowing leukocytes. J. Immunol. Methods. 239, 109-119 (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved