需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
实时数字成像大鼠提睾肌缺血再灌注损伤(IRI)的白细胞 - 内皮细胞相互作用
摘要
数字提睾微循环毛细血管静脉活体荧光显微镜是一种方便的方法获得白细胞 - 内皮细胞相互作用的见解在体内
摘要
在病理条件下,如脑卒中,心肌梗死,肠缺血,以及移植和心血管手术。1以前缺血组织的再灌注后的大阵,而必要的预防不可逆转的缺血再灌注损伤(IRI)有牵连组织损伤,诱发过度炎症反应受影响的组织。毗邻的活性氧,活化补体系统的生产和增加血管通透性,激活白细胞再灌注过程中的病理级联在炎症组织损伤的原则演员之一。2,3白细胞激活是一个多步过程组成轧制,坚定的粘附和轮回之间复杂的相互作用的粘附分子介导的反应,如补体因子,趋化因子,血小板活化因子的趋化因子。 <虽然在毛细血管静脉的白细胞滚动主要选择素5的相互作用介导,与他们的柜台配体,坚定白细胞粘附血管内皮细胞是通过粘附分子(ICAM)与血管细胞结合的选择控制类p =“的jove_content”>粘附分子(VCAM),6,7
在体内的白细胞-内皮细胞相互作用观察的金标准是活体显微镜技术,首次在1968年8。
虽然各个器官缺血再灌注损伤(缺血再灌注损伤)的各种型号,9-12只有少数是适合微血管床的白细胞招聘的直接可视化的图像质量高的水平上。
在这里,我们促进提睾微循环的毛细血管后微静脉的活体荧光显微镜的数字作为一种方便的方法大鼠IRI的研究,定性和定量分析白细胞招聘横纹肌组织,并为实现该技术提供了一个详细的手册13。我们进一步说明常见的陷阱,应该使读者能够真正体会,安全地执行方法,并提供有用的提示。
在由步步协议,我们描述如何获得足够的监测,保持时间较长的动物坚决麻醉呼吸控制麻醉下开始。然后,我们描述优秀的光学分辨率为薄平板提睾准备和提供已在我们的实验室建立在IRI白细胞成像的协议。
研究方案
1。麻醉和监测
- 适当的国家和机构伦理应该在之前进行动物实验。继批准从伦理委员会麻醉男性只SD大鼠的体重从120 - 180克。提供2 - 3%异氟醚,异氟醚蒸发器和一个有机玻璃箱,通过放置在大鼠内。
- 尽快达到适当的麻醉水平(缺乏反应脚趾或尾巴捏)大鼠加权和腹侧颈区剃光。
- 放在一个加热垫在背卧鼠体温保持在37°C和异氟醚适用于2卷用硅胶面具%。
最好使用手术显微镜完成以下准备步骤。
- 准备气管,颈动脉和颈内静脉,在该地区执行Ø水平2厘米的皮肤切口f的胸骨上切迹和动员横向的唾液腺。
- 你现在面临的腹侧颈部肌肉。仔细在中线分开,发现气管。暴露1 - 2厘米的气管和下放置一个微型镊子,从而提高了。
- 现在割开一半通过气管的腹侧面。要小心不要削减,一路过关斩将,如果你这样做,气管切端将陷入胸部,是非常困难的工作。
- 插入进气管,先前已被连接到动物呼吸机下部气管插管使用Abbocath管(14G)。提示:坚定地固定在磁铁夹以及缝合的气管内管周围必须保持在气管插管。我们一般使用涤纶5/0缝线,然而,类似缝合材料都可以使用。
- 呼吸可以控制量(频率,35 - 45次/分,潮气量,4.5 - 5毫升FIO 2 ,0.35 - 0.50;异氟醚1.5 - 2%)14肺不张是可以预防的,保持一个积极的呼气末压力5至10毫米的H 2 O的15
- 对于颈canulation,右胸骨舌骨肌是由钝性分离,找到颈动脉。
- 仔细分离迷走神经从颈内动脉,并安装在一个倾斜的微型镊子的动脉,阻止血液从心脏流向。
- 通过颈动脉下方的两片缝合的长度相等。在参考的心,更远端缝合捆紧闭塞从头部的血液流动,而松散地绑在颈动脉近端缝合。
- 使用微型剪刀两国结扎颈内动脉被制作成一小截。
- 插入充满生理盐水的解决方案,连接到一个压力传感器的聚乙烯导管(0.28 mm内径)。
- 雷姆奥雅纳的微型镊子和螺纹导管进入动脉。然后拧紧近端周围动脉导管结扎。提示:第二近端缝合的应用可以防止微型镊子取出后出血。
- 配合周围的颈动脉远端结扎和附加锚固导管。
- 连续监测麻醉监测心跳率和血压。执行间歇动脉血气分析,用血气分析仪16 17,18一个心脏率低于300 BPM或超过360 BPM以及平均动脉压下降80毫米汞柱以下,超过5分钟,排除标准。维持血在生理限度内的pH值(7.35 - 7.45)。在实验的情况下被终止,由于异常的监测率,划破脖子上的脱位或exanguation的动物。
静脉应用的荧光染料或其他药物Øf利益,执行以下步骤:
- 集中区的左侧颈内静脉的手术显微镜。
- 每手钳,撕薄筋膜,显露颈静脉。装入一个角度的微型镊子的静脉。血流量就会停止。
- 使用镊子,两片缝合的长度相等,通过下和谐的颈canulation的颈静脉。领带远端缝合紧密和松散绕颈静脉近端缝合。
- 使之成为一小截,颈静脉插入聚乙烯导管(0.28 mm内径)已用生理盐水冲洗。标记,切口canulation可以更加苛刻和费时比颈。
- 主题的向心导管和收紧最接近心脏周围的静脉导管结扎。
- 不合格通畅后,配合周围的导管远端结扎。提示:附加固定的博用胶带日导管可以防止脱落。
- 频繁冲洗导管,以防止管腔内凝血。
2。提睾肌的制备
- 我们使用铝1.5阶段 - 2厘米的厚度,提睾成像。迅速的阶段采用的加热垫,从而减轻了提睾组织的热控制所需的温度。这是炎症的研究是至关重要的。另外一个有机玻璃平台可用于尽管提睾温度调节更加困难。阴囊放置在舞台中央。
- 最初的切口,在皮肤和外部谨慎扩张皮下用细剪刀空间非常远端阴囊精索筋膜以上。避免接触与仪器的基本组织。
- 尽快组织暴露,它是沾了预先加热(37°C间)磷酸盐缓冲液的Wi日,钙和镁。应用解决方案,定期到任何暴露的组织。
- 小心取下摆脱提睾肌周围组织之间的外部精索筋膜及提睾肌的结缔组织。
- 提睾肌的外表面,然后小心翼翼地清除结缔组织。连续灌流期间清扫水合物的结缔组织,促进知名度和清除。
- 缝合提睾袋按住末端,稍微延长麻袋结束。
- 切开腹侧方面的麻袋远端延长切口近端使用微型剪刀。仔细烧灼出血船只沿切口线利用热烧灼。避免不必要的烧灼限制额外的炎症刺激。提示:准备外围附近的血流动力学改变本组织损伤19因此,最大限度地减少本身影响数据收集,编制中心附近的血管,应当用于成像。
- 开放睾在于虽然仍然由薄韧带连接到下面的睾丸附睾铝基座持平。反映睾丸一侧暴露出这包括小动脉和静脉连接到附睾的韧带。使用烧灼密封的船只,并采用微型剪刀切睾丸和提睾组织之间的结缔组织韧带。
- 轻轻推入腹股沟管孤立的睾丸。其他作者近端结扎(睾丸)睾丸切除后,连同相关的腹股沟时尚垫在IRI的诱导白细胞活化,我们尽量避免一切额外的手术刺激敏感的模型20,因此我们不切除睾丸,这通常不是必要提睾肌得到充分暴露。
- 除了第一四边固定缝合组织(每侧两个)和线程附加到磁带谨慎径向铝舞台上传播的提睾组织。离开铝阶段,腹股沟管的外部入口之间的差距,简化缺血随后提睾裁剪。
- 将两个聚乙烯导管的两端(0.28 mm内径)提睾组织灌流设置。确保流明是自由的空气,以避免在最终液腔气泡。
- 画一条线周围的提睾肌使用注射器凡士林(凡士林)。行必须扩大覆盖的盖玻片的大小。
- 要创建一个流体室,放置在提睾组织方形盖玻片(32×32毫米)和凡士林线牢牢附着的边缘。
- 在案件的提睾组织灌流与一个特定的药物,周围流感连续更换id是不必要的。一个单一的应用磷酸盐缓冲到创建商会的钙和镁的盐溶液,然后可能是足够的。与药物的局部刺激作用,但应通过微灌注泵进行连续3毫升每小时的速度。
- 提睾组织现在已经准备好显微成像。
3。活体安装
活体的基本格局可能会有所不同。对于萤光成像实验应执行在一个黑暗的房间。
- 被转移到动物活体萤光显微镜配备了470的LED光源照明外延纳米阶段。用开水浸泡的目标(20×/ 1.0),达到约800×的放大倍率。高分辨率的数码相机和个人电脑上的离线评估的存储记录的方式记录观察。
- 白细胞标签,注入罗丹明6G静脉经颈静脉导管在浓度为0.4毫克/公斤体重。
- 选择一个观察的毛细血管后微静脉。容器的大小应介于20-60微米和血流量应该足够了。为了尽量减少预活化组织的影响,只船只中的白细胞滚动<20 cells/30秒和小静脉内皮细胞的贴壁细胞数<10cells/200μm可能被用来作进一步分析。
- 如果可能的话,最多三个毛细血管静脉可用于观察,然而,他们应在位于一提睾组织的相应部分,以避免混淆不同时间点的船只。
4。缺血再灌注损伤(IIR)的
- 30分钟,让组织稳定。
- 执行30秒的记录,建立基础值白细胞滚动和坚持。理想的情况下,共有三个基础录音生成验证细胞数量和获得标准偏差。
- 轻轻地放在周围非常近端露出的提睾组织所使用的应用镊子1 Biemer船只剪辑。血瘀应立即发生,并可以通过可视化荧光显微镜观测船节。
- 可以利用各种时间课程,根据所需的损坏级别。我们申请缺血时间30分钟,其他作者的描述。21-23后取出血管钳。让血液流至15分钟的稳定。
- 随后的30秒录音,可在整个再灌注期间(例如30秒,每15分钟)。数字保存录音离线分析。
- 终止实验,大鼠按钝器如剪刀刀片沉闷边缘颅底安乐死足够的麻醉下颈椎脱位。与其他另一方面,基地的尾巴快速拉升,造成颈椎头骨分离。
5。离线视频播放分析
- 对于脱机视频播放分析是有益使用的软件,可以选择不同的图片和视频序列中的慢动作观察。适当调整对比度和亮度。我们使用的允许长度测量和数字放大倍率的显微镜制造商提供的软件。
- 白细胞滚动量化,定义了一个虚拟的垂直线相交的船只,在所有的记录是一致的。通过在30秒内手动的行滚动白细胞计数的数量。
- 黏附白细胞的量化,确定23一成不变的清晰可见白细胞计数在30秒200微米船节,在所有的记录是一致的-从而defined将贴壁24。
6。代表结果
IRI的提睾肌的平均动脉压(MAP),心脏率和血液的pH值没有影响
使用上述设置( 图1),我们调查了两个小时的协议在IRI的微循环,但更长的观测时间长达6个小时是可能的。正如图2所示,提睾肌IRI的大鼠循环没有显着macrohemodynamic影响整个调查期间平均动脉压和心脏率保持稳定。此外,我们监测生理极限范围内的动脉血pH值的频繁测量的动态平衡,并没有表现出显着的组间差异。
IRI的诱导白细胞提睾流通的滚动
白细胞内皮细胞相互作用,是一个关键在急性炎症的事件。通过活体显微镜,我们发现在滚动的白细胞数量在IRI的提睾肌( 图3A)至21日,25以前的数据一致的时间依赖性增加。滚动轴承安装了两个小时的观测时间,以最大的137.63±22.55%的基准值后,再灌注时间120分钟,然后达到统计学意义(137.63±22.55比99.43±14.04%的基准值)相比,假手术动物。
IRI的诱导白细胞粘附在提睾循环
白细胞 - 内皮细胞相互作用的进一步评估,我们分析了白细胞粘附在200微米船节。 IRI的诱导黏附白细胞数量大大超出了假值的增加,经营动物60分钟后(118.33±6.83比96.27±5.78%的基准值),并进一步ASCEnded由再灌注120分钟( 图3B)。
在体内模型中所描述的总结提供一致的数据在IRI,而动物的生存和流通稳定的急性白细胞激活是必要的。
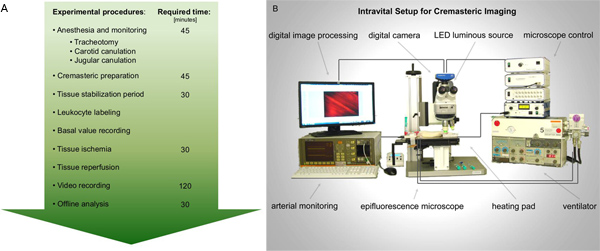
图1。 A.大鼠提睾肌缺血再灌注损伤的活体荧光显微镜性能的流程图。麻醉和监测所需的准备工作之后,暴露大鼠提睾肌的影像。采取组织缺血前后白细胞活化记录。随后的视频分析是最好的离线执 行。就拟议的活体设置的原理图。 点击这里查看大图 。
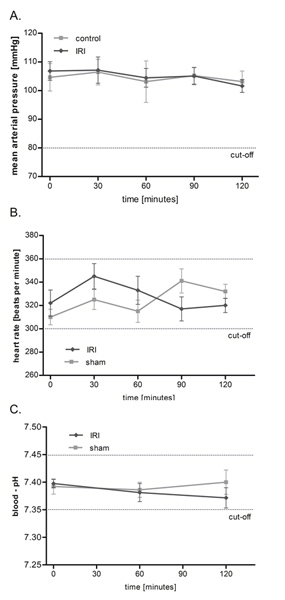
图2。提睾肌IRI的平均动脉压(MAP),心脏率和血液的pH值没有影响。整个实验通过压力传感器监测平均动脉压(A)和心脏速率(b)每30分钟后,有权canulation颈动脉。动脉血pH值(三)测量后进行0,60,和120分钟。值是平均值±SEM 6种不同的大鼠和范围上没有显着的组间差异的生理水平。 点击这里查看大图 。
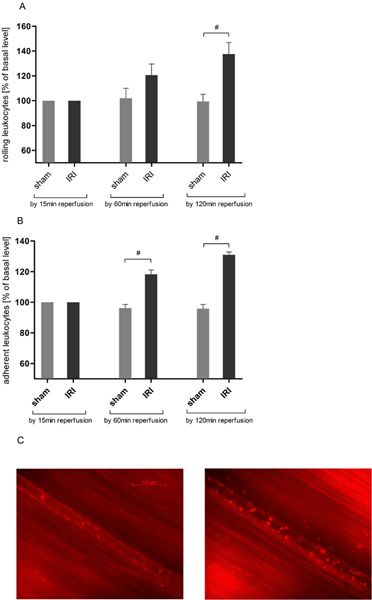
图3。 IRI的增加白细胞在提睾循环。标签与罗丹明6G(0.4毫克/公斤体重),白细胞活体荧光显微镜被用来确定组织缺血30分钟后,120分钟的协议再灌注损伤的白细胞内皮互动后的内皮细胞的相互作用。记录被放大倍率约×800。 答:IRI的显着增加了120分钟,再灌注提睾肌的毛细血管静脉滚动白细胞,而白细胞的滚动保持稳定,在整个实验中提睾组织没有接受缺血。值平均值±SEM观察大鼠6。 #P <0.05采用配对t检验。黏附白细胞的数量显着增加随机选择200μm的提睾缺血和随后的60分钟组织再灌注30分钟后postcapillary船节。结果得到甚至莫重新宣判后两小时再灌注期间。值平均值±SEM观察大鼠6。 #P <0.05采用配对t检验的毛细血管后微静脉C.代表的照片前缺血(左)和120分钟后,IRI的(右)。 点击这里查看大图 。
讨论
白细胞-内皮细胞相互作用,生产活性氧和激活补体系统是IRI的诱导组织功能障碍的主要特点。26受影响组织的微循环被视为不可分割的炎症发病网站。除了 如流室检测27,28的 体外实验,它是强制性的,以提供行之有效的活体成像模型,以进一步评估在体内相关。虽然已在不同的器官系统有牵连IRI的,我们在这里描述的方法系统地研究白细胞与内皮细胞相互作用...
披露声明
没有利益冲突的声明。
致谢
授予的“德意志研究联合会”(EI 866/1-1)苏艾森哈特支持这项工作。
材料
| Name | Company | Catalog Number | Comments |
| 设备名称: | 公司名称: | 目录号: | 评论: |
| forene 100%(V / V) | 住持 | B506 | API的异氟醚 |
| 涤纶缝合 | serag Weissner | OC108000 | |
| portex精细孔聚乙烯管材 | 史密斯医疗 | 800/100/100 | 0.28毫米内径 |
| 0.9%的生理盐水溶液 | fresinus卡比 | 808771 | |
| 变化的一个尖端豪华烧灼套件的 | bovie医学 | 警报1动作延迟时间 | |
| abbocath-14Gţ | venisystems | G713- A01 | 作为镜头筒 |
| 伺服呼吸机900C | MAQUET | 用作动物ventialtor的 | |
| 逻辑压力传感器 | 史密斯医疗 | MX1960 | |
| sirecust 404显示器 | 西门子 | ||
| ABL的700台式分析仪 | 辐射计 | 血液气体测量 | |
| 加热垫 | effenberger | 8319 | |
| 铝合金舞台 | alfun | AW7022 | |
| 手术显微镜OPMI 6 SDFC | 卡尔·蔡司 | ||
| 显微仪器实验室小号等 | 科技 | 767 | |
| biemer船只夹 | 迪纳 | 64.562 | |
| 应用镊子 | 迪纳 | 64.568 | 为Biemer血管夹 |
| 罗丹明6G | Sigma-Aldrich公司 | R4127 | |
| 凡士林白民建联 | 温斯洛普 | 2726853 | |
| 盖玻片 | 32×32毫米 | ||
| 活体设置 | |||
| zeis Axio上范围A-1中太 | 卡尔Zeis | 490036 | 萤光显微镜 |
| 470 nm的LED | 卡尔Zeis | 423052 | 荧光光源 |
| 科利柏2系统 | 卡尔Zeis | 423052 | |
| W计划的复消色差透镜20X / 1,0迪爱生 | 卡尔Zeis | 421452 | 浸水目标 |
| AxioCam MRM牧师3火线 | 卡尔Zeis | 426509 | 高清晰度的数码相机 |
| AXIO视力LE软件 | 卡尔Zeis | 410130 | 用于离线分析 |
参考文献
- Cetin, C. Protective effect of fucoidin (a neutrophil rolling inhibitor) on ischemia reperfusion injury: experimental study in rat epigastric island flaps. Ann. Plast. Surg. 47, 540-546 (2001).
- Granger, D. N. Role of xanthine oxidase and granulocytes in ischemia-reperfusion injury. Am. J. Physiol. 255, H1269-H1275 (1988).
- Lazarus, B. The role of mast cells in ischaemia-reperfusion injury in murine skeletal muscle. J Pathol. 191, 443-448 (2000).
- van den Heuvel, M. G. Review: Ischaemia-reperfusion injury in flap surgery. J. Plast. Reconstr. Aesthet. Surg. 62, 721-726 (2009).
- Rosen, S. D. Cell surface lectins in the immune system. Semin. Immunol. 5, 237-247 (1993).
- van der Flier, A., Sonnenberg, A. Function and interactions of integrins. Cell Tissue Res. 305, 285-298 (2001).
- Panes, J., Perry, M., Granger, D. N. Leukocyte-endothelial cell adhesion: avenues for therapeutic intervention. Br. J. Pharmacol. 126, 537-550 (1999).
- Gavins, F. N., Chatterjee, B. E. Intravital microscopy for the study of mouse microcirculation in anti-inflammatory drug research: focus on the mesentery and cremaster preparations. J. Pharmacol. Toxicol. Methods. 49, 1-14 (2004).
- Sutton, T. A. Injury of the renal microvascular endothelium alters barrier function after ischemia. Am. J. Physiol. Renal. Physiol. 285, 191-198 (2003).
- Serracino-Inglott, F. Differential nitric oxide synthase expression during hepatic ischemia-reperfusion. Am. J. Surg. 185, 589-595 (2003).
- Eppinger, M. J. Mediators of ischemia-reperfusion injury of rat lung. Am J Pathol. 150, 1773-1784 (1997).
- Dumont, E. A. Real-time imaging of apoptotic cell-membrane changes at the single-cell level in the beating murine heart. Nat Med. 7, 1352-1355 (2001).
- Baez, S. An open cremaster muscle preparation for the study of blood vessels by in vivo microscopy. Microvasc Res. 5, 384-394 (1973).
- Woeste, G. Octreotide attenuates impaired microcirculation in postischemic pancreatitis when administered before induction of ischemia. Transplantation. 86, 961-967 (2008).
- Schultz, J. E., Hsu, A. K., Gross, G. J. Morphine mimics the cardioprotective effect of ischemic preconditioning via a glibenclamide-sensitive mechanism in the rat heart. Circ. Res. 78, 1100-1104 (1996).
- Dobschuetz, E. v. o. n. Dynamic intravital fluorescence microscopy--a novel method for the assessment of microvascular permeability in acute pancreatitis. Microvasc Res. 67, 55-63 (2004).
- Vutskits, L. Adverse effects of methylene blue on the central nervous system. Anesthesiology. 108, 684-692 (2008).
- Takasu, A. Improved survival time with combined early blood transfusion and fluid administration in uncontrolled hemorrhagic shock in rats. J. Trauma. 8, 312-316 (2010).
- Proctor, K. G., Busija, D. W. Relationships among arteriolar, regional, and whole organ blood flow in cremaster muscle. Am. J. Physiol. 249, 34-41 (1985).
- Bagher, P., Segal, S. S. The Mouse Cremaster Muscle Preparation for Intravital Imaging of the Microcirculation. J. Vis. Exp. (52), e2874 (2011).
- Kanwar, S., Hickey, M. J., Kubes, P. Postischemic inflammation: a role for mast cells in intestine but not in skeletal muscle. Am. J. Physiol. 275, 212-218 (1998).
- Leoni, G. Inflamed phenotype of the mesenteric microcirculation of melanocortin type 3 receptor-null mice after ischemia-reperfusion. FASEB J. 22, 4228-4238 (2008).
- Simoncini, T. Interaction of oestrogen receptor with the regulatory subunit of phosphatidylinositol-3-OH kinase. Nature. 407, 538-541 (2000).
- Woollard, K. J. Pathophysiological levels of soluble P-selectin mediate adhesion of leukocytes to the endothelium through Mac-1 activation. Circ. Res. 103, 1128-1138 (2008).
- Mori, N. Ischemia-reperfusion induced microvascular responses in LDL-receptor -/- mice. Am. J. Physiol. 276, H1647-H1654 (1999).
- Eisenhardt, S. U. Monitoring Molecular Changes Induced by Ischemia/Reperfusion in Human Free Muscle Flap Tissue Samples. Ann. Plast. Surg. , (2011).
- Eisenhardt, S. U. Generation of activation-specific human anti-{alpha}M{beta}2 single-chain antibodies as potential diagnostic tools and therapeutic agents. Blood. 109, 3521-3528 (2007).
- Eisenhardt, S. U. Dissociation of pentameric to monomeric C-reactive protein on activated platelets localizes inflammation to atherosclerotic plaques. Circ Res. 105, 128-137 (2009).
- Eisenhardt, S. U. C-reactive protein: how conformational changes influence inflammatory properties. Cell Cycle. 8, 3885-3892 (2009).
- Granger, D. N. . Physiology and pathophysiology of leukocyte adhesion. , 520 (1995).
- Baatz, H. Kinetics of white blood cell staining by intravascular administration of rhodamine 6G. Int. J. Microcirc. Clin. Exp. 15, 85-91 (1995).
- Mempel, T. R. In vivo imaging of leukocyte trafficking in blood vessels and tissues. Curr. Opin. Immunol. 16, 406-417 (2004).
- Abbitt, K. B., Rainger, G. E., Nash, G. B. Effects of fluorescent dyes on selectin and integrin-mediated stages of adhesion and migration of flowing leukocytes. J. Immunol. Methods. 239, 109-119 (2000).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。