A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياس الخواص الميكانيكية للالكنان السكري غشائي مع مجهر القوة الذرية
In This Article
Summary
تم قياس الخصائص الميكانيكية للالكنان السكري من المسافة البادئة باستخدام البطانية المجالات ميكرون الحجم على الكابولي AFM. تم زراعة الخلايا البطانية في غرفة مخصصة في ظل ظروف تدفق الفسيولوجية للحث على التعبير الكنان السكري. وقد تم تحليل البيانات باستخدام نموذج رقيقة لتحديد سمك الكنان السكري ومعامل.
Abstract
ويقتصر فهمنا للتفاعل الكريات البيض وجدار الوعاء الدموي أثناء التقاط الكريات البيض من فهم غير مكتمل الخصائص الميكانيكية للطبقة السطحية البطانية. من المعروف أن توزع جزيئات الالتصاق على الكريات البيض غير موحد بالنسبة لتضاريس سطح 3، أن يحد من تضاريس لاصقة تشكيل السندات مع غيرها من الأسطح 9، وأن القوات اتصال الفسيولوجية (≈ 5،0 حتي 10،0 في زغيبة PN) يمكن ضغط زغيبات على أنها اقل من ثلث طولها يستريح، وزيادة إمكانية الوصول إلى جزيئات على سطح معارضة 3 و 7. ونحن نعتبر أن البطانة كهيكل لمدة الطبقات، جسم الخلية جامدة نسبيا، بالإضافة إلى الكنان السكري، وطلاء لينة واقية السكر على سطح اللمعية 6. وقد تبين أن الكنان السكري يمكن أن تكون بمثابة حاجز للحد من التصاق الكريات البيض من السطح إلى 4 البطانية.في هذا التقرير أن نبدأ في معالجة التشوه من السطوح البطانية لفهم كيفية صلابة البطانية الميكانيكية قد تؤثر على تشكيل السندات. الخلايا البطانية التي تزرع في ثقافة ساكنة لا تعبر عن الكنان السكري قوية، ولكن الخلايا نمت في ظل ظروف تدفق الفسيولوجية تبدأ في الكنان السكري التقريبي لوحظ في الجسم الحي 2. وقد تم قياس معامل للجسم الخلية البطانية باستخدام مجهر القوة الذرية (AFM) ليكون يقرب من 5 إلى 20 كيلو باسكال 5. وقد تم دراسة سمك وهيكل الكنان السكري باستخدام المجهر الإلكتروني 8، وتم يقترب من معامل للالكنان السكري باستخدام أساليب غير مباشرة، ولكن على حد علمنا، لم تكن هناك أي تقارير منشورة من القياس المباشر للمعامل الكنان السكري في الخلايا الحية . في هذه الدراسة، نقدم تجارب المسافة البادئة التي مع التحقيق الذي تجريه AFM الرواية على الخلايا التي تم زرعها في ظروف لتحقيق أقصى قدر من التعبير عنها لأماه الكنان السكريقياسات كه المباشر للمعامل وسمك بطانة الكنان السكري.
Protocol
1. طرق
1،1 غرفة تدفق خلية
تم بناء غرفة تدفق A، كما هو موضح في الشكل رقم 1، بحيث يمكن أن تنمو الخلايا تحت القص من 1.0 باسكال (10 DYN / سم 2) ونقل بعد ذلك مباشرة إلى اللجوء MFP3D AFM (سانتا باربارا، CA).
- وقد أعدت غرفة تدفق للتجربة عن طريق تنظيف لأول مرة الشرائح الزجاجية في حل البيرانا (3:1 H 2 SO 4: H 2 O 2) لمدة 15 دقيقة ثم غسل ولهم الماء المقطر. وبعد ذلك إلى خبز جاف والمغلفة مع triethoxy أمينو سيلاني (APTES) في فراغ غرفة الترسيب.
- كما قطع طوقا سيليكون باستخدام أداة قطع SD صورة ظلية. هذا سمح لنا للسيطرة على أبعاد الغرفة ناعما تدفق للسيطرة على معدل التدفق وإجهاد القص خلال نمو الخلايا. عادة، وقطعت قناة 6.4 ملم 19 ملم واسعة من قبل فترة طويلة من ورقة من السيليكون ملم 0.4. معدل التدفق اللازمة لأجناسالشركة المصرية للاتصالات ليتم احتساب إجهاد القص من 1.0 باسكال (10 DYN / سم 2) على افتراض تدفق الصفحي في قناة مستطيلة مع المعادلة:
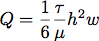
حيث Q هي معدل التدفق، τ هو إجهاد القص، μ هو لزوجة المتوسط، يفترض هنا هي 1.0 ميجا باسكال (0.01 * DYN ثانية / سم 2)، H ارتفاع وث هو العرض للغرفة تدفق .
- تم محاذاة قطعة الأعلى للغرفة مع تدفق حشية في الخلية طبق الثقافة وتأمين مع عصابة المغناطيسي. وقد شغل الجمعية مع ايزوبروبيل (IPA) لتعقيم.
- تم تجميعها في نظام التدفق الكامل. تم ربط المنافذ تدفق في الخلية طبق الثقافة لثلاثي الصمامات. تم توصيل الصمامات لفتح 30 حقنة ملق. تم مسح IPA من خلال النظام الذي كان يغسل بعد ذلك مع 30 مل من المتوسط مكوي مع 4٪ مصل العجل الجنين (FCS). وقد شغل ثم النظام مع 20 مل من المتوسط تكنولوجيز المزيد نمو الخلايا. وضعت أغطية على قمم من الحقن. كان غطاء خزان الحقنة الصيد إبرة في المكان لنقل متوسطة عودة إلى خزان تغذية. كانت تعلق العقيمة مرشحات ميكرون 0.2 إلى مداخل الهواء في أغطية لمنع تلوث النظام. كان غرفة جاهزة للتدفق ثم بذر الخلية.
1،2 خلية ثقافة
- تم شراء خلايا بطانة الأوعية الدموية الوريد السري (في HUVEC) والمتوسطة النمو من تقنيات المزيد (رينسيلار، NY) ونمت لالتقاء في قارورة T25.
- تمت إزالة المتوسطة النمو من القارورة وأحادي الطبقة من الخلايا التي تم إصدارها مع 2 مل من التربسين 2.5٪. مرة واحدة كانت الخلايا في الحل، وتطفئ trypsinization مع إضافة 10 مل من مستنبت الخلية إلى القارورة.
- التم طرد ه التعليق الخلية لمدة 5 دقائق وتمت إزالة طاف. ومعلق الخلايا في 1 مل من مستنبت الخلية (التي تحتوي على مصل) للحقن في غرفة التدفق.
- تم تحميل التعليق الخلية (0.5 مل، = 50،000 الخلايا) في حقنة وحقنها في غرفة تدفق من خلال صمام ثلاثي.
- سمح للخلايا لتسوية الالتزام والركيزة الزجاج لمدة 2 ساعة قبل بدأ التدفق. ونمت الخلايا تحت تدفق في حاضنة عند 37 درجة مئوية لمدة 1 إلى 5 أيام حتى متموجة.
1.3 إعداد الكابولي والمسافة البادئة الخليوي
- تم تنظيف Tipless الكابولي AFM (NanoWorld، سويسرا) في حامض النيتريك لمدة 5 دقائق و functionalized مع triethoxy أمينو سيلاني (APTES) في غرفة ترسيب البخار.
- A حل من 5 ملغ / مل وزنا NHS-LC-سلفو البيوتين في محلول ملح هانك التخزين المؤقت (HBSS) أعدت. وغمرت المياه في الكابولي في حل لمدة 15 دقيقة لconjuبوابة سيلاني مع الكيمياء (NHS) N-Hydroxysuccinimide.
- وقدم حل وسط البيوتين مجانا من احتضان 20 مل من تقنيات المزيد خلية ثقافة المتوسط (بما في ذلك المصل) مع 200 ميكرولتر من الخرز لمدة 12 ساعة streptavadin. تم إزالة حبات من المتوسطة مع المغناطيس وتصفية المتوسطة من خلال مرشح 0.22 ميكرون العقيمة.
- تمت إزالة غرفة تدفق من الخلية طبق الثقافة وتم غسلها الخلايا في 37 ° C البيوتين خالية المتوسط.
- وتم إعداد محلول المخزون من 1 ميكرولتر من 2.4 ميكرومتر الخرز المغلفة مع streptavidin في 1 مل من المتوسط مجانا البيوتين، وإضافة 100 ميكرولتر من الأسهم إلى الخلية طبق الثقافة.
- كان قد تم اعتقالهم الخرز Streptavidin حتى مع ناتئ من الهبوط على سطح تلميح الزجاج بالقرب من التراجع، وحبة، وتحديد المواقع ذروة ناتئ على حبة، ومن ثم الضغط على أسفل ناتئ على عدة ثواني حبة ويستريح ل.
- كان لحساسية ناتئ التدبيرد من الطعج على منطقة من الزجاج عارية واستخدام المنحدر من منحنى لضبط انحراف الطرف بوصفها وظيفة من الجهد.
- ثم تم حساب ثابت الربيع للناتئ من المعايرة الحرارية في البرنامج MFP3D.
- واستخدمت بعد ذلك لمعايرة ناتئ مسافة بادئة للعينات، كما هو مبين في الشكل 2. هذه الخرز 2،4 ميكرومتر توفر مساحة أكبر اتصال مع سطح الخلية بحيث يمكن الكشف عن الخواص الميكانيكية للطبقة ناعمة الكنان السكري. وكان وضعه في ناتئ فوق خلية بالقرب من نواة الخلية ونهج الناعمة تم استخدام تلميح إلى الخلية لضبط ارتفاع حوالي 3 ميكرومتر ناتئ فوق سطح الخلية. تم تعيين البرنامج لمدة 20 الانبعاجات المتكررة بمعدل 1 ميكرومتر / ثانية إلى أقصى قوة من ن ن 7. ما يقرب من 6 ثوانى المنقضي بين اتصالات المتعاقبة. فمن الممكن استخدام معدلات مختلفة من المسافة البادئة لاختبار المعتمدة على الوقت خصائص الكنان السكري، على الرغم من هذه الأولية التجارب، فقط تم استخدام معدل المسافة البادئة واحد (1 ميكرومتر / ثانية).
2. المسافة البادئة نظرية
ويمكن وصف المسافة البادئة إلى مرونة نصف مساحة مع دائرة نصف قطرها R مجال استخدام نظرية هيرتز حيث يتم إعطاء قوة المسافة البادئة، F، عن طريق المعادلة:
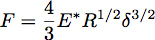
حيث δ هو عمق المسافة البادئة و* E هو معامل تخفيض من المواد تحت الاختبار (الشكل 3). في حالة وجود إندينتر شديدة تؤثر بلا حدود موحدة مرنة نصف الفضاء، وتعطى من قبل E * المعادلة:
3/50163eq3.jpg "/>
حيث E هو معامل المرونة وν هي نسبة بواسون للمادة. وقد ألهم عمل مؤخرا مع الأفلام البلاستيكية ووضع نموذج الطبقة الثانية لتحديد معامل وسمك الأغشية الرقيقة 1. نحن نطبق هذا النموذج لبيولوجيا الخلية عن طريق معالجة الكنان السكري كفيلم موحدة لينة رقيقة على سطح خلايا الجسم. باستخدام هذا النموذج، وانخفاض معامل يصبح النظام:
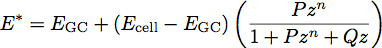
حيث E هو معامل GC من الكنان السكري، E الخلية هي معامل جسم الخلية، P، Q و N هي الثوابت التي تم تحديدها تجريبيا من البوليمر تناسبها، وتعطى من قبل Z المعادلة:
-together.within صفحة = "دائما"> 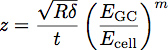
حيث t هو سمك طبقة الكنان السكري. ويرد التخطيطي من هذه المعلمات في الشكل 3. وقد تبين النموذج ليكون وسيلة دقيقة لتحديد معامل وسمك طبقة رقيقة على صلابة الركيزة 1. ويمكن استخدام هذه المعادلة لتناسب منحنيات تم الحصول عليها من المسافة البادئة في الخلايا لتحديد معامل وسمك بطانة الكنان السكري، كما هو موضح في الشكل 4.
النتائج
في تجربة نموذجية، تم الحصول على 20 القوة-VS-المسافة من منحنيات منطقة معينة من الخلية، وعادة في المنطقة محيط بالنواة، القريب، ولكن لم يكن في النواة (داخل ميكرومتر 2 ~). تم تنسيق منحنيات حساب أي انحراف العينة خلال مدة القياس ومن ثم بلغ متوسط الضجيج لإزالة ناتئ، كما ه?...
Discussion
استخدمنا القيم المحسوبة من النموذج طبقتين ونظرية هيرتز في تصميم نموذج التفاعل من الكريات البيض في الدم مع الجدار البطانية. وحسبنا أن زغيبة على الكريات البيض التي يبلغ قطرها 50 نانومتر تحت تحميل PN 10 ونحو 150 نانومتر البادئة في الكنان السكري، سوى جزء ضئيل من مجموع سمك. هذ...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
فإن الكتاب أود أن أشكر ايلينا Lomakina، Bauserman ريتشارد، يانغمان مارغريت، فاكنين شاي، جيسيكا سنايدر، Striemer كريس، ناتاراج ناكول، هونغ تشونغ لى، Khire تيجاس، ولام اريك لمساعدتهم في هذا المشروع. وقد تم تمويل هذا المشروع من قبل المعاهد الوطنية للصحة # 018208 PO1 HL.
Materials
| Name | Company | Catalog Number | Comments |
| اسم الكاشف / المواد | شركة | كتالوج رقم | تعليقات |
| مكوي والمتوسطة | Gibco | 16600-082 | |
| الجنين مصل العجل | Hyclone | SH30070 | |
| البطانية متوسطة نمو الخلايا | المزيد تكنولوجيا | MCDB-131 | |
| تجميع الوريد السري الخلايا البطانية الإنسان | المزيد تكنولوجيا | PHUVEC/T-25 | |
| حمض الكبريتيك | JT بيكر | 9681-02 | |
| ماء الأوكسجين | VWR | BDH3742-1 | |
| (3-أمينو) triethoxysilane | الدريتش | 440140-100ML | |
| الآيزوبروبيل الكحول | VWR | BDH8999-4 | |
| التربسين | Cellgro | 25-054-C1 | |
| هانك محلول الملح التخزين المؤقت | Gibco | 14175-095 | |
| سلفو NHS-LC-البيوتين | الحرارية العلمية | 21335 | |
| الخرز Streptavadin | Dynabeads | 112.06D | |
| MFP-3D AFM | اللجوء بحوث | ||
| Tipless الكابولي | Nanoworld | ARROW-TL1-50 | |
| صورة ظلية SD | Quickutz | صورة ظلية-SD | |
| سيليكون المطاط | ستوكويل Elastomerics | SE50-RS | |
| 30 مل المحاقن | بنتون ديكنسون | 309650 | |
| الإبر قياس 18 | بنتون ديكنسون | 305196 | |
| تمديد مجموعات | هوسبيرا | 4429-48 | |
| 4 طريقة الصمامات | Teleflex | W21372 | |
| قبعات ميناء ذكر / أنثى | سميث الطبية | MX491B | |
| تحوي مضخة | واتسون، مارلو | 401U / D | |
| تحوي أنابيب | واتسون، مارلو | 903.0016.016 | |
| مرشحات معقمة | بظلالها علوم الحياة | 4652 |
References
- Clifford, C., Seah, M. Nanoindentation measurement of young's modulus for compliant layers on stiffer substrates including the effect of poisson's ratios. Nanotechnology. , (2009).
- Gouverneur, M., Spaan, J. A. E., Pannekoek, H., Fontijn, R. D., Vink, H. Fluid shear stress stimulates incorporation of hyaluronan into endothelial cell glycocalyx. Am. J. Physiol. Heart. Circ. Physiol. 290 (1), 458-452 (2006).
- Hocde, S. A., Hyrien, O., Waugh, R. E. Cell adhesion molecule distribution relative to neutrophil surface topography assessed by tirfm. Biophysical Journal. 97 (1), 379-387 (2009).
- Lipowski, H. H. The endothelial glycocalyx as a barrier to leukocyte adhesion and its mediation by extracellular proteases. Annals of biomedical engineering. 40 (4), 840-848 (2012).
- Lu, L., Oswald, S. J., Ngu, H., Yin, F. C. P. Mechanical properties of actin stress fibers in living cells. Biophysical Journal. 95 (12), 6060-6071 (2008).
- Pries, A. R., Secomb, T. W., Gaehtgens, P. The endothelial surface layer. Pflugers Archiv. European Journal of Physiology. 440 (5), 653-666 (2000).
- Spillmann, C. M., Lomakina, E., Waugh, R. E. Neutrophil adhesive contact dependence on impingement force. Biophysical Journal. 87 (6), 4237-4245 (2004).
- vanden Berg, B. M., Vink, H., Spaan, J. A. E. The endothelial glycocalyx protects against myocardial edema. Circulation Research. 92 (6), 592-594 (2003).
- Williams, T. E., Nagarajan, S., Selvaraj, P., Zhu, C. Quantifying the impact of membrane microtopology on effective two-dimensional affinity. J. Biol. Chem. 276 (16), 13283-138 (2001).
- Vink, H., Duling, B. Identification of Distinct Luminal Domains for Macromolecules, Erythrocytes, and Leukocytes Within Mammalian Capillaries. Circulation Research. 79, 581-589 (1996).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved