Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Die Quantifizierung der mechanischen Eigenschaften des Endothelial Glykokalyx mit Atomic Force Microscopy
In diesem Artikel
Zusammenfassung
Die mechanischen Eigenschaften von Endothelzellen Glykokalyx wurden durch Einrückung mit Mikrometer große Kugeln auf AFM Cantilever gemessen. Endothelzellen wurden in einem benutzerdefinierten Kammer unter physiologischen Bedingungen kultiviert, um die Strömung Glykocalix Expression zu induzieren. Daten wurden unter Verwendung eines Dünnfilm-Modell, um die Dicke und Elastizitätsmodul Glykocalix bestimmen.
Zusammenfassung
Unser Verständnis der Wechselwirkung von Leukozyten und der Gefäßwand während Leukozyten-Abscheidung wird durch eine unvollständige Verständnis der mechanischen Eigenschaften des endothelialen Oberflächenschicht begrenzt. Es ist bekannt, dass Adhäsionsmolekülen auf Leukozyten ungleichmäßig relativ Oberflächentopographie 3 verteilt, begrenzt, dass Topographie Klebeverbindung Formation mit anderen Oberflächen 9, und dass physiologische Anpresskräfte (≈ 5,0 bis 10,0 pN pro Mikrovillus) können die Mikrovilli als komprimieren weniger als ein Drittel ihrer Ruhelänge, Erhöhung der Zugänglichkeit von Molekülen an die Gegenfläche 3, 7. Wir betrachten das Endothel als Zwei-Schichtstruktur, der relativ starren Zellkörper, plus der Glykocalix, eine weiche Schutzschicht Zuckerdragierung auf der luminalen Oberfläche 6. Es hat sich gezeigt, dass die Glykocalix kann als eine Barriere, um die Adhäsion von Leukozyten an das Endothel Oberfläche 4 zu reduzieren handeln.In diesem Bericht werden wir damit beginnen, die Verformbarkeit der endothelialen Oberflächen behandeln zu verstehen, wie die endotheliale mechanische Steifigkeit könnte Bindung beeinflussen. Endothelzellen in statischer Kultur gezüchtet nicht Ausdruck eines robusten Glykokalyx, aber Zellen unter physiologischen Strömungsverhältnisse gewachsen beginnen ungefähre dem Glykokalyx in vivo 2 beobachtet. Der Modul der Endothelzelle Körpers gemessen wurde mittels Rasterkraftmikroskopie (AFM) auf etwa 5 bis 20 kPa 5 sein. Die Dicke und Struktur der Glykocalix wurden mittels Elektronenmikroskopie untersucht 8, und der Modulus der Glykocalix wurde approximiert durch indirekte Methoden, aber nach unserem Wissen gibt es keine veröffentlichten Berichten einer direkten Messung der Glykocalix Modulus in lebenden Zellen . In dieser Studie zeigen wir Experimente Einbuchtung mit einem neuartigen AFM-Sonde auf Zellen, die unter Bedingungen kultiviert wurden, um ihre Expression zu ma Glycocalyx zu maximierenke direkte Messungen der Elastizitätsmodul und die Dicke des endothelialen Glykocalix.
Protokoll
Ein. Methoden
1,1 Zelle Flusskammer
Ein Strömungskammer, in Abbildung 1 dargestellt, wurde so konstruiert, dass Zellen unter einer Scherung von 1,0 Pa (10 dyn / cm 2) angebaut werden könnten und dann direkt mit einer Asylum MFP3D AFM (Santa Barbara, CA) transferiert.
- Für 15 min und dann Waschen mit destilliertem Wasser: Die Strömungskammer wurde für den Versuch durch erste Reinigung der Glasträger in Piranhalösung (H 2 O 2 03.01 H 2 SO 4) hergestellt. Sie wurden dann zu backenden trockenen und beschichtet mit Aminopropyltriethoxysilan (APTES) in einem Vakuum-Abscheidungskammer.
- Eine Silikondichtung geschnitten wurde mit einer Silhouette SD Schneidwerkzeug. Dies erlaubte uns, fein steuern die Strömungskammer Dimensionen zur Steuerung der Durchflussmenge und Scherbeanspruchung während des Zellwachstums. Typischerweise wurde eine 6,4 mm breite Kanal von 19 mm Länge aus einem Blech von 0,4 mm geschnitten Silikon. Der Durchfluss erforderlich Gattungente eine Schubspannung von 1,0 Pa (10 dyn / cm 2) wird unter der Annahme berechnet laminare Strömung in einem rechteckigen Kanal mit der Gleichung:
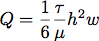
wobei Q die Strömungsrate ist, τ die Scherspannung, μ die Viskosität des Mediums, hier angenommenen bis 1,0 mPa (0,01 dyn * sec / cm 2) ist, h die Höhe und w die Breite der Strömungskammer .
- Das obere Stück der Strömungskammer wurde mit der Dichtung in der Zellkulturschale ausgerichtet und befestigt mit einem Magnetring. Die Anordnung wurde mit Isopropylalkohol (IPA) für die Sterilisation gefüllt.
- Der vollständige Flow-System montiert wurde. Die Strömungsöffnungen in der Zellkulturschale wurden Dreiwegeventile verbunden. Die Ventile wurden mit 30 ml Spritze öffnens. IPA wurde durch das System, das dann mit 30 ml McCoy-Medium mit 4% fötales Kälberserum (FCS) gewaschen wurde gespült. Das System wurde dann mit 20 ml der Vec Technologies Zellwachstumsmedium gefüllt. Covers wurden auf den Gipfeln der Spritzen gesetzt. Der Auffangbehälter Spritzenkappe hatte eine Nadel im Ort bis mittlere zurück an den Vorratsraum. Sterile 0,2 um Filter wurden auf den Lufteinlässen in den Deckeln angebracht, um eine Kontamination des Systems zu verhindern. Die Flusskammer war dann bereit für die Zell-Aussaat.
1,2 Cell Culture
- Menschliche Nabelschnurvenen-Endothelzellen (HUVEC'S) und Wachstumsmedium wurden aus Vec Technologies gekauft (Rensselaer, NY) und bis zur Konfluenz in einer T25-Flasche.
- Das Wachstumsmedium wurde aus dem Kolben und der Monoschicht der Zellen mit 2 ml 2,5% Trypsin entfernt freigesetzt. Sobald die Zellen in Lösung waren, wurde die Trypsinierung durch Zugabe von 10 ml Zellkulturmedium in den Kolben gequencht.
- The Zellsuspension wurde 5 Minuten zentrifugiert und der Überstand wurde entfernt. Die Zellen wurden in 1 ml Zellkulturmedium (mit Serum) zur Injektion in die Strömungskammer resuspendiert.
- Die Zellsuspension (0,5 ml, ~ 50.000 Zellen) wurde in eine Spritze gefüllt und in die Strömungskammer durch eine Drei-Wege-Ventil.
- Die Zellen konnten sich absetzen und sich an dem Glassubstrat für 2 Stunden vor dem Flow wurde gestartet. Die Zellen wurden unter Strömungsbedingungen in einem Inkubator bei 37 ° C für 1 bis 5 Tage bis zur Konfluenz.
1,3 Cantilever Vorbereitung und Cell Einzug
- Spitzenlose AFM Kragarme (NanoWorld, Schweiz) wurden in Salpetersäure für 5 min gereinigt und funktionalisiert mit Aminopropyltriethoxysilan (APTES) in einer Dampfabscheidungskammer.
- Eine Lösung von 5 mg / ml NHS Gew.-Sulfo-LC-Biotin in gepufferte Salz Hanks-Lösung (HBSS) wurde hergestellt. Die Ausleger wurden in die Lösung für 15 min bis konjugierte untergetauchtenTor das Silan mit N-Hydroxysuccinimid (NHS) Chemie.
- Eine Lösung von Biotin freiem Medium wurde durch Inkubation 20 ml Vec Technologies Zellkulturmedium (einschließlich Serum) mit 200 ul Streptavadin Perlen für 12 Stunden hergestellt. Die Perlen wurden vom Medium mit einem Magnet entfernt und das Medium wurde durch einen 0,22 um Sterilfilter filtriert.
- Die Strömungskammer wurde aus der Zellkulturschale entnommen und die Zellen wurden in 37 ° C Biotin-freien Medium gewaschen.
- Eine Stammlösung von 1 ul 2,4 um Perlen mit Streptavidin in 1 ml Biotin Medium beschichtet war bereit, und 100 ul der Aktie wurde auf der Zellkulturschale aufgenommen.
- Streptavidin-Beads wurden mit dem Ausleger von der Landung die Spitze auf der Glasoberfläche neben einer Sicke, Zurückziehen, Positionieren der Spitze des Auslegers über den Wulst und dann Drücken des Auslegers nach unten auf die Sicke und ruhenden für mehrere Sekunden aufgenommen.
- Die Empfindlichkeit des Auslegers war Maßnahmed durch Einrücken auf einen Bereich aus blankem Glas und unter Verwendung der Steigung der Kurve, um die Auslenkung der Spitze als eine Funktion der Spannung eingestellt.
- Die Federkonstante des freitragenden wurde dann aus einem thermischen Kalibrierung im MFP3D Software berechnet.
- Der kalibrierte Cantilever wurde dann verwendet, um Gedankenstrich der Proben, wie in Abbildung 2 dargestellt. Diese 2,4 um Perlen bieten eine größere Kontaktfläche mit der Zelloberfläche so dass die mechanischen Eigenschaften der weichmagnetischen Schicht Glykocalix detektiert werden kann. Der Cantilever wurde über eine Zelle nahe dem Zellkern und einem weichen Ansatz der Spitze auf der Zelle wurde verwendet, um den Cantilever Höhe etwa 3 um oberhalb der Zelloberfläche gesetzt positioniert. Die Software wurde für 20 wiederholt Vertiefungen mit einer Rate von 1 um / sec auf eine maximale Kraft von 7 nN eingestellt. Ungefähr 6 Sekunden zwischen den aufeinanderfolgenden Kontakten vergangen. Es ist möglich, unterschiedliche Raten der Einbuchtung verwenden, um für zeitabhängigen Eigenschaften der Glykocalix testen, obwohl in diesen anfänglichen Versuche, lediglich eine einzige Einbuchtung Rate (1 um / sec) wurde verwendet.
2. Einrückung Theory
Einbuchtung in einen elastischen Halbraum mit einer Kugel mit dem Radius R kann unter Verwendung Hertz Theorie wo die Kraft der Einbuchtung, F, durch die Gleichung gegeben ist:
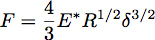
Wobei δ die Eindringtiefe und E * die reduzierte Modul des Materials unter Test (Abbildung 3). Im Falle einer unendlich steif Eindringkörper Aufprallen eines einheitlichen elastischen Halbraum wird E * nach folgender Formel berechnet:
3/50163eq3.jpg "/>
wobei E der Elastizitätsmodul und ν ist die Poisson-Verhältnis des Materials. Neuere Arbeiten mit Polymerfilmen wurde die Entwicklung einer zweischichtigen Modell zur Bestimmung des Moduls und der Dicke von dünnen Filmen 1 angeregt. Wir wenden dieses Modell auf Zellbiologie durch Behandeln der Glykocalix als einheitliche dünne weiche Folie auf der Oberfläche der Zelle Körper. Mit diesem Modell wird der reduzierte Elastizitätsmodul des Systems:
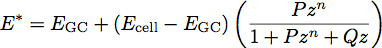
Wobei E GC der Modul des Glykokalyx ist, E Zelle der Modul des Zellkörpers ist, P, Q und n Konstanten sind, der empirisch aus dem Polymer passt bestimmt, und z durch die folgende Gleichung gegeben:
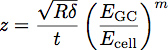
Wobei t die Dicke der Schicht Glykocalix. Eine schematische Darstellung dieser Parameter wird in 3 gezeigt. Das Modell wurde gezeigt, dass eine genaue Methode zur Bestimmung des Moduls und der Dicke eines dünnen Films auf Substrat 1 steifer sein. Diese Gleichung kann verwendet werden, um die Kurven aus Einbuchtung in Zellen erhalten passen, um den Modul und die Dicke des endothelialen Glycocalyx zu bestimmen, wie in Abbildung 4 dargestellt.
Ergebnisse
In einem typischen Experiment wurden 20 Kraft-gegen-Entfernungskurven aus einem gegebenen Bereich der Zelle erhalten wird, typischerweise in der perinukleären Region, in der Nähe, aber nicht auf, den Kern (innerhalb ~ 2 um). Die Kurven wurden zur Berücksichtigung eines Probe Drift über die Dauer der Messung ausgerichtet und dann gemittelt, um Geräusche zu entfernen Cantilever, wie in Abbildung 4 dargestellt. Die Kurven wurden analysiert und passen mit den zwei Schichten-Modell, das zur Bestimmung d...
Diskussion
Wir verwendeten Werte aus dem Zwei-Schichten-Modells und Hertz Theorie, um die Wechselwirkung eines Leukozyten im Blut zirkulierenden Endothelzellen mit der Wand Modell berechnet. Wir haben errechnet, daß eine auf der Mikrovillus Leukozyten mit einem Durchmesser von 50 nm unter einer 10 pN Last würde Gedankenstrich etwa 150 nm in die Glykocalix, nur einen Bruchteil der Gesamtdicke. Dies zeigt an, dass der Glykocalix, mit Eigenschaften wie in diesem Experiment gemessen, eine erhebliche Barriere für Zell-Zell-Wechselwi...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Autoren bedanken sich bei Elena Lomakina, Richard Bauserman, Margaret Youngman, Shay Vaknin, Jessica Snyder, Chris Striemer, Nakul Nataraj, Hung Li Chung, Tejas Khire und Eric Lam für ihre Unterstützung bei diesem Projekt danken. Dieses Projekt wurde durch die NIH # PO1 HL 018208 finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenz / Material | Firma | Catalog Number | Kommentare |
| McCoy-Medium | Gibco | 16600-082 | |
| Fetal Calf Serum | Hyclone | SH30070 | |
| Endothelial Cell Growth Medium | Vec Technologies | MCDB-131 | |
| Gepoolten menschlichen Nabelschnur-Endothelzellen | Vec Technologies | PHUVEC/T-25 | |
| Schwefelsäure | JT Baker | 9681-02 | |
| Wasserstoffperoxid | VWR | BDH3742-1 | |
| (3-Aminopropyl) triethoxysilan | Aldrich | 440.140-100ML | |
| Isopropylalkohol | VWR | BDH8999-4 | |
| Trypsin | Cellgro | 25-054-C1 | |
| Hanks Buffered Salt Solution | Gibco | 14175-095 | |
| Sulfo-NHS-LC-Biotin | Thermo Scientific | 21335 | |
| Streptavadin Perlen | Dynabeads | 112.06D | |
| MFP-3D AFM | Asylum Research | ||
| Spitzenlose Cantilevers | Nanowelt | ARROW-TL1-50 | |
| Silhouette SD | Quickutz | Silhouette-SD | |
| Silicone Rubber | Stockwell Elastomerics | SE50-RS | |
| 30 ml Spritzen | Benton Dickinson | 309650 | |
| 18 Gauge-Nadeln | Benton Dickinson | 305196 | |
| Erweiterung Sets | Hospira | 4429-48 | |
| 4-Wege-Ventile | Teleflex | W21372 | |
| Male / Female Hafen Caps | Smiths Medical | MX491B | |
| Schlauchpumpen | Watson-Marlow | 401U / D | |
| Schlauchpumpen Tubing | Watson-Marlow | 903.0016.016 | |
| Sterilfilter | Pall Life Science | 4652 |
Referenzen
- Clifford, C., Seah, M. Nanoindentation measurement of young's modulus for compliant layers on stiffer substrates including the effect of poisson's ratios. Nanotechnology. , (2009).
- Gouverneur, M., Spaan, J. A. E., Pannekoek, H., Fontijn, R. D., Vink, H. Fluid shear stress stimulates incorporation of hyaluronan into endothelial cell glycocalyx. Am. J. Physiol. Heart. Circ. Physiol. 290 (1), 458-452 (2006).
- Hocde, S. A., Hyrien, O., Waugh, R. E. Cell adhesion molecule distribution relative to neutrophil surface topography assessed by tirfm. Biophysical Journal. 97 (1), 379-387 (2009).
- Lipowski, H. H. The endothelial glycocalyx as a barrier to leukocyte adhesion and its mediation by extracellular proteases. Annals of biomedical engineering. 40 (4), 840-848 (2012).
- Lu, L., Oswald, S. J., Ngu, H., Yin, F. C. P. Mechanical properties of actin stress fibers in living cells. Biophysical Journal. 95 (12), 6060-6071 (2008).
- Pries, A. R., Secomb, T. W., Gaehtgens, P. The endothelial surface layer. Pflugers Archiv. European Journal of Physiology. 440 (5), 653-666 (2000).
- Spillmann, C. M., Lomakina, E., Waugh, R. E. Neutrophil adhesive contact dependence on impingement force. Biophysical Journal. 87 (6), 4237-4245 (2004).
- vanden Berg, B. M., Vink, H., Spaan, J. A. E. The endothelial glycocalyx protects against myocardial edema. Circulation Research. 92 (6), 592-594 (2003).
- Williams, T. E., Nagarajan, S., Selvaraj, P., Zhu, C. Quantifying the impact of membrane microtopology on effective two-dimensional affinity. J. Biol. Chem. 276 (16), 13283-138 (2001).
- Vink, H., Duling, B. Identification of Distinct Luminal Domains for Macromolecules, Erythrocytes, and Leukocytes Within Mammalian Capillaries. Circulation Research. 79, 581-589 (1996).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten