È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Quantificare le proprietà meccaniche del glicocalice endoteliale con microscopia a forza atomica
In questo articolo
Riepilogo
Le caratteristiche meccaniche del glicocalice endoteliale sono state misurate utilizzando sfere indentazione micron di dimensioni su cantilever AFM. Le cellule endoteliali sono state coltivate in una camera personalizzata in condizioni fisiologiche di flusso per indurre l'espressione glicocalice. I dati sono stati analizzati utilizzando un modello di pellicola sottile per determinare lo spessore glicocalice e modulo.
Abstract
Nostra comprensione dell'interazione dei leucociti e la parete del serbatoio durante la cattura dei leucociti è limitata da una non completa comprensione delle proprietà meccaniche dello strato di superficie endoteliale. È noto che molecole di adesione sui leucociti sono distribuite in modo non uniforme rispetto alla superficie topografia 3, che limita la formazione topografia adesivo legame con altre superfici 9, e che le forze di contatto fisiologici (≈ 5,0-10,0 pN per microvillus) può comprimere i microvilli come meno un terzo della loro lunghezza a riposo, aumentando l'accessibilità di molecole alla superficie opposta 3, 7. Consideriamo l'endotelio come struttura a due strati, il corpo cellulare relativamente rigido, più il glicocalice, un rivestimento morbido zucchero protettivo sulla superficie luminale 6. E 'stato dimostrato che il glicocalice può agire come una barriera per ridurre l'adesione dei leucociti al 4 superficie endoteliale.In questa relazione si comincia ad affrontare la deformabilità delle superfici endoteliali per capire come la rigidità meccanica endoteliale potrebbe influenzare la formazione del legame. Le cellule endoteliali in coltura statica non esprimono un glicocalice robusta, ma le cellule cresciute in condizioni di flusso fisiologiche cominciano ad approssimare il glicocalice osservate in vivo 2. Il modulo del corpo cellulare endoteliale è stata misurata utilizzando la microscopia a forza atomica (AFM) da circa 5 a 20 kPa 5. Lo spessore e la struttura del glicocalice sono stati studiati mediante microscopia elettronica 8, e il modulo del glicocalice è stato calcolato utilizzando metodi indiretti, ma a nostra conoscenza, non ci sono stati rapporti pubblicati di una misura diretta del modulo glicocalice in cellule viventi . In questo studio, presentiamo indentazione esperimenti effettuati con una nuova sonda AFM sulle cellule che sono state coltivate in condizioni di massimizzare la loro espressione di glicocalice make misurazioni dirette del modulo e lo spessore del glicocalice endoteliale.
Protocollo
1. Metodi
1,1 Cella camera di flusso
Una camera di flusso, illustrato in figura 1, è stato costruito in modo che le cellule possono essere coltivate in un taglio di 1,0 Pa (10 dyn / cm 2) e poi trasferita direttamente a un AFM Asylum MFP3D (Santa Barbara, CA).
- La camera di flusso è stato preparato per l'esperimento prima pulizia dei vetrini in soluzione Piranha (3:1 H 2 SO 4: H 2 O 2) per 15 min e poi lavando con acqua distillata. Essi sono stati poi cotto a secco e rivestita con trietossi amminopropil silano (APTES) in una camera di deposizione sotto vuoto.
- Una guarnizione in silicone è stato tagliato con un utensile da taglio Silhouette SD. Questo ha permesso di controllare con precisione le dimensioni della camera di flusso per il controllo della portata e sollecitazione di taglio durante la crescita cellulare. Tipicamente, un canale è stato tagliato 6,4 millimetri di larghezza per 19 mm di lunghezza da un foglio di silicone 0,4 mm. La portata necessaria per generite una sollecitazione di taglio di 1,0 Pa (10 dyn / cm 2) è calcolato assumendo flusso laminare in un canale rettangolare con l'equazione:
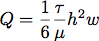
dove Q è la portata, τ è la tensione tangenziale, μ è la viscosità del mezzo, assume qui per essere 1,0 mPa (0,01 sec * dyn / cm 2), h è l'altezza e w è la larghezza della camera di flusso .
- La parte superiore della camera di flusso è stata allineata con la guarnizione nella piastra di coltura cellulare e fissato con un anello magnetico. Il gruppo è stato riempito con alcol isopropilico (IPA) per la sterilizzazione.
- Il sistema a flusso totale è stato assemblato. Le porte di flusso nella piastra di coltura cellulare sono stati collegati a tre vie. Le valvole sono state collegate ad aprire siringa da 30 mls. IPA è stato lavato attraverso il sistema, che è stato poi lavato con 30 ml di mezzo di McCoy con 4% di siero fetale bovino (FCS). Il sistema è stato riempito con 20 ml di mezzo di crescita cellulare Vec Technologies. Copertine sono stati collocati sulle cime delle siringhe. Il tappo del serbatoio cattura siringa aveva un ago in atto per spostare il supporto al serbatoio di alimentazione. 0,2 micron filtri sterili erano attaccati alle prese d'aria dei coperchi per evitare la contaminazione del sistema. La camera di flusso è quindi pronto per semina cellulare.
1,2 Colture Cellulari
- Cellule endoteliali della vena ombelicale (HUVEC) e terreno di coltura sono stati acquistati da Technologies Vec (Rensselaer, NY) e coltivate a confluenza in una beuta T25.
- Il mezzo di crescita è stato rimosso dal pallone e il monostrato di cellule rilasciate con 2 ml di 2,5% tripsina. Una volta che le cellule erano in soluzione, la tripsinizzazione è stata bloccata con l'aggiunta di 10 ml di mezzo di coltura cellulare al pallone.
- Thsospensione cellulare è stata centrifugata e per 5 minuti ed il surnatante è stato rimosso. Le cellule sono state risospese in 1 ml di mezzo di coltura cellulare (contenente siero) per l'iniezione nella camera di flusso.
- La sospensione cellulare (0,5 ml, ~ 50.000 cellule) è stato caricato in una siringa e iniettato nella camera di flusso attraverso una valvola a tre vie.
- Le cellule sono state lasciate sedimentare e aderire al substrato di vetro per 2 h prima di flusso è stato avviato. Le cellule sono state cresciute in condizioni di flusso in un incubatore a 37 ° C per 1 a 5 giorni fino confluenti.
1.3 Preparazione a sbalzo e rientro cellulare
- Tipless cantilever AFM (nanomondo, Svizzera) sono stati puliti in acido nitrico per 5 min e funzionalizzato con amminopropil trietossi silano (APTES) in una camera di deposizione vapore.
- Una soluzione di 5 mg / ml in peso NHS-solfo-LC-biotina in soluzione salina tamponata di Hank (HBSS) è stato preparato. I cantilever sono stati immersi nella soluzione per 15 minuti per coniugatocancello il silano con N-Hydroxysuccinimide (NHS) chimica.
- Una soluzione di mezzo di biotina libera è stata effettuata incubando 20 ml di mezzo di coltura cellulare Vec Technologies (compreso il siero) con 200 microlitri di perline streptavadin per 12 hr. Le perle sono state rimosse dal mezzo di magnete e il mezzo è stato filtrato attraverso un filtro di 0,22 micron sterile.
- La camera di flusso è stato rimosso dalla piastra di coltura cellulare e le cellule sono state lavate in 37 ° C biotina medie.
- Una soluzione stock di 1 ml di 2,4 micron perle rivestite con streptavidina in 1 ml di mezzo di biotina libera è stato preparato, e 100 pl di magazzino sono stati aggiunti alla piastra di coltura cellulare.
- Perline streptavidina stati prelevati con il cantilever di atterraggio della punta sulla superficie del vetro accanto ad un tallone, ritrarre, posizionando l'apice del cantilever sul tallone, e quindi premendo il cantilever giù sulle secondo tallone e di riposo per diversi.
- La sensibilità della misura era cantileverd indentando su una regione di vetro nuda e utilizzando la pendenza della curva di impostare la deflessione punta in funzione della tensione.
- La costante elastica del cantilever stato quindi calcolato da una calibrazione termica nel software MFP3D.
- Il cantilever calibrato è stato poi utilizzato per rientro dei campioni, come mostrato in Figura 2. Queste perle 2,4 micron offrono una maggiore superficie di contatto con la superficie cellulare in modo che le proprietà meccaniche dello strato morbido glicocalice può essere rilevato. Il cantilever è stato posizionato sopra una cella vicino al nucleo cellulare e un approccio morbido del puntale nella cella è stato usato per impostare l'altezza a sbalzo circa 3 micron sopra la superficie cellulare. Il software è stato impostato per 20 rientranze ripetute ad una velocità di 1 um / sec ad una forza massima di 7 nN. Circa 6 secondi trascorsi tra i contatti successivi. È possibile utilizzare diversi tassi di rientro per verificare dipendenti dal tempo proprietà del glicocalice, anche se in questi primi esperimenti, solo un tasso rientranza singola (1 um / sec) è stato usato.
2. Teoria indentazione
Rientro in un semispazio elastico con una sfera di raggio R possono essere descritti usando teoria di Hertz in cui viene data la forza di rientro, F, mediante l'equazione:
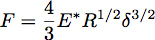
Dove δ è la profondità di penetrazione e * E è il modulo ridotto del materiale in prova (Figura 3). Nel caso di un penetratore infinitamente rigida interferire uniforme elastica semispazio, E * è data dall'equazione:
3/50163eq3.jpg "/>
dove E è il modulo elastico e ν è il rapporto di Poisson del materiale. Recente lavoro con polimero film ha ispirato lo sviluppo di un modello a due strati per la determinazione del modulo e lo spessore di film sottili 1. Stiamo applicando questo modello alla biologia cellulare trattando il glicocalice come una pellicola sottile uniforme morbido sulla superficie del corpo cellulare. Utilizzando questo modello, il modulo ridotta del sistema diventa:
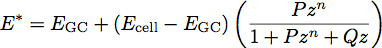
Dove E è il modulo GC del glicocalice, cella E è il modulo del corpo cellulare, P, Q ed n sono costanti che sono stati determinati empiricamente dal polimero adatto, e Z è data dall'equazione:
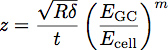
Dove t è lo spessore dello strato di glicocalice. Uno schema di questi parametri è mostrato in Figura 3. Il modello è stato dimostrato di essere un modo accurato per determinare il modulo e lo spessore di una pellicola sottile su substrato rigido 1. Questa equazione può essere utilizzata per adattare le curve ottenute dal rientro in cellule per determinare il modulo e lo spessore del glicocalice endoteliale, come mostrato in Figura 4.
Risultati
In un esperimento tipico, 20 forza-vs-distanza curve sono state ottenute da una data regione della cellula, tipicamente nella regione perinucleare, vicino, ma non, il nucleo (entro ~ 2 micron). Le curve sono state allineate per tenere conto di qualsiasi deriva campione per tutta la durata della misurazione e poi mediati per rimuovere il rumore cantilever, come mostrato in Figura 4. Le curve sono state analizzate e forma con il modello a due strati che è stato sviluppato per la determinazione del modulo...
Discussione
Abbiamo usato valori calcolati dal modello a due strati e teoria Hertz per modellare l'interazione di un leucociti circolanti nel sangue con la parete endoteliale. Abbiamo calcolato che un microvillus sulla leucociti con un diametro di 50 nm sotto un carico di 10 pN sarebbe trattino circa 150 nm nel glicocalice, solo una frazione dello spessore totale. Ciò indica che il glicocalice, con proprietà misurate in questo esperimento, è una barriera significativa interazione cellula-cellula e può essere un grande ostac...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Gli autori desiderano ringraziare Elena Lomakina, Richard Bauserman, Margaret Youngman, Shay Vaknin, Jessica Snyder, Chris Striemer, Nakul Nataraj, Hung Li Chung, Tejas Khire, e Eric Lam per la loro assistenza in questo progetto. Questo progetto è stato finanziato dal NIH # PO1 HL 018208.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente / materiale | Azienda | Numero di catalogo | Commenti |
| Mezzo di McCoy | Gibco | 16600-082 | |
| Fetal Calf Serum | Hyclone | SH30070 | |
| Cellule endoteliali terreno di crescita | Vec Technologies | MCDB-131 | |
| Pool umani ombelicale cellule endoteliali Vena | Vec Technologies | PHUVEC/T-25 | |
| Acido solforico | JT Baker | 9681-02 | |
| Perossido di idrogeno | VWR | BDH3742-1 | |
| (3-amminopropil) triethoxysilane | Aldrich | 440140-100ML | |
| Alcool isopropilico | VWR | BDH8999-4 | |
| Tripsina | Cellgro | 25-054-C1 | |
| Sale di Hank soluzione tamponata | Gibco | 14175-095 | |
| solfo-NHS-LC-biotina | Thermo Scientific | 21335 | |
| Streptavadin perline | Dynabeads | 112.06D | |
| MFP-3D AFM | Asylum Research | ||
| Mensole Tipless | Nanomondo | ARROW-TL1-50 | |
| Silhouette SD | Quickutz | Silhouette-SD | |
| Gomma di silicone | Stockwell elastomeri | SE50-RS | |
| 30 ml Siringhe | Benton Dickinson | 309650 | |
| Calibro 18 aghi | Benton Dickinson | 305196 | |
| Set di estensione | Hospira | 4429-48 | |
| 4 vie | Teleflex | W21372 | |
| Maschio / femmina Port Caps | Smith Medical | MX491B | |
| Pompa peristaltica | Watson-Marlow | 401U / D | |
| Tubi peristaltica | Watson-Marlow | 903.0016.016 | |
| filtri sterili | Pall Life Science | 4652 |
Riferimenti
- Clifford, C., Seah, M. Nanoindentation measurement of young's modulus for compliant layers on stiffer substrates including the effect of poisson's ratios. Nanotechnology. , (2009).
- Gouverneur, M., Spaan, J. A. E., Pannekoek, H., Fontijn, R. D., Vink, H. Fluid shear stress stimulates incorporation of hyaluronan into endothelial cell glycocalyx. Am. J. Physiol. Heart. Circ. Physiol. 290 (1), 458-452 (2006).
- Hocde, S. A., Hyrien, O., Waugh, R. E. Cell adhesion molecule distribution relative to neutrophil surface topography assessed by tirfm. Biophysical Journal. 97 (1), 379-387 (2009).
- Lipowski, H. H. The endothelial glycocalyx as a barrier to leukocyte adhesion and its mediation by extracellular proteases. Annals of biomedical engineering. 40 (4), 840-848 (2012).
- Lu, L., Oswald, S. J., Ngu, H., Yin, F. C. P. Mechanical properties of actin stress fibers in living cells. Biophysical Journal. 95 (12), 6060-6071 (2008).
- Pries, A. R., Secomb, T. W., Gaehtgens, P. The endothelial surface layer. Pflugers Archiv. European Journal of Physiology. 440 (5), 653-666 (2000).
- Spillmann, C. M., Lomakina, E., Waugh, R. E. Neutrophil adhesive contact dependence on impingement force. Biophysical Journal. 87 (6), 4237-4245 (2004).
- vanden Berg, B. M., Vink, H., Spaan, J. A. E. The endothelial glycocalyx protects against myocardial edema. Circulation Research. 92 (6), 592-594 (2003).
- Williams, T. E., Nagarajan, S., Selvaraj, P., Zhu, C. Quantifying the impact of membrane microtopology on effective two-dimensional affinity. J. Biol. Chem. 276 (16), 13283-138 (2001).
- Vink, H., Duling, B. Identification of Distinct Luminal Domains for Macromolecules, Erythrocytes, and Leukocytes Within Mammalian Capillaries. Circulation Research. 79, 581-589 (1996).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon