Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Atomik Kuvvet Mikroskobu ile Endotelyal Glycocalyx Mekanik Özelliklerinin nicel
Bu Makalede
Özet
Endotel glycocalyx mekanik özellikleri AFM konsollar üzerine mikron boyutlu küreler kullanarak girinti ile ölçüldü. Endotel hücreleri glycocalyx ifadesi neden fizyolojik akış koşullarında özel bir odasında kültüre edildi. Veri glycocalyx kalınlık ve modül belirlemek için, ince bir film model kullanılarak analiz edildi.
Özet
Lökositler ve lökosit çekme sırasında damar duvarının etkileşimin anlaşılmasına endotel yüzey tabakasının mekanik özellikleri eksik bir anlayış ile sınırlıdır. Bu lökosit adezyon moleküllerinin yüzey topografyası 3 göreli olmayan düzgün yayılı olduğu bilinmektedir, bu topografya diğer yüzeyleri 9 yapışkan bağ oluşumu sınırlar ve fizyolojik temas kuvvetleri (≈ 5,0 - mikrovillus başına 10.0 pN) olarak mikrovilluslar sıkıştırabilir karşıt yüzeyi 3, 7 ila moleküllerin yönelik artan istirahat uzunluğunun üçte biri kadar biraz. Bir iki-tabakalı yapı, nispeten sert hücre gövdesi, artı glycocalyx, lümen yüzeyi 6 üzerinde bir koruyucu yumuşak bir şeker kaplama gibi endotelyum düşünün. Bu glycocalyx endotel yüzeyi 4 lökositlerin yapışmasını azaltmak için bir engel olarak hareket edebilir olduğu gösterilmiştir.Bu yazıda endotel mekanik sertliği bağ oluşumu nasıl etkileyeceğini anlamak için endotel yüzeyler deformabilitesi ele başlar. Statik kültüründe yetişen Endotel hücreleri sağlam glycocalyx ifade etmezler, ancak fizyolojik akış koşullarında yetiştirilen hücreler in vivo 2 gözlenen yaklaşık glycocalyx başlar. Endotel hücre vücudun modülü yaklaşık 5 ila 20 kPa 5 olmak atomik kuvvet mikroskobu (AFM) kullanılarak ölçülmüştür. Glycocalyx kalınlığı ve yapısı elektron mikroskobu 8 kullanılarak çalışılmıştır ve glycocalyx bir modülü dolaylı yöntemler kullanılarak yaklaştırılır olmuştur, ama bildiğimiz kadarıyla, canlı hücreler içerisinde glycocalyx modülü doğrudan ölçüm yayımlanmış bir rapor olmamıştır . Bu çalışmada, biz ma kendi glycocalyx ifade maksimize etmek koşullarda kültüre edilmiştir hücreleri üzerine bir roman AFM probe ile yapılan girinti deneyler sunmakendotel glycocalyx bir modülü ve kalınlığı ke doğrudan ölçümler.
Protokol
1. Yöntemler
1.1 Hücre Akış Odası
Hücreler 1.0 Pa (10 dyn / cm 2) bir makaslama altında yetiştirilir ve daha sonra bir Sı MFP3D AFM (Santa Barbara, CA) ile doğrudan transfer edilebilir böylece Şekil 1'de gösterildiği gibi, akış bölme, inşa edildi.
- 15 dakika boyunca ve daha sonra damıtılmış su ile yıkama: akış bölme birinci pirana çözeltisi (H2O 03:01 2 H 2 SO 4) cam slaytlar temizleme ile deney için hazırlanmıştır. Daha sonra pişmiş edildi kuru ve bir vakum biriktirme odasında silan aminopropil triethoxy (APTES) ile kaplı.
- Bir silikon conta bir Silhouette SD kesici alet kullanılarak kesildi. Bu bize ince hücre büyümesi sırasında akış hızı ve makaslama stres kontrolü için akış odasının boyutlarını denetlemek için izin verdi. Tipik olarak, bir kanal 0,4 mm silikon bir tabaka, uzun 19 mm genişliğinde 6,4 mm kesildi. Cins için gerekli olan akış hızıte 1,0 Pa (10 dyn / cm 2) bir kayma gerilmesi denklemi ile dikdörtgen bir kanalda laminer akış olduğu varsayılarak hesaplanır:
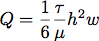
Q akış hızıdır, τ makaslama gerilmesi, μ, ortamın viskozitesi olan 1.0 MPa (0.01 * sn dyn / cm 2) olduğu kabul burada, h yükseklik ve w akış odasının genişliği .
- Akış odasının üst parça hücre kültürü çanağı içinde conta ile hizalanmış ve bir manyetik halka ile tespit edildi. Montaj sterilizasyon için izopropil alkol (IPA) ile doluydu.
- Tam akış sistemi monte edildi. Hücre kültürü çanak akış portu üç yollu vanalar bağlanmıştır. Vanalar 30 ml şırınga açmak bağlanmıştırs. IPA sonra% 4 Fetal Buzağı Serumu (FCS) ile McCoy ortam, 30 ml ile yıkandı sistemi yoluyla yıkandı. Sistem daha sonra Vec Technologies hücre büyüme ortamı 20 ml ile dolduruldu. Kapaklar şırınga üstleri üzerine yerleştirildi. Catch rezervuar şırınga kapağını yem deposuna geri orta taşımak yerine bir iğne vardı. Steril 0.2 um filtre sisteminin kirlenmesini önlemek için kapak içinde hava girişleri bağlanmıştır. Akış odasının sonra hücre ekimi için hazır.
1.2 Hücre Kültürü
- İnsan umbilikal ven endotel hücreleri (HUVEC) 'ın ve büyüme orta Vec Technologies satın (Rensselaer, NY) ve T25 Flask izdiham yetiştirilmiştir.
- Büyüme ortamı şişeye% 2.5 tripsin ve 2 ml ile serbest hücrelerin tek tabaka çıkarıldı. Hücrelerin çözelti içinde sağlandıktan sonra tripsinizasyonla şişeye hücre kültür ortamı 10 ml ilavesi ile söndürülmüştür.
- ThE hücre süspansiyonu 5 dakika boyunca santrifüj edildi ve süpernatan ayrılmıştır. Hücreler, akış bölme içine enjeksiyon için hücre kültürü ortamı (serum içeren) 1 ml içinde tekrar süspanse edildi.
- Hücre süspansiyonu (0.5 ml, ~ 50.000 hücre) bir şırınga içine yüklenmiş ve bir üç yollu valf içinden akış bölmesi içine enjekte edildi.
- Hücreler akış başlatılmasından önce 2 saat için yerleşmek ve cam substrat yapışma izin verildi. Hücreler 37 küvözde akışı altında yetiştirilen ° 1 ile 5 gün boyunca C konfluent kadar.
1.3 Cantilever Hazırlama ve Hücre Girinti
- Tipless AFM konsol (NanoWorld, İsviçre) 5 dk için nitrik asit temizliği ve buhar biriktirme odasında silan aminopropil triethoxy (APTES) ile fonksiyonelleştirilmiş edildi.
- 5 Hank Tamponlu Tuz Çözeltisi içinde (HBSS) hazırlandı ağırlık NHS-sülfo-LC-biotin ile mg / ml 'lik bir çözelti. Çıkma konjuge etmek için 15 dakika için çözelti içine daldırılmış edildikapı N-hidroksisüksinimid (NHS) kimya ile silan.
- Biotin içermeyen aracı madde içindeki bir çözeltisi, 12 saat boyunca streptavadin boncuk 200 ul ile Vec Technologies hücre kültür ortamı (serum içeren) 20 ml inkübe edilerek yapıldı. Boncuklar bir mıknatıs ile ortamdan uzaklaştırılmış ve ortam bir 0.22 um steril filtre içinden süzülmüştür.
- Akış bölme hücre kültürü çanağı çıkartılmış ve hücreler 37 ° C de biyotin içermeyen aracı madde içinde yıkanmıştır.
- Biotin içermeyen aracı madde 1 ml streptavidin ile kaplanmış 2.4 mikron boncuk 1 ul bir stok çözeltisi hazırlanmış ve stok 100 ul hücre kültür kabına ilave edildi.
- Streptavidin boncuk, bir boncuk, geri çekme yanındaki cam yüzey üzerinde ucu iniş boncuk üzerinde konsolun apeks konumlandırma ve ardından boncuk ve dinlenme birkaç saniye üzerine konsol aşağı basarak konsol ile tutuklandılar.
- Konsolun hassasiyeti tedbirçıplak cam bir bölge üzerine girinti ve voltajın bir fonksiyonu olarak uç sapma belirlemek için eğrisinin eğimi kullanılarak d.
- Konsolun yay sabiti sonra MFP3D yazılım bir termal kalibrasyon hesaplandı.
- Şekil 2'de gösterildiği gibi kalibre konsol sonra, numuneler girinti için kullanılmıştır. Bunlar, 2.4 mikron boncuklar yumuşak glycocalyx tabakanın mekanik özelliklerini tespit edilebilmesi için hücre yüzeyi ile daha geniş bir temas alanına sahiptir. Konsol hücre çekirdeği ve hücre üzerine ucu yaklaşık 3 mikron hücre yüzeyi üzerinde konsol yüksekliğini ayarlamak için kullanılan yumuşak bir yaklaşım yakın bir hücre üzerine yerleştirildi. Yazılımı 7 nN bir maksimum kuvvet ile 1 um / sn bir hızda 20 tekrarlanan girintileri için belirlenmiştir. Yaklaşık 6 sn ardışık kişiler arasında geçen. Bu glycocalyx zamana bağlı özellikleri test etmek için girinti farklı oranlarda kullanmak mümkün olmasına rağmen bu ilk yılında deneyler, sadece tek bir girinti oranı (1 um / saniye) kullanılmıştır.
2. Girinti Teorisi
R yarıçaplı bir küre ile yarı-uzay elastik içine Girinti girinti kuvveti, F, denklem ile verilir Hertz teorisi kullanılarak tarif edilebilir:
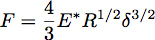
Δ olduğu yerde girinti derinliği ve E * test edilen malzeme (Şekil 3) ve indirgenmiş modülü olduğunu. Üniform bir elastik yarı-uzay çarpan bir sonsuz sert ucu söz konusu olduğunda, E * denklem ile ifade edilir:
3/50163eq3.jpg "/>
E burada elastik modül ile ν malzemenin Poisson oranıdır. Polimer film ile son çalışmaları ince filmlerin 1 modülü ve kalınlığı belirlemek için bir iki katmanlı modelin geliştirilmesi ilham kaynağı olmuştur. Bu hücre vücut yüzeyi üzerinde düzgün bir ince yumuşak bir film olarak glycocalyx muamele ile hücre biyolojisi, bu modelin uygulamaktadırlar. Bu modeli kullanarak, sistem indirgenmiş modülü olur:
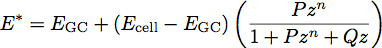
E GC glycocalyx bir modül olduğu durumlarda, E bir hücre, vücut modülü, P, Q ve n, ampirik olarak uygun polimer esas alınarak tespit edilmiştir, ve z denklem ile verilmektedir sabitleridir:
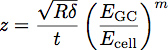
T glycocalyx katmanın kalınlığı olduğu. Bu parametrelerin bir şeması Şekil 3'de gösterilmektedir. Bu model, katı substrat 1 üzerinde bir ince film modülü ve kalınlığı belirlemek doğru bir yol olduğu gösterilmiştir. Şekil 4'te gösterildiği gibi bu denklem, endotel glycocalyx bir modül ve kalınlığı belirlemek için hücre içine girinti elde edilen eğrileri uyması için de kullanılabilir.
Sonuçlar
Tipik bir deneyde, 20 kuvvet-vs-mesafe eğrisi yakın, ancak çekirdek (~ 2 mikron içinde), üzerinde, tipik olarak perinükleer bölge, hücre belirli bir bölge elde edilmiştir. Eğrileri ölçüm süresi üzerinde hiçbir örnek kayması için hesap hizalanır ve daha sonra Şekil 4'de gösterildiği gibi, kendi kendini taşır gürültü çıkarmak için ortalamaları alınmıştır. Eğrileri analiz ve ince polimer filmler 1 modülü ve kalınlığı belirlemek için geliştirilen ...
Tartışmalar
Bu iki tabaka modeli ve endotel duvar ile kan içinde dolaşan bir lökosit etkileşimini modellemek için Hertz teori hesaplanan değerler kullanılmıştır. Biz, 10 pN yük altında 50 nm çapında lökosit bir mikrovillus glycocalyx içine yaklaşık 150 nm girinti edeceğini toplam kalınlığı yalnızca bir kısmını hesaplanmıştır. Bu, bu deneyde ölçüldüğü gibi özelliklere sahip glycocalyx, hücre-hücre etkileşim için önemli bir engel olan ve lökosit hücre yapışma sırasında yapışma sıras?...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Yazarlar, bu proje ile birlikte yardım için Elena Lomakina, Richard Bauserman, Margaret Youngman, Shay Vaknin, Jessica Snyder, Chris Striemer, Nakul Nataraj, Hung Li Chung, Tejas Khire, ve Eric Lam teşekkür etmek istiyorum. Bu proje NIH # PO1 HL 018208 tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif / Malzeme Adı | Şirket | Katalog Numarası | Yorumlar |
| McCoy'un Orta | Gibco | 16600-082 | |
| Fötal Buzağı Serumu | Hyclone | SH30070 | |
| Endotel Hücre Büyümesi Orta | Vec Teknolojileri | MCDB-131 | |
| Pooled İnsan Umbilical Ven Endotel Hücreleri | Vec Teknolojileri | PHUVEC/T-25 | |
| Sülfürik Asit | JT Baker | 9681-02 | |
| Hidrojen peroksit | VWR | BDH3742-1 | |
| (3-aminopropil) triethoxysilane | Aldrich | 440140-100ML | |
| İzopropil Alkol | VWR | BDH8999-4 | |
| Tripsin | Cellgro | 25-054-C1 | |
| Hank'in Tamponlu Tuz Çözeltisi | Gibco | 14175-095 | |
| sülfo-NHS-LC-Biotin | Thermo Scientific | 21335 | |
| Streptavadin boncuk | Dynabeads | 112.06D | |
| MFP-3D AFM | İltica Araştırma | ||
| Tipless cantilevers | Nanoworld | OK-TL1-50 | |
| Silhouette SD | Quickutz | Silhouette-SD | |
| Silikon Kauçuk | Stockwell Elastomerics | SE50-RS | |
| 30 ml şırıngalar | Benton Dickinson | 309650 | |
| 18 gauge iğne | Benton Dickinson | 305196 | |
| Uzatma Takımları | Hospira | 4429-48 | |
| 4 yollu vanalar | Teleflex | W21372 | |
| Erkek / Kadın Liman Caps | Smith'in Tıp | MX491B | |
| Peristaltik Pompa | Watson-Marlow | 401U / D | |
| Peristaltik Hortum | Watson-Marlow | 903.0016.016 | |
| steril filtre | Pall Yaşam Bilimleri | 4652 |
Referanslar
- Clifford, C., Seah, M. Nanoindentation measurement of young's modulus for compliant layers on stiffer substrates including the effect of poisson's ratios. Nanotechnology. , (2009).
- Gouverneur, M., Spaan, J. A. E., Pannekoek, H., Fontijn, R. D., Vink, H. Fluid shear stress stimulates incorporation of hyaluronan into endothelial cell glycocalyx. Am. J. Physiol. Heart. Circ. Physiol. 290 (1), 458-452 (2006).
- Hocde, S. A., Hyrien, O., Waugh, R. E. Cell adhesion molecule distribution relative to neutrophil surface topography assessed by tirfm. Biophysical Journal. 97 (1), 379-387 (2009).
- Lipowski, H. H. The endothelial glycocalyx as a barrier to leukocyte adhesion and its mediation by extracellular proteases. Annals of biomedical engineering. 40 (4), 840-848 (2012).
- Lu, L., Oswald, S. J., Ngu, H., Yin, F. C. P. Mechanical properties of actin stress fibers in living cells. Biophysical Journal. 95 (12), 6060-6071 (2008).
- Pries, A. R., Secomb, T. W., Gaehtgens, P. The endothelial surface layer. Pflugers Archiv. European Journal of Physiology. 440 (5), 653-666 (2000).
- Spillmann, C. M., Lomakina, E., Waugh, R. E. Neutrophil adhesive contact dependence on impingement force. Biophysical Journal. 87 (6), 4237-4245 (2004).
- vanden Berg, B. M., Vink, H., Spaan, J. A. E. The endothelial glycocalyx protects against myocardial edema. Circulation Research. 92 (6), 592-594 (2003).
- Williams, T. E., Nagarajan, S., Selvaraj, P., Zhu, C. Quantifying the impact of membrane microtopology on effective two-dimensional affinity. J. Biol. Chem. 276 (16), 13283-138 (2001).
- Vink, H., Duling, B. Identification of Distinct Luminal Domains for Macromolecules, Erythrocytes, and Leukocytes Within Mammalian Capillaries. Circulation Research. 79, 581-589 (1996).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır