É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Quantificar as propriedades mecânicas do Glicocálix endotelial com Microscopia de Força Atômica
Neste Artigo
Resumo
As características mecânicas do glicocálice endotelial foi medida através da indentação utilizando esferas micronizadas em cantilevers de AFM. As células endoteliais foram cultivadas numa câmara de costume em condições de fluxo fisiológicas para induzir a expressão de glicocálice. Os dados foram analisados utilizando um modelo de película fina, para determinar a espessura e módulo de glicocálice.
Resumo
Nossa compreensão da interacção de leucócitos e da parede do vaso durante a captura de leucócitos é limitada por uma compreensão incompleta das propriedades mecânicas da camada de superfície endotelial. Sabe-se que as moléculas de adesão nos leucócitos estão distribuídos de maneira não uniforme em relação à superfície topografia 3, que a topografia limita a formação da ligação adesiva com superfícies de outros 9, e que as forças de contacto fisiológicas (≈ 5,0-10,0 pN por microvilosidades) pode comprimir os microvilos como menos de um terço do seu comprimento de repouso, o aumento da acessibilidade das moléculas para a superfície oposta 3, 7. Consideramos que o endotélio como uma estrutura de duas camadas, o corpo da célula, relativamente rígida, mais o glicocálice, um revestimento de açúcar mole protectora na superfície luminal 6. Tem sido demonstrado que o glicocálice pode actuar como uma barreira para reduzir a adesão de leucócitos ao endotélio de superfície 4.Neste relatório, nós começamos a abordar a deformabilidade de superfícies endoteliais para entender como a rigidez mecânica endotelial pode afetar a formação de vínculo. As células endoteliais em cultura estática não expressam uma glicocálice robusto, mas as células cultivadas em condições de fluxo fisiológicas começam a aproximar o glicocálice observada in vivo 2. O módulo de elasticidade do corpo de célula endotelial foi medida através de microscopia de força atómica (AFM) ser aproximadamente de 5 a 20 kPa 5. A espessura e estrutura do glicocálice foram estudadas utilizando microscopia electrónica de 8, e o módulo de elasticidade do glicocálice foi aproximada usando métodos indirectos, mas o nosso conhecimento, não existem relatos na literatura de uma medição directa do módulo glicocálice em células vivas . No presente estudo, nós apresentamos experiências feitas com um recuo AFM novel sonda em células que foram cultivadas em condições de maximizar a sua expressão glicocálice de maas medições directas ke do módulo e da espessura do glicocálice endotelial.
Protocolo
1. Métodos
Câmara de caudal 1,1 Célula
A câmara de fluxo, mostrado na Figura 1, foi construído de modo a que as células podem ser cultivadas sob um corte de 1,0 Pa (10 dyn / cm 2) e, em seguida, transferido directamente para uma Asylum MFP3D AFM (Santa Barbara, CA).
- A câmara de fluxo foi preparado para o ensaio, em primeiro lugar a limpeza das lâminas de vidro, em solução piranha (3:1 H 2 SO 4: H 2 O 2) durante 15 min e, em seguida, lavando-as com água destilada. Eles foram então cozidos a seco e revestidos com aminopropil-trietoxi-silano (APTES), numa câmara de deposição de vácuo.
- A junta de silicone foi cortada utilizando uma ferramenta de corte Silhouette SD. Isto permitiu-nos controlar com precisão as dimensões de fluxo da câmara de controlo da taxa de fluxo e tensão de cisalhamento durante o crescimento celular. Tipicamente, um canal foi cortado 6,4 milímetros de largura por 19 mm de comprimento a partir de uma folha de silicone de 0,4 mm. A vazão necessária para gêneroste uma tensão de corte de 1,0 Pa (10 dines / cm 2) é calculada assumindo um fluxo laminar de um canal rectangular com a equação:
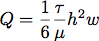
onde Q é a taxa de fluxo, τ é a tensão de cisalhamento, μ é a viscosidade do meio, aqui assumido como sendo 1,0 mPa (0,01 dines * s / cm 2), h é a altura e w é a largura da câmara de fluxo .
- A parte superior da câmara de fluxo alinhado com o vedante na placa de cultura de células e fixado com um anel magnético. O conjunto foi cheio com álcool isopropílico (IPA) para a esterilização.
- O sistema de escoamento total foi montado. As portas de fluxo na placa de cultura de células foram conectados a válvulas de três vias. As válvulas foram conectados a abrir 30 ml seringas. IPA foi borbulhada através do sistema, o qual foi então lavado com 30 ml de meio de McCoy com 4% de soro fetal bovino (FCS). O sistema foi então cheio com 20 ml do meio de crescimento de células Vec Technologies. As tampas foram colocadas sobre as partes superiores das seringas. A captura do reservatório tampão tinha uma seringa de agulha no lugar para mover meio de volta para o reservatório de alimentação. Estéreis filtros de 0,2 mM foram ligados às entradas de ar nas tampas para evitar a contaminação do sistema. A câmara de fluxo foi então pronto para a sementeira de células.
1,2 Cultura de Células
- As células endoteliais da veia umbilical humana (HUVEC) quer do meio de cultura foram adquiridos a partir de Vec Technologies (Rensselaer, NY) e crescidas até à confluência num balão T25.
- O meio de crescimento foi removido do balão e a monocamada de células libertadas com 2 ml de tripsina 2,5%. Uma vez que as células estavam em solução, a tripsinização foi interrompida com a adição de 10 ml de meio de cultura de células para o balão.
- Thsuspensão de células e centrifugou-se durante 5 min e o sobrenadante foi removido. As células foram ressuspensas em 1 ml de meio de cultura celular (contendo soro) para injecção no interior da câmara de fluxo.
- A suspensão de células (0,5 ml, ~ 50.000 células) foi carregada para uma seringa e injectado na câmara de fluxo através de uma válvula de três vias.
- As células foram deixadas assentar e aderir ao substrato de vidro por 2 horas antes de o fluxo foi iniciado. As células foram cultivadas sob fluxo dentro de uma incubadora a 37 ° C durante 1 a 5 dias até à confluência.
1,3 Preparação Cantilever e recuo celular
- Cantilever sem cantilevers de AFM (NanoWorld, Suíça) foram limpas em ácido nítrico durante 5 min e funcionalizado com aminopropil-trietoxi-silano (APTES), numa câmara de deposição de vapor.
- Uma solução de 5 mg / ml, em peso, NHS-sulfo-LC-biotina, em solução salina tamponada de Hank (HBSS) foi preparado. As vigas foram submergidos na solução durante 15 min a conjuportão do silano com N-hidroxi-succinimida química (NHS).
- Uma solução de meio livre de biotina foi feita por incubação de 20 ml de meio de cultura Vec Technologies celular (incluindo soro) com 200 ul de contas de streptavadin de 12 hr. As esferas foram removidas do meio de um íman e o meio foi filtrado através de um filtro de 0,22 ^ M estéril.
- A câmara de fluxo foi removido da placa de cultura de células e as células foram lavadas em meio de 37 ° C a biotina livre.
- Uma solução de reserva de 1 ul de 2,4 uM esferas revestidas com estreptavidina, em 1 ml de meio isento de biotina foi preparada, e 100 uL do stock foi adicionada à placa de cultura de células.
- Contas de estreptavidina foram colhidos com o cantilever, enviando a ponta sobre a superfície do vidro ao lado de uma retracção, grânulo, o posicionamento da ponta do cantilever sobre o talão, e, em seguida, premir o cantilever para baixo sobre os segundos e talão de descanso para vários.
- A sensibilidade do cantilever foi medidad, recuando para a região de vidro nu e usando o declive da curva para definir a deflexão da ponta como uma função da tensão.
- A constante de mola do cantilever foi então calculada a partir de uma calibração térmica no software MFP3D.
- O cantilever calibrado foi então utilizado para recuar as amostras, tal como mostrado na Figura 2. Estes grânulos de 2,4 uM oferecer uma maior área de contacto com a superfície da célula de modo a que as propriedades mecânicas da camada de glicocálice macio pode ser detectado. O cantilever foi colocada sobre uma célula de perto do núcleo celular e uma abordagem suave da ponta para a terceira célula foi usada para ajustar a altura do braço de suporte cerca de 3 um acima da superfície da célula. O software foi ajustado para 20 indentações repetidas a uma taxa de 1 um / seg a uma força máxima de 7 nN. Aproximadamente 6 segundos decorrido entre contactos sucessivos. É possível a utilização de diferentes taxas de recuo para testar as propriedades dependentes do tempo do glicocálice, embora nestes inicial experiências, apenas uma taxa única indentação (1 um / seg) foi usada.
2. Teoria recuo
Indentação em um meio-espaço elástico com uma esfera de raio R pode ser descrito utilizando teoria de Hertz, onde a força de recuo, F, é dada pela equação:
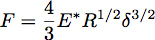
Onde δ é a profundidade de indentação e E * é o módulo de redução do material a ensaiar (Figura 3). No caso de um penetrador infinitamente rígida que colide um uniforme elástica semi-espaço, E * é dado pela equação:
3/50163eq3.jpg "/>
onde E é o módulo elástico e ν é o coeficiente de Poisson do material. Trabalhos recentes com películas de polímeros tem inspirado o desenvolvimento de um modelo de duas camadas para a determinação do módulo de elasticidade e espessura de filmes finos 1. Estamos a aplicar este modelo para a biologia celular, tratando o glicocálice como uma película fina e uniforme macia na superfície do corpo da célula. Usando este modelo, o módulo de elasticidade reduzido do sistema torna-se:
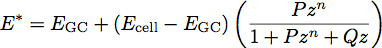
Onde E é o módulo de GC do glicocálice, células E é o módulo de elasticidade do corpo da célula, P, Q e n são constantes que foram determinadas empiricamente a partir do polímero se encaixa, e z é dado pela equação:
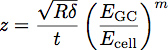
Onde t é a espessura da camada de glicocálice. Um esquema destes parâmetros é mostrado na Figura 3. O modelo tem sido demonstrado ser um modo adequado para determinar o módulo de elasticidade e espessura de uma película fina no substrato mais rígido 1. Esta equação pode ser usada para ajustar as curvas obtidas a partir de indentação em células para determinar o módulo de elasticidade e espessura da glicocálice endotelial, como mostrado na Figura 4.
Resultados
Numa experiência típica, 20 força-vs-distância curvas foram obtidas a partir de uma dada região de célula, tipicamente na região perinuclear, próximo, mas não sobre, o núcleo (dentro de ~ ^ M 2). As curvas foram alinhados para levar em conta qualquer variação de amostra ao longo da duração da medição e, em seguida, em média, para remover o ruído cantilever, como mostrado na Figura 4. As curvas foram analisadas e se encaixam com o modelo de duas camadas que foi desenvolvido para determi...
Discussão
Foram utilizados os valores calculados a partir do modelo de duas camadas e teoria de Hertz para modelar a interacção de um dos leucócitos em circulação no sangue com a parede endotelial. Calculamos que um microvilosidades na leucócitos com um diâmetro de 50 nm sob uma carga de 10 iria pN travessão aproximadamente 150 nm para o glicocálice, apenas uma fracção da espessura total. Isto indica que o glicocálice, com propriedades como medidos nesta experiência, é uma barreira significativa para a interacção ...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Os autores gostariam de agradecer a Elena Lomakina, Richard Bauserman, Margaret Youngman, Shay Vaknin, Jessica Snyder, Chris Striemer, Nakul Nataraj, Hung Li Chung, Tejas Khire, e Eric Lam por sua ajuda com este projeto. Este projeto foi financiado pelo NIH # PO1 HL 018208.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente / Material | Companhia | Número de catálogo | Comentários |
| Meio de McCoy | Gibco | 16600-082 | |
| Fetal Calf Serum | Hyclone | SH30070 | |
| Meio de Crescimento de Células Endoteliais | Vec Technologies | MCDB-131 | |
| Agrupados células endoteliais da veia umbilical humana | Vec Technologies | PHUVEC/T-25 | |
| Ácido sulfúrico | JT Baker | 9681-02 | |
| Peróxido de Hidrogênio | VWR | BDH3742-1 | |
| (3-aminopropil) trietoxissilano | Aldrich | 440.140-100ML | |
| Álcool isopropílico | VWR | BDH8999-4 | |
| Tripsina | Cellgro | 25-054 C1- | |
| Solução salina tamponada de Hank | Gibco | 14175-095 | |
| sulfo-NHS-LC-Biotina | Thermo Scientific | 21335 | |
| Contas Streptavadin | Dynabeads | 112.06D | |
| MFP-3D AFM | Asylum Research | ||
| Cantilevers Cantilever sem | Nanoworld | Arrow-TL1-50 | |
| Silhouette SD | Quickutz | Silhueta-SD | |
| Borracha de silicone | Stockwell Elastomerics | SE50-RS | |
| Seringas 30 ml | Benton Dickinson | 309650 | |
| 18 agulhas de calibre | Benton Dickinson | 305196 | |
| Conjuntos de extensão | Hospira | 4429-48 | |
| Válvulas de 4 vias | Teleflex | W21372 | |
| Masculino / Feminino Caps Porto | Smith Medical | MX491B | |
| Bomba peristáltica | Watson-Marlow | 401U / D | |
| Tubulação Peristaltic | Watson-Marlow | 903.0016.016 | |
| filtros estéreis | Ciências da Vida Pall | 4652 |
Referências
- Clifford, C., Seah, M. Nanoindentation measurement of young's modulus for compliant layers on stiffer substrates including the effect of poisson's ratios. Nanotechnology. , (2009).
- Gouverneur, M., Spaan, J. A. E., Pannekoek, H., Fontijn, R. D., Vink, H. Fluid shear stress stimulates incorporation of hyaluronan into endothelial cell glycocalyx. Am. J. Physiol. Heart. Circ. Physiol. 290 (1), 458-452 (2006).
- Hocde, S. A., Hyrien, O., Waugh, R. E. Cell adhesion molecule distribution relative to neutrophil surface topography assessed by tirfm. Biophysical Journal. 97 (1), 379-387 (2009).
- Lipowski, H. H. The endothelial glycocalyx as a barrier to leukocyte adhesion and its mediation by extracellular proteases. Annals of biomedical engineering. 40 (4), 840-848 (2012).
- Lu, L., Oswald, S. J., Ngu, H., Yin, F. C. P. Mechanical properties of actin stress fibers in living cells. Biophysical Journal. 95 (12), 6060-6071 (2008).
- Pries, A. R., Secomb, T. W., Gaehtgens, P. The endothelial surface layer. Pflugers Archiv. European Journal of Physiology. 440 (5), 653-666 (2000).
- Spillmann, C. M., Lomakina, E., Waugh, R. E. Neutrophil adhesive contact dependence on impingement force. Biophysical Journal. 87 (6), 4237-4245 (2004).
- vanden Berg, B. M., Vink, H., Spaan, J. A. E. The endothelial glycocalyx protects against myocardial edema. Circulation Research. 92 (6), 592-594 (2003).
- Williams, T. E., Nagarajan, S., Selvaraj, P., Zhu, C. Quantifying the impact of membrane microtopology on effective two-dimensional affinity. J. Biol. Chem. 276 (16), 13283-138 (2001).
- Vink, H., Duling, B. Identification of Distinct Luminal Domains for Macromolecules, Erythrocytes, and Leukocytes Within Mammalian Capillaries. Circulation Research. 79, 581-589 (1996).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados