Method Article
التصور من ATP سينسيز Dimers في الميتوكوندريا بواسطة الكترون البرد المقطعي
In This Article
Summary
نقدم بروتوكول لكيفية جمع ومعالجة الإلكترون البرد tomograms الميتوكوندريا كله. توفر تقنية رؤى تفصيلية في هيكل، وظيفة، وتنظيم مجمعات البروتين غشاء كبيرة في الأغشية البيولوجية الأصلية.
Abstract
الإلكترون البرد المقطعي هو أداة قوية في علم الأحياء الهيكلي، قادرة على تصور هيكل ثلاثي الأبعاد للعينات البيولوجية، مثل الخلايا، العضيات، غشاء الحويصلات، أو الفيروسات في التفاصيل الجزيئية. لتحقيق ذلك، والمزججة العينة المائية بسرعة في الإيثان السائل، الذي يحافظ عليه في دولة المجمدة-رطب مقرب لمواطن. في المجهر الإلكتروني، يتم تسجيل سلسلة الميل في درجة حرارة النيتروجين السائل، والتي يتم بناؤها tomograms 3D. نسبة الإشارة إلى الضوضاء من حجم المقطعي منخفضة بطبيعتها. يتم تحسين معترف بها، وميزات المتكررة التي subtomogram المتوسط، الذي يتم قطع subvolumes الفردية خارج، وبلغ متوسط محاذاة للحد من الضوضاء. بهذه الطريقة، خرائط 3D مع قرار من 2 نانومتر أو أفضل يمكن الحصول عليها. A نوبة من الهياكل ذات الدقة العالية المتاحة للحجم 3D ثم تنتج النماذج الذرية المجمعات البروتين في بيئتها الأصلية. نحن هنا تظهر كيف نستخدم الإلكترون البرد tomograpHY دراسة في الموقع تنظيم مجمعات البروتين غشاء كبيرة في الميتوكوندريا. نجد أن يتم تنظيم synthases ATP في صفوف من dimers على طول قمم عالية مقوسة من أعراف الغشاء الداخلي، في حين مجمع I يتم توزيع عشوائيا في المناطق غشاء على جانبي الصفوف. بواسطة subtomogram المتوسط حصلنا على هيكل الميتوكوندريا ATP سينسيز ديمر داخل غشاء أعراف.
Introduction
الميتوكوندريا هي السلطة منازل للخلية. عن طريق تحويل بروتون والتدرج الكهروكيميائي عبر الغشاء الداخلي الميتوكوندريا إلى طاقة الرابطة الكيميائية، وسينسيز ATP الميتوكوندريا تنتج معظم ATP التي تحرك العمليات الخلوية. من أجل فهم الآليات وراء تحويل الطاقة الميتوكوندريا، نحن بحاجة إلى تحديد هيكل سينسيز ATP في الموقع، ومعرفة كيف يتم ترتيب ذلك وزعت في غشاء الميتوكوندريا الداخلية. على الرغم من أن الهياكل عالية الدقة لمعظم مكونات الميتوكوندريا سينسيز اعبي التنس المحترفين 1-3 والخرائط منخفضة الدقة من كله معقد 4 متاحة، فمن المهم وضع هيكل والتشكل من عمل انزيم في الغشاء. وقد افترض توزيع سينسيز ATP في غشاء الميتوكوندريا الداخلي على نطاق واسع أن يكون عشوائيا، ولكن في وقت مبكر إيجاد 5 والنتائج الأولية الخاصة بنا 6 إلي أن ذلك لا تانه حالة. وقد أكدت الدراسات اللاحقة من مجموعتنا وآخرون 7 أن يتم ترتيب سينسيز ATP في صفوف طويلة من dimers على طول التلال المنحنية بإحكام من الغشاء الداخلي الميتوكوندريا أعراف 8، في حين تظهر مضخات البروتون من سلسلة نقل الإلكترون إلى أن يكون موجودا في أي من الجانبين من الصفوف 9. هذا الترتيب له انعكاسات هامة على آليات تحويل الطاقة الميتوكوندريا.
هذه التقنية التي استخدمناها لتحديد هذا الترتيب هي الإلكترون البرد التصوير المقطعي (البرد ET). البرد ET حاليا الطريقة الوحيدة التي توفر دقة ثلاثي الأبعاد (3D) حجم الخلايا، ومقصورات الخلوية أو العضيات في قرار الجزيئي. البرد ET مناسبة خاصة لدراسة المجمعات الكبيرة في الأغشية البيولوجية، لأن الأغشية تظهر مع النقيض جيدة وسهلة لتتبع في حجم المقطعي 3D.
أساليب أخرى لدراسة هيكل 3D من الخلايا أو organellوفاق لا توفر التفاصيل الجزيئية. سوبر ضوء قرار المجهري 10، 11 هو رائع في الكشف عن موقف أو المسافات بين الباعثة للضوء تسميات تعلق على البروتينات في المصالح مع دقة عشرات نانومتر، لكنه لا يكشف هيكل البروتين نفسه، حتى في دقة منخفضة . المجهر انتقال الإلكترون من أقسام التسلسلية 12 أو التصوير كتلة وجه عن طريق مسح الإلكترون المجهري 13 من العينات البيولوجية البلاستيكية جزءا لا يتجزأ من تقدم وجهات النظر منخفضة الدقة من وحدات التخزين الخلوية ولكن أيضا لا تكشف التفاصيل الجزيئية. يمكن أن قوة المجهر الذري 14 في مبدأ تقديم قرار الجزيئي أو حتى الذري، ولكن فقط على سطح الأشياء على، دعم قوي مسطح بالذرة. أخيرا، الأشعة السينية التصوير المقطعي 15 أو تناثر مكثفة نبضات الأشعة السينية وأشعة الليزر من الإلكترون الحر 16 من غير المرجح أن تكشف عن بنية معقدة كبيرة، والأشياء، لادوري مثل الخلايا بأكملها أو العضيات في مقرار olecular في المستقبل المنظور. وهكذا في الوقت الحاضر، لا يوجد بديل لالبرد ET للدراسات لهيكل 3D من الخلايا أو العضيات في قرار نانومتر.
البرد ET هو الأسلوب المفضل لدراسة هيكل والتشكل المجالس البروتين المرتبط الغشاء بما في ذلك مجمع المسام النووية 17، وارتفاع أنفلونزا مجمعات 18، وسياط البروتينات السيارات 22، 23 ولكن أيضا تنظيم الخلايا البكتيرية كلها 19 ودخول الفيروسات المسببة للأمراض مثل فيروس نقص المناعة البشرية في الخلايا 20-23. البرد ET لا يقدر بثمن لتصور البروتينات الخيطية وتفاعلاتها في الخلية، بما في ذلك خيوط الأكتين 24 أو 25 axonemes. ويمكن تعزيز القرار إلى 2 نانومتر أو أفضل من المتوسط subtomogram 26، حيث يتم قطع subvolumes المتكرر، وميزات العادية من حجم المقطعي وبلغ متوسط بواسطة واحد الجسيمات الصورة المواليةتقنيات cessing.
البرد ET ينطوي على اكتساب سلسلة من الصور الإسقاط من عينة رقيقة (<التدوير 250Nm) التي اتخذت في زوايا الميل المختلفة في المجهر الإلكتروني النافذ (TEM). يجب أن تكون العينة رقيقة بحيث الإلكترونات، التي تتفاعل بقوة مع المسألة، وتتناثر لا أكثر من مرة. نثر متعددة يجعل الصور الناتجة من الصعب تفسير ويقلل التباين. يتم محاذاة الصور للمنطقة العينة المختارة بالنسبة لبعضها البعض، ويتوقع في الفضاء 3D باستخدام برنامج كمبيوتر مناسب، وتوليد حجم 3D للعينة. وساعد محاذاة الصور عن طريق علامات إيمانية الذهب، والتي تختلط مع العينة قبل التجميد. يجب أن تكون علامات إيمانية مثالي 10 أو أكثر موزعة بالتساوي موجودة في كل صورة لتحقيق المواءمة جيدة.
لمراقبة التفاصيل الجزيئية، العينات المجمدة-يغرق في الإيثان السائل، الذي يحفظ الدولة رطب الأصلية الخاصة بهم. في تجميد السائلالإيثان هو سريع جدا (5 ~ 10 درجة مئوية / ثانية) 27 لا تتبلور الماء ولكن لا يزال في، تشبه الزجاج الدولة المزجج. الكريستال الجليد الأضرار تشكيل الهياكل البيولوجية الحساسة. كما تعاني العينات البيولوجية من أضرار الإشعاع، هناك حد لعدد الكلي للنثر الأحداث يمكن أن يتسامح مع العينة. وهكذا اكتسب الصور في وضع جرعة منخفضة: تم تحديد مساحة الفائدة عند التكبير المنخفض (1،500X) مع جرعة أقل من 1 إلكترون ه - / 2 نانومتر (طريقة البحث). ثم يتم تركيز الصورة في التكبير العالي، قبالة منطقة (وضع التركيز) الفائدة. فقط عندما يتم الحصول على صورة، والمشع مجال الاهتمام مع جرعة الإلكترون أعلى (وضع التعرض).
هنا، نقدم لمحة عامة عن كيفية جمع ومعالجة الإلكترون البرد tomograms، وذلك باستخدام ATP dimers سينسيز في الغشاء الداخلي الميتوكوندريا كمثال. يصف بروتوكول التالي كيفية تحضير الميتوكوندريا لالبرد ET، كيفية إعدادوجمع سلسلة الميل بلغ إجمالي جرعة الإلكترون محددة، وكيفية معالجة سلسلة الميل للحصول على حجم 3D من مساحة الفائدة. ويتضح لمحة عامة عن الإجراء في الشكل 1.
Protocol
1. إعداد الميتوكوندريا من الخلايا أو الأنسجة التي كتبها التفاضلية الطرد المركزي
يصف هذا القسم إجراء عام لعزل الميتوكوندريا سليمة من الكائنات حقيقية النواة المختلفة. المكونات العازلة وسرعة الطرد المركزي دقة تحتاج إلى أن يكون الأمثل لكل الأنسجة / دراسة الأنواع.
- كسر الخلايا في عازلة متساوي التوتر (على سبيل المثال، 250 ملي السكروز، 10 ملي HEPES الرقم الهيدروجيني 7.4)، وذلك باستخدام مطحنة الزجاج حبة (أفطورة الفطرية) 28، الهضم الأنزيمي من جدار الخلية (خميرة الخباز) 29، والحاملة للكرة الخالط (واحد -cell حقيقيات النوى / الثقافة خلية / الديدان الخيطية) 30، أو الخلاط (الأنسجة الحيوانية أو النباتية) 31.
- إزالة الحطام الخلية عن طريق الترشيح من خلال الشاش تليها منخفضة السرعة الطرد المركزي (2،000 x ج، 4 ° C و 10 دقيقة).
- جمع وطاف بيليه الميتوكوندريا بواسطة عالية السرعة الطرد المركزي (9،000 x ج، 4 ° C، 10 دقيقة).
- عند الضرورة، استخدم متساوي التوتر خطوة متدرجة الكثافة لتنقية إضافية للجزء الميتوكوندريا 32.
2. إعداد الميتوكوندريا للالكترون البرد المقطعي
يصف القسم التالي كيفية الحصول على العينات المجمدة-رطب لالبرد ET. ملاحظة: الأسلوب ينطوي على استخدام النيتروجين السائل شديد البرودة والإيثان، الذي يمكن أن يسبب حروقا جلدية شديدة. يجب ارتداء نظارات واقية وقفازات السلامة البرد الحماية. الإيثان السائل، الذي هو أيضا قابلة للاشتعال، يجب أن يتم التعامل معها في غطاء الدخان.
- و resuspend مكعبات الميتوكوندريا في 250 ملي طرهالوز، 10 ملي HEPES عازلة في درجة الحموضة 7.4 إلى تركيز حوالي 5 ملغ / مل البروتين الكلي.
- توهج التفريغ شبكات EM الكربون هولي، جنبا الكربون تصل، في جهاز الفراغ وفقا لتعليمات الشركة الصانعة.
- تسييل بعض ملليلتر من الإيثان عن طريق توجيه تيار من غاز الإيثان على الجانب الداخلي من بارد النيتروجين السائلإد حاوية الألومنيوم.
- مزيج من البروتين A-مترافق الذهب إيمانية تعليق 1: 1 مع تعليق الميتوكوندريا وتطبيق فورا 3 ميكرولتر إلى شبكة EM توهج التفريغ الذي عقد في ملاقط.
- وضع ملاقط في جهاز التزجيج، على سبيل المثال، مقصلة محلية الصنع. وصمة عار من السائل الزائد مع إسفين من ورق الترشيح (~ 5 ثانية أو حتى يتوقف السائل نشر) والغطس على الفور إلى شبكة الإيثان السائل عن طريق الإفراج عن الزناد.
- نقل الشبكة من الإيثان السائل في النيتروجين السائل. أثناء النقل، وإزالة الزائد من الإيثان الشبكة مع ورق الترشيح. وضع غيض من قطعة على شكل وتد من ورق الترشيح في الإيثان السائل. كما تشرق الإيثان السائل، اسحب بلطف الشبكة تصل ورقة الترشيح ولكن يبقيه تحت الجبهة السائلة. تتم إزالة الإيثان السائل من الشبكة عن طريق عمل شعري مرة واحدة وتمت إزالة جميع الإيثان السائل، ونقل على الفور الشبكة في النيتروجين السائل.
- وضع الشبكة المزجج في صندوق تخزين شبكة، والثانية تخزين تحت النيتروجين السائل لاستخدامها لاحقا عند الاقتضاء.
3. تسجيل من المقطعي الميل سلسلة
يصف القسم التالي كيفية إعداد وجمع سلسلة الميل تصوير الشعاعي الطبقي من الحبيبات الخيطية مع المجهر Polara الإلكترون مجهزة مرشح الطاقة بعد العمود وكاميرا CCD. وتستخدم بروتوكولات مماثلة مع كل البرد الإلكترون المجاهر مجهزة CCD أو المباشرة الكاميرات كاشف الإلكترون.
- محاذاة المجهر
- إدراج اختبار عينة مثل الجرافيت والجزر الذهب على الفيلم الكربون هولي.
- حدد وضع البحث في نظام جرعة منخفضة من المجهر.
- جلب عينة إلى ارتفاع eucentric. هذا هو الحد الأدنى من حركة نقطة س ص عند إمالة صاحب العينة. توسيط نقطة من الفائدة عند 0 درجة الميل، والميل المرحلة إلى 20 درجة وإعادة مركز نقطة عن طريق تغيير ض الارتفاع. العودة إلى 0 درجة وتكرار حتى يتم تصغير تعويض الوحشي.
- حددطريقة التعرض. اختيار التكبير المطلوب لتحصيل مقطعية (على سبيل المثال، 25،000X على كاشف ≈ 0.6 نانومتر حجم العينة بكسل).
- اختيار فتحة المكثف صغيرة (50-70 ملم) وتحديد حجم وكثافة بقعة شعاع بحيث الشعاع هو أوسع من مجرد جهاز التصوير ويعطي قراءة بكسل 60 ه - / بكسل (CCD) أو 14 ه - / بكسل / ثانية (كاشف الإلكترون المباشر، وطريقة العد).
- مركز فتحة المكثف.
- البحث جاوس التركيز على سبيل المثال، ونقاط الحد الأدنى من التباين. إعادة تعيين المجهر يزيل التباؤر القراءة الصحيحة والنقاط المحورية ومركز التناوب وفقا لتعليمات الشركة الصانعة.
- الاتصال الهاتفي في يزيل التباؤر المطلوب لتسجيل مقطعية. ملاحظة: عالية يزيل التباؤر (8 ميكرومتر) يزيد النقيض ولكن يقلل القرار، في حين يزيل التباؤر منخفضة (2-4 ميكرون) يزيد قرار على حساب التباين.
- أكثر من حفرة فارغة، وتوليد إشارة مكاسب جديدة ومواءمة مرشح الطاقة وفقا لالصانعالتعليمات.
- محاذاة طرق البحث والتعرض. في وضع التعرض، وتوسيط نقطة الاهتمام والتحول إلى البحث عن واسطة. حدد التكبير من 1،500X (0.033 ميكرون / بكسل من العينة على كاشف) ويزيل التباؤر من 100 ميكرون (لزيادة النقيض). جلب نقطة اهتمام العودة إلى مركز باستخدام لفائف تحول الصورة.
- في وضع البحث، وضبط حجم وكثافة بقعة شعاع بحيث الشعاع هو أوسع من مجرد جهاز التصوير ويعطي قراءة بكسل ~ 20 ه - / بكسل (CCD) أو ~ 8 ه - / بكسل / ثانية (كاشف الإلكترون المباشر، عد واسطة).
- العثور على عينة منطقة جيدة
- إدراج الشبكة مع الميتوكوندريا المجمدة-رطب في المجهر الإلكتروني في درجة حرارة النيتروجين السائل (يرجى الرجوع إلى تعليمات الشركة الصانعة EM).
- في وضع البحث، البحث في الشبكة للمناطق المناسبة سمك الجليد ونوعية العينة. تأخذ 6 ثانية البحث عن الصور من المناطق الواعدة لتحديد مدى ملاءمتها لجمع مقطعية. بوتح ينبغي أن يكون غشاء الميتوكوندريا الداخلي والخارجي مرئية في هذا التكبير.
- تسجيل من الميل سلسلة المقطعي
- مرة واحدة تم العثور على منطقة عينة جيدة، وإمالة مرحلة ± 60 درجة لتحديد أقصى مدى الميل ما هو متاح من دون أي عرقلة أو التعرض مجال التركيز من شبكة القضبان أو كتل الجليد.
- على حفرة مملوءة الجليد قريب من مظهر مماثل، تغيير إلى وضع التعرض وضبط شدة شعاع أو الحصول على الصور مرة لذلك كل الصورة المسجلة لديها جرعة الإلكترون من 30-50 ه - / بيكسل للأجهزة المتقارنة بواسطة الشحنات أو البريد 6-8 - / بكسل / ثانية كشف الإلكترون مباشرة، عد واسطة.
- حساب نسبة توزيع جرعة (I 0 / I 60) بقسمة متوسط عدد الإلكترونات لصورة 1 ثانية المكتسبة في 0 درجة مع أن من 60 درجة صورة. توضح هذه نسبة الزيادة في وقت التعرض المطلوب للحفاظ على عدد الإلكترونات لكل صورة ثابتة مع زيادة زاوية الميل (التعرض الوقت = 1 / جنظام التشغيل (α) n حيث (I 0 / I 60) = 2 ن). يخدم النسبة أيضا باعتبارها مؤشرا جيدا لسمك الجليد. عادة يتم تسجيل tomograms جيدة من الميتوكوندريا مع I 0 / I 60 = 2،3-2،6.
- أكثر من حفرة فارغة، والحصول على صورة 1 ثانية في وضع التعرض ولاحظ عدد الإلكترونات في Å 2. مع مراعاة نسبة توزيع جرعة، وحساب إجمالي عدد الصور التي يمكن تسجيلها لجرعة الإلكترون الإجمالية محددة (على سبيل المثال، <40 ه - / 2 لتحديد هيكل و~ 160 ه - / 2 لمورفولوجيا).
- تحديد الفاصل الزمني المناسب الميل لجمع مقطعية بقسمة مجموع مجموعة الميل (على سبيل المثال، 120 درجة لل± 60 درجة) على العدد الكلي من الصور المحسوبة في 3.3.4.
- إعداد وتسجيل مقطعية مع المعايير المحددة أعلاه باستخدام برامج جمع البيانات التلقائي المناسب 33، 34. وعادة ما تكون بدأت سلسلة الميل في ± 20 درجة و تمر 0 درجة قبل الوصول يميل عالية من أجل تعظيم محتويات المعلومات من الصور الميل المنخفض الذي دمر خلال زيادة جرعة إلكترون.
4. إنشاء وتجزئة وحدات التخزين المقطعي
يصف هذا القسم كيف يتم إنشاء مجلدات تصوير الشعاعي الطبقي من الميتوكوندريا من سلسلة الميل وكيف موجودة للعرض العام على وحدات التخزين.
- حفظ سلسلة المقطعي الميل إلى الدليل المناسب. توليد كومة الصورة وتحويله إلى تنسيق الملف المناسب مع البرمجيات مفتوحة المصدر، مثل dm2mrc أو tif2mrc (حزمة IMOD) التي تحول .dm3، .dm4 أو ملفات .tif إلى أكوام لجنة نهر الميكونج. ويلزم مداخن MRC لإعادة الإعمار مقطعي مع IMOD 35. حزم أخرى تتطلب تنسيقات مختلفة.
- محاذاة الصور وتوليد مقطعية باتباع الخطوات بالتفصيل في البرنامج التعليمي IMOD ( http://bio3d.colorado.edu/imod/doc/etomoTutorial.html ).
- تعزيز النقيض من مقطعية باستخدام غير الخطية مرشح متباين الخواص نشر توزيعها مع IMOD. هذا الفلتر يعمل بشكل جيد للأغشية والجسيمات المرتبطة غشاء مثل ATP سينسيز.
- عن التصور، يدويا شريحة مقطعية من يستخدم البرامج المتاحة تجاريا مثل أميرة. تعيين voxels الموافق الغشاء الداخلي أو الخارجي وتوليد السطح. باستخدام الخيار الفرس في البرنامج المساعد EM-36 حزمة لAMIRA احتفال موقع ATP سينسيز الجسيمات.
5. Subtomogram المتوسطات من ATP سينسيز Dimers وتركيب الهياكل X-راي
يصف القسم التالي كيف يمكن الحصول على المتوسطات subtomogram من ATP سينسيز dimers.
- باستخدام جزيئات علامة مداخل وحزمة البرامج المناسبة مثل "الجزءتقدير ICLE لبرنامج الكترون المقطعي "، وحساب متوسط subtomogram.
- لاستصدار قرار التقدير، المقارنة بين متوسطات subtomogram تحدد بشكل مستقل من قبل فورييه قذيفة ارتباط 37.
- إذا المتاحة، قفص الاتهام المعروف الهياكل الأشعة السينية في المتوسط subtomogram من قبل هيئة جامدة المناسب، إما يدويا أو باستخدام الآلية الروتينية لرسو السفن متتابعة مثل تلك الموجودة في برنامج الوهم 38.
النتائج
الإلكترون البرد tomograms من الميتوكوندريا تكشف بوضوح مورفولوجيا 3D من عضية (الشكل 2). تجزئة اليدوية للأغشية في حجم المقطعي توضح هيكل أعراف في الحبيبات الخيطية. بواسطة التصوير الميتوكوندريا من مختلف سلالات الخميرة خروج المغلوب التي تفتقر إلى بعض المكونات البروتين، وتأثير هذه البروتينات على أعراف التشكل يمكن من خلال تقييم الشكل 3 يظهر الحبيبات الخيطية من سلالة الخميرة التي تفتقر إلى ATP سينسيز فرعية الإلكترونية. مطلوب هذا المكون من مجمع سينسيز ATP لdimerization من سينسيز ATP الميتوكوندريا. الميتوكوندريا من هذه السلالة تفتقر إلى أعراف رقائقي طبيعي من الميتوكوندريا wildtype (الشكل 2) وبدلا تحتوي على عدد حجرات الأغشية الداخلية. هذه الأجزاء هي إما خالية من أعراف أو تحتوي على الانغلافات غشاء على شكل بالون صغيرة (الشكل 3).
في توم ograms مع تباين جيد والمجمعات الكبيرة البروتين الميتوكوندريا، في هذه الحالة ATP dimers سينسيز، يمكن رؤيتها بسهولة (الشكل 4، فيلم 1). يمكن تحديد هياكل المجمعات في 2-3 قرار نانومتر بواسطة subtomogram المتوسط (الشكل 5. فيلم 2). ويمكن وضع متوسط أحجام العودة الى مقطعية لتقييم تنظيم المجمعات الفردية بالنسبة لبعضها البعض وغيرها من المجمعات البروتين في غشاء (الشكل 6؛ فيلم 3).
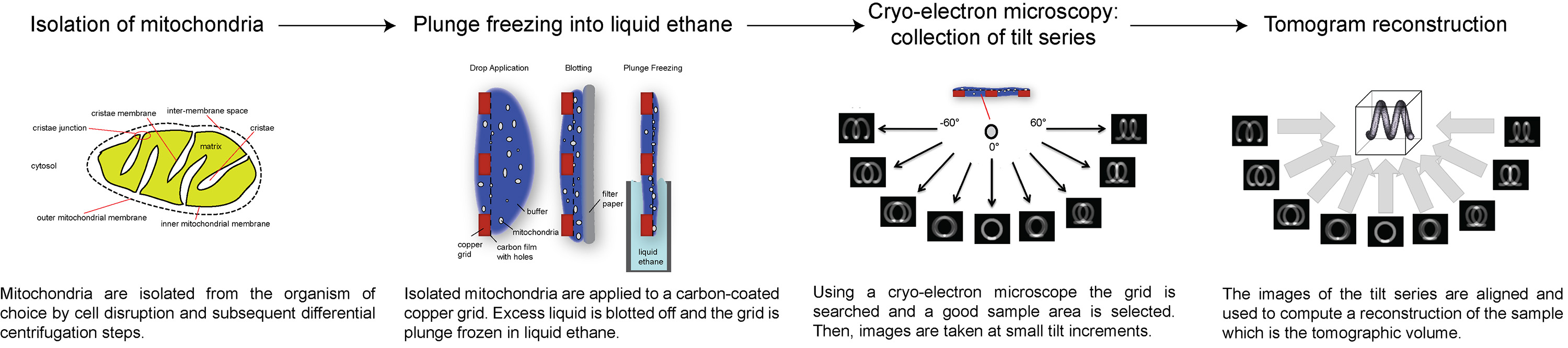
الرقم 1. تدفق-بيانيا يبين مراحل الإلكترون البرد المقطعي. انقر هنا لمشاهدة صورة أكبر.
ogether.within الصفحات = "دائما"> 
الشكل 2. الصرف من الحبيبات الخيطية من wildtype S. الخباز. شريحة الوسطى من خلال حجم المقطعي من wildtype S. الحبيبات الخيطية الخباز (يسار) والحجم أصدرت سطح المقابلة (يمين). يظهر حجم مجزأة من الغشاء الخارجي باللون الرمادي ومجلدات من الحدود الداخلي وأعراف الأغشية باللون الأزرق الفاتح. مقتبس من ديفيز وآخرون 8. انقر هنا لمشاهدة صورة أكبر.

الرقم 3. الخيطية Mitochondrion من S. سلالة الخباز تفتقر حدة فرعية اللازمة لATP سينسيز dimerization. شريحة من خلال حجم الشعاعي الطبقي (يسار) والمرافق الحجم المقدمة السطح (يمين) من الحبيبات الخيطية من S. سلالة الخباز تفتقر إلى البروتين البريد فرعية اللازمة لATP سينسيز dimerization. بالمقارنة مع الشكل 2، والحبيبات الخيطية من سلالة متحولة تفتقر إلى أعراف رقائقي طبيعي من الميتوكوندريا wildtype. بدلا من ذلك، الحبيبات الخيطية لديها العديد من المقصورات الغشاء الداخلي إما مع أي أعراف أو على شكل بالون أعراف. وبالتالي الإلكترون البرد المقطعي يبرز التغيرات في التشكل الغشاء بسبب الحذف الجين. مقتبس من ديفيز وآخرون 8. انقر هنا لمشاهدة صورة أكبر.

شملت رقمالبريد 4. الخيطية Mitochondrion من فطر P. الوزية. شريحة من خلال حجم الشعاعي الطبقي (يسار) والحجم جعل سطح المصاحب (يمين) من الحبيبات الخيطية من الفطريات الخيطية P. الوزية. في هذا مقطعية، الصفوف من 10 نانومتر الجسيمات (النصال الصفراء) وتقع فوق التلال غشاء منحنية للغاية في أعراف الغشاء الداخلي (انظر فيلم 1). وقد تم تحديد هذه الجسيمات كما dimers ATP سينسيز بواسطة subtomogram المتوسط. من ديفيز وآخرون 9. انقر هنا لمشاهدة صورة أكبر.
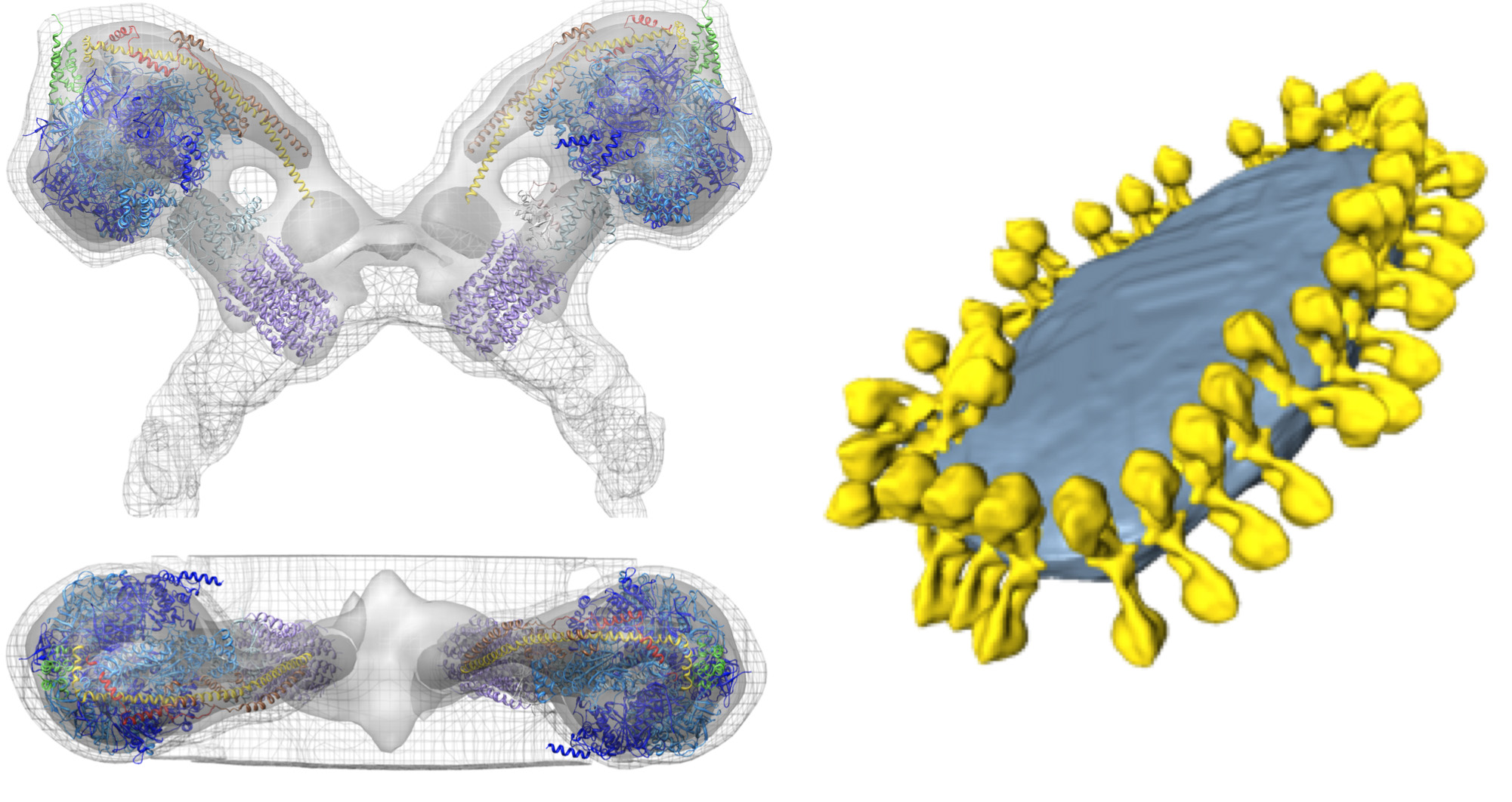
الشكل 5. هيكل وتنظيم سينسيز ATP الميتوكوندريا. جانبية ومن أعلى تبين كثافة الإلكترونات من سينسيز ديمر ATP من S. ج erevisiae على النحو الذي يحدده subtomogram المتوسط مع نماذج الذرية المجهزة (يسار). الميتوكوندريا الداخلية غشاء الحويصلة تبين تنظيم ATP dimers سينسيز في الصفوف (يمين). تكونت الرقم عن طريق وضع المتوسط subtomogram من سينسيز ديمر ATP في حجم مجزأة من حويصلة الغشاء، وذلك باستخدام الإحداثيات خلال حساب المتوسط. مقتبس من ديفيز وآخرون 8. نماذج الذرية: F 1 / الدوار الدائري [PDB: 2WPD] 39 (الأزرق والأرجواني). أوليغوميسين حساسة تمنح البروتين OSCP [PDB: 2BO5] 40 (الخضراء). الطرفية ساق جزء [PDB: 2CLY] (1) مع بقايا N-النهائية من [PDB: 2WSS] (2) (الأصفر والأحمر) (انظر فيلم 2). اضغط هنا لمشاهدة صورة أكبر.
_upload / 51228 / 51228fig6highres.jpg "العرض =" 500 "/>
الرقم 6. المعزولة عرف الحويصلة من P. الوزية الحبيبات الخيطية. شرائح من حجم المقطعي (يسار) والحجم أصدرت سطح المصاحب (يمين) من حويصلة عرف من P. الوزية. كثافة البروتين جاحظ من الغشاء مرئية بوضوح. كثافة المشار إليها النصال الصفراء هي dimers سينسيز اعبي التنس المحترفين، كما حددها subtomogram المتوسط. وتشير السهام الخضراء لكثافة الأجسام المضادة التي حددها وضع العلامات كما NADH نازعة (مجمع 1، لمزيد من التفاصيل انظر 9). تجزئة من كثافة البروتين يكشف منظمتهم في أعراف، مع dimers ATP سينسيز (الأحمر والأصفر) تشكيل الصفوف على طول التلال أعراف منحنية للغاية والمجمعات NADH نازعة (الأخضر) في المناطق غشاء على جانبي الصفوف (انظر فيلم 3). من ديفيز وآخرون 9.28 / 51228fig7highres.jpg "الهدف =" _ على بياض "> اضغط هنا لمشاهدة صورة أكبر.
الفيلم 1. الكترون البرد مقطعية لP. الوزية الحبيبات الخيطية، ويظهر الفيلم شرائح متتالية من خلال حجم المقطعي التي اتخذت من الحبيبات الخيطية من الفطريات الخيطية P. الوزية. يشار إلى صفوف ATP سينسيز بواسطة النصال الصفراء. يظهر للسطح المقدمة، وحجم مجزأة موقع ATP سينسيز (المجالات الصفراء) فيما يتعلق بنية أعراف 3D. الغشاء الخارجي، والرمادي. غشاء الحدود الداخلي والأزرق الشفاف. أعراف الأغشية والأزرق مبهمة. من ديفيز وآخرون 9. انظر الشكل 4. اضغط هنا لمشاهدة الفيديو.
فيلم 2. المتوسط Subtomogram من الميتوكوندريا ATP سينسيز ديمر من S. الخباز مع نماذج الذرية المجهزة. كان المتوسطتحسب من 121 subvolumes. يتم عرض كثافة على ثلاثة مستويات كفاف: 1S - عيون، 2S - رمادي فاتح و3S - الرمادي الداكن. تم تركيب نماذج الذرية في كثافة استخدام روتين مناسبا متتابعة في الوهم. نماذج الذرية: F 1 / الدوار الدائري [PDB: 2WPD] 39 (الأزرق والأرجواني). أوليغوميسين حساسة تمنح البروتين OSCP [PDB: 2BO5] 40 (الخضراء). الطرفية ساق جزء [PDB: 2CLY] (1) مع بقايا N-النهائية من [PDB: 2WSS]. 2 (الأصفر والأحمر) اضغط هنا لمشاهدة الفيديو.
مقتبس من ديفيز وآخرون 8. انظر الشكل 5.
فيلم 3. المعزولة أعراف الحويصلة من P. وتظهر الحبيبات الخيطية الوز. شرائح متتالية من خلال حجم المقطعي، تليها الحجم أصدرت سطح مجزأة. كثافة البروتين جاحظ من membranه هي واضحة للعيان. كثافة الحمراء والصفراء هي dimers سينسيز اعبي التنس المحترفين. الكثافة الخضراء هي NADH نازعة (مجمع الأول) على النحو الذي يحدده وضع العلامات الأجسام المضادة. من ديفيز وآخرون 9. انظر أيضا الشكل 6. انقر هنا لمشاهدة الفيديو.
Discussion
بروتوكول المعروضة هنا يوفر مقدمة لالبرد ET وsubtomogram المتوسط من الميتوكوندريا، ولكن يمكن تطبيق نفس الإجراء أساسا لأي حجرة أو غشاء الخلية الأخرى. للحصول على أفضل البيانات الممكنة، الخطوات الحاسمة أثناء إجراء وإعداد العينات و الاستراتيجية يغرق عملية التجميد واكتساب البيانات. جودة العينة، وهو أمر حاسم لتحقيق النجاح، ويعتمد على بروتوكول تجميد الأمثل لضمان سماكة الجليد مناسب، وهو أمر ذو أهمية قصوى لصورة جيدة التباين. الاستراتيجية المثلى للحصول على البيانات تعتمد على الصك وعينة. تشمل المعلمات ليكون الأمثل جرعة الإلكترون لكل صورة، مخطط الميل ويزيل التباؤر. الحصول على صورة مقطعية جيد لعينة جيدة يجعل تجهيز جميع المزيد من الخطوات أسهل ويضمن النتيجة النهائية مرضية.
البرد ET جنبا إلى جنب مع المتوسط subtomogram والنموذج المناسب الذري تقدم تفاصيل عن كيفية ترتيب المجمعات البروتين في الالبيئة الخلوية المحلية سعر الفائدة الفعلي. هذه التقنية هي مناسبة بالتساوي للتحقيق في هيكل مجمعات البروتين غشاء الكبيرة، مثل سلسلة supercomplexes التنفسي (1.7 MDA)، dimers سينسيز ATP (2x500 كيلو دالتون)، أو مجمع المسام النووية (~ 120 MDA) 8، 9، 17. تنظيم بطولة dimers سينسيز في الصفوف لا يمكن ملاحظتها بواسطة تقنيات عالية الدقة مثل البلورات بالأشعة السينية، NMR أو واحد الجسيمات البرد EM، لأن تتعطل الصفوف ديمر عن طريق استخراج المنظفات، وهي خطوة ضرورية في العزلة وتنقية مجمعات البروتين الغشاء.
ترتيب سينسيز ATP في صفوف من dimers على طول التلال أعراف هو مبدأ التنظيم العالمي الميتوكوندريا في جميع الأنواع. المجمعات البروتون ضخ سلسلة نقل الإلكترون، في مجمع معين الأول (NADH نازعة)، وتقع في المناطق غشاء جانبي الصفوف 8،9. هذا تنظيم السلسلة التنفسية لها تأثير عميق على الطاقة الحيوية الميتوكوندريا. إذا كانت الصفوف ديمر لا يمكن أن تشكل بسبب غياب مفارز البروتين ديمر محددة، الخلايا تظهر مرة جيل أطول وانخفاض اللياقة البدنية الخلوية، كما لوحظ في متحولة الخميرة هو مبين في الشكل (3) 41. مع الاهتمام المتزايد في أمراض الميتوكوندريا، وهي مفصلة فهم الأساس الجزيئي التركيب الدقيق الذي يحكم وظيفة الميتوكوندريا هو من أهمية قصوى. يوفر الإلكترون البرد المقطعي وجود صلة بين بنية البروتين الذي تحدده أساليب عالية الدقة، وتوزيع وترتيب هذه البروتينات في الغشاء على نطاق نانومتر. هذا يجعل البرد ET أداة أساسية لفهم بنية وظيفة الميتوكوندريا في الصحة والمرض.
وتشمل التطورات التقنية ومزيد من التحسينات في البرد ET استراتيجيات بروتين وضع العلامات لتحديد موقف من البروتيناتن مفارز في المجمعات الجزيئات أو موقع البروتينات متميزة أصغر أو أقل (<0.5 MDA) في الخلايا. بالإضافة إلى ذلك، أساليب المعالجة الهجين EM، التي تجمع بين subtomogram المتوسط مع تحليل جسيم واحد أو إعادة الإعمار حلزونية قد قررت مؤخرا هياكل البروتين ل~ 8 42، 43. وتقتصر هذه الأساليب المعالجة حاليا لتنقية البروتينات، التي يتم فصلها جيدا في الجليد أو تشكيل الجمعيات حلزونية وحاليا لا تنطبق على البيئات الخلوية المزدحمة مثل الميتوكوندريا وأعراف الأغشية. لجمع البيانات، ويجري تطوير الحوسبة والأجهزة أدوات جديدة لتمكين اكتساب مقطعية الآلي، وزيادة تباين الصورة وتقليل الجرعة الإجمالية المطلوبة الإلكترون. الحد الأساسي الوحيد في البرد ET هو الضرر الإشعاعي للعينة بواسطة شعاع الالكترون. هذا يعني أن الإلكترون فقط جرعات منخفضة جدا يمكن استخدامها لتسجيل كل صورة من سلسلة الميل المقطعي، مما أدى إلى ضعف إشارة رنسبة يحد في نهاية المطاف القرار تحقيقه س الضوضاء. وكشف الإلكترون المباشر الجديدة، صدر قبل أقل من عام، ويتم حاليا ثورة مجال واحد الجسيمات البرد EM 44، 45. توفر هذه كاشفات جديدة النقيض أعلى وأفضل قرار في أقل جرعة الإلكترون. للإلكترون البرد التصوير المقطعي، وهذا يعني أن سلسلة الميل مع أحجام خطوة صغيرة أو حتى tomograms محور مزدوج يمكن جمعها دون المخاوف بشأن أضرار الإشعاع المفرط (اتفاقية مكافحة التصحر صورة واحدة تعادل في جرعة الإلكترون إلى 5 الصور مباشرة كاشف الإلكترون). على كميات هائلة من البيانات التي تنتجها هذه كاشفات تخلق التحديات الخاصة في التعامل مع البيانات ومعالجتها وتخزينها، والتي سيتعين التغلب عليها.
وبالإضافة إلى ذلك، لوحات المرحلة، والتي تعمل على مبادئ مماثلة لتلك التي تستخدم بشكل روتيني في المجهر الضوئي لتعزيز المرحلة النقيض من ذلك، يجري حاليا تطويرها للانتقال المجهر الإلكتروني 46، 47. هذا يجب أن تسمح tomograms التي يتعين جمعها أقرب إلى التركيز وبالتالي على دقة أعلى، بينما في نفس الوقت الحفاظ على منخفضة الدقة الميزات الضرورية للمواءمة وتفسير أحجام تصوير الشعاعي الطبقي. أخذت معا، فإن هذه التطورات التكنولوجية بشكل كبير توسيع نطاق الأسئلة البيولوجية التي يمكن معالجتها من خلال البرد ET.
Disclosures
تعلن الكتاب أنه ليس لديهم المصالح المالية المتنافسة.
Acknowledgements
وأيد هذا العمل من قبل جمعية ماكس بلانك (KMD، BD، AWM، السل، TBB، DJM، وWK)، الكتلة التميز فرانكفورت "المجمعات ضخم الجزيئات" بتمويل من جمعية الألمانية للبحوث (WK) وما بعد الدكتوراه EMBO طويل الأجل الزمالة (VAMG).
Materials
| Name | Company | Catalog Number | Comments |
| Sucrose | Roth | 4621.2 | |
| Trehalose | Sigma-Aldrich | T9449 | |
| HEPES | Sigma-Aldrich | H3375 | |
| Zymolase | biomol | Z1000.1 | |
| Density gradient medium | Sigma-Aldrich | D1556 or P1644 | |
| Protein A gold | Aurion | 810.111 | 10 nm |
| Ethane | Air Liquide | P0502S02R0A001 | |
| Nitrogen | Air Liquide | I4150RG | |
| Consumables | |||
| Filter paper | Whatman, GE Healthcare | 1004 090 | Nr 4 |
| Tweezers | Dumont | T506 | Non-magnetic, pattern #5 |
| EM combined test grid | Plano GmbH | S142 | grapite and gold islands on holey carbon film |
| Holey carbon grids | Quantifoil Micro Tools GmbH or C-flat | R2/2 300 Cu mesh | |
| Cryo grid boxes | Plano GmbH | 160-42 | Alternative home-made metal boxes |
| Potter | Sigma-Aldrich | P7984 | |
| Blender | Waring | 8011S | |
| Glass bead mill - bead beater | BioSpec Products | 1107900-105 | Including 0.5 mm beads |
| Ball-bearing (Balch) homogeniser | isobiotec | H8 | |
| Centrifuge | Thermo Scientific | 46915 | Sorvall RC6+ |
| Glow-discharge apparatus | Bal-Tec A.G. | CTA 010 | |
| Grid vitrification device | FEI, Gatan or Leica | Alternative home-made plunger | |
| Transmission electron microscope | FEI or Jeol | 300 keV | |
| Direct electron detector | Gatan | K2 summit | 4k x 4k pixels, counted mode |
| Charge coupled device (CCD) | Gatan | US4000 | 4k x 4k pixels (alternative to Direct electron detector) |
| Energy filter | Gatan or Jeol | ||
| Software | |||
| Image acquisition software | Gatan | ||
| Tomogram acquisition software | Gatan, FEI, USCF, or UC-Boulder | 4 alternatives | |
| Tomogram processing software | FEI, UCSF or UC-Boulder | 3 alternatives | |
| Subtomogram averaging software | UC-Boulder, or University of Basel | 2 alternatives | |
| Tomogram visualization software | UC-Boulder, FEI, or University of Utah | 3 alternatives | |
| Visualization software plugin | Goethe university | http://www.biophys.uni-frankfurt.de/frangakis/ | |
| Structure visualization software | UCSF | http://www.cgl.ucsf.edu/chimera/ | |
| Numerical calculation software | MathWorks | http://www.mathworks.de/academia/ | |
References
- Dickson, V. K., Silvester, J. A., Fearnley, I. M., Leslie, A. G., Walker, J. E. On the structure of the stator of the mitochondrial ATP synthase. The EMBO journal. 25, 2911-2918 (2006).
- Rees, D. M., Leslie, A. G., Walker, J. E. The structure of the membrane extrinsic region of bovine ATP synthase. Proceedings of the National Academy of Sciences of the United States of America. 106, 21597-21601 (2009).
- Watt, I. N., Montgomery, M. G., Runswick, M. J., Leslie, A. G., Walker, J. E. Bioenergetic cost of making an adenosine triphosphate molecule in animal mitochondria. Proceedings of the National Academy of Sciences of the United States of America. 107, 16823-16827 (2010).
- Baker, L. A., Watt, I. N., Runswick, M. J., Walker, J. E., Rubinstein, J. L. Arrangement of subunits in intact mammalian mitochondrial ATP synthase determined by cryo-EM. Proceedings of the National Academy of Sciences of the United States of America. 109, 11675-11680 (2012).
- Allen, R. D., Schroeder, C. C., Fok, A. K. An investigation of mitochondrial inner membranes by rapid-freeze deep-etch techniques. The Journal of cell biology. 108, 2233-2240 (1989).
- Strauss, M., Hofhaus, G., Schroder, R. R., Kühlbrandt, W. Dimer ribbons of ATP synthase shape the inner mitochondrial membrane. The EMBO journal. 27, 1154-1160 (2008).
- Dudkina, N. V., Oostergetel, G. T., Lewejohann, D., Braun, H. P., Boekema, E. J. Row-like organization of ATP synthase in intact mitochondria determined by cryo-electron tomography. Biochimica et biophysica acta. 1797, 272-277 (2010).
- Davies, K. M., Anselmi, C., Wittig, I., Faraldo-Gomez, J. D., Kühlbrandt, W. Structure of the yeast F1Fo-ATP synthase dimer and its role in shaping the mitochondrial cristae. Proceedings of the National Academy of Sciences of the United States of America. 109, 13602-13607 (2012).
- Davies, K. M., et al. Macromolecular organization of ATP synthase and complex I in whole mitochondria. Proceedings of the National Academy of Sciences of the United States of America. 108, 14121-14126 (2011).
- Wurm, C. A., et al. Nanoscale distribution of mitochondrial import receptor Tom20 is adjusted to cellular conditions and exhibits an inner-cellular gradient. Proceedings of the National Academy of Sciences of the United States of America. 108, 13546-13551 (2011).
- Schermelleh, L., Heintzmann, R., Leonhardt, H. A guide to super-resolution fluorescence microscopy. The Journal of cell biology. 190, 165-175 (2010).
- Austin, J. R. 2nd, Staehelin, L. A. Three-dimensional architecture of grana and stroma thylakoids of higher plants as determined by electron tomography. Plant physiology. 155, 1601-1611 (2011).
- Ohta, K., et al. Beam deceleration for block-face scanning electron microscopy of embedded biological tissue. Micron. 43, 612-620 (2012).
- Buzhynskyy, N., Sens, P., Prima, V., Sturgis, J. N., Scheuring, S. Rows of ATP synthase dimers in native mitochondrial inner membranes. Biophysical journal. 93, 2870-2876 (2007).
- Larabell, C. A., Nugent, K. A. Imaging cellular architecture with X-rays. Current opinion in structural biology. 20, 623-631 (2010).
- Miao, J., Hodgson, K. O., Sayre, D. An approach to three-dimensional structures of biomolecules by using single-molecule diffraction images. Proceedings of the National Academy of Sciences of the United States of America. 98, 6641-6645 (2001).
- Maimon, T., Elad, N., Dahan, I., Medalia, O. The human nuclear pore complex as revealed by cryo-electron tomography. Structure. 20, 998-1006 (2012).
- Meyerson, J. R., et al. Determination of molecular structures of HIV envelope glycoproteins using cryo-electron tomography and automated sub-tomogram averaging. Journal of visualized experiments : JoVE. (58), (2011).
- Chen, S., et al. Electron cryotomography of bacterial cells. Journal of visualized experiments : JoVE. (39), (2010).
- Bharat, T. A., et al. Structural dissection of Ebola virus and its assembly determinants using cryo-electron tomography. Proceedings of the National Academy of Sciences of the United States of America. 109, 4275-4280 (2012).
- Bennett, A. E., et al. Ion-abrasion scanning electron microscopy reveals surface-connected tubular conduits in HIV-infected macrophages. PLoS pathogens. 5, e1000591(2009).
- Liu, J., et al. Cellular architecture of Treponema pallidum: novel flagellum, periplasmic cone, and cell envelope as revealed by cryo electron tomography. Journal of molecular biology. 403, 546-561 (2010).
- Liu, J., et al. Intact flagellar motor of Borrelia burgdorferi revealed by cryo-electron tomography: evidence for stator ring curvature and rotor/C-ring assembly flexion. Journal of bacteriology. 191, 5026-5036 (2009).
- Patla, I., et al. Dissecting the molecular architecture of integrin adhesion sites by cryo-electron tomography. Nature cell biology. 12, 909-915 (2010).
- Heuser, T., et al. Cryoelectron tomography reveals doublet-specific structures and unique interactions in the I1 dynein. Proceedings of the National Academy of Sciences of the United States of America. 109, E2067-E2076 (2012).
- Briggs, J. A. Structural biology in situ-the potential of subtomogram averaging. Current opinion in structural biology. 23, (2013).
- Cheng, D., Mitchell, D. R. G., Shieh, D. B., Braet, F. Current Microscopy Contributions to Advances in Science and Technology. Méndez-Vilas, A. 2, Formatex. (2012).
- Brust, D., et al. Cyclophilin D links programmed cell death and organismal aging in Podospora anserina. Aging cell. 9, 761-775 (2010).
- Gregg, C., Kyryakov, P., Titorenko, V. I. Purification of mitochondria from yeast cells. Journal of visualized experiments : JoVE. (30), (2009).
- Bhaskaran, S., et al. Breaking Caenorhabditis elegans the easy way using the Balch homogenizer: an old tool for a new application. Analytical biochemistry. 413, 123-132 (2011).
- Pavlov, P. F., Rudhe, C., Bhushan, S., Glaser, E. In vitro and in vivo protein import into plant mitochondria. Methods in molecular biology. 372, 297-314 (2007).
- Graham, J. M., et al. Ch. 3, Current protocols in cell biology. Bonifacino, J. S. , John Wiley and Sons. (2001).
- Zheng, S. Q., et al. UCSF tomography: an integrated software suite for real-time electron microscopic tomographic data collection, alignment, and reconstruction. Journal of structural biology. 157, 138-147 (2007).
- Mastronarde, D. N. Automated electron microscope tomography using robust prediction of specimen movements. Journal of structural biology. 152, 36-51 (2005).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD. Journal of structural biology. 116, 71-76 (1996).
- Pruggnaller, S., Mayr, M., Frangakis, A. S. A visualization and segmentation toolbox for electron microscopy. Journal of structural biology. 164, 161-165 (2008).
- Scheres, S. H., Chen, S. Prevention of overfitting in cryo-EM structure determination. Nature methods. 9, 853-854 (2012).
- Pettersen, E. F., et al. UCSF Chimera--a visualization system for exploratory research and analysis. Journal of computational chemistry. 25, 1605-1612 (2004).
- Dautant, A., Velours, J., Giraud, M. F. Crystal structure of the Mg.ADP-inhibited state of the yeast F1c10-ATP synthase. The Journal of biological chemistry. 285, 29502-29510 (2010).
- Carbajo, R. J., et al. Structure of the F1-binding domain of the stator of bovine F1Fo-ATPase and how it binds an alpha-subunit. Journal of molecular biology. 351, 824-838 (2005).
- Paumard, P., et al. The ATP synthase is involved in generating mitochondrial cristae morphology. The EMBO journal. 21, 221-230 (2002).
- Bharat, T. A., et al. Structure of the immature retroviral capsid at 8 A resolution by cryo-electron microscopy. Nature. 487, 385-389 (2012).
- Bartesaghi, A., Lecumberry, F., Sapiro, G., Subramaniam, S. Protein secondary structure determination by constrained single-particle cryo-electron tomography. Structure. 20, 2003-2013 (2012).
- Bai, X. C., Fernandez, I. S., McMullan, G., Scheres, S. H. Ribosome structures to near-atomic resolution from thirty thousand cryo-EM particles. eLife. 2, e00461(2013).
- Li, X., et al. Electron counting and beam-induced motion correction enable near-atomic-resolution single-particle cryo-EM. Nature methods. , (2013).
- Danev, R., Nagayama, K. Optimizing the phase shift and the cut-on periodicity of phase plates for TEM. Ultramicroscopy. 111, 1305-1315 (2011).
- Walter, A., et al. Practical aspects of Boersch phase contrast electron microscopy of biological specimens. Ultramicroscopy. 116, 62-72 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved