Method Article
ויזואליזציה של הדימרים synthase ATP במיטוכונדריה על ידי אלקטרונים קריו טומוגרפיה
In This Article
Summary
אנו מציגים פרוטוקול של איך לאסוף ואלקטרון תהליך cryo-tomograms של כל המיטוכונדריה. הטכניקה מספקת מידע מפורט לגבי המבנה, תפקוד, והארגון של קומפלקסי חלבוני קרום גדולים בקרומים ביולוגיים מקומיים.
Abstract
cryo-טומוגרפיה של האלקטרון היא כלי רב עוצמה בביולוגיה מבנית, מסוגל לדמיין את המבנה התל ממדי של דגימות ביולוגיות, כגון תאים, האברונים, שלפוחית קרום, או וירוסים בפירוט מולקולרי. כדי להשיג זאת, המדגם המימית הוא מזוגג במהירות באתאן הנוזלי, השומר אותו ב, מדינה קפוא התייבשות קרובה לילידים. במיקרוסקופ האלקטרונים, סדרת הטיה נרשמת בטמפרטורה של חנקן נוזלי, שממנו tomograms 3D משוחזר. יחס אות לרעש של טומוגרפיה הנפח הוא מטבעו נמוך. תכונות מוכרות, חוזרות משופרות באמצעות מיצוע subtomogram, שבו subvolumes בודד לגזור, מיושר וממוצע כדי להפחית את הרעש. בדרך זו, 3D מפות עם רזולוציה של 2 ננומטר או טוב יותר ניתן להשיג. התאמה של מבנים ברזולוציה גבוהה הזמינים ל3D הנפח ואז מייצרת מודלים אטומיים של קומפלקסי חלבונים בסביבה הטבעית שלהם. כאן אנו מראים כיצד אנו משתמשים cryo-tomograp אלקטרוןHY ללמוד הארגון באתרו של קומפלקסי חלבוני קרום גדולים במיטוכונדריה. אנו מוצאים כי synthases ATP מאורגנים בשורות של הדימרים לאורך קודקודיו מעוגלים מאוד של cristae הקרום הפנימי, ואילו אני מורכב מופץ באופן אקראי באזורי הקרום משני צדי השורות. על ידי מיצוע subtomogram השגנו מבנה של דימר synthase ATP במיטוכונדריה בתוך קרום cristae.
Introduction
המיטוכונדריה הוא הכח, בתים של התא. על ידי המרת שיפוע פרוטון אלקטרוכימי על פני קרום המיטוכונדריה הפנימי לתוך קשר כימי באנרגיה, synthase ATP במיטוכונדריה מייצר את רוב ATP שמניע את תהליכים תאיים. על מנת להבין את המנגנונים שמאחורי המרת אנרגיה של המיטוכונדריה, אנחנו צריכים לקבוע את המבנה של synthase ATP באתר, ולגלות איך זה מסודר והופץ בקרום המיטוכונדריה הפנימי. למרות שמבנים ברזולוציה גבוהה של רוב המרכיבים של המיטוכונדריה ATP synthase 1-3 והמפות ברזולוציה הנמוכה של 4 המורכבים כולו זמינים, חשוב להקים את המבנה וקונפורמציה של האנזים הפועל בקרום. חלוקת synthase ATP בקרום המיטוכונדריה הפנימית כבר הניחה באופן נרחב כדי להיות אקראי, אבל מוקדם מציאת 5 והתוצאות הראשוניות שלנו 6 הצביעו על כך שזה לא tהוא המקרה. מחקרים מאוחרים יותר מהקבוצה שלנו ואחרים 7 אישרו כי synthase ATP מסודר בשורות של הדימרים לאורך הרכסים בחוזקה המעוגלים של cristae קרום המיטוכונדריה הפנימי 8 ארוכות, ואילו משאבות הפרוטון של שרשרת העברת אלקטרונים מופיעות להיות ממוקמות בכל צד של השורות 9. יש הסדר זה השלכות חשובות על המנגנונים של המרת אנרגיה של המיטוכונדריה.
הטכניקה ששמשנו לקביעת הסדר זה היא cryo-טומוגרפיה של אלקטרון (cryo-ET). Cryo-ET הוא כיום השיטה היחידה המספקת כמויות מדויקות תלת ממדים (3D) של תאים, תאים סלולריים או אברונים ברזולוציה מולקולרית. Cryo-ET הוא מתאים במיוחד ללימוד מתחמים גדולים בממברנות ביולוגיות, משום שהקרומים מופיעים עם ניגודיות טובה וקלים לאתר בכרכי טומוגרפיה 3D.
שיטות אחרות כדי ללמוד את מבנה 3D של תאים או organelles לא מספק פירוט מולקולרי. הרזולוציה סופר מיקרוסקופ אור 10, 11 היא מעולה בחושף את העמדה או מרחקים בין תוויות פולטות אור מחוברות לחלבוני עניין עם דיוק של עשרות ננומטר, אבל זה לא לחשוף את המבנה של החלבון עצמו, אפילו ברזולוציה נמוכה . במיקרוסקופ אלקטרונים הילוכים סעיפים סידוריים 12 או לחסום פנים הדמיה על ידי סריקה במיקרוסקופ אלקטרונים 13 של דגימות ביולוגיות מוטבע פלסטיק לספק תצוגות ברזולוציה נמוכה של כרכים סלולריים אבל גם לא חושף פרטים מולקולריים. כוח מיקרוסקופיה האטומית 14 יכולה בעיקרון לספק רזולוציה מולקולרית או אפילו אטומית, אבל רק על פני השטח של אובייקטים על תמיכה אטומית שטוחה, מוצקה. לבסוף, טומוגרפיה רנטגן 15 או פיזור של פולסים חזקים של קרינת X מלייזרי אלקטרונים חופשיים היא 16 סבירה כדי לחשוף את המבנה של אובייקטים גדולים ומורכבים, לא מחזוריים כגון תאים או אברונים שלמים במ 'הרזולוציה olecular בעתיד הנראה לעין. כך בהווה, אין חלופה לקריו ET ללימודים של מבנה 3D של תאים או אברונים ברזולוציה ננומטר.
Cryo-ET הוא שיטת הבחירה לבחינת המבנה והמבנה של מכלולים הקשורים חלבון קרום כוללים המתחם הגרעיני הנקבובית 17, ספייק שפעת קומפלקסי 18, ושוטונים חלבוני מנוע 22, 23 אלא גם הארגון של תאים שלמים של חיידקי 19 וכניסה של וירוסים פתוגניים כגון HIV בתאי 20-23. Cryo-ET הוא לא יסולא בפז המאפשר הדמיה חלבונים סיביים ויחסי הגומלין שלהם בתא, כולל סיביים אקטין 24 או axonemes 25. הרזולוציה ניתן לשפר עד 2 ננומטר או טוב יותר על ידי subtomogram ממוצע 26, לפיה subvolumes של תכונות חוזרות ונשנות, רגילות נחתכות מטומוגרפיה נפח ובממוצע על ידי פרו תמונת חלקיק יחידטכניקות cessing.
Cryo-ET כרוך ברכישה של סדרה של תמונות הקרנה של דגימה דקה (<250nm) נלקחה בזוויות הטיה שונות במיקרוסקופ אלקטרונים הילוכים (TEM). הדגימה חייבת להיות רזה כדי שאלקטרונים, אשר אינטראקציה חזקה עם עניין, פזורים לא יותר מפעם אחת. פיזור מרובה הופך את התמונות וכתוצאה מכך קשה לפרש, ומפחית את הניגוד. תמונות של אזור הדגימה שנבחר מיושרות ביחס לכל אחד אחר ומוקרנות לתוך חלל 3D על ידי תוכנת מחשב מתאימה, יצירת נפח 3D של הדגימה. היישור של התמונות נעזר בסמני fiducial זהב, אשר מעורבבים עם המדגם לפני ההקפאה. סמני fiducial באופן אידיאלי 10 או יותר באופן שווה מופצים צריכים להיות נוכחים בכל תמונה כדי להשיג התאמה טובה.
כדי לצפות בפירוט מולקולרי, דוגמאות הן לצלול קפוא באתאן הנוזלי, השומר על מדינת התייבשות האם שלהם. הקפאה בנוזלאתאן הוא כל כך מהר (~ 10 5 ° C / sec) 27 שהמים אינו להתגבש אבל נשאר במדינה מזוגגת, כמו זכוכית. גביש קרח נזקי היווצרות מבנים ביולוגיים רגישים. כדגימות ביולוגיות סובלות מנזקי קרינה, יש גבול למספר הכולל של אירועי פיזור הדגימה יכולה לסבול. תמונות ובכך רכשו במצב במינון נמוך: שטח של עניין מזוהה בהגדלה נמוכה (1,500X) עם מינון אלקטרון להלן דואר 1 - / (מצב חיפוש) ננומטר 2. התמונה לאחר מכן התמקדה בהגדלה גבוהה יותר, את האזור של עניין (מצב מיקוד). רק כאשר תמונה שנרכשה, את תחומי עניין שלו מוקרנים עם מינון גבוה יותר אלקטרונים (מצב חשיפה).
כאן, אנו מציגים סקירה של איך לאסוף וcryo-tomograms אלקטרון תהליך, באמצעות הדימרים synthase ATP בקרום המיטוכונדריה הפנימי לדוגמא ירושלים. הפרוטוקול הבא מתאר כיצד להכין מיטוכונדריה לcryo-ET, כיצד להגדיר אתולאסוף סדרת הטיה עם מנה ספציפית כוללת אלקטרון, וכיצד לעבד את הסדרה להטות להשיג 3D נפח של השטח של עניין. סקירה של ההליך מתואר באיור 1.
Protocol
.1 הכנת המיטוכונדריה מתאים או רקמות על ידי צנטריפוגה דיפרנציאלי
סעיף זה מתאר נוהל כללי לבידוד של המיטוכונדריה ללא פגע מאורגניזמים אוקריוטים שונים. רכיבי חיץ ומהירויות צנטריפוגה המדויקות צריכים להיות מותאם לכל רקמה / מינים למדו.
- לשבור תאי חיץ איזוטוני (למשל, 250 סוכרוז מ"מ, 10 HEPES מ"מ pH 7.4), (תפטיר פטרייה) באמצעות טחנת חרוזי זכוכית 28, עיכול אנזימטי של דופן התא (Saccharomyces cerevisiae) 29, homogenizer מיסבים כדורי (אחת -cell אאוקריוטים / תאים / נמטודות תרבות) 30, או בלנדר (רקמות בעלי חיים או צמח) ביום 31 ב.
- הסר פסולת תא על ידי סינון דרך בד מוסלין ואחריו צנטריפוגה במהירות נמוכה (2,000 XG, 4 ° C, 10 דקות).
- לאסוף מיטוכונדריה supernatant והגלול על ידי צנטריפוגה במהירות גבוהה (9,000 XG, 4 ° C, 10 דקות).
- במידת הצורך, להשתמש בשיפוע צעד הצפיפות שוה לטיהור נוספת של שבריר של המיטוכונדריה 32.
2 הכנת המיטוכונדריה לאלקטרונים קריו טומוגרפיה
הסעיף הבא מתאר כיצד להשיג דגימות-התייבשות קפוא לcryo-ET. הערה: השיטה כרוכה בשימוש בחנקן נוזלי קר מאוד ואתאן, אשר יכולה לגרום לכוויות בעור חמורות. משקפי בטיחות וכפפות cryo-הגנה חייבים להיות משוחק. אתאן הנוזלי, שהוא גם דליק, יש לטפל במנדף.
- Resuspend מיטוכונדריה pelleted ב250 trehalose מ"מ, 10 חיץ HEPES מ"מ בpH 7.4 לריכוז של כ 5 מ"ג / חלבון כולל מ"ל.
- רשתות זוהר פריקה EM פחמן מחורר, צד של פחמן, במכשיר ואקום לפי הוראות יצרן.
- נזל כמה מיליליטרים של אתאן על ידי הפניית זרם של גז אתאן על הצד הפנימי של מגניב חנקן נוזלימיכל אלומיניום ed.
- מערבבים השעיה fiducial זהב חלבון מצומדות- 1: 1 עם השעיה של המיטוכונדריה ולהחיל באופן מיידי 3 μl לרשת EM זוהר פריקה שנערכה בפינצטה.
- הנח את פינצטה במכשיר vitrification, למשל, גיליוטינה תוצרת בית. למחוק את נוזל עודף עם טריז של נייר סינון (~ 5 שניות או עד שמפסיק נוזל מתפשט) ולצלול מייד לרשת לאתאן הנוזלי על ידי שחרור על ההדק.
- העבר את הרשת מאתאן הנוזלי לתוך חנקן נוזלי. במהלך העברה, להסיר אתאן העודף מהרשת עם נייר סינון. הנח את הקצה של פיסת נייר סינון בצורת טריז לאתאן הנוזלי. כאתאן הנוזלי עולה, בעדינות לגרור את הרשת עד נייר הסינון אבל לשמור את זה מתחת לחזית הנוזלית. אתאן הנוזלי הוסר מהרשת על ידי פעולת נימים וברגע שכל אתאן הנוזלי הוסר, להעביר באופן מיידי את הרשת לתוך חנקן נוזלי.
- הנח את הרשת המזוגגת לתוך קופסא אחסון רשת,nd לאחסן תחת חנקן נוזלי לשימוש מאוחר יותר כמתאים.
.3 הקלטה של סדרת ההטיה טומוגרפיה
הסעיף הבא מתאר כיצד להגדיר ולאסוף סדרת הטיה טומוגרפית של mitochondrion עם מיקרוסקופ אלקטרונים Polara מצויד במסנן אנרגיית פוסט טור ומצלמת CCD. פרוטוקולים דומים נמצאים בשימוש בכל cryo-מיקרוסקופי האלקטרונים מצוידים בCCD או מצלמות ישירות גלאי אלקטרונים.
- יישר את מיקרוסקופ
- הכנס בדיקת דגימה למשל, גרפיט ואיי זהב על סרט פחמן מחורר.
- מצב חיפוש בחר במערכת במינון הנמוך של מיקרוסקופ.
- להביא מדגם לגובה eucentric. זוהי הנקודה של תנועת XY מינימאלית כאשר ההטיה בעל הדגימה. מרכז נקודת העניין ב 0 ° הטיה, להטות את הבמה כדי 20 ° מחדש מרכז הנקודה על ידי שינוי z-הגובה. חזור אל 0 ° וחזור עד הקיזוז לרוחב ממוזער.
- בחרמצב חשיפה. בחר הגדלה רצויה לאיסוף tomogram (למשל, 25,000X בגלאי ≈ 0.6 ננומטר דגימת גודל פיקסל).
- בחר צמצם הקבל קטן (50-70 מ"מ) ובחר גודל נקודה ועוצמת קרן, כך שהקרן היא פשוט יותר מאשר מכשיר ההדמיה ונותנת קריאת פיקסל של 60 דואר - / פיקסל (CCD) או 14 דואר - / פיקסל / שניות (גלאי אלקטרונים ישירים, מצב ספירה).
- צמצם הקבל מרכז.
- מצא למשל מוקד גאוס, נקודה של ניגוד מינימאלי. קריאת איפוס defocus מיקרוסקופ ונקודות ציר נכונות ומרכז סיבוב פי הוראות יצרן.
- החיוג בdefocus הרצוי להקלטת tomogram. הערה: defocus גבוה (8 מיקרומטר) מגבירה ניגוד אך מפחיתה רזולוציה, ואילו defocus הנמוך (2-4 מיקרומטר) מגדיל רזולוציה על חשבון לעומת זאת.
- מעל חור ריק, ליצור התייחסות רווח חדשה וליישר מסנן אנרגיה על פי יצרן שלהוראות.
- יישר מצבי חיפוש וחשיפה. במצב חשיפה, מרכז נקודת העניין ולעבור למצב החיפוש. הגדלה נבחרת של 1,500X (0.033 מיקרומטר / פיקסל של דגימה בגלאי) וdefocus של 100 מיקרומטר (לניגוד מוגבר). להביא נקודה חזרה ריבית למרכז באמצעות סלילי משמרת תמונה.
- במצב חיפוש, להתאים את גודל מקום ואת עוצמת קרן, כך שהקרן היא פשוט יותר מאשר מכשיר ההדמיה ונותנת קריאת פיקסל של ~ 20 דואר - / פיקסל (CCD) או ~ 8 דואר - / פיקסל / שנייה (גלאי אלקטרונים ישירים, ספירת מצב).
- מציאת שטח דגימה טובה
- הכנס את הרשת עם מיטוכונדריה-התייבשות קפוא למיקרוסקופ האלקטרונים בטמפרטורה של חנקן נוזלי (עיין בהוראות של יצרן EM).
- במצב חיפוש, חיפוש ברשת לתחומי איכות עובי קרח ודגימה מתאימה. קח את תמונת חיפוש 6 שניות של אזורים המבטיחים כדי לקבוע התאמה לאוסף tomogram. Both קרום המיטוכונדריה הפנימי וחיצוני צריך להיות גלוי בהגדלה זו.
- הקלטה של סדרת הטיה טומוגרפיה
- ברגע שאזור דגימה טוב נמצא, להטות את הבמה ± 60 ° כדי לקבוע את טווח ההטיה המרבי שזמין ללא כל חסימה של החשיפה או להתמקד באזור על ידי ברים רשת או גושי קרח.
- על חור מלאת קרח סמוך מראה דומה, לעבור למצב חשיפה ולהתאים את זמן עוצמת קרן או רכישת תמונה יש כל כך כל תמונה נרשמה מינון אלקטרון של 30-50 דואר - / פיקסל לCCDs או 6-8 דואר - / פיקסל / S גלאי אלקטרונים ישירים, לספור מצב.
- לחשב את יחס חלוקת מנה (אני 0 / אני 60) על ידי חלוקת מספר האלקטרונים הממוצע לתמונת 1 שניות נרכשה ב 0 ° עם זה של תמונה 60 °. יחס זה מתאר את העלייה בזמן חשיפה הנדרשת כדי לשמור על ספירת אלקטרונים קבועה לכל תמונה עם הגדלת זווית הטיה (זמן = 1 / c חשיפהמערכת הפעלה (α) n שם (אני 0 / אני 60) = 2 n). היחס משמש גם כאינדיקציה טובה לעובי קרח. tomograms הטוב של המיטוכונדריה נרשם בדרך כלל עם אני 0 / אני 60 = 2.3-2.6.
- מעל חור ריק, לרכוש תמונת 1 שניות במצב חשיפה ולציין את ספירת האלקטרונים ל2. אם ניקח בחשבון את יחס חלוקת המנה, לחשב את המספר הכולל של תמונות שניתן להקליט עבור הסכום כולל מינון אלקטרון ספציפי (לדוגמא, <40 דואר - / 2 לקביעת מבנה ו~ 160 דואר - / 2 למורפולוגיה).
- לקבוע את מרווח ההטיה המתאים לאוסף tomogram על ידי חלוקת טווח ההטיה הכוללת (לדוגמא, 120 ° ל± 60 °) במספר הכולל של תמונות מחושבים ב3.3.4.
- להגדיר ולהקליט tomogram עם הפרמטרים שנקבעו לעיל באמצעות תוכנת איסוף נתונים אוטומטי מתאים 33, 34. סדרת הטיה בדרך כלל התחילה ב± 20 ° ולעבור 0 ° לפני שהגיע בנטיות גבוהות על מנת למקסם את תוכן המידע של תמונות נמוכה הטיה אשר נהרס על ידי מינון אלקטרון הגדלת.
.4 יצירה ופילוח כרכי טומוגרפיה
סעיף זה מתאר כיצד כרכים טומוגרפית של מיטוכונדריה נוצרים סדרת הטיה ואיך כרכי נוכחים לצפייה כללית מ.
- שמור את הסדרה להטות טומוגרפית לספרייה מתאימה. צור ערימת תמונה ולהמיר לפורמט מתאים קובץ עם תוכנות קוד פתוח, כגון dm2mrc או tif2mrc (חבילת IMOD), אשר להמיר .dm3, .dm4 או .tif קבצים לערימות MRC. ערימות MRC נדרשות לשיקום טומוגרפית עם IMOD 35. חבילות אחרות דורשות פורמטים שונים.
- יישר את התמונות וליצור tomogram ידי ביצוע השלבים המפורטים בהדרכת IMOD ( http://bio3d.colorado.edu/imod/doc/etomoTutorial.html ).
- לשפר את הניגודיות של tomogram באמצעות מסנן דיפוזיה איזוטרופי שאינו ליניארי מופץ עם IMOD. מסנן זה עובד היטב עבור ממברנות וחלקיקי קרום הקשורים כגון synthase ATP.
- להדמיה, באופן ידני קטע tomogram באמצעות תוכניות זמינות באופן מסחרי לדוגמא, אמירה. הקצאת voxels המתאימים הקרום הפנימי או חיצוני וליצור משטח. שימוש באפשרות השלט בתוסף EM-חבילה לעמירה 36 לסמן את המיקום של חלקיקי synthase ATP.
מיצוע .5 Subtomogram של הדימרים synthase ATP והתאמה של מבני X-Ray
הסעיף הבא מתאר כיצד ניתן להשיג ממוצעי subtomogram של הדימרים synthase ATP.
- שימוש בחלקיקים המסומנים כקלט וחבילת תוכנה מתאימה, כגון "חלקהערכת icle לתכנית 'אלקטרונים טומוגרפיה, לחשב ממוצע subtomogram.
- להערכת רזולוציה, להשוות בין שני ממוצעי subtomogram באופן עצמאי נקבעו על ידי מתאם פגז פורייה 37.
- אם מבנים זמינים, מזח ידוע רנטגן לתוך ממוצע subtomogram על ידי גוף נוקשה הולם, באופן ידני או באמצעות רוטינות עגינה רציפות אוטומטיות כגון אלה בתכנית כימרה 38.
תוצאות
cryo-tomograms אלקטרונים של המיטוכונדריה באופן ברור לחשוף את מורפולוגיה 3D של אברון (איור 2). פילוח ידני של הקרומים בטומוגרפיה נפח ממחיש את המבנה של cristae בmitochondrion. על ידי ההדמיה מיטוכונדריה מזני השמרים נוקאאוט שונים שאין להן מרכיבי חלבון מסוימים, את ההשפעה של חלבונים אלה על מורפולוגיה cristae יכולה על ידי העריכה. איור 3 מציג mitochondrion מזן שמרים חסרי דואר למקטע synthase ATP. רכיב זה של מתחם synthase ATP דרוש לdimerization של synthase ATP במיטוכונדריה. המיטוכונדריה מזן זה חסר cristae שבשבת הרגילה של המיטוכונדריה wildtype (איור 2) ובמקום להכיל מספר תאי קרום הפנימיים. תאים אלה הם גם נטולי cristae או מכילים invaginations הקטן בצורת בלון קרום (איור 3).
בtom ograms עם ניגודיות טובה, קומפלקסי חלבוני המיטוכונדריה גדולים, בהדימרים synthase מקרה ATP זה, הם בקלות נראית לעין (איור 4: 1 סרט). המבנים של הקומפלקסים ניתן לקבוע ב2-3 הרזולוציה ננומטר על ידי מיצוע subtomogram (איור 5; סרט 2). הכרכים הממוצע ניתן להציב בחזרה לtomogram כדי להעריך את הארגון של מתחמים בודדים ביחס לזה ולקומפלקסי חלבונים אחרים בקרום (איור 6; סרט 3).
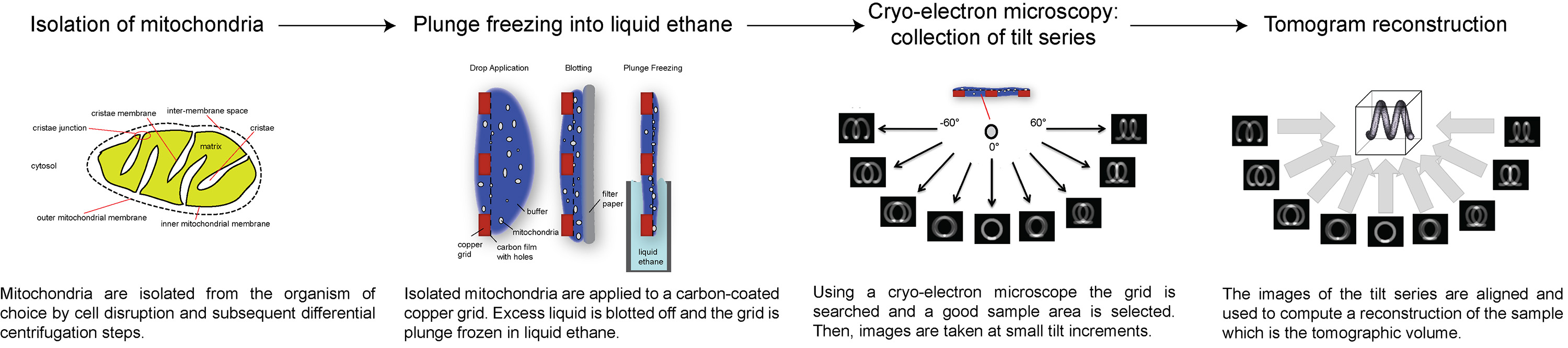
איור 1 תרשים זרימה המציג את השלבים של cryo-טומוגרפיה של אלקטרון. לחץ כאן לצפייה בתמונה גדולה יותר.
ogether.within-page = "תמיד"> 
איור 2 מורפולוגיה של mitochondrion מwildtype S. Cerevisiae. הפרוסה מרכזית באמצעות טומוגרפיה נפח של wildtype ס mitochondrion cerevisiae (משמאל) ומקביל שניתנו משטח נפח (מימין). הנפח המפולח של הקרום החיצוני מוצג באפור והכרכים של הגבול הפנימי וcristae ממברנות בצבע תכלת. מעובד מתוך אל דייויס ואח 8. לחץ כאן לצפייה בתמונה גדולה יותר.

איור 3 mitochondrion מS. מתח cerevisiae חסר מקטע הנדרש לATP dimerization synthase. פורסים באמצעות נפח טומוגרפיה (משמאל) וליווי שניתנו משטח נפח (מימין) של mitochondrion מS. מתח cerevisiae חסר הדואר למקטע חלבון דרוש לdimerization synthase ATP. בהשוואה לאיור 2, mitochondrion מזן המוטציה חסר cristae שבשבת הרגילה של המיטוכונדריה wildtype. במקום זאת, יש לו את mitochondrion רבים תאי קרום פנימי עם או בלי cristae או cristae בצורת בלון. כך אלקטרון cryo-טומוגרפיה מדגישה שינויים במורפולוגיה קרום בשל מחיקות גן. מעובד מתוך אל דייויס ואח 8. לחץ כאן לצפייה בתמונה גדולה יותר.

Figurדואר mitochondrion .4 מהפטרייה פ anserina. פורסים באמצעות נפח טומוגרפיה (משמאל) ונלווה שניתנו משטח נפח (מימין) של mitochondrion מהפטרייה הסיבית פ anserina. בtomogram זה, שורות של 10 חלקיקי ננומטר (ראשי חץ צהובים) ממוקמות מעל רכסי קרום מעוקלים ביותר בcristae הקרום הפנימי (ראה סרט 1). חלקיקים אלה זוהו כהדימרים synthase ATP על ידי מיצוע subtomogram. מדייויס et al 9. לחץ כאן לצפייה בתמונה גדולה יותר.
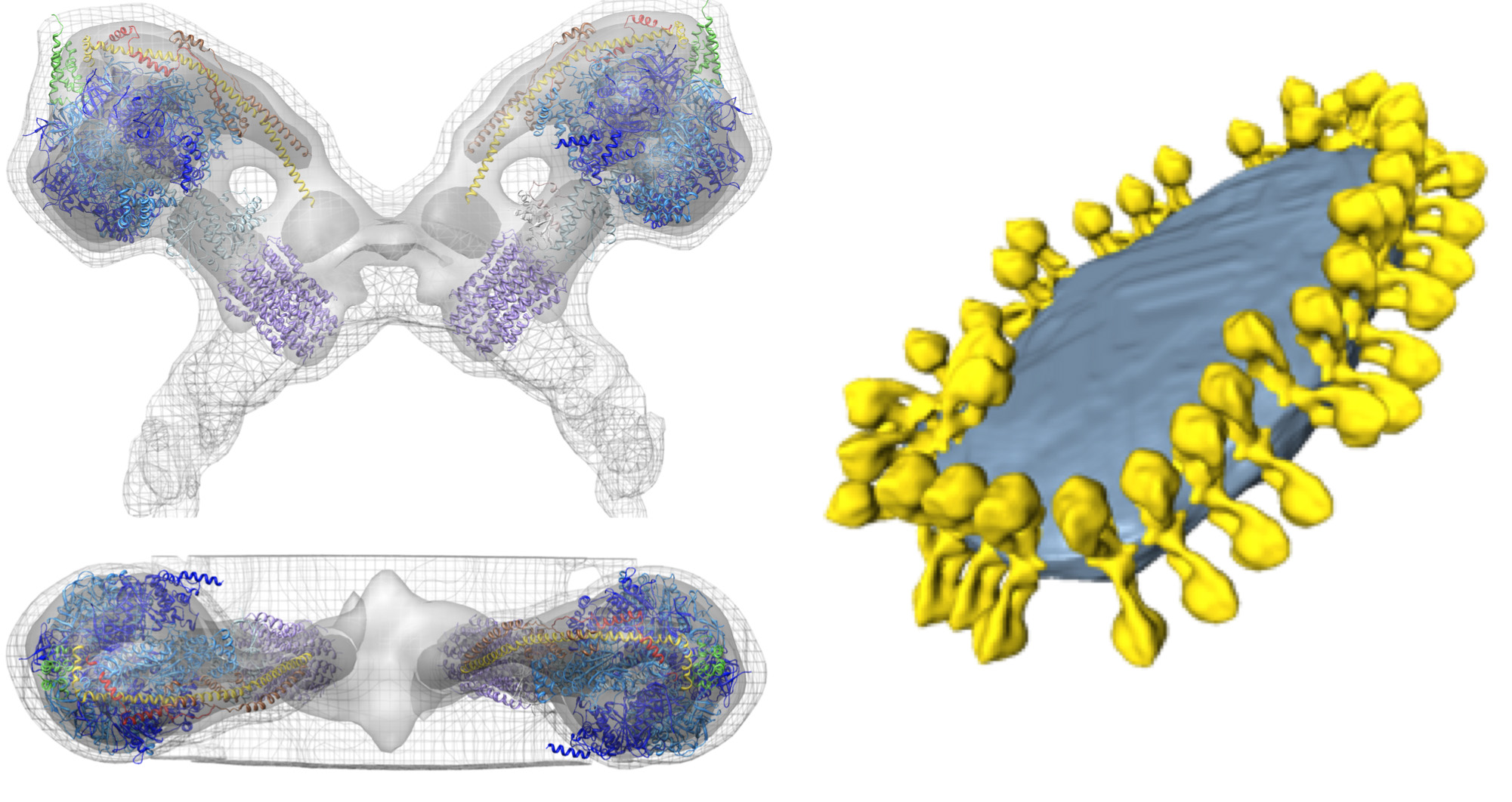
איור מבנה .5 וארגון של synthase ATP במיטוכונדריה. צד ומבט מלמעלה מראה את צפיפות האלקטרונים של דימר synthase ATP מס ג erevisiae כפי שנקבע על ידי מיצוע subtomogram עם מודלים אטומיים מצוידים (משמאל). שלפוחית מיטוכונדריאלי הפנימית קרום מראה את הארגון של הדימרים synthase ATP בשורות (מימין). הדמות נוצרה על ידי מיקום ממוצע subtomogram של דימר synthase ATP לתוך הנפח המפולח של שלפוחית הקרום, באמצעות הקואורדינטות מחושבים בממוצע. מעובד מתוך אל דייויס ואח 8. מודלים אטומי: F 1 / רוטור טבעת [PDB: 2WPD] 39 (כחול וסגול); oligomycin רגיש חלבון OSCP המקנה [PDB: 2BO5] 40 (ירוק); בר גבעול היקפי [PDB: 2CLY] 1 עם שאריות N-מסוף מ[ PDB: 2WSS] 2 (צהוב ואדום) (ראה סרט 2). לחץ כאן לצפייה בתמונה גדולה יותר.
_upload / 51,228 / "width =" 51228fig6highres.jpg 500 "/>
איור 6 מבודדות שלפוחית Crista מפ anserina mitochondrion. פרוסות מטומוגרפיה נפח (משמאל) ונלווה שניתנו משטח נפח (מימין) של שלפוחית Crista מפ anserina. צפיפות חלבון הבולטת מהקרום גלויה לעין. הצפיפויות שצוינו על ידי ראשי חץ צהובים הן הדימרים synthase ATP, כפי שזוהו על ידי מיצוע subtomogram. ראשי חץ ירוקים מצביעים על צפיפות זוהתה על ידי תיוג נוגדן כדהידרוגנז NADH (מורכב 1; לפרטים ראו 9). פילוח צפיפות החלבון מגלה הארגון שלהם בcristae, עם הדימרים ATP synthase (האדומים וצהובים) ויצרו שורות לאורך רכסי cristae המעוקלים מאוד ומתחמי דהידרוגנז NADH (הירוק) באזורי הקרום משני צדי השורות (ראה סרט 3). מדייויס et 9 אל.28 51228fig7highres.jpg "target =" / _blank "> לחץ כאן כדי להציג תמונה גדולה יותר.
סרט .1 אלקטרונים cryo-tomogram של פ anserina mitochondrion. הסרט מראה פרוסות רצופות באמצעות טומוגרפיה נלקח מmitochondrion מהפטרייה הסיבית פ נפח anserina. שורות של synthase ATP מסומנות על ידי ראשי חץ צהובים. , הנפח המפולח שניתנו המשטח מציג את המיקום של synthase ATP (ספירות צהובות) ביחס למבנה cristae 3D. קרום חיצוני, אפור; קרום פנימי גבול, כחול שקוף; cristae קרומים, כחול אטום. מדייויס et 9 אל. ראה גם באיור 4. לחץ כאן לצפייה בוידאו.
סרט .2 ממוצע Subtomogram של דימר synthase ATP במיטוכונדריה מS. Cerevisiae עם מודלים אטומיים מצוידים. הממוצע היהמחושב מ121 subvolumes. הצפיפות מוצגת בשלוש רמות גובה: 1s - רשת, 2s - אפור ו-3 אור - אפור כהה. מודלים אטומי הותאמו לצפיפות באמצעות שגרת הכושר רציפה בכימרה. מודלים אטומי: F 1 / רוטור טבעת [PDB: 2WPD] 39 (כחול וסגול); oligomycin רגיש חלבון OSCP המקנה [PDB: 2BO5] 40 (ירוק); בר גבעול היקפי [PDB: 2CLY] 1 עם שאריות N-מסוף מ[ PDB: 2WSS]. 2 (צהוב ואדום) לחץ כאן לצפייה בוידאו.
מעובד מתוך אל דייויס ואח 8. ראה גם באיור 5.
סרט .3 מבודדות שלפוחית cristae מפ anserina mitochondrion. פרוסות רצופות באמצעות טומוגרפיה הנפח מוצג, ואחריו המפולח שניתנו משטח הנפח. צפיפות חלבון הבולטת מmembranהדואר גלוי לעין. צפיפויות אדומות וצהובות הן הדימרים synthase ATP. צפיפויות ירוקות הם דהידרוגנז NADH (אני מורכב) כפי שנקבע על ידי תיוג נוגדן. מדייויס et 9 אל. ראה גם באיור 6. לחץ כאן לצפייה בוידאו.
Discussion
הפרוטוקול המובא כאן מספק מבוא לקריו ET ומיצוע subtomogram של מיטוכונדריה, אבל בעצם אותו ההליך יכול להיות מיושם על כל תא תא אחר או קרום. כדי להשיג את הנתונים הטובים ביותר האפשריים, שלבים קריטיים במהלך ההליך הם הכנת מדגם, אסטרטגיית רכישת תהליך ההקפאה לצלול ונתונים. איכות מדגם, שהוא קריטי להצלחה, תלויה בפרוטוקול הקפאה מותאמת על מנת להבטיח עובי קרח מתאים, אשר הוא בעלת חשיבות עליונה לניגוד תמונה טוב. אסטרטגיית הרכישות של נתונים אופטימליות תלויה במכשיר והמדגם. פרמטרים להיות מותאמים כוללים מנת אלקטרון לכל תמונה, תכנית ההטיה וdefocus. רכישת tomogram טובה של מדגם טוב עושה את כל העיבוד נוסף על שלבים יותר קל ומבטיח תוצאה סופי משביעת רצון.
שילוב Cryo-ET עם מיצוע subtomogram והמתאים מודל אטומי מספק פרטים של איך קומפלקסי חלבונים מסודרים בהסביבה סלולרית ילידי Eir. הטכניקה היא מתאים באותה מידה לחקירת המבנה של קומפלקסי חלבוני קרום גדולים, כגון supercomplexes נשימה שרשרת (1.7 מד"א), הדימרים synthase ATP (2x500 KDA), או מורכבת הנקבובית הגרעיני (~ 120 מד"א) 8, 9, 17. הארגון של הדימרים synthase ATP לשורות לא יכול להיות שנצפה על ידי טכניקות ברזולוציה גבוהה כגון קריסטלוגרפיה רנטגן, NMR או חלקיק יחיד cryo-EM, כי שורות דימר הם שיבשו על ידי מיצוי חומר ניקוי, שבו הוא צעד הכרחי בבידוד וטיהור של קומפלקסי חלבוני קרום.
ההסדר של synthase ATP בשורות של הדימרים לאורך רכסי cristae הוא עיקרון מארגן אוניברסלי של המיטוכונדריה בכל המינים. מתחמי פרוטון שאיבה של שרשרת העברת אלקטרונים, במתחם מסוים אני (dehydrogenase NADH), ממוקמים באזורי הקרום משני צדי השורות 8,9. ארגון זה של שרשרת הנשימה יש השפעה עמוקה על bioenergetics המיטוכונדריה. אם שורות דימר לא יכולות להיווצר בשל העדר של יחידות משנה חלבון דימר ספציפי, תאי תערוכת פעמים דור ארוכים יותר וכושר סלולארי מופחת, כפי שנצפו במוטצית השמרים שמוצגת באיור 3 41. עם העניין ההולך וגובר במחלות מיטוכונדריאליות, מפורטים הבנה של הבסיס המולקולרי השולט ultrastructure ותפקוד המיטוכונדריה היא בעלת חשיבות עליונה. cryo-טומוגרפיה של האלקטרון מספקת קישור בין מבנה חלבון נקבע על פי שיטות ברזולוציה גבוהה, וההפצה וסידור של חלבונים אלה בקרום בקנה המידה של ננומטר. זה עושה cryo-ET כלי חיוני להבנת מבנה ותפקוד של המיטוכונדריה בבריאות ובחוליים.
התפתחויות נוספות טכניות ושיפורים בcryo-ET כוללים אסטרטגיות חלבון תיוג לזהות את עמדתו של protein תת יחידות במתחמי macromolecular או המיקום של חלבונים שונים קטנים יותר או פחות (<0.5 מד"א) בתאים. בנוסף, שיטות עיבוד EM ההיברידי, המשלבות מיצוע subtomogram עם ניתוח חלקיקים בודד או שחזור סליל לאחרונה נקבעו מבנים חלבוניים ל~ 8 42 A, 43. שיטות עיבוד אלו כרגע מוגבלות לחלבונים מטוהרים, אשר מופרדים היטב בקרח או ליצור מכלולי סליל וכרגע אינו ישימים לסביבות סלולריות צפופות כמו המיטוכונדריה וcristae ממברנות. לאיסוף נתונים, כלים מחשוב וחומרה חדשים מפותחים על מנת לאפשר רכישת tomogram אוטומטית, להגדיל את ניגוד תמונה ולהפחית את סך מינון אלקטרון הנדרש. המגבלה הבסיסית בלבד בcryo-ET היא נזקי קרינה למדגם על ידי קרן האלקטרונים. משמעות דבר היא כי מינוני אלקטרון רק נמוכים מאוד יכולים לשמש כדי להקליט כל תמונה של סדרת ההטיה טומוגרפיה, וכתוצאה מכך אות t העניo-רעש יחס שסופו של דבר מגביל את הרזולוציה השגה. הגלאים החדשים האלקטרון ישיר, שוחררו לפני פחות משנה, בימים אלו מהפכה בתחום חלקיק היחיד cryo-EM 44, 45. גלאים החדשים אלה מספקים ניגודיות גבוהה יותר ורזולוציה טובה יותר במינונים נמוכים יותר אלקטרונים. לcryo-טומוגרפיה של אלקטרון, זה אומר שסדרת הטיה עם גדלי צעד קטנים או tomograms ציר אפילו כפול ניתן לאסוף חששות לגבי נזקי קרינה מוגזמים (CCD תמונה אחת שווה במינון אלקטרון עד 5 תמונות גלאי אלקטרונים ישירות) בלי. הכמויות גדולות של נתונים היוצר על ידי גלאים אלה יוצרים אתגרים משלהם בנתונים טיפול, עיבוד ואחסון, אשר יש להתגבר.
בנוסף, צלחות שלב, הפועלות על עקרונות דומים לאלה המשמשים באופן שיגרתי במיקרוסקופ אור כדי לשפר את ניגוד שלב, בימים אלו שפותחו עבור מיקרוסקופ אלקטרונים הילוכים 46, 47. צריך זה לאפשר tomograms שייגבה קרוב יותר להתמקד, ולכן ברזולוציה גבוהה יותר, ואילו באותו הזמן השמירה ברזולוציה נמוכה תכונות הכרחיות ליישור ופרשנות של כרכים טומוגרפית. יחדיו, התקדמות הטכנולוגית אלה תרחיב באופן משמעותי את מגוון שאלות ביולוגיות שניתן לטפל על ידי cryo-ET.
Disclosures
החוקרים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgements
עבודה זו נתמכה על ידי אגודת מקס פלנק (KMD, BD, AWM, שחפת, TBB, DJM, וWK), האשכול של אקסלנס "מכלולי Macromolecular" פרנקפורט ממומן על ידי Deutsche Forschungsgemeinschaft (WK) וטווח ארוך EMBO הבתר מלגה (VAMG).
Materials
| Name | Company | Catalog Number | Comments |
| Sucrose | Roth | 4621.2 | |
| Trehalose | Sigma-Aldrich | T9449 | |
| HEPES | Sigma-Aldrich | H3375 | |
| Zymolase | biomol | Z1000.1 | |
| Density gradient medium | Sigma-Aldrich | D1556 or P1644 | |
| Protein A gold | Aurion | 810.111 | 10 nm |
| Ethane | Air Liquide | P0502S02R0A001 | |
| Nitrogen | Air Liquide | I4150RG | |
| Consumables | |||
| Filter paper | Whatman, GE Healthcare | 1004 090 | Nr 4 |
| Tweezers | Dumont | T506 | Non-magnetic, pattern #5 |
| EM combined test grid | Plano GmbH | S142 | grapite and gold islands on holey carbon film |
| Holey carbon grids | Quantifoil Micro Tools GmbH or C-flat | R2/2 300 Cu mesh | |
| Cryo grid boxes | Plano GmbH | 160-42 | Alternative home-made metal boxes |
| Potter | Sigma-Aldrich | P7984 | |
| Blender | Waring | 8011S | |
| Glass bead mill - bead beater | BioSpec Products | 1107900-105 | Including 0.5 mm beads |
| Ball-bearing (Balch) homogeniser | isobiotec | H8 | |
| Centrifuge | Thermo Scientific | 46915 | Sorvall RC6+ |
| Glow-discharge apparatus | Bal-Tec A.G. | CTA 010 | |
| Grid vitrification device | FEI, Gatan or Leica | Alternative home-made plunger | |
| Transmission electron microscope | FEI or Jeol | 300 keV | |
| Direct electron detector | Gatan | K2 summit | 4k x 4k pixels, counted mode |
| Charge coupled device (CCD) | Gatan | US4000 | 4k x 4k pixels (alternative to Direct electron detector) |
| Energy filter | Gatan or Jeol | ||
| Software | |||
| Image acquisition software | Gatan | ||
| Tomogram acquisition software | Gatan, FEI, USCF, or UC-Boulder | 4 alternatives | |
| Tomogram processing software | FEI, UCSF or UC-Boulder | 3 alternatives | |
| Subtomogram averaging software | UC-Boulder, or University of Basel | 2 alternatives | |
| Tomogram visualization software | UC-Boulder, FEI, or University of Utah | 3 alternatives | |
| Visualization software plugin | Goethe university | http://www.biophys.uni-frankfurt.de/frangakis/ | |
| Structure visualization software | UCSF | http://www.cgl.ucsf.edu/chimera/ | |
| Numerical calculation software | MathWorks | http://www.mathworks.de/academia/ | |
References
- Dickson, V. K., Silvester, J. A., Fearnley, I. M., Leslie, A. G., Walker, J. E. On the structure of the stator of the mitochondrial ATP synthase. The EMBO journal. 25, 2911-2918 (2006).
- Rees, D. M., Leslie, A. G., Walker, J. E. The structure of the membrane extrinsic region of bovine ATP synthase. Proceedings of the National Academy of Sciences of the United States of America. 106, 21597-21601 (2009).
- Watt, I. N., Montgomery, M. G., Runswick, M. J., Leslie, A. G., Walker, J. E. Bioenergetic cost of making an adenosine triphosphate molecule in animal mitochondria. Proceedings of the National Academy of Sciences of the United States of America. 107, 16823-16827 (2010).
- Baker, L. A., Watt, I. N., Runswick, M. J., Walker, J. E., Rubinstein, J. L. Arrangement of subunits in intact mammalian mitochondrial ATP synthase determined by cryo-EM. Proceedings of the National Academy of Sciences of the United States of America. 109, 11675-11680 (2012).
- Allen, R. D., Schroeder, C. C., Fok, A. K. An investigation of mitochondrial inner membranes by rapid-freeze deep-etch techniques. The Journal of cell biology. 108, 2233-2240 (1989).
- Strauss, M., Hofhaus, G., Schroder, R. R., Kühlbrandt, W. Dimer ribbons of ATP synthase shape the inner mitochondrial membrane. The EMBO journal. 27, 1154-1160 (2008).
- Dudkina, N. V., Oostergetel, G. T., Lewejohann, D., Braun, H. P., Boekema, E. J. Row-like organization of ATP synthase in intact mitochondria determined by cryo-electron tomography. Biochimica et biophysica acta. 1797, 272-277 (2010).
- Davies, K. M., Anselmi, C., Wittig, I., Faraldo-Gomez, J. D., Kühlbrandt, W. Structure of the yeast F1Fo-ATP synthase dimer and its role in shaping the mitochondrial cristae. Proceedings of the National Academy of Sciences of the United States of America. 109, 13602-13607 (2012).
- Davies, K. M., et al. Macromolecular organization of ATP synthase and complex I in whole mitochondria. Proceedings of the National Academy of Sciences of the United States of America. 108, 14121-14126 (2011).
- Wurm, C. A., et al. Nanoscale distribution of mitochondrial import receptor Tom20 is adjusted to cellular conditions and exhibits an inner-cellular gradient. Proceedings of the National Academy of Sciences of the United States of America. 108, 13546-13551 (2011).
- Schermelleh, L., Heintzmann, R., Leonhardt, H. A guide to super-resolution fluorescence microscopy. The Journal of cell biology. 190, 165-175 (2010).
- Austin, J. R. 2nd, Staehelin, L. A. Three-dimensional architecture of grana and stroma thylakoids of higher plants as determined by electron tomography. Plant physiology. 155, 1601-1611 (2011).
- Ohta, K., et al. Beam deceleration for block-face scanning electron microscopy of embedded biological tissue. Micron. 43, 612-620 (2012).
- Buzhynskyy, N., Sens, P., Prima, V., Sturgis, J. N., Scheuring, S. Rows of ATP synthase dimers in native mitochondrial inner membranes. Biophysical journal. 93, 2870-2876 (2007).
- Larabell, C. A., Nugent, K. A. Imaging cellular architecture with X-rays. Current opinion in structural biology. 20, 623-631 (2010).
- Miao, J., Hodgson, K. O., Sayre, D. An approach to three-dimensional structures of biomolecules by using single-molecule diffraction images. Proceedings of the National Academy of Sciences of the United States of America. 98, 6641-6645 (2001).
- Maimon, T., Elad, N., Dahan, I., Medalia, O. The human nuclear pore complex as revealed by cryo-electron tomography. Structure. 20, 998-1006 (2012).
- Meyerson, J. R., et al. Determination of molecular structures of HIV envelope glycoproteins using cryo-electron tomography and automated sub-tomogram averaging. Journal of visualized experiments : JoVE. (58), (2011).
- Chen, S., et al. Electron cryotomography of bacterial cells. Journal of visualized experiments : JoVE. (39), (2010).
- Bharat, T. A., et al. Structural dissection of Ebola virus and its assembly determinants using cryo-electron tomography. Proceedings of the National Academy of Sciences of the United States of America. 109, 4275-4280 (2012).
- Bennett, A. E., et al. Ion-abrasion scanning electron microscopy reveals surface-connected tubular conduits in HIV-infected macrophages. PLoS pathogens. 5, e1000591(2009).
- Liu, J., et al. Cellular architecture of Treponema pallidum: novel flagellum, periplasmic cone, and cell envelope as revealed by cryo electron tomography. Journal of molecular biology. 403, 546-561 (2010).
- Liu, J., et al. Intact flagellar motor of Borrelia burgdorferi revealed by cryo-electron tomography: evidence for stator ring curvature and rotor/C-ring assembly flexion. Journal of bacteriology. 191, 5026-5036 (2009).
- Patla, I., et al. Dissecting the molecular architecture of integrin adhesion sites by cryo-electron tomography. Nature cell biology. 12, 909-915 (2010).
- Heuser, T., et al. Cryoelectron tomography reveals doublet-specific structures and unique interactions in the I1 dynein. Proceedings of the National Academy of Sciences of the United States of America. 109, E2067-E2076 (2012).
- Briggs, J. A. Structural biology in situ-the potential of subtomogram averaging. Current opinion in structural biology. 23, (2013).
- Cheng, D., Mitchell, D. R. G., Shieh, D. B., Braet, F. Current Microscopy Contributions to Advances in Science and Technology. Méndez-Vilas, A. 2, Formatex. (2012).
- Brust, D., et al. Cyclophilin D links programmed cell death and organismal aging in Podospora anserina. Aging cell. 9, 761-775 (2010).
- Gregg, C., Kyryakov, P., Titorenko, V. I. Purification of mitochondria from yeast cells. Journal of visualized experiments : JoVE. (30), (2009).
- Bhaskaran, S., et al. Breaking Caenorhabditis elegans the easy way using the Balch homogenizer: an old tool for a new application. Analytical biochemistry. 413, 123-132 (2011).
- Pavlov, P. F., Rudhe, C., Bhushan, S., Glaser, E. In vitro and in vivo protein import into plant mitochondria. Methods in molecular biology. 372, 297-314 (2007).
- Graham, J. M., et al. Ch. 3, Current protocols in cell biology. Bonifacino, J. S. , John Wiley and Sons. (2001).
- Zheng, S. Q., et al. UCSF tomography: an integrated software suite for real-time electron microscopic tomographic data collection, alignment, and reconstruction. Journal of structural biology. 157, 138-147 (2007).
- Mastronarde, D. N. Automated electron microscope tomography using robust prediction of specimen movements. Journal of structural biology. 152, 36-51 (2005).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD. Journal of structural biology. 116, 71-76 (1996).
- Pruggnaller, S., Mayr, M., Frangakis, A. S. A visualization and segmentation toolbox for electron microscopy. Journal of structural biology. 164, 161-165 (2008).
- Scheres, S. H., Chen, S. Prevention of overfitting in cryo-EM structure determination. Nature methods. 9, 853-854 (2012).
- Pettersen, E. F., et al. UCSF Chimera--a visualization system for exploratory research and analysis. Journal of computational chemistry. 25, 1605-1612 (2004).
- Dautant, A., Velours, J., Giraud, M. F. Crystal structure of the Mg.ADP-inhibited state of the yeast F1c10-ATP synthase. The Journal of biological chemistry. 285, 29502-29510 (2010).
- Carbajo, R. J., et al. Structure of the F1-binding domain of the stator of bovine F1Fo-ATPase and how it binds an alpha-subunit. Journal of molecular biology. 351, 824-838 (2005).
- Paumard, P., et al. The ATP synthase is involved in generating mitochondrial cristae morphology. The EMBO journal. 21, 221-230 (2002).
- Bharat, T. A., et al. Structure of the immature retroviral capsid at 8 A resolution by cryo-electron microscopy. Nature. 487, 385-389 (2012).
- Bartesaghi, A., Lecumberry, F., Sapiro, G., Subramaniam, S. Protein secondary structure determination by constrained single-particle cryo-electron tomography. Structure. 20, 2003-2013 (2012).
- Bai, X. C., Fernandez, I. S., McMullan, G., Scheres, S. H. Ribosome structures to near-atomic resolution from thirty thousand cryo-EM particles. eLife. 2, e00461(2013).
- Li, X., et al. Electron counting and beam-induced motion correction enable near-atomic-resolution single-particle cryo-EM. Nature methods. , (2013).
- Danev, R., Nagayama, K. Optimizing the phase shift and the cut-on periodicity of phase plates for TEM. Ultramicroscopy. 111, 1305-1315 (2011).
- Walter, A., et al. Practical aspects of Boersch phase contrast electron microscopy of biological specimens. Ultramicroscopy. 116, 62-72 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved