Method Article
دراسة سرطان البنكرياس الجذعية خصائص الخلايا لتطوير استراتيجيات علاجية جديدة
In This Article
Summary
Pancreatic cancer stem cells (CSCs) can be expanded in vitro using the anchorage-independent sphere culture technique, which represents a powerful tool to study CSC biology and can serve as the first step to develop novel CSC-targeting therapies. Here the methodology for expanding, analyzing and targeting of pancreatic CSCs is provided.
Abstract
غدية الأقنية البنكرياس (PDAC) يحتوي على مجموعة فرعية من الخلايا الجذعية السرطانية مكون للأورام حصرا (الخلايا الجذعية السرطانية) والتي ثبت لدفع بدء الورم، ورم خبيث ومقاومة الاشعاعي والكيماوي. نحن هنا وصف منهجية محددة لزراعة الخلايا الجذعية السرطانية في البنكرياس الإنسان الأساسية في شكل كرات الورم في ظروف مرسى مستقل. تزرع الخلايا في المصل خالية، وظروف غير ملتصقة من أجل إثراء لالخلايا الجذعية السرطانية في حين ذريتهم أكثر متباينة لا البقاء على قيد الحياة وتتكاثر خلال المرحلة الأولى بعد زرع البذور من خلايا مفردة. هذا الاختبار يمكن أن تستخدم لتقدير نسبة الخلايا الجذعية السرطانية موجودة في عدد السكان من الخلايا السرطانية. سواء من حيث الحجم (التي يمكن أن تتراوح 35-250 ميكرومتر) وعدد من المجالات الورم شكلت يمثل النشاط CSC آوى في أي من السكان الجزء الأكبر من الخلايا السرطانية مثقف أو المقطوع حديثا وهضمها الأورام 1،2. باستخدام هذا الاختبار، وجدنا مؤخرا أن الميتفورمين ablates انتقائي pancreatالخلايا الجذعية السرطانية جيم؛ وهو الاكتشاف الذي تم تؤكده أيضا في وقت لاحق من خلال إظهار التعبير تقلص من الجينات / علامات سطح المرتبطة تعدد القدرات وانخفاض في tumorigenicity المجراة من الخلايا المعالجة الميتفورمين. كخطوة أخيرة للتنمية قبل السريرية كنا نعامل والفئران الحاملة الأورام التي أقيمت مع الميتفورمين وجدت لفترات طويلة بشكل ملحوظ البقاء على قيد الحياة. تجري حاليا الدراسات السريرية اختبار استخدام الميتفورمين في المرضى الذين يعانون من PDAC (على سبيل المثال، NCT01210911، NCT01167738، وNCT01488552). ميكانيكيا، وجدنا أن الميتفورمين يؤدي الى أزمة الطاقة القاتلة في الخلايا الجذعية السرطانية من خلال تعزيز أنواع الاكسجين التفاعلية (ROS) الإنتاج والحد من إمكانات عبر الغشاء الميتوكوندريا. في المقابل، لم يكن القضاء عليها غير الخلايا الجذعية السرطانية عن طريق العلاج الميتفورمين، وإنما خضع عكسها اعتقال دورة الخلية. ولذلك، يخدم دراستنا كمثال ناجح للإمكانات تشكيل المجال في المختبر كأداة فحص لتحديد المركبات التي يحتمل استهداف CSCالصورة، ولكن هذه التقنية تحتاج إلى مزيد من في المختبر، والتحقق من صحة الجسم الحي للقضاء على الاكتشافات كاذبة.
Introduction
البنكرياس غدية الأقنية (PDAC) هي واحدة من الأورام الصلبة الأكثر عدوانية. اليوم هو الأكثر شيوعا وفاة 4 تشرين المرتبطة بالسرطان في المجتمع الغربي، ويتوقع أن ترتفع إلى سبب 2 الثانية الأكثر شيوعا خلال العقد المقبل (~ 400،000 حالة وفاة سنويا في جميع أنحاء العالم) 3. وفي وقت التشخيص 90٪ من المرضى الحالي مع متقدمة من المرض، والتي لديها البقاء على قيد الحياة لمدة 5 سنوات أقل من 5٪. وظل هذا المعدل بقاء مخيب للآمال لم يتغير في السنوات ال 50 الماضية على الرغم من الأنشطة البحثية المكثفة على نحو متزايد 4. من 10٪ المتبقية من المرضى الذين لديهم مرض يحتمل "قابل للشفاء من خلال الاستئصال الجراحي، و80٪ يموتون من تكرار في غضون 5 سنوات. لسنوات عديدة كان مستوى الرعاية لمرض متقدمة حيد جيمسيتابين، ولكن هذا يمنح فقط البقاء على قيد الحياة ميزة هامشية 5. التحسينات الصغيرة في البقاء على قيد الحياة على المدى القصير قد تحققت من خلال إضافةمن erlotinib 6 أو 7 capecitabine، إلا أن فائدة البقاء على قيد الحياة هي في ترتيب أسابيع مع بقاء الكلي متوسط تزال ~ 6 أشهر. في الآونة الأخيرة، ظهرت نتائج مشجعة لجيمسيتابين / NAB -paclitaxel 8 والجمع FOLFIRINOX نظام 9،10. هذه العلاجات تحسن متوسط بقاء بنسبة متواضعة 2 و 4 أشهر على التوالي، ولكنها شديدة السمية والناجين على المدى الطويل لا تزال استثناء نادر. على الرغم من أن العلاج يوفر إمكانية للتحسين، وهذه هي الأنظمة السامة التي كثير من المرضى لا تستجيب أو تظهر فقط تحسن تدريجي في البقاء على قيد الحياة. ونتيجة لذلك، هناك حاجة ملحة لاستكمال العلاجات الحالية ووضع الرواية، وأساليب علاجية متعددة الوسائط على الأرجح.
ورم التجانس
لقد أصبح من الواضح بشكل متزايد أن عدم التجانس السرطان لا تقتصر فقط على متميز التطوري subclones داخلهان كل ورم 11، ولكن مدفوعة أيضا المظهري وعدم التجانس الوظيفي والمرونة داخل كل subclone 12. ما يسمى الخلايا الجذعية السرطانية (الخلايا الجذعية السرطانية) أو الخلايا محفز للأورام هي المسؤولة عن عدم التجانس intraclonal 13-16. على وجه التحديد، الخلايا الجذعية السرطانية تمثل مجموعة فرعية من الخلايا السرطانية، ونحن وغيرهم وقد وفرت أدلة قاطعة، وصولا الى خلية واحدة، وأنها تمثل جذور المرض مما أدى لجميع السلالات المتباينة داخل كل subclone السرطان 17. الأهم من ذلك، هذه الخلايا ضرورية لالسلوك المنتشر وتمثل أيضا مصدرا هاما للانتكاس المرض بعد العلاج، وحتى مع الأدوية الفعالة نسبيا قادرة على إحداث الانحدار الورم الأولي (على سبيل المثال، -paclitaxel NAB) 15،18-20. من المهم أن نلاحظ أن الخلايا الجذعية السرطانية لا تمثل بالضرورة بحسن نية الخلايا الجذعية، كما أنها لا تنشأ من خلايا جذعية الأنسجة في كثير من الحالات، وإنما لديهم ACQuired ميزات معينة للخلايا الجذعية. وتعرف معظم هذه ظيفيا، ليتم تجهيز سبيل المثال الخلايا الجذعية السرطانية مع غير محددة قدرة التجديد الذاتي مما يجعلها مقاومة للعلاج الكيميائي التقليدي، وتظهر زيادة الغزو الذي يعزز النشاط النقيلي.
وظيفية الجذعية للسرطان الظواهر الخلية
ويستند هذا النمط الظاهري وظيفية الخلايا الجذعية السرطانية على قدرتها على تجديد الذات، والتي يمكن اختبارها في المختبر باستخدام تشكيل المجال المسلسل والمقايسات تشكيل مستعمرة على التوالي. والأهم من ذلك الخلايا الجذعية السرطانية قادرة على التجديد الذاتي الدب في tumorigenicity الجسم الحي والتي يمكن اختبارها عن طريق الحد من التخفيف في المقايسات فيفو كما قراءات وظيفية في نهاية المطاف، ويفضل خلال زرع المسلسل يدل على حصرية tumorigenicity على المدى الطويل. وعلاوة على ذلك، هناك عدم التجانس داخل مقصورة CSC، مع جزء من السكان متميزة الخلايا الجذعية السرطانية التي تحمل القدرة الحصرية لتثير الانبثاث التي ليست مجردنتيجة مباشرة لالخالصة في tumorigenicity الجسم الحي. في الواقع، الخلايا الجذعية السرطانية metastastitic اكتساب القدرة على التهرب من الورم الرئيسي، البقاء على قيد الحياة في نهاية المطاف anoikis ونقل من والبذور المواقع الثانوية. ويمكن اختبار هذه القدرات الوظيفية المتقدمة في المختبر باستخدام المقايسات الغزو المعدلة والحية باستخدام فحوصات ورم خبيث.
استهداف الخلايا الجذعية للسرطان
نحن وغيرنا قد قدم أدلة مقنعة على أن العلاجات تركز على الورم الجزء الأكبر من الخلايا PDAC متباينة، حتى في تركيبة مع وكلاء استهداف سدى، لا يكون لها تأثير كبير على تطور الورم ونتيجة لاحقة ما لم جنبا إلى جنب مع استراتيجية CSC استهداف 21، 22. وهكذا، استنادا إلى المهام الحاسمة الخلايا الجذعية السرطانية في تطور المرض ومقاومة للعلاج، ينبغي لهذه الخلايا يعني عنصر أساسي لأي نهج العلاج رواية 18،20، ولكن سوف يتطلب فهم أشمل من ذلك بكثير سو آلية تنظيمية الخلايا الجذعية السرطانية. على الرغم من أن الخلايا الجذعية السرطانية وذريتهم أكثر متباينة تتحمل متطابقة دول الأرض الوراثية فيما يتعلق تغيرات جينية، الخلايا الجذعية السرطانية تظهر ملامح متميزة، وبالتالي العزم epigenetically التعبير الجيني أن حصة وحدات مع الخلايا الجذعية المحفزة. وليس فقط تم ربط معظم الجينات المسؤولة عن توليد الخلايا الجذعية المحفزة التي يسببها (NANOG، Oct3 / 4، Klf4، Sox2) إلى السرطان، ولكن يقتصر التعبير عنها في الغالب إلى المقصورة الخلايا الجذعية السرطانية. وعلاوة على ذلك، فقد أنشأت الآن أهمية وظيفية الخلايا الجذعية السرطانية التي كتبها الخسارة من وظيفة التجارب باستخدام الأدوات الوراثية لاستهداف الخلايا الجذعية السرطانية بحزم مفهوم CSC لعدة أنواع السرطان 23-25. في حين أن معظم هذه الطرق تعتمد على نماذج الماوس، وبالتالي غير قابلة للتحويل إلى العيادة بسهولة، وأنها لا توفر إثبات صحة مفهوم لأهميتها السريرية المحتملة لاستهداف الخلايا الجذعية السرطانية في تركيبة مع الخلايا السرطانية بكميات كبيرة.
دراسة الخلايا الجذعية للسرطان في السادسترو إلى التعرف كعب أخيل تلك "
من أجل تحديد طرق جديدة وقابلة للتطبيق سريريا لاستهداف الخلايا الجذعية السرطانية، ودراسة خصائصها بانتظام في المختبر ويستخدم على نطاق واسع تشكيل المجال في هذا السياق. وضعت أصلا لدراسة الطبيعي بيولوجيا الخلايا الجذعية، بما في ذلك تجديد الذات والقدرة على التمايز، وقد تم تكييف هذا الاختبار في وقت لاحق لدراسة الخلايا الجذعية السرطانية في المختبر، واستخدمت لتحقيق الخلايا الجذعية السرطانية معزولة عن PDAC 20. لقد وجدنا أن مجالات ورم يتكون من خلايا PDAC الإنسان الأساسية تحمل كل سمات مميزة الخلايا الجذعية السرطانية، وبالتالي تشير إلى أنها تحتوي على الخلايا الجذعية السرطانية في البنكرياس حسنة النية 21. وهكذا، فإن فحص المجال الورم يمثل أداة قوية للكشف عن علاجات أكثر فعالية في المختبر، ولكنها تحتاج إلى مزيد من النتائج التي جرى تقييمها في أكثر صرامة في المقايسات الجسم الحي. في الواقع، ينبغي أن يعامل البيانات التي تم إنشاؤها مع هذا الاختبار في المختبر بحذر شديد كما في اله فحص قد يكون عرضة للخطأ كبير. بروتوكولات موحدة للغاية، بما في ذلك العد الآلي من المجالات تشكيلها، وينبغي وضع لضمان البيانات استنساخه والتنبؤية.
في هذا السياق، فإننا المستخدمة مؤخرا هذا الاختبار لفحص الخلايا الجذعية السرطانية في البنكرياس المستمدة من مجموعة متنوعة من PDACs الإنسان الابتدائية وبينت أن هذه الخلايا هي معرضة بشدة لإعادة برمجة التمثيل الغذائي من خلال مكافحة السكري ميتفورمين المجمع. سابقا، وقد تجلى ميتفورمين لمنع توسع الخلايا السرطانية عن طريق تنشيط غير مباشر من AMP تنشيط بروتين كيناز (AMPK) مما يشير إلى وتثبيط لاحق من mTOR س 26، مما أدى إلى انخفاض تخليق البروتين وتكاثر الخلايا 27. بالإضافة إلى هذه الآثار على السكان الورم بكميات كبيرة، ونحن وآخرون قد وجدت أن الميتفورمين هو قادرة على استهداف وفعلا القضاء على الخلايا الجذعية السرطانية حيوانية في عدد من الأورام الصلبة مثل سرطان الثدي وسرطان المريء، ورم أرومي وسرطان البنكرياس 28-31 </ سوب>. وبالتالي، يمثل الميتفورمين استراتيجية علاجية جديدة واعدة وآمنة لعدة سرطانات مع الحاجة غير الملباة الطبية حاليا. وعلاوة على ذلك، وذلك باستخدام تشكيل المجال باعتبارها وسيلة لإثراء لالخلايا الجذعية السرطانية، أظهرنا أن الآثار الأولية الميتفورمين على الخلايا الجذعية السرطانية في البنكرياس مستقلة عن تفعيل AMPK وتعتمد في الغالب على سميتها الميتوكوندريا متواضعة (عن طريق تثبيط مجمع I)، الذي كان على ما يبدو قاتلة للمجموعة الفرعية الخلايا الجذعية السرطانية فقط. لهذا الأخير تمكنا من تقييم إنتاج واستهلاك الأوكسجين الميتوكوندريا ROS الخلوي لكونها تبين سمية الدواء على المستوى الخلوي. وفي وقت لاحق، يمكن التحقق من صحة هذه البيانات في المختبر في نماذج الماوس قبل السريرية وبالفعل أدى لفترات طويلة بشكل ملحوظ البقاء على قيد الحياة 31. المنهجية الواردة في هذه الوثيقة تسمح للجيل السريع لمحات حساسية العقاقير لالخلايا الجذعية السرطانية، بما في ذلك دراسات على آثارها على CSC عملية التمثيل الغذائي. نحن نقدم الآن بمد تفاصيل التجريبية حول كوم المستخدمةplementary في التجارب المختبرية وإجراءات الجسم الحي.
Protocol
تم الحصول على الأورام PDAC الإنسان مع الموافقة المسبقة الخطية (كوميونيداد دي مدريد، إسبانيا (CP-CNIO CTC-11 - CI 11/103-E) زرع أورام البنكرياس الإنسان في الفئران العوز المناعي يتطلب موافقة مجلس المراجعة المؤسسية وكذلك المؤسسي يجب أن تتم رعاية الحيوان واللجنة الاستخدام (IACUC) الإجراءات من طعم أجنبي نماذج ورم الماوس البنكرياس وفقا للوائح المؤسسية والوطنية. (هنا جنة الأخلاقيات من معهد السعود كارلوس الثالث؛ مدريد، أسبانيا، والبروتوكول PA 34_2012).
1. الثقافة وسائل الإعلام
- إعداد الكامل المتوسطة.
- تكملة RPMI المتوسطة مع 10٪ FBS، 100 وحدة / مل البنسلين / الستربتومايسين. 500 مل من RPMI إضافة 55 مل من الحرارة المعطل FBS و 6 مل من البنسلين / الستربتومايسين (10000 U / مل، 100X).
- تخزين المتوسطة كاملة في 4 ° C.
- إعداد الخلايا الجذعية السرطانية المتوسطة.
- تكملة المصل خالية DMEM / F12 جامعة المدينة العالميةم مع 100 وحدة / مل البنسلين / الستربتومايسين و 2 ملي الجلوتامين.
- تخزين المتوسطة CSC في 4 ° C. B27 (01:50) و 20 نانوغرام / مل bFGF تضاف حديثا إلى متوسطة قبل كل تجربة.
ملاحظة: وقد تبين أن إضافة B27 لزيادة تكوين المجال الورم وللحفاظ على عدة مقاطع من الثقافات المجال 32. تكوين المتوسط هو خطوة حاسمة ويجب أن يكون اختبار كل نوع من الخلايا في الثقافة. نوصي اختبار التجديد الذاتي والقدرة على التفريق بين المجالات وتحليل التعبير عن علامات CSC التدفق الخلوي (أي CD133 + وCD44 +).
- إعداد خارج الخلية الجريان الفحص المتوسطة.
- هذه الوسيلة المحدد هو DMEM القاعدية 5030 التي تحتوي على الفيتامينات والأحماض الأمينية وغيرها من الملاحق، ولكنها تفتقر الجلوتامين، والجلوكوز، بيروفات والبيكربونات.
- للمقايسة الحالي، تكملة المتوسطة مع 2 ملي الجلوتامين، والجلوكوز 8 مم و 2 مم البيروفات الصوديوم إلى النشاط الأيضي الميتوكوندريا الكامل.
ملاحظة: إن غياب بيكربونات الصوديوم ضروري من أجل قياس دقيق تحمض خارج الخلية من الخلايا نموا في الثقافة، منذ العادية المتوسط تحتوي على بيكربونات سوف العازلة تغيرات درجة الحموضة أثناء الفحص. وبالإضافة إلى ذلك، فإن استخدام وسيلة القاعدية يسمح رقابة مشددة من تركيز L-الجلوتامين (كما L-ألانيل الجلوتامين) الجلوكوز، أو البيروفات الصوديوم اللازمة لفحص ظروف مختلفة و / أو التطبيقات.
2. المجال تشكيل الفحص والتحليل
ملاحظة: يجب تنفيذ جميع بروتوكولات زراعة الأنسجة والتلاعب باستخدام تقنيات معقمة باهتمام كبير باستخدام نظيفة، خالية من المنظفات، والأواني الزجاجية العقيمة. قبل الاستخدام، وقبل دافئ كل المتوسطة والحل في 37 ° C المياه حمام (كبديل، يمكنك استخدام الحلول قبل تحسنت في RT المتوسطة و). الحصول على الأورام PDAC الإنسان كما هو مفصل في السابق 21.
- عزل الخلايا الجذعية السرطانية من PDAC الإنسان (الشكل1)
- في خزانة السلامة البيولوجية العقيمة نقل الأنسجة PDAC الإنسان إلى مم طبق ثقافة 60 × 15 تحتوي على 1 مل من العقيمة 1X الفوسفات مخزنة المالحة (PBS). تخطر على الورم إلى أجزاء صغيرة (1-5 ملم) باستخدام مشرط معقم وملقط.
- إضافة 1 مل العقيمة 1X PBS إلى الطبق الثقافة وكرر الخطوة سحن حتى يتم فصل الأنسجة تماما، بانتظام هذا يتطلب 3-4 جولات. نقل تعليق الأنسجة (أعلى تصل إلى الحجم النهائي من 5 مل مع 1X PBS) في أنبوب معقم والتجانس ميكانيكيا ذلك مع dissociator مثل gentleMACS.
- احتضان النسيج المتجانس مع كولاجيناز (استخدام 2.5 ملغ / مل من كولاجيناز في 1X PBS) لمدة 60 دقيقة عند 37 ° C ثم الطرد المركزي لمدة 5 دقائق في 900 ز س. صب وطاف و resuspend الكريات خلية في 10 مل من المتوسط الشامل. تصفية تعليق الخلية من خلال مصفاة 40 ميكرومتر وأجهزة الطرد المركزي لمدة 5 دقائق في 900 ز س.
- صب وطاف و resuspendبيليه مع 5 مل من خلايا الدم الحمراء تحلل العازلة (كلوريد الأمونيوم والبوتاسيوم، ACK)، واحتضان
- Resuspend وبيليه في الخلايا الجذعية السرطانية المتوسطة، لوحة على طبق الجيلاتين المغلفة، واحتضان عند 37 درجة مئوية لمدة 1 ساعة. وهذه الخطوة إزالة معظم الخلايا الليفية التي تربط بسرعة على لوحة.
- إزالة لوحة من الحاضنة واستعادة بعناية تعليق الخلية وتحديد عدد قابلة للحياة (التريبان الأزرق والسلبية) الخلايا باستخدام عدادة الكريات. لهذا الغرض، المزيج بلطف تعليق وماصة 20 ميكرولتر من تعليق في أنبوب إيبندورف. إضافة 20 ميكرولتر (نسبة 1: 1) من اللون الأزرق التريبان للخلايا في أنبوب microcentrifuge وتخلط جيدا. ماصة ما يقرب من 10 ميكرولتر من الخليط على عدادة الكريات.
- عد جميع الخلايا واضحة في الأرباع الأربعة ركن من الغرفة العد لعدد خلايا قابلة للحياة. ملاحظة: الجدوى والعائد من الخلايا قد تختلف اختلافا كبيرا بين عينات الورم. لPDAC عينات الجدوى يتراوح betwe بانتظامأون 45-70٪، وقطعة نسيج من عينة الورم العيانية التي يبلغ قطرها 3-5 مم ينبغي أن تسفر إلى ما يقرب من 5X10 6 خلايا قابلة للحياة.
- مجال تشكيل الفحص والعلاج ميتفورمين
- أخذ العدد المطلوب من الخلايا وإضافة حجم مناسب من الخلايا الجذعية السرطانية المتوسطة لإعداد تركيز خلية من 2000 خلية / مل. لا تبقي لتعليق الخلية على الجليد لمدة لا تزيد 1H ويخلط جيدا قبل الطلاء.
- إضافة 500 ميكرولتر من 1X PBS إلى الصف الأول والأخير من 24 لوحة جيدا لالترطيب من أجل المساعدة في تقليل التبخر المتوسط. البذور الخلايا إلى خلايا مرفق منخفضة للغاية لوحات في مناطق ذات كثافة من 2000 خلية لكل جيدا في 1 مل من المجال ورم المتوسطة (2000 خلية / مل).
ملاحظة: عدد الخلايا المستخدمة في مجال ورم فحوصات تشكيل قد تختلف بين أنواع الأورام. - علاج لا يقل عن 4 آبار مع السيارة (المراقبة السلبية) و 4 آبار مع كل معاملة المخصصة، على سبيل المثال، 3 ملم من الميتفورمين. ررايس الخلايا في حاضنة لتعيين 37 ° C وتزويد الخلايا مع CO 2 5٪ لمدة أسبوع واحد.
ملاحظة: يجب أن لا يتم تغيير المتوسطة من أجل السماح بتشكيل دون عائق من المجالات الورم، ولكن يمكن تصدرت مع عوامل النمو على أساس يومي لأنها ليست مستقرة في مستنبت. - كل يوم إضافة العلاج، على سبيل المثال، 3 ملم من الميتفورمين أو مركبة على كل من الآبار. تقييم عدد من المجالات الورم تشكلت بعد 5 و / أو 7 أيام عن طريق استخدام عداد الخلايا الآلية التي تسمح للفرز الهياكل الكبيرة (الشكل 2).
ملاحظة: فقط المجالات الورم مع لا يقل عن 40 ميكرون ينبغي النظر ويمكن تصنيفها على أنها صغيرة (40 - 80 ميكرون) أو كبيرة (80-120 ميكرون)، على التوالي. نتائج يمكن كما هو موضح نسبة المجالات الورم مقسوما على العدد الأولي للخلايا المصنف (على سبيل المثال، 2000 الخلايا).
- الركض المسلسل من الجيل الأول الكرات ورم
- بعد 7 أيام من الحضانة حصاد المجالات الورم باستخدام مصفاة الخلية 40 ميكرومتر وأجهزة الطرد المركزي لهم لمدة 5 دقائق في 900 x ج في RT.
- فصل بيليه من المجالات ورم الخلايا واحدة باستخدام التربسين، ومن ثم توسيع الخلايا وحيدة الخلية تعليق تم الحصول عليها مرة أخرى لمدة 7 أيام آخر كما هو موضح أعلاه (انظر 2.2).
3. تحليل الأيض (ROS إنتاج واستهلاك الأوكسجين)
- ROS الإنتاج
- في هذا البروتوكول، ونحن قد استخدمت كربوكسي DCFDA كمثال لقياس إنتاج ROS لأنه هو التحقيق بأسعار معقولة وسريعة وتستخدم على نطاق واسع للكشف عن ROS. ومع ذلك، هناك عدة تحقيقات والمنهجيات الأخرى التي يمكن استخدامها لهذا الاختبار.
- علاج ورم المجالات مع ميتفورمين كما هو موضح في 2.2 لالمبلغ المخصص من الزمن. في نهاية العلاج، الكرات الورم الحصاد باستخدام مصفاة الخلية 40 ميكرومتر، الطرد المركزي الخلايا في 900 x ج لمدة 5 دقائق و resuspend بيليه في 1 مل من trypsفي احتضان لمدة 20 دقيقة عند 37 ° C.
- بمجرد singularized الخلايا، الطرد المركزي في 900 x ج و resuspend الخلايا في HBSS تحتوي على 2.5 ميكرومتر كربوكسي DCFDA. احتضان الخلايا لمدة 20 دقيقة عند 37 درجة مئوية في الظلام.
- قبل تحليل التدفق الخلوي حماية الخلايا الملون من الضوء وكربوكسي-DCFDA يمكن أن يكون إعطاء نتائج إيجابية كاذبة أكسدة صور. وضع أنابيب على الجليد حتى التحليل.
ملاحظة: كربوكسي-DCFDA هو فلوري بعد رد الفعل مع مجموعة متنوعة من أنواع الاكسجين والنيتروجين التفاعلي، ويجري الكشف عنها في FL1 (مثلا: 488nm، 520m الطوق م.).
- قياس الأكسجين استهلاك
- لهذا البروتوكول، ونحن سوف تستخدم نظام خارج الخلية الجريان محلل من فرس البحر العلوم البيولوجية، كمثال على ذلك. معطف المطلوب لوحة زراعة الخلايا بمحلول مكون من 22،4 ميكروغرام / مل من الخلايا والأنسجة لاصق لمدة 20 دقيقة في RT. شطف الآبار بالماء 2-3 مرات قبل البذر الخلايا.
- في نهاية العلاج، الكرات الورم الحصاد باستخدام 40 ميكرومتر مصفاة الخلية، الطرد المركزي الخلايا في 900 x ج لمدة 5 دقائق و resuspend بيليه في 1 مل من التربسين. احتضان لمدة 20 دقيقة عند 37 ° C.
- لوحة singularized الخلايا في لوحة زراعة الخلايا في مناطق ذات كثافة من 30000 خلية / جيدا ل96 لوحة جيدا (الحجم النهائي: 150 ميكرولتر). resuspend الخلايا في استهلاك الأوكسجين فحص المتوسطة التي تحتوي على 8 ملي الجلوكوز و 2 ملي البيروفات الصوديوم.
- الطرد المركزي الخلايا إلى قاع البئر التي تدور الطرد المركزي من الآبار حتى تم التوصل 100 x ج ومن ثم السماح للمحطة الطرد المركزي مع قبالة الفرامل. عكس اتجاه لوحة وتكرار هذه العملية. نقل لوحة إلى 37 درجة مئوية الحاضنة دون إضافة CO 2 لمدة 30 دقيقة.
- في هذه الأثناء، وإعداد خرطوشة للفحص. كل بئر يحتوي على 4 عن طريق الحقن المختلفة لتحميل (25 ميكرولتر / منفذ):
- ميناء A: الميتفورمين. للحصول على تركيز النهائي من 3 ملم في البئر، يعد حل 8X (24 ملم)، حيث بلغ حجم النهائي سيكون 175ميكرولتر بعد حقن ميناء A.
- ميناء B: الميتفورمين. لإضافة 3 مم والحصول على تركيز النهائي من 6 مم في البئر، يعد حل 9X (27 ملم)، حيث بلغ حجم النهائي سيكون 200 ميكرولتر بعد حقن ميناء B.
- ميناء C: الميتفورمين. لإضافة 3 مم والحصول على تركيز النهائي من 9 ملي في البئر، يعد حل 10X (30 مم)، والحجم النهائي سيكون 225 ميكرولتر بعد الحقن من ميناء C.
- ميناء D: روتينون 11 ميكرومتر، للحصول على 1μM كما التركيز النهائي في البئر (11x). ملاحظة: روتينون يمنع تماما أي نشاط الميتوكوندريا المتبقية.
- معايرة خرطوشة وتحميل لوحة الثقافة الخلية. إجراء فحص مع بروتوكول قياسي من الخلط والقياس.
- حساب النسبة المئوية لتثبيط من إجمالي التنفس الميتوكوندريا التي كتبها الميتفورمين التوصل إليها نسبة تثبيط تم الحصول عليها مع روتينون (مجموعة الى 100٪).
4.طعم أجنبي نموذج للالإنسان سرطان البنكرياس في الفئران نقص المناعة
ملاحظة: ترتيب الأعداد الكافية من الإناث، ونماذج عارية أو غيرها من athymic أكثر المناعة الماوس مثل NOD-SCID، SCID-بيج، أو مجموعة موردي المواد النووية للتجارب 33. الأوتوكلاف جميع الأدوات الجراحية قبل التجربة، والسماح لهم ليبرد لRT قبل الاستخدام. للأورام تحت الجلد كنا لا تقل عن 4 الفئران في كل حالة مع ورم واحد في الجناح ليصبح المجموع 8 الأورام.
- طعم أجنبي زراعة
- إعداد قطع الورم من البنكرياس عينات الأنسجة السرطانية البشرية. نقل الورم في طبق بتري وتشريح الأنسجة إلى قطع صغيرة (2 مم في القطر، و~ 8 مم 3) باستخدام مشرط وملقط لعقد الأنسجة. تراجع القطع التي تم الحصول عليها في هلامي حل خليط من البروتين أبقى على الجليد.
- تخدير الفئران باستخدام 1-3٪ isofluorane أو غيرها من التخدير inhalative أو عن طريق الحقن.
ملاحظة: قبل البدء في أي بروك الجراحيةedure، تأكد من أن الفئران قد فقدت تماما وعيه من خلال تحفيز الجلد في منطقة البطن أو يسحب مع زوج من الملقط منشقة. تطبيق مرهم العين لمنع جفاف. - مرة واحدة وقد اتخذت التخدير تأثير، ويمسح الجزء الخلفي من الفئران مع المحتوية على الايثانول الجلد مطهر. إدارة البوبرينورفين (0.05 ملغ / كغ BW) قبل الجراحة لضمان تسكين بعد العملية.
- رفع الجلد مرة أخرى مع ملقط، وجعل 0.7 - 1.0 سم شق طويل مع المقص الصغير معقمة ثم إعداد بصراحة جيب صغير تحت الجلد، حيث يتم إدخال قطعة من النسيج سرطان البنكرياس المستمدة من المريض (~ 8 مم 3).
- إغلاق الجرح باستخدام 1-2 المواد الغذائية الجلد. إزالتها بعد 7 أيام. عودة الفئران لأقفاصها وإبقائها على وسادة التدفئة أو تحت مصباح التدفئة حتى أنها تنشط بشكل كامل مرة أخرى.
- بعد ورم زرع، ومراقبة الفئران على الأقل مرتين أسبوعيا لنمو الورم وعلامات العامة الناشئة الاعتلال مثل الفراء تكدرت، huncheد الموقف، والجمود.
- مرة واحدة وقد وصلت الأورام متوسط حجم 200 ملم 3، يتم اختيارهم بصورة عشوائية الفئران للعلاج منها. إدارة السيارة أو ميتفورمين يوميا عن طريق الحقن الملكية الفكرية (150 ملغ / كغ BW) أو عن طريق مياه الشرب (150 ملغ / كغ BW) مع تأثيرات معاملة مماثلة.
- رصد عبء الورم باستخدام الفرجار وحساب حجم الورم مرة واحدة في الأسبوع (قياس حجم الورم = 1/2 طول × التنفس × العرض).
- التضحية الفئران مرة واحدة وصلت الأورام 1 سم في القطر أو الفئران بدء عرض أي علامات الألم أو المرض الشديد كما هو محدد أعلاه.
النتائج
الميتفورمين يستهدف بشكل انتقائي الخلايا الجذعية السرطانية البنكرياس
درسنا أولا الآثار الفنية للعلاج الميتفورمين على في المختبر قدرة التجديد الذاتي الخلايا الجذعية السرطانية. لهذا الغرض، أجرينا فحوصات تشكيل المجال باستخدام خلايا البنكرياس الإنسان الأساسية السرطان معزولة عن الأنسجة PDAC مقطوعة أثناء الجراحة. لاحظنا أن الميتفورمين انخفضت بشدة حجم المجالات شكلت (الشكل 1A). كان هذا على الأرجح عن طريق تثبيط التوسع في السلالات من ديوان الخدمة المدنية، والتي لا تزال تمثل الجزء الأكبر من الخلايا الموجودة في المجالات كما يتم إثراء فقط عن الخلايا الجذعية السرطانية. والواقع أن المجالات أطول يتم تربيتها دون الركض أكثر اتساعا توسيع السلالات أكثر متباينة سيكون. وهكذا وجدنا ميتفورمين لخفض كبير في عدد من المجالات شكلت في الواقع بغض النظر عن حجمها، والتي تحدث بطريقة تعتمد على الجرعة يشير إلى تثبيط قوي قدرة التجديد الذاتي للCاللجان الدائمة (لا تظهر البيانات). وجدنا أن الميتفورمين في 3 ملي انخفضت بشكل ملحوظ في عدد من المجالات شكلت (الشكل 1B). من أجل دراسة أكثر صرامة الآثار الطويلة الأمد للميتفورمين على قدرة التجديد الذاتي الخلايا الجذعية السرطانية، ونحن passaged في وقت لاحق من الأجواء الأولية شكلت في المجالات الثانوي والعالي. على الرغم من أن المصابين عولجوا الأجواء الأولية مع الميتفورمين، وبشكل كبير ومتزايد خفض تشكيل المجالات في الممرات الثانية والثالثة، تورط والعلاج الميتفورمين القضاء في الواقع لا رجعة فيه غالبية الخلايا الجذعية السرطانية (الشكل 1C). وهكذا، أظهرت البيانات المتوفرة لدينا آثار كبيرة للميتفورمين على قدرة التجديد الذاتي الخلايا الجذعية السرطانية في البنكرياس العلاج الأساسي، وبالتالي تشجيع لنا لأداء المزيد من ميكانيكي وكذلك الدراسات في الجسم الحي.
الميتفورمين يمنع استخدام الميتوكوندريا استهلاك الأوكسجين ويؤدي إنتاج ROS
منذ metformiوقد تبين ن ليكون بمثابة السم الميتوكوندريا عن طريق تثبيط جزئيا النشاط I معقدة، درسنا القادم الآثار الحادة للميتفورمين على استهلاك الأوكسجين الخلوية في الخلايا المشتقة المجال. لهذا الغرض، اخترنا الخلايا المشتقة من اثنين تمثيلية الأورام PDAC الأولية وقياس استهلاك الأوكسجين مع مرور الوقت بعد حقن متتابعة من 3 ملي الميتفورمين (ثلاث حقن) و 1 ميكرومتر روتنون (حقنة واحدة). كما هو مبين في الشكل 2A، حقن الميتفورمين يسببها انخفاض سريع وتعتمد على الجرعة في استهلاك الأوكسجين، والتي تنوعت كبيرة بين الأورام المختلفة. حسبنا النشاط الميتوكوندريا المتبقية على علاج الميتفورمين عن طريق حقن روتينون، وهو مجمع قوية I المانع، التي هي قادرة على تثبيط تماما استهلاك الأوكسجين الميتوكوندريا. الحساسية للميتفورمين من حيث استهلاك الأوكسجين الميتوكوندريا المترابطة مع قدرتها على حمل إنتاج ROS يعرف بأنه تشريد المتوسط من الشعبية التيlation بعد العلاج الميتفورمين (الشكل 2B، اللوحة اليسرى)، والتي يمكن قياسها بسهولة (الشكل 2B، اللوحة اليمنى). كما هو متوقع، أظهرت الخلايا الأولية التي كانت الأكثر حساسية لتثبيط استهلاك الأوكسجين أيضا أقوى زيادة في الإنتاج ROS على علاج الميتفورمين. وبالتالي، فإن هذه الأيضية في التجارب المختبرية تثبت أن أهداف الميتفورمين الخلايا الجذعية السرطانية عن طريق تثبيط اعتمادهم على وظيفة الميتوكوندريا، مما أدى إلى زيادة لاحقة في إنتاج ROS الميتوكوندريا في نهاية المطاف واستحثاث موت الخلايا المبرمج.
الميتفورمين الأكشاك PDAC التقدم في فيفو
درسنا أخيرا آثار الميتفورمين في الجسم الحي باستخدام xenografts الأنسجة المستمدة من مختلف المرضى مع PDAC. لاحظنا انخفاضا كبيرا في تطور الورم بالنسبة للفئران المعالجة ميتفورمين بالمقارنة مع مجموعة المراقبة، ولكن الأورام أبدا ديسا تماماppeared (الشكل 3). وفي وقت لاحق، خلال المدى الطويل متابعة جميع الأورام انتكس في نهاية المطاف يشير إلى المقاومة الميتفورمين من الخلايا على قيد الحياة المرحلة الأولى من العلاج. ومع ذلك، والعلاج الميتفورمين، حتى عندما يطبق وكيل واحد، تمديد بقاء بشكل كبير في جميع الفئران.
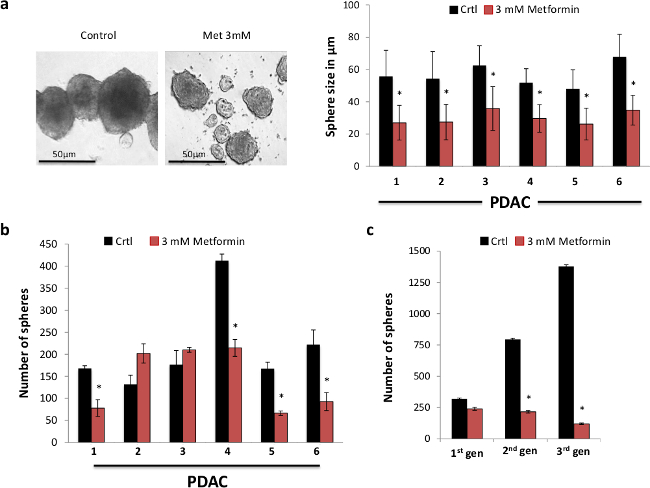
الشكل 1. ميتفورمين يستهدف بشكل انتقائي الخلايا الجذعية السرطانية. (A) انخفضت ميتفورمين حجم المجالات. صور تمثيلية من المجالات التي تم الحصول عليها بعد العلاج مع جرعات المشار الميتفورمين لمدة 7 أيام (اللوحة اليمنى). الكمي لحجم المجال (n≥6) (اللوحة اليسرى)، والأرقام المشار إليها في محور إحداثي تمثل الورم الفردية. (B) سعة تشكيل المجال في وجود أو عدم وجود الميتفورمين لمدة 7 أيام (n≥6)، فإن الأرقام المشار إليها في إحداثيمحور تمثل الورم الفردية. (C) الرسم البياني الممثل من CSC قدرة التجديد الذاتي في المجالات الثانوية والثالثية من خلايا سرطان البنكرياس الأولية. وعولج المجالات فقط خلال تشكيل المجال الجيل الأول ليصبح المجموع 7 أيام (ن = 6). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
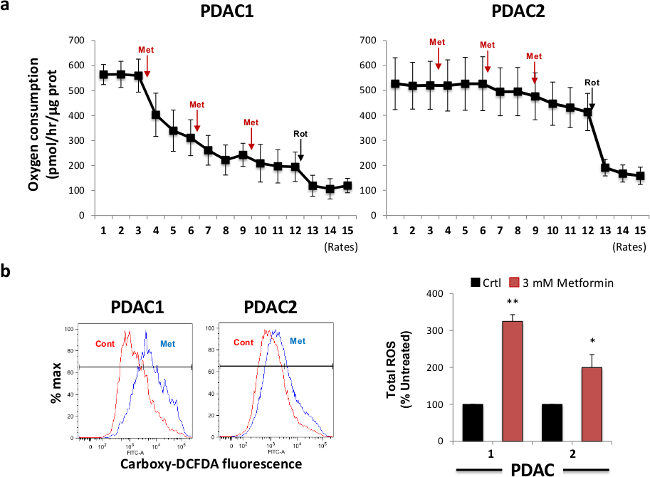
الشكل 2. علاج الميتفورمين يحول دون استهلاك الأوكسجين ويؤدي ROS الإنتاج. (A) ميتفورمين بالإضافة يمنع استهلاك الأوكسجين (OCR) من الخلايا المشتقة المجال. وعولج اثنان مختلف المجالات الثانوية PDAC مع ميتفورمين و تم قياس التغيرات OCR عن طريق تحليل تدفق خارج الخلية. تم استخدام حقن روتنون كجهاز تحكم عن إجمالي استهلاك OCR الميتوكوندريا.يمثل X-محور معدل استهلاك الأوكسجين في بمول الأوكسجين / ساعة تطبيع من محتوى البروتين في كل بئر. وعولج المجالات (B) PDAC المستخدمة في A لمدة 8 ساعة مع الميتفورمين وتقييم إنتاج ROS التدفق الخلوي باستخدام كربوكسي DCFDA. اليسار، تدفق تمثيلي الخلوي المؤامرات. الحق، ملخص البيانات من ثلاث تجارب مستقلة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
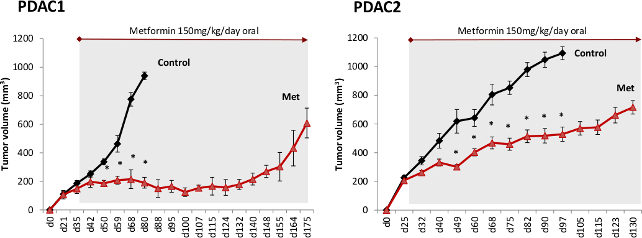
الشكل 3. ميتفورمين الأكشاك PDAC التقدم في الجسم الحي. زرعت اثنين من مختلف الأنسجة طعم أجنبي PDAC في الفئران المناعة وخصص العلاج بعد أن تم التحقق اتخاذ الورم الأولي. تم علاج الفئران مع الميتفورمين (الحد) تضاف إلى مياه الشرب (150 ملغم / كغم من الجسم ويGHT. بناء على 5 مل من استهلاك المياه في اليوم الواحد). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
Discussion
مع ظهور والتحقق لاحقا لمفهوم CSC للعديد من الأورام، وقد اكتسب مجال تطوير الأدوية زخما جديدا، مع احتمال تطوير علاجات السرطان أكثر كفاءة وتقليل المخاطر للانتكاس المرض في وقت لاحق. ومع ذلك، الحقل CSC لا يزال في مرحلة مبكرة والمزيد الذي يتعين تحقيقه من حيث فهم CSC المنشأ والانتشار، ودورها في تشكيل بنية الورم وتعزيز ورم خبيث.
في هذا السياق، واستخدام المقايسات CSC استنساخه وذات مغزى وكذلك تفسير مستنير من البيانات التي تم الحصول عليها يمثل عنصرا حاسما لتعزيز فهمنا لCSC علم الأحياء. من وجهات نظر عديدة البيولوجية، برز تشكيل المجال باعتبارها فحص قيمة للغاية. مع ذلك يجب أن يكون المستخدمون على علم حدودها من أجل تفسير صحيح نتائجها التجريبية. أحد الجوانب الهامة للنظر حتى قبل تقييم المجال شكليةبيانات نشوئها هو أصل العينة التحقيق، لأن النتائج التي تم الحصول عليها من عينات المستمدة من المريض جديدة يمكن ان تكون مختلفة كثيرا عن تلك التي تم الحصول عليها من خطوط الخلايا السرطانية المعمول بها.
الكلاسيكية مجال فحوصات تشكيل تشمل إستزراع الخلايا في كثافة نسيلي في لوحات فائقة الانخفاض التعلق وتقييم تشكيل المجال في وجود عامل نمو البشرة (EGF) و / أو عامل نمو الخلايا الليفية الأساسية (ب-FGF) المخصب، ولكن خالية من مصل المتوسطة 21، 34. تكوين ثقافة المتوسطة هي أيضا قضية هامة للنظر فيها. في تجربتنا وجدنا أن DMEM / F12 تستكمل مع B27، bFGF والجلوتامين في غياب المصل كان وسيلة الأمثل لنمو وتوسيع والحفاظ على CSC في ظروف غير متمايزة. وجدنا أن في هذا الشرط الثقافة (متوسطة وتعليق) الخلايا تعبر عن كميات عالية من علامات الخلية الجذعية السرطانية (بما في ذلك CD133 +، CD44 + CD24 + و) و لا تعبر عن البروتينات المرتبطة التمايز (CK-20 وCK-19).
واحدة من الافتراضات الأساسية لهذه المقايسات هو أن كل مجال هو نسيلي، أي مجال واحد ناتج عن التوسع في الخلايا الجذعية واحدة. ومع ذلك، هي في جوهرها مجالات البنى الدينامية التي تكون عرضة لصهر حتى في انخفاض كثافة البذر 35. خلايا الطلاء هو خطوة حاسمة في البروتوكول وكثافة خلية واحدة / جيد بالتأكيد يمكن الالتفاف على مسألة التجميع. ولكن حتى بالنسبة الأسلاف فرز مستقبلي، وهذا يؤدي بانتظام في تشكيل المجال منخفض جدا بسبب انخفاض جوهري النشاط تشكيل المجال ويمكن أن تعزى أيضا إلى تحفيز autocrine محدودة بسبب تأثيرات التخفيف. في تجربتنا لاحظنا أن 30٪ فقط من خلايا مطلي قادرة على تشكيل المجالات. نوصي باستخدام لا يقل عن 100 خلية / جيدا للحصول على نتائج متسقة وقابلة للتكرار.
وتستند طرق ثقافة أخرى لCSC النمو على الثقافات 3D صلبة أو شبه صلبة (على سبيل المثال، على أساس مatrigel، والكولاجين أو ميثيل). وقد استخدمت هذه الأساليب للحد من التنقل الخلية واللاحق تجميع خلية 36. ومع ذلك، كل من هذه المصفوفات تتحمل القيود الخاصة بها. على سبيل المثال، matrigel هو الغشاء القاعدي للذوبان معزولة عن Engelbreth-هولم-سوان (EHS) الورم وعلى الرغم من أن استخراج يشبه المعقدة البيئة ورم الخلية وجدت في العديد من الأنسجة، فإنه يحتوي على عدة عوامل النمو أكثر أو أقل تحديدا والتي غالبا ما يجعل ميكانيكي دراسات لعناصر تنظيمية محددة صعبة للغاية. نقطة أخرى من الاعتبار هو أن وظائف الخلية القدرات ووقف تشكيل المجال ليست شروط للتبادل 34. بينما ثبت بعض الخلايا الجذعية والسلف لعرض فشل تشكيل مجال القدرة 37، لتوليد المجالات في المختبر لا يستبعد في الجسم الحي وظيفة الجذعية / السلف. على سبيل المثال، الخلايا الجذعية هادئة ببساطة قد لا يستجيب لمنبهات خارج الخلية التي تقدمهااختيار في ظروف المختبر الثقافة. وهكذا، على المدى الطويل في المختبر والمجراة قدرة التجديد الذاتي للسكان الخلية النقى تفضيلي أثناء الركض المسلسل، ينبغي تقييم من أجل إثبات أو دحض وظيفة الخلايا الجذعية. في هذا السياق، والقدرة على مستقبلي في وقت واحد نشر السكان متنوعة من الخلايا الجذعية والسلف هي أحد الجوانب الهامة للمقايسة تشكيل المجال ويجعل هذا الاختبار ذات قيمة عالية للحقل CSC. طالما يتم الاحتفاظ حدودها في الاعتبار لتفسير البيانات التي تم الحصول عليها.
وقد استخدمت على نطاق واسع المقايسات تشكيل المجال لتحديد بأثر رجعي الخلايا الجذعية على أساس قدرتها على التجديد الذاتي والتمايز في مستوى خلية واحدة في المختبر. اكتشاف علامات التي تسمح للعزلة المحتملين للخلايا الجذعية وذريتها من المجراة على مكانة يسمح للخصائص الوظيفية للسكان المنقى إلى تعريف. جombination من مجال تشكيل فحص وFACS هو استراتيجية ناجحة لعزل الخلايا من الأنسجة الصلبة أو إثراء مجموعات سكانية فرعية محددة من PDAC في الثقافة. على سبيل المثال، والتعبير في وقت واحد EpCAM، CD24 CD44 ويعرف جزء من السكان الخلايا الجذعية السرطانية قادرة على: التجديد الذاتي، التفريق والشروع في الورم، مما يعكس عدم تجانس الورم الأصلي. هيرمان وآخرون. أظهرت أن الخلايا CD133 + تمتلك تضاف قدرة التكاثري ويتميز CSC 15. وقد استخدمت أيضا علامات أخرى لتوصيف الخلايا الجذعية السرطانية: يرتبط ALDH- 1 (ألدهيد نازعة-1) التعبير مع الخلايا مكون للأورام عالية في سرطان البنكرياس 38؛ خلايا قادرة على استبعاد الصبغة DNA هويشت 33342 والسكان الجانب اسمه (SP) الخلايا، لديها القدرة المؤكدة لبدء الأورام 39. أظهرنا مؤخرا أن تألق ذاتي مقصورة التحت خلوية يميز السكان متميزة من خلايا الإنسان مع الصفات CSC حصرية عبر أنواع الأورام المختلفة40 على الرغم من أن أيا من هذه العلامات يبدو أن تميز السكان نقية الخلايا الجذعية السرطانية بشكل انتقائي، تركيبات أكثر وأكثر تعقيدا من علامات تحتاج إلى استخدامها لFACS تنقية السكان أكثر دقة من الخلايا.
لا تزال العديد من الأسئلة حول الدور الدقيق الخلايا الجذعية السرطانية في الأصل، والتقدم، ومقاومة المخدرات من الأورام. على سبيل المثال، وسيلة واحدة لمعالجة مسألة التطور نسيلي لتحديد إذا وكيف CSC واحد يبدأ الورم، يمكن أن يكون لتحليل عينات من المرضى في مراحل مختلفة من هذا المرض، وعلى وجه التحديد اتباع أرقام الخلايا الجذعية السرطانية أثناء وبعد العلاج. طريق الإجابة على هذه الأسئلة، يمكننا أن نجعل تقدم ملموس من معرفتنا الخلايا الجذعية السرطانية في الأورام الصلبة وتطوير علاج لمنع تطور الورم في نهاية المطاف والانتكاس.
Disclosures
الكتاب ليس لديهم مصلحة المتنافسة في الكشف عنها.
Acknowledgements
وأيد هذا البحث من قبل ERC المتقدم باحث جرانت (باسكال-CSC 233460)، البرنامج الإطاري السابع للجماعة الأوروبية (FP7 / 2007-2013) بموجب اتفاقية منحة لا 256974 (EPC-TM-NET) ولا 602783 (CAM-باك )، وSubdirección عامة دي Evaluación ذ فومنتو دي لا INVESTIGACION، فوندو دي INVESTIGACION SANITARIA (PS09 / 02129 وPI12 / 02643)، والبرنامج الوطني دي Internacionalización دي لا I + D، Subprogramma: الداعية إلى الاستقلال 2009 (PLE2009-0105؛ MINISTERIO دي ECONOMIA ذ Competitividad، إسبانيا). وأيد E. Lonardo من قبل زمالة روش. وأيد M. سيوفي من قبل برنامج زمالة دكتوراه مسبقا لا كايكسا.
Materials
| Name | Company | Catalog Number | Comments |
| Counting Chamber/Hemocytometer | Hausser Scientific Co | 3200 | |
| CASY Cell Counter and Analyzer for proliferation and viability measurement | Roche Innovatis | AG CASY Model TTC 45,60,150 μm | |
| GentleMACS Dissociator | Miltenyi Co | 130-093-235 | |
| GentleMACS C Tubes | Miltenyi Co | 130-093-237 | |
| 24-well Ultra-low Attachment Plates | Corning | 3474 | |
| 100-mm tissue culture dishes | BD Falcon | 353803 | |
| Cell strainer | BD Falcon | 352350 | |
| 15-ml polypropylene conical tube | BD Falcon | 352097 | |
| 50-ml polypropylene conical tube | BD Falcon | 352070 | |
| 1.5 ml sterile tubes | Eppendorf | 0030 120.086 | |
| 50 ml centrifuge tubes | Corning | 430828 | |
| Sterile petri dishes, 10 cm dishes | Corning | 353003 | |
| 26 G needles | BD Falcon | 300600 | |
| 100 ul Hamilton Syringe | Hamilton Syringe Co | 81075 | |
| Collagenase type IV | Stem Cell Technologies | 7909 | |
| RPMI Medium 1640 | Life technologies | 11875-085 | |
| Penicillin/Streptomycin solution, 100X | Life technologies | SV30010 | |
| Metformin | Sigma | D150959-5G | |
| L-glutamine, 200 mM, 100X | Life technologies | 25030-081 | |
| D-Glucose | Sigma | G8270 | |
| 100mM Sodium Pyruvate solution | Life technologies | 11360-070 | |
| Seahorse Assay medium | Seahorse Bioscience | 100965-000 | |
| BD Cell-TAK Cell and Tissue adhesive | BD Biosciences | 354240 | |
| Trypsin solution, 0.05% | Life technologies | 25300054 | |
| B27 Supplement 50x | Life technologies | 17504-044 | |
| Basic Fibroblast Growth Factor | Sigma | F0291 | |
| Bovine Serum Albumin | Sigma | A9576 | |
| Dulbecco’s Modified Eagle Medium/F12 | Sigma | D8437 | |
| Sterile 1x Dulbecco’s Phosphate Buffered Saline | Sigma | D8537 | |
| Trypan Blue | Life technologies | 15250-061 | |
| Carboxy-DCFDA(5-(and-6)-Carboxy-2',7'-DichlorofluoresceinDiacetate) | Life technologies | C-369 | |
| Rotenone | Sigma | R8875 | |
| Ethanol 70% (vol/vol) | Sigma | 459844 | |
| Isofluorane | IsoVet, Braun | 571105.8 | |
| Matrigel | BD Biosciences | 35620 | |
| Sterile Cotton tipped applicator | Puritan medical | ||
| XF96e FluxPak with cell plates, calibrant and cartridges | Seahorse Bioscience | 102416-100 | |
| XF96e Extracellular Flux analyzer | Seahorse Bioscience | ||
| Incubator with CO2 input | |||
| Micro scissors | |||
| Curved forceps | |||
| Splinter forceps | |||
| Caliper |
References
- Whipple, C. A., Young, A. L., Korc, M. A KrasG12D-driven genetic mouse model of pancreatic cancer requires glypican-1 for efficient proliferation and angiogenesis. Oncogene. 31 (20), 2535-2544 (2012).
- Li, D. S., Yuan, Y. H., Tu, H. J., Liang, Q. L., Dai, L. J. A protocol for islet isolation from mouse pancreas. Nat Protoc. 4 (11), 1649-1652 (2009).
- Rahib, L., et al. Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States. Cancer Res. 74 (11), 2913-2921 (2014).
- Siegel, R., Naishadham, D., Jemal, A. Cancer statistics. CA Cancer J Clin. 62 (1), 10-29 (2012).
- Burris, H. A., et al. Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial. J Clin Oncol. 15 (6), 2403-2413 (1997).
- Moore, M. J., et al. Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer: a phase III trial of the National Cancer Institute of Canada Clinical Trials Group. J Clin Oncol. 25 (15), 1960-1966 (2007).
- Cunningham, D., et al. Phase III randomized comparison of gemcitabine versus gemcitabine plus capecitabine in patients with advanced pancreatic cancer. J Clin Oncol. 27 (33), 5513-5518 (2009).
- Von Hoff, D. D., et al. Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine. N Engl J Med. 369 (18), 1691-1703 (2013).
- Conroy, T., et al. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med. 364 (19), 1817-1825 (2011).
- Gourgou-Bourgade, S., et al. Impact of FOLFIRINOX compared with gemcitabine on quality of life in patients with metastatic pancreatic cancer: results from the PRODIGE 4/ACCORD 11 randomized trial. J Clin Oncol. 31 (1), 23-29 (2013).
- Yachida, S., et al. Distant metastasis occurs late during the genetic evolution of pancreatic cancer. Nature. 467 (7319), 1114-1117 (2010).
- Garcia-Silva, S., Frias-Aldeguer, J., Heeschen, C. Stem cells & pancreatic cancer. Pancreatology. 13 (2), 110-113 (2013).
- Hermann, P. C., Mueller, M. T., Heeschen, C. Pancreatic cancer stem cells--insights and perspectives. Expert Opin Biol Ther. 9 (10), 1271-1278 (2009).
- Hermann, P. C., Huber, S. L., Heeschen, C. Metastatic cancer stem cells: a new target for anti-cancer therapy. Cell Cycle. 7 (2), 188-193 (2008).
- Hermann, P. C., et al. Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer. Cell Stem Cell. 1 (3), 313-323 (2007).
- Li, C., et al. Identification of pancreatic cancer stem cells. Cancer Res. 67 (3), 1030-1037 (2007).
- Kreso, A., Dick, J. E. Evolution of the cancer stem cell model. Cell Stem Cell. 14 (3), 275-291 (2014).
- Gallmeier, E., et al. Inhibition of ataxia telangiectasia- and Rad3-related function abrogates the in vitro and in vivo tumorigenicity of human colon cancer cells through depletion of the CD133(+) tumor-initiating cell fraction. Stem Cells. 29 (3), 418-429 (2011).
- Hermann, P. C., Bhaskar, S., Cioffi, M., Heeschen, C. Cancer stem cells in solid tumors. Semin Cancer Biol. 20 (2), 77-84 (2010).
- Mueller, M. T., et al. Combined targeted treatment to eliminate tumorigenic cancer stem cells in human pancreatic cancer. Gastroenterology. 137 (3), 1102-1113 (2009).
- Lonardo, E., et al. Nodal/Activin signaling drives self-renewal and tumorigenicity of pancreatic cancer stem cells and provides a target for combined drug therapy. Cell Stem Cell. 9 (5), 433-446 (2011).
- Li, C., et al. c-Met is a marker of pancreatic cancer stem cells and therapeutic target. Gastroenterology. 141 (6), 2218-2227 (2011).
- Chen, J., et al. A restricted cell population propagates glioblastoma growth after chemotherapy. Nature. 488 (7412), 522-526 (2012).
- Schepers, A. G., et al. Lineage tracing reveals Lgr5+ stem cell activity in mouse intestinal adenomas. Science. 337 (6095), 730-735 (2012).
- Driessens, G., Beck, B., Caauwe, A., Simons, B. D., Blanpain, C. Defining the mode of tumour growth by clonal analysis. Nature. 488 (7412), 527-530 (2012).
- Shaw, R. J., et al. The kinase LKB1 mediates glucose homeostasis in liver and therapeutic effects of metformin. Science. 310 (5754), 1642-1646 (2005).
- Martin-Castillo, B., Vazquez-Martin, A., Oliveras-Ferraros, C., Menendez, J. A. Metformin and cancer: doses, mechanisms and the dandelion and hormetic phenomena. Cell Cycle. 9 (6), 1057-1064 (2010).
- Honjo, S., et al. Metformin sensitizes chemotherapy by targeting cancer stem cells and the mTOR pathway in esophageal cancer. Int J Oncol. 45 (2), 567-574 (2014).
- Wurth, R., et al. Metformin selectively affects human glioblastoma tumor-initiating cell viability: A role for metformin-induced inhibition of Akt. Cell Cycle. 12 (1), 145-156 (2013).
- Cufi, S., et al. Metformin-induced preferential killing of breast cancer initiating CD44+CD24-/low cells is sufficient to overcome primary resistance to trastuzumab in HER2+ human breast cancer xenografts. Oncotarget. 3 (4), 395-398 (2012).
- Lonardo, E., et al. Metformin targets the metabolic achilles heel of human pancreatic cancer stem cells. PLoS One. 8 (10), e76518 (2013).
- Gu, Y., et al. The effect of B27 supplement on promoting in vitro propagation of Her2/neu-transformed mammary tumorspheres. J Biotech Res. 3, 7-11 (2011).
- Ishizawa, K., et al. Tumor-initiating cells are rare in many human tumors. Cell Stem Cell. 7 (3), 279-282 (2010).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), 1707-1710 (1992).
- Singec, I., et al. Defining the actual sensitivity and specificity of the neurosphere assay in stem cell biology. Nat Methods. 3 (10), 801-806 (2006).
- Lawson, D. A., Xin, L., Lukacs, R. U., Cheng, D., Witte, O. N. Isolation and functional characterization of murine prostate stem cells. Proc Natl Acad Sci U S A. 104 (1), 181-186 (2007).
- Seaberg, R. M., van der Kooy, D. Adult rodent neurogenic regions: the ventricular subependyma contains neural stem cells, but the dentate gyrus contains restricted progenitors. J Neurosci. 22 (5), 1784-1793 (2002).
- Jimeno, A., et al. A direct pancreatic cancer xenograft model as a platform for cancer stem cell therapeutic development. Mol Cancer Ther. 8 (2), 310-314 (2009).
- Hirschmann-Jax, C., et al. A distinct 'side population' of cells with high drug efflux capacity in human tumor cells. Proc Natl Acad Sci U S A. 101 (39), 14228-14233 (2004).
- Miranda-Lorenzo, I., et al. Intracellular autofluorescence: a biomarker for epithelial cancer stem cells. Nat Methods. 11 (11), 1161-1169 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved